水稻白叶枯病病原菌为黄单胞杆菌水稻致病变种Xanthomonas oryzae pv. oryzae (Xoo),一般发病情况下可造成水稻减产20%~30%,严重时甚至绝收[1,2]。目前我国主要通过培育水稻抗病品种以及喷施噻枯唑、链霉素等药剂进行防治,并因长期单一用药,在生产上已经出现了不同程度的抗药性,防治效果明显降低[3,4,5,6,7],因此研发和筛选防治水稻白叶枯病的新型、高效杀菌剂成为了目前亟待解决的问题[8]。
噻唑锌(zincthiazole)化学名称为2-氨基-5-巯基-1,3,4-噻二唑锌,是由浙江新农化工有限公司自主研发的新型、高效噻唑类杀菌剂,主要用于防治水稻白叶枯病、水稻细菌性条斑病等细菌性病害[9]。但目前关于噻唑锌对水稻黄单胞杆菌生物活性的研究报道较少[10,11]。笔者研究比较了噻唑锌对水稻黄单胞杆菌的生长抑制作用和对水稻白叶枯病的治疗及保护作用、药剂在水稻中的传导性以及抗性风险,旨在为该药剂的科学应用提供参考。
1 材料与方法 1.1 供试材料 1.1.1 菌株
水稻黄单胞杆菌Xanthomonas oryzae pv. oryzae野生型敏感菌株ZJ173及PXO99为本实验室保存菌株;噻枯唑抗性菌株2-1-1[11]及噻唑锌抗性菌株RR-75,由ZJ173菌株经活体筛选得到,由本实验室分离、鉴定并保存;噻枯唑抗性菌株518,根据菌株2-1-1基因组文库所建转化子,通过两亲交配筛选得到,由本实验室分离、鉴定并保存[12]。 1.1.2 水稻品种
籼优63,为水稻白叶枯病高感品种,按常规方法种植于室内盆钵中,每盆4株,生长至分蘖末期时进行接种。 1.1.3 培养基
参照文献方法[13]制备。NA培养基:聚蛋白胨5 g,酵母粉1 g,牛肉浸膏3 g,蔗糖10 g,琼脂17 g,pH 7.0;NB培养基:聚蛋白胨5 g,酵母粉1 g,牛肉浸膏3 g,蔗糖15 g,pH 7.0。 1.1.4 药剂
98.7%噻唑锌(zinc thiazole)原药和20%噻唑锌悬浮剂(SC),均由浙江新农化工股份有限公司提供;对照药剂92.5%噻枯唑(bismerthiazol)原药及20%噻枯唑可湿性粉剂(WP)由浙江龙湾化工有限公司提供;试剂为分析纯。将噻唑锌和噻枯唑原药分别用N,N-二甲基甲酰胺配成1×104 mg/L的母液,备用。 1.2 试验方法
1.2.1 噻唑锌对水稻黄单胞杆菌的室内毒力测定
采用比浊法[14]。将菌株ZJ173在NB培养液中振荡培养(28 ℃,170 r/min)约40 h。取用超纯水稀释至浊度为100(约1×107 CFU/mL)的菌悬液100 μL,分别加入到25 mL含有0、12.5、 25、50、100和200 mg/L噻唑锌原药的NB培养液中,振荡培养24~34 h,测定浊度。每处理重复3次,试验重复2次。计算并分析噻唑锌抑制ZJ173生长的剂量-反应曲线回归方程、EC50值、EC90值及相关系数r。 1.2.2 噻唑锌抗性突变体的诱导与筛选
离体抗药性菌株的紫外诱变:取对数生长期的ZJ173菌悬液100 μL,均匀涂布于含300 μg/mL噻唑锌的NA平板上,28 ℃下预培养1 h,于紫外灯(20 W,254 nm,预热15 min)下20 cm处分别照射5、6、7、8、9、10 s后,置于28 ℃恒温黑暗条件下培养4~7 d,检查菌落生成情况。挑取单菌落转移至含10 μg/mL噻唑锌的NA平板上。同时设置不经紫外照射的对照平板,计算自发突变率。
活体抗药性菌株的药剂诱导:参照剪叶接种方法[14],于水稻植株上喷施有效成分质量浓度为300 μg/mL的噻唑锌SC,24 h后剪叶接种1×107CFU/mL 的敏感菌株ZJ173菌悬液,15 d后分离回收叶片中的黄单胞杆菌。所得120株单菌落经活化后,分别接种至预先喷施过300 μg/mL噻唑锌SC的水稻上,15 d后测量病斑长度。根据沈光斌等[6]的方法,以病斑长度相对抑制率作为判别抗性及敏感菌株的标准,参照噻枯唑的抗性区分标准,将对噻唑锌的相对抑制率≥70%的菌株鉴定为敏感菌株,反之为抗药性菌株[11]。分别按式(1)和式(2)计算病斑长度抑制率及相对抑制率。
抑制率/%= [(清水对照组病斑长度-药剂处理组病斑长度)/清水对照组病斑长度]×100(1) 相对抑制率/%=对供试菌株的抑制率对ZJ173的抑制率×100(2) 1.2.3 抗药性遗传稳定性测定
将获得的疑似噻唑锌抗性突变体分别转移至不含噻唑锌的NA平板上,培养4 d后(称为第1代),用接种环随机取一环单菌落,划线转移到新的NA平板上继续培养。如此转接培养10代后,按照1.2.2节方法剪叶接种,15 d后测定有效成分质量浓度为300 μg/mL的噻唑锌SC对病斑的抑制率。每试验重复3次,每次20株。 1.2.4 噻唑锌对水稻黄单胞杆菌的作用方式研究
分别在用有效成分质量浓度为25、50、100、200、400 μg/mL的噻唑锌SC和对照药剂噻枯唑 WP喷 施水稻叶片前或喷施后1 d,剪叶接种1×107 CFU/mL的敏感菌株ZJ173菌悬液,15 d后检查病斑长度。试验重复3次,每个浓度处理重复5株,每株3片叶。计算各处理的病斑抑制率、毒力回归方程、EC50值及相关系数r。 1.2.5 交互抗性测定
分别在用有效成分质量浓度为300 μg/mL的噻唑锌SC和噻枯唑WP喷施水稻叶片前或喷施后1 d,取中部2片叶,采用剪叶法分别接种1×107 CFU/mL 的敏感菌株ZJ173、噻枯唑抗性菌株2-1-1以及噻唑锌抗性菌株RR-75的菌悬液,15 d后测量病斑长度。试验重复3次,每次20株。按公式(1)和(2)计算各处理的相对抑制率。 1.2.6 噻唑锌内吸传导行为研究
1.2.6.1 根系对药剂的吸收及传导性测定
将水稻种植于温室盆钵中,4株/钵,待生长至四叶期时每盆分别灌施20 mL有效成分质量浓度为0、10、100和1 000 μg/mL的噻唑锌SC。24 h后取水稻中部2片叶,采用剪叶法[14]分别接种1×107 CFU/mL 的ZJ173菌悬液,培养15 d后根据叶片上的病斑长度,通过公式(1)计算抑制率,以评价根系对药液的吸收和传导情况。每处理重复20株,试验重复3次。 1.2.6.2 叶片对药剂的吸收及传导方向测定
取四叶期水稻中部2片叶,用毛刷分别涂布30 μL有效成分质量浓度为0(CK)、250、500、1 000和2 000 μg/mL的噻唑锌SC于叶片中部1 cm处[15],自然风干后采用剪叶法分别将1×107 CFU/mL的ZJ173菌悬液接种于涂药位置之上3 cm(A)、涂药位置(B)及涂药位置之下3 cm(C)处(图 1)。其中A处接菌用于检验噻唑锌的向上传导活性,C处接菌用于检验其向下传导活性。15 d后根据叶片上的病斑长度,通过公式(1)计算抑制率,以评价叶片对药液的吸收和传导情况。每处理重复20株,试验重复 3次。
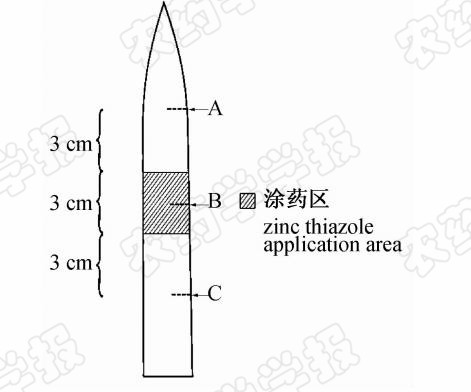 | 图 1 水稻叶片上噻唑锌涂药区及接菌位置示意图Fig.1 Schematic of zinc thiazole applicationand bacteria inoculation locationon rice leaves |
试验数据采用DPSv7.05软件处理,并通过邓肯氏新复极差法进行差异显著性分析。 2 结果与分析 2.1 噻唑锌对水稻黄单胞杆菌离体生长的抑制活性
结果(表 1)表明,噻唑锌对3株水稻黄单胞杆菌的EC50值介于90.17~94.18 μg/mL之间。而据文献报道,噻枯唑对水稻黄单胞杆菌具有较强的抑制效果,其EC50值为0.71~0.88 μg/mL[11, 13]。此外,在活体上对噻枯唑表现为抗性的菌株2-1-1在离体条件下并未检测到对噻唑锌及噻枯唑的抗性。
| 表 1 噻唑锌对水稻黄单胞杆菌的室内毒力 Table 1 In vitro toxicity of zinc thiazole against X.oryzae pv.oryzae |
离体条件下,通过多次紫外光照射诱变未能获得生长不受影响的噻唑锌抗性菌株。但在经噻唑锌处理过的水稻植株上接种ZJ173菌株15 d 后,将分离到的120个菌株再次接种到用噻唑锌处理过的水稻植株上,如此经药剂筛选2代后,共获得16个能够在药剂处理后稻苗上致病的抗药性菌株,其抗药性出现频率为13.3%(图2)。从中随机选取3株抗药性菌株,分别编号为RR-32、RR-45和RR-75,用于测定抗药性性状的遗传稳定性。
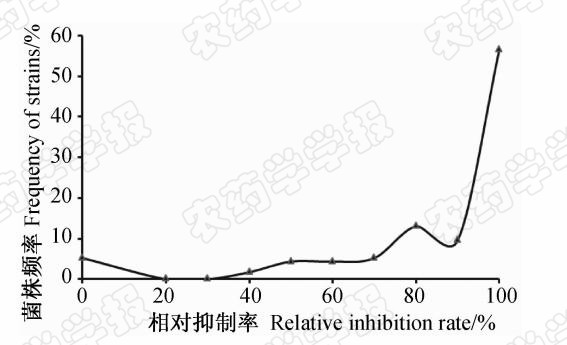 | 图2 噻唑锌活体抗药性诱变菌株相对抑制率频率分布Fig.2 The frequency distribution of zinc thiazole relative inhibition rate against isolates of X.oryzae pv.oryzae recovered from rice leaves |
从表2中可知,与敏感菌株ZJ173相比,第1代疑似噻唑锌抗性突变体对噻唑锌的敏感性有所降低,而经10次转代后,噻唑锌对抗性菌株RR-75的相对抑制率保持在45.5%,而对RR-45和RR-32的相对抑制率则分别升高至72.3%和71.1%,表明水稻黄单胞杆菌对噻唑锌的抗药性不能稳定遗传。
| 表2 水稻黄单胞杆菌对噻唑锌的抗性遗传稳定性比较 Table 2 Comparison of inheritance stability of resistant isolates of X.oryzae pv.oryzae to zinc thiazole |
采用有效成分质量浓度分别为25、50、100和200 μg/mL的噻唑锌SC和噻枯唑WP分别喷施水稻后再接种ZJ173,测定药剂的保护作用。结果表明,供试4种浓度下,噻唑锌的抑制率分别为33.2%、51.9%、61.7%和75.8%,而噻枯唑分别为15.3%、65.3%、73.9%和85.7%。相反,先接种后再施药 处理,测定药剂的治疗作用,则噻唑锌的抑制率分别为49.2%、67.5%、70.7%和80.8%,噻枯唑分别为13.5%、48.6%、49.8%和78.6%。其中25 μg/mL噻唑锌的治疗效果相当于其50 μg/mL时的保护效果,说明噻唑锌对水稻白叶枯病有良好的治疗和保护作用,且治疗作用大于保护作用。通过DPS软件分析,得噻唑锌对水稻白叶枯病的治疗和保护作用EC50值分别为22.9和52.5 μg/mL,治疗作用显著优于保护作用;而对照药剂噻枯唑的治疗和保护作用EC50值分别为64.8和50.6 μg/mL,其保护作用相对更优(图 3)。
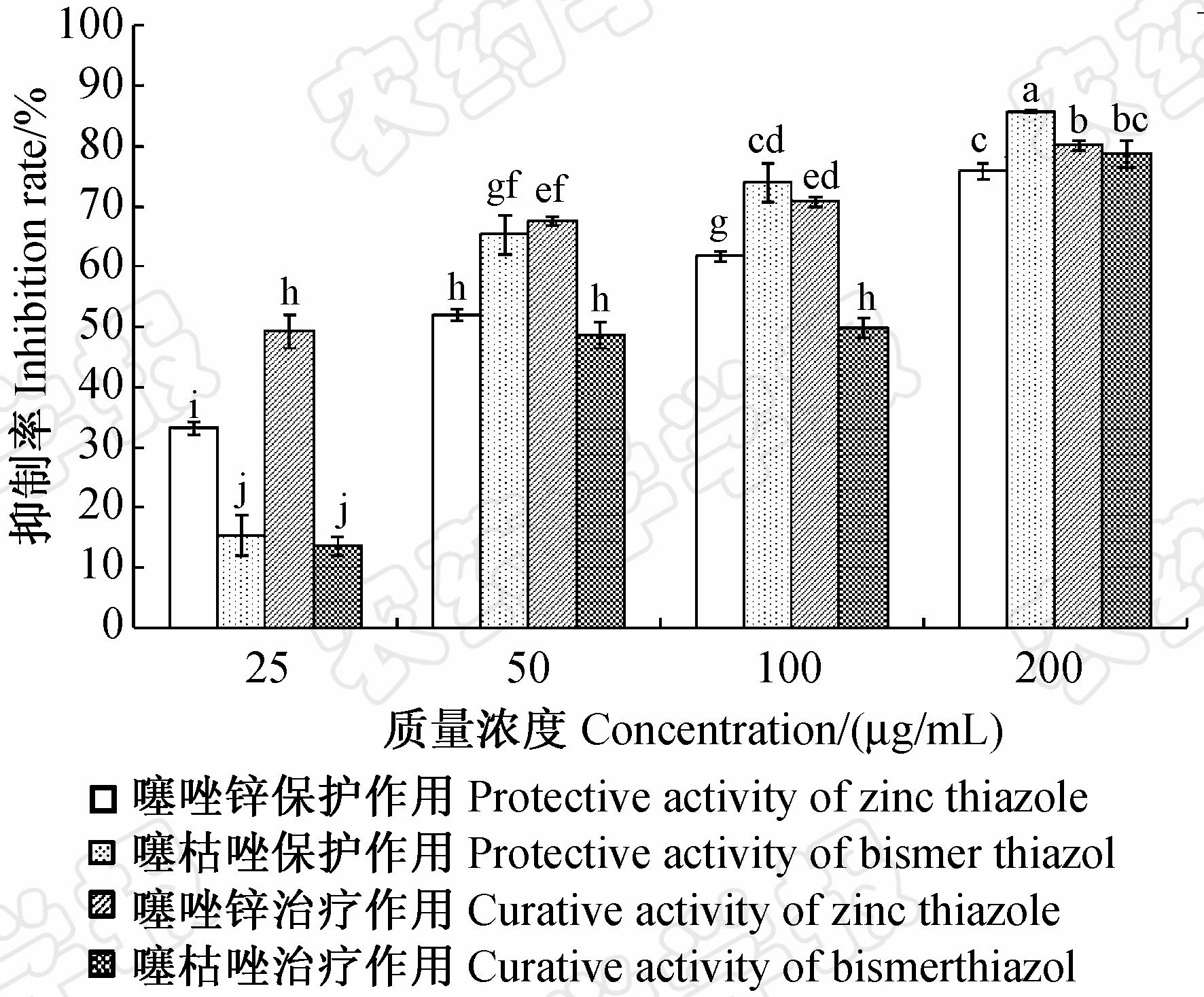 | 图3 噻唑锌和噻枯唑对水稻白叶枯病的治疗和保护作用比较Fig.3 Comparison of protective and curative activity between zinc thiazole and bismerthiazol against X.oryzae pv.oryzae注: 图中相同字母表示差异不显著(P=0.05)。 Note: Figures with the same letter are not significantly differentat P=0.05 according to Duncan’s multiple range test. |
结果见图 4)。其中噻唑锌抗性菌株RR-75对噻枯唑也表现出了抗药性,其治疗作用的相对抑制率为46.3%,保护作用的相对抑制率为35.3%,均低于70%。同样,噻枯唑抗性菌株2-1-1对噻唑锌也表现出了抗药性,其治疗作用的相对抑制率为14.3%,保护作用的相对抑制率为0。通过DPS软件计算分析,噻唑锌对噻枯唑抗性菌株的抑制率与其对敏感菌株ZJ173的抑制率之间存在显著性差异;反之亦然。说明噻唑锌与噻枯唑之间存在交互抗性。
 | 图 4 水稻黄单胞杆菌对噻唑锌和噻枯唑的交互抗性 Fig.4 Cross-resistance between zinc thiazole and bismerthiazol注: 图中相同字母表示差异不显著(P=0.05);RR-75为活体抗噻唑锌菌株,2-1-1为活体抗噻枯唑菌株。 Note: Figures with the same letter are not significantly different at P=0.05 according to Duncan’s multiple range test,stain RR-75 is resistant to zinc thiazole,strain 2-1-1 is resistant to bismerthiazol. |
结果(图 5)表明,噻唑锌灌根处理对水稻下部叶片 病斑长度的抑制率高于对上部叶片的抑制率,其中,1 000 μg/mL的噻唑锌灌根处理对下部叶片病斑长度的抑制率达到74.7%,10 μg/mL处理对下部叶片病斑长度的抑制率与100 μg/mL处理对上部叶片病斑长度的抑制率相似,分别为42.7%和44.8%。表明噻唑锌可通过水稻根部吸收,并逐渐向上传导,优先运输至靠近处理部位的叶片
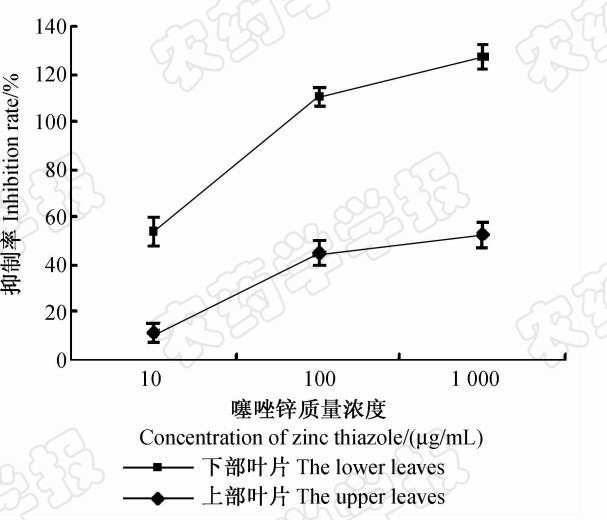 | 图 5 噻唑锌在水稻根部的吸收与传导 Fig.5 Systemic absorption and translocation of zinc thiazole from rice root |
结果(图6)表明,噻唑锌对水稻叶片处理部位以上(叶片上部)的防治效果最好,1 000 μg/mL处理组叶片上部病斑长度为1.62 cm,抑制率达67.6%,显著高于同浓度药剂对处理部位(叶片中部)及处理部位以下(叶片下部)病斑长度的抑制率;2 000 μg/mL噻唑锌处理组叶片上部病斑长度为1.12 cm,其抑制率为77.6%,叶片下部病斑长度为2.81 cm,抑制率为43.8%。说明噻唑锌能够被水稻叶片吸收,并表现为向顶性传导,而向叶片基部传导的能力较差。
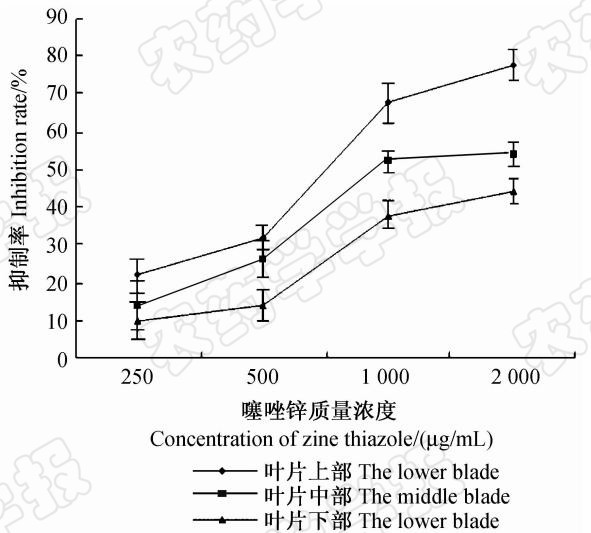 | 图6 噻唑锌在水稻叶片中的吸收与传导Fig.6 Systemic absorption and translocation of zinc thiazole in detached leaves |
本文报道了噻唑锌对水稻白叶枯病致病菌黄单胞杆菌的生物活性及作用特点。研究发现,噻唑锌在离体条件下对水稻黄单胞杆菌的毒力显著低于对照药剂噻枯唑,其原因可能是由于噻唑锌的难溶性所致。但在活体上噻唑锌对水稻黄单胞杆菌表现出了强烈的抑制活性[10],且治疗作用大于保护作用。有研究表明,锌可以直接毒害病原体[16],由此推测锌离子可能是导致噻唑锌和噻枯唑活性差异的原因。此外,由于锌离子还可促进植物生长[16],因此噻唑锌是否具有植物生长促进作用或增产作用,有待进一步研究。 本研究发现,噻唑锌具有内吸向顶性传导特性和优良的治疗作用,因此应有利于防治从叶尖或叶缘开始发病的水稻白叶枯病[17]。
病原菌的抗药性已成为世界重大农业问题之一[18,19,20,21]。本研究组前期已报道水稻黄单胞杆菌极易对噻枯唑产生抗药性,从而导致噻枯唑对水稻白叶枯病的防治效果经常不理想,此外在水稻植株上表现为抗药性的菌株在离体条件下并不表现为抗药性 [5,6,7,11,13],说明水稻黄单胞杆菌在活体上对噻枯唑的抗性机制不同于离体条件下噻枯唑对其生长的抑制机制。本研究发现,水稻黄单胞杆菌在离体条件下对噻唑锌也难以产生抗药性,但其在噻唑锌处理过的活体水稻植株上却很容易产生抗药性,该结果与水稻黄单胞杆菌对噻枯唑的抗药性类似。值得注意的是,在无药剂选择压力下,多数噻唑锌抗性菌株的抗药性会丧失。据此,笔者认为噻唑锌用于防治水稻白叶枯病的抗性风险较低。但由于噻唑锌与噻枯唑之间存在交互抗性,因此在对噻枯唑已产生抗性的地区使用噻唑锌防治水稻白叶枯病,效果可能不理想。而在尚未对噻枯唑产生抗性的地区优先使用噻唑锌,或在水稻生长早期首先选用噻唑锌,将有利于延缓水稻黄单胞杆菌对噻唑类杀菌剂抗药性的发生。
| [1] | STRANG R N, SCOTT P R. Plant disease: a threat to global food security[J]. Annu Rev Phytopathol, 2005, 43: 83-116. |
| [2] | MEW T, ALVERAZ A, LEACH J, et al. Focus on bacterial blight of rice[J]. Plant Diseasea, 1993, 77(1): 5-12. |
| [3] | 张宇君, 李俊, 赵伟, 等. 水稻白叶枯病菌对拌种灵抗药性分子机制研究[J]. 中国农业科学, 2005, 38(1): 64-69. ZHANG Yujun, LI Jun, ZHAO Wei, et al. Molecular mechanism of amicarthiazol resistance in Xanthomonas oryzae pv.oryzae[J]. Sci Agric Sin, 2005, 38(1): 64-69. (in Chinese) |
| [4] | XU Ying, ZHU Xiaofeng, ZHOU Mingguo, et al. Status of streptomycin resistance development in Xanthomonas oryzae pv.oryzae and Xanthomonas oryzae pv.oryzicola in China and their resistance characters[J]. J Phytopathol, 2010, 158(9): 601-608. |
| [5] | 马忠华, 周明国, 叶钟音. 噻枯唑对水稻白叶枯病菌作用机制研究初报[J]. 植物病理学报, 1997, 27(3):237-241. MA Zhonghua, ZHOU Mingguo, YE Zhongyin. The action mode of saikuozuo againt Xanthomonas oryzae pv.oryzae[J]. Acta Phytopathol Sin, 1997, 27(3): 237-241. (in Chinese) |
| [6] | 沈光斌, 周明国. 水稻白叶枯病菌对噻枯唑的抗药性监测[J]. 植物保护, 2002, 28(1): 9-10. SHEN Guangbin, ZHOU Mingguo. Resistance monitoring of Xanthomonas oryzae pv.oxyzae to saikuzuo[J]. J Plant Prot, 2002, 28(1): 9-10. (in Chinese) |
| [7] | 周明国, 叶钟音, 刘经芬. 杀菌剂抗性研究进展[J]. 南京农业大学学报, 1994, 17(3): 33-41. ZHOU Mingguo, YE Zhongyin, LIU Jingfen. Research advances on fungicide resistance[J]. J Nanjing Agric Univ, 1994, 17(3): 33-41. (in Chinese) |
| [8] | 成家壮. 防治水稻白叶枯病药剂的研究[J]. 世界农药, 2008, 30(5): 13-15. CHENG Jiazhuang. Research for the pesticides to control Xanthomonas oryzae pv.oxyzae[J]. World Pestic, 2008, 30(5): 13-15. (in Chinese) |
| [9] | 魏方林, 戴金贵, 许丹倩, 等. 创制农药噻唑锌对水稻细菌性病害的田间药效[J]. 农药, 2007, 46(12): 810-811. WEI Fanglin, DAI Jingui, XU Danqian, et al. Efficacy of the new creating pesticide zn thiazole against bacteria disease[J]. Agrochemical, 2007, 46(12): 810-811. (in Chinese) |
| [10] | ZHANG C, WU H, LI X, et al. Baseline sensitivity of natural populations and resistance of mutants of Xanthomonas oryzae pv.oryzae to a novel bactericide, zinc thiazole[J]. Plant Pathol, 2013, 62(6): 1378-1383. |
| [11] | 徐颖. 水稻黄单胞杆菌对链霉素和噻枯唑的抗药性监测和抗药性机制研究[D]. 南京: 南京农业大学, 2010. XU Ying. Occurrence and mechanisms of streptomycin and bismerthiazol resistance in Xanthomonas oryzae pv.oryzae in China[D]. Nanjing: Nanjing Agricultual University, 2010. (in Chinese) |
| [12] | 张勇. 水稻白叶枯病菌和条斑病菌对噻枯唑和链霉素的抗药性机理研究[D]. 南京: 南京农业大学, 2011. ZHANG Yong. Mechanisms of bismerthiazol and streptomycin resistace in Xanthomonas oryzae pv.oryzae and Xanthomonas oryzae pv.oryzicola[D]. Nanjing: Nanjing Agricultual University, 2011. (in Chinese) |
| [13] | 马忠华, 周明国, 王建新, 等. 水稻白叶枯病菌对噻枯唑的抗药性[J]. 南京农业大学学报, 1996, 19(2): 22-25. MA Zhonghua, ZHOU Mingguo, WANG Jianxin, et al. Characcters of resistant isolates of Xanthomonas oryzae to saikuzuo[J].J Nanjing Agric Univ, 1996, 19(2): 22-25. (in Chinese) |
| [14] | 深见顺一, 上杉康, 石冢皓造, 等. 农药实验法:杀菌剂篇[M]. 北京: 农业出版社, 1991: 31-41. SHENGJIAN Shunyi, SHANGSHAN Kang, SHIZHONG Haozao, et al. Method of Pesticide Experiment: Article of Fungicide [M]. Beijing: China Agriculture Press, 1991: 31-41. (in Chinese) |
| [15] | 李恒奎, 周明国. 氰烯菌酯对禾谷镰孢菌的生物活性及其内吸输导性研究[J]. 农药学学报, 2006, 8(1): 30-35. LI Hengkui, ZHOU Mingguo. Studies on the biological activity of JS399-19 against Fusarium graminearum and its systemic translocation[J]. Chin J Pestic Sci, 2006, 8(1): 30-35. (in Chinese) |
| [16] | 徐晓燕, 杨肖娥, 杨玉爱. 锌在植物中的形态及生理作用机理研究进展[J]. 广东微量元素科学,1999,6(11): 1-6. XU Xiaoyan, YANG Xiaoe, YANG Yuai. Progress in research on the forms of Zn in plant and mechanisms of physiological role of Zn[J]. Guangdong Trace Elements Sci, 1999, 6(11): 1-6.(in Chinese) |
| [17] | 林孔勋. 杀菌剂毒理学[M]. 北京: 中国农业出版社, 1995: 84-98. LIN Kongxun. Fungicidal Toxicology[M]. Beijing: China Agriculture Press, 1995: 84-98. (in Chinese) |
| [18] | ZHANG Y J, LI J, ZHAO W, et al. A single amino acid substitution in the SdhB protein of succinate dehydrogenase determines resistance to amicarthiazol in Xanthomonas oryzae pv.oryzae[J]. Pest Manag Sci, 2010, 66(6): 627-633. |
| [19] | 高山林, 朱立宏. 水稻白叶枯病抗性遗传研究[J]. 南京农学院学报, 1982(1): 22-35 GAO Shanlin, ZHU Lihong. A study of the inheritance of the resistance to bacterial leaf blight, Xanthomonas oryzae Dowson, in rice(Oryzae satival)[J]. J Nanjing Agric Coll, 1982(1): 22-35.(in Chinese) |
| [20] | FUJI M, TAKEDA T, UCHIDA K, et al. The latest status of resistance to strobilurin type action fungicides in Japan[C]//The BCPC Conference: Pests and Diseases, Volume 1. Brighton, UK: BCPC, 2000: 421-426. |
| [21] | HEANEY S P, HALL A A, DAVIES S A, et al. Resistance to fungicides in the QoI-STAR cross-resistance groups: current perspectives[C]//The BCPC Conference: Pests and Diseases, Volume 2. Brighton, UK: BCPC, 2000: 755-762. |
 2014, Vol. 16
2014, Vol. 16


