我国大棚蔬菜的种植规模已越来越大,与露地蔬菜相比,大棚蔬菜因生长在相对封闭的特殊环境之中,更易发生病虫害,使得农药用量增加,同时农产品和环境中农药残留的风险也相应增大。已有研究表明,有机磷类、苯甲酰脲类、取代苯类农药在大棚蔬菜中的残留量均比其在露地蔬菜中的高,尽管其残留量随时间延长而降低,但存在一定的波动性[ 1, 2, 3, 4]。
啶虫脒是一种高效、广谱、低毒、低残留的新烟碱类杀虫剂,广泛用于水稻、蔬菜、果树上的蚜虫、飞虱、蓟马等鳞翅目害虫的防治[5]。目前,有关啶虫脒在露地环境下的残留及消解行为已有一些研究报道[ 6, 7, 8],但尚未见有关其在大棚蔬菜与露地蔬菜中残留规律的比较研究。
笔者采用乙腈提取、固相萃取净化、高效液相色谱分析的方法,测定了啶虫脒在露地和大棚2种种植条件下黄瓜和土壤中的消解动态和最终残留,旨在阐明在2种不同的种植环境下,啶虫脒在黄瓜及其土壤中的残留差异,以期为啶虫脒在露地和大棚蔬菜中的科学施用提供参考。
Agilent 1200高效液相色谱仪,附带紫外光检测器和Agilent 1200色谱工作站;IKA T18基本型组织匀浆机(德国IKA公司);N-EVAP112型24孔氮吹仪(德国邦德公司);固相萃取仪(美国Supelco公司);高速离心机(美国Beckman公司);QL-901涡旋混合器(江苏海门市麒麟医用仪器厂);PYB普通摇床(中国科学院武汉科学仪器厂);JY2002电子天平(精确至0.01 g,上海精密科学仪器有限公司);KQ-600E型超声波清洗器(昆山市超声仪器有限公司)。
啶虫脒(acetamiprid)标准品(纯度99.5%,美国Sigma公司);9%啶虫脒可湿性粉剂(山东绿霸化工股份有限公司);弗罗里硅土(Florisil)(60~100 μm)和石墨化炭黑(120~400 μm)经烘烤活化(北京艾杰尔科技有限公司);乙腈、丙酮、正己烷均为HPLC级(德国Merck公司);无水硫酸钠用前经烘干处理。
按照《农药残留试验准则》[9],于2012年在江苏省南京市同时进行露地和大棚条件下的消解动态和最终残留试验。露地和大棚同时种植黄瓜,品种为露丰。两处地块土质、肥力等条件相似,常规栽培管理,大棚中根据黄瓜生长需要进行通风或遮盖,两处地块中黄瓜的生长时期、形态状况等相近。每处理重复3次,每重复为1个小区,每小区面积 20 m2,各小区之间设保护行;同时设空白对照处理。采集生长正常、成熟、无病害的黄瓜样品,不少于 2 kg;采用土壤取样器在每个小区耕作层取5~10个点的土壤样品,每个点取样1 kg左右;黄瓜及土壤样品四分法缩分后各留样500 g,于-20 ℃冰箱中保存,待测。
采用9%啶虫脒可湿性粉剂,按有效成分30.375 g/hm2(推荐高剂量的1.5倍)的剂量,于黄瓜果实生长至成熟个体约一半大小时对水(600 kg/hm2)稀释后均匀喷雾,分别于施药后2 h和1、3、5、7、10、14、21 和30 d采集黄瓜样品,测定啶虫脒在黄瓜中的残留量。
另外在露地和大棚的试验地块,分别选20 m2表面平整、墒情适中的空白地块,采用上述相同剂量对水稀释后对地表进行喷雾处理,分别于施药后2 h和1、3、5、7、10、14、21和30 d 采集0~10 cm深的土壤样品,测定啶虫脒在土壤中的残留量。
采用9%啶虫脒可湿性粉剂,设低剂量(有效成分)20.25 g/hm2(推荐高剂量)和高剂量(有效成分)30.375 g/hm2 2个处理,分别施药1次和2次,施药间隔期为7 d。于黄瓜果实生长初期开始施药,按施药剂量从低到高的顺序均匀喷雾处理。分别于最后一次施药后2、3、5、7 d采集黄瓜和土壤(0~15 cm)样品,测定啶虫脒在黄瓜和土壤中的最终残留量。
黄瓜样品:准确称取20.0 g黄瓜样品于 250 mL 具塞三角瓶中,加入40 mL乙腈,用组织匀浆机匀浆提取2 min后,经滤纸过滤于250 mL具塞三角瓶中,滤液中加入5 g 氯化钠,盖紧后剧烈振摇 3 min左右,静置。准确吸取10 mL上层清液,氮气吹干后,用1 mL V(正己烷)∶V(丙酮)=90∶10的混合溶剂溶解残留物,待净化。
采用弗罗里硅土(Florisil)+石墨化炭黑小柱净化。于5 mL聚乙烯注射筒内依次填装0.5 g Florisil和0.1 g石墨化炭黑,先用2 mL V(正己烷)∶V(丙酮)=90∶10的混合溶剂活化小柱,加入1 mL上述提取液,再用5 mL该混合溶剂淋洗,弃去淋出液。用8 mLV(正己烷)∶V(丙酮)=50∶50的混合溶剂 洗脱,流速控制在2 mL/min,收集洗脱液。氮气吹干后用1 mL流动相V(乙腈)∶V(水)=70∶30定容,供高效液相色谱(HPLC)分析。
土壤样品:准确称取风干土壤样品10.0 g于250 mL具塞三角瓶内,加入30 mL乙腈,摇床振荡提取2.5 h,滤纸过滤,滤液中加入1~1.5 g无水硫酸钠,加盖剧烈振摇1 min后静置。取上层清液10 mL,氮气吹干后,用1 mL流动相V(乙腈)∶V(水)=70∶30定容,供HPLC分析。
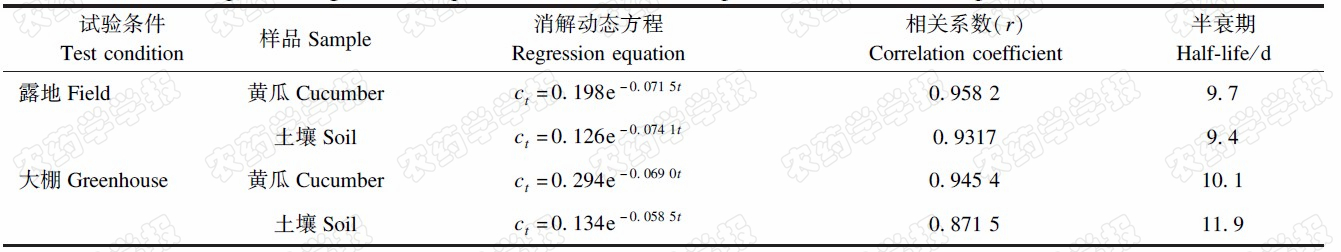
Agilent ZORBAX SB-C18不锈钢柱(255 mm×4.6 mm×5 μm);流动相为V(乙腈)∶V(水)=70∶30,流速0.70 mL/min;检测波长为245 nm;柱温20 ℃;进样体积10 μL。在此条件下,可实现啶虫脒与杂质的有效分离,啶虫脒的保留时间为3.8 min左右(见图1)。
 | 图1 啶虫脒标准样品色谱图(0.5 mg/L) Fig.1 Chromatogram of acetamiprid standard(0.5 mg/L) |
准确称取啶虫脒标准品0.05 g(精确至0.001 g),用乙腈溶解并定容至50.0 mL,配成标准母液(1 000 mg/L)。先用流动相V(乙腈)∶V(水)=70∶30 稀释至100 mg/L,再用该流动相逐级稀释成20、10、5、2、1、0.5、0.1 mg/L的啶虫脒标准工作溶液。在上述色谱条件下进样测定,以啶虫脒质量浓度为横坐标,以相应峰面积为纵坐标,绘制标准曲线。
在空白黄瓜、土壤样品中分别添加0.02、0.05和0.2 mg/kg 的啶虫脒,按所建立的方法进行提取、净化和HPLC检测,计算添加回收率和相对标准偏差(RSD)。每个水平重复3次,同时设空白对照。
采用一级动力学方程式(ct=c0e-kt)计算啶虫脒在黄瓜或土壤中的残留量,半衰期(t1/2)=ln2/k[10]。
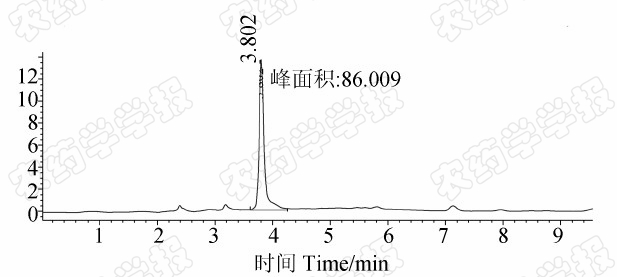
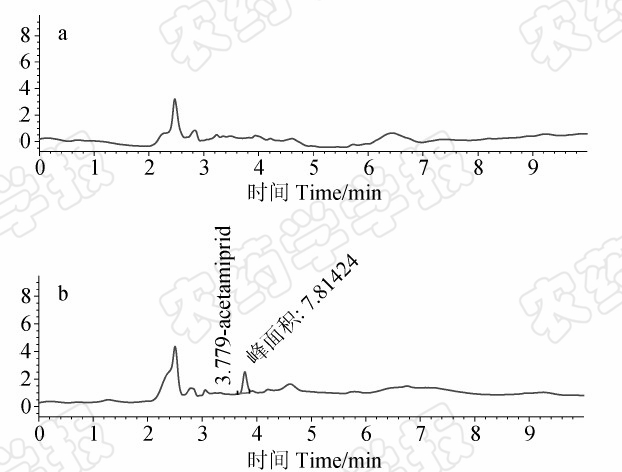
在所选液相色谱条件下,啶虫脒在本研究中的回归方程为y=86.626x-2.921 (R2=0.999 9),在0.1~20 mg/L范围内,其质量浓度与色谱峰面积呈显著的线性关系,可满足定量分析的需求。外标法定量的结果表明,啶虫脒在黄瓜和土壤中的最小检出量(LOD,按S/N=3计)为1.0 ng,定量限(LOQ)均为0.02 mg/kg。在0.02、0.05、0.2 mg/kg 3个添加水平下,啶虫脒在黄瓜和土壤中的添加回收率分别为78%~104%(RSD为6.5%~14%)和80%~114%(RSD为2.6%~15%),均符合农药残留分析要求。相关色谱图见图2~图3。
 | 图2 空白黄瓜(a)和添加0.05 mg/kg啶虫脒
黄瓜(b)样品色谱图 Fig.2 Chromatograms of blank cucumber (a) and cucumber spiked with acetamiprid (b)(0.05 mg/kg) |
 | 图3 空白土壤(a)和添加0.2 mg/kg
啶虫脒土壤(b)样品色谱图 Fig.3 Chromatograms of blank soil (a) and soil spiked with acetamiprid (b)(0.2 mg/kg) |
啶虫脒在黄瓜和土壤中的残留量均随着时间的延长而逐渐降低。施药当天(施药后2 h),其在露地黄瓜和土壤中的原始沉积量分别为0.20和0.13 mg/kg,在大棚黄瓜和土壤中分别为0.29和0.14 mg/kg,即露地黄瓜和土壤中啶虫脒的原始沉积量均分别低于大棚(图4),而其在大棚黄瓜和土壤中的半衰期均长于露地(表1),表明啶虫脒在露地中的消解速率大于其在大棚中的。
由表2数据可知:9%啶虫脒可湿性粉剂按有效成分20.25 和30.375 g/hm2的剂量分别施药1次和2次,距最后一次施药间隔期为2 d时,无论露地还是大棚,黄瓜和土壤中啶虫脒的最终残留量均远低于我国2012年规定的其在黄瓜上的MRL值1.0 mg/kg[11]。随着采样间隔期的延长,黄瓜和土壤中啶虫脒的残留量均随之下降。在相同采收间隔期和施药次数下,高剂量处理组黄瓜和土壤中啶虫脒的残留量均高于低剂量处理组;在相同采收间隔期和施药剂量下,其残留量均随着用药次数的增加而增加。除高剂量施药1次、间隔3 d和5 d这2个处理可能因施药不均或采样随机性等因素使得大棚黄瓜中啶虫脒的最终残留量比露地的低外,其余处理在相同条件(施药剂量、施药次数和采样间隔期)下,大棚黄瓜和土壤中啶虫脒的最终残留量均高于露地,最高达6倍(高剂量施药2次、间隔7 d的处理)。
| 表1 啶虫脒在黄瓜和土壤中的消解动力学方程及其相关参数 Table 1Dissipation regression equation and correlation parameters of acetamiprid in cucumber and soil |
| 表2 啶虫脒在黄瓜和土壤中的最终残留量(平均值±标准差) Table 2 Final residues of acetamiprid in cucumbers and soil(Mean± SD) |
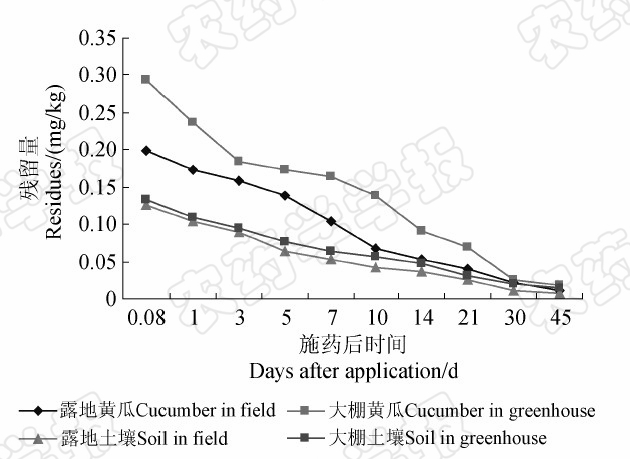 | 图4 啶虫脒在黄瓜和土壤中的消解动态曲线 Fig.4 Residue decline curve of acetamiprid in cucumber and soil |
本研究结果表明,无论黄瓜还是土壤样品,露地条件下啶虫脒的原始沉积量及残留量均低于大棚,且在露地条件下其消解比在大棚中快。这可能是由于在露地施药时,风的影响会使药液发生漂移,进而减少了药液在果实表面的沉积量;也可能是由于在露地条件下,粘附在黄瓜表面、土壤表层及土壤浅层中的农药受阳光、雨水等气候因子的影响较大,更易被稀释和消解。而在大棚,虽然高温、高湿可能在一定程度上能够加快农药的消解,但因其处在相对封闭的特殊环境中,受外部自然条件的影响不大,因此消解较慢。这与张志勇等[12]对多菌灵的研究结果相吻合。此外,本研究结果还显示:在施药后的前期采样,啶虫脒在大棚条件下的消解速率比其在露地中的快;而在后期采样则结果相反。这可能是因为试验前期天气基本无降雨,大棚中高温、高湿环境加快了啶虫脒的消解,而在试验后期出现了降雨,露地环境中啶虫脒受到雨水冲刷、稀释作用强烈,因此消解较大棚中快。Khay等[1]研究认为,不仅大棚中的高温环境有利于加快虱螨脲的降解,而且作物的生长稀释作用也是导致农药残留减少的因素之一。啶虫脒在黄瓜上的消解可能也存在类似的情况。
| [1] | KHAY S, CHOI J H, ABD EL-ATY A M, et al. Dissipation behavior of lufenuron, benzoylphenylurea insecticide, in/on Chinese cabbage applied by foliar spraying under greenhouse conditions[J]. Bull Environ Contam Toxicol, 2008, 81(4): 369-372. |
| [2] | 刘宇, 冯志田. 温室蔬菜有机磷农药残留量检测[J]. 中国媒介生物学及控制杂志, 2010, 21(3): 289. LIU Yu, FENG Zhitian. Assay of organophosphorous pesticide residues in greenhouse vegetables[J]. Chin J Vector Biol Control, 2010, 21(3): 289. (in Chinese) |
| [3] | 谢显传, 张少华, 王冬升, 等. 露地和大棚条件下阿维菌素在蔬菜作物上的残留消解动态比较[J]. 中国农业科学, 2008, 41(10): 3399-3404. XIE Xianchuan, ZHANG Shaohua WANG Dongsheng, et al. Comparative studies on the degradation dynamics of abamectin in open field and greenhouse vegetables[J]. Scientia Agricultura Sinica, 2008, 41(10): 3399-3404. (in Chinese) |
| [4] | 白云明, 李非里, 盛光遥. 温室大棚土壤中农药残留的时间和空间变化特征[C]. 杭州, 2008: 92. BAI Yunming, LI Feili, SHENG Guangyao. Spatial and temporal variations of pesticide residues in greenhouse soil[C]. Hangzhou, 2008: 92. (in Chinese) |
| [5] | 李慧冬, 李瑞菊, 王文博, 等. 啶虫脒在甘蓝和土壤中的残留消解动态研究[J]. 生态环境, 2008, 17(5): 2224-2227. LI Huidong, LI Ruiju, WANG Wenbo, et al. The dynamics of acetamiprid residue disappearance in cabbage and soil[J]. Ecol Environ, 2008, 17(5): 2224-2227. (in Chinese) |
| [6] | XIE Guohong, LIU Guoguang, SUN Dezhi, et al. Effects of surfactants on the kinetics of acetamiprid photolysis[J]. Reaction Kinetics Catal Lett, 2008, 95(2): 289-299. |
| [7] | 王英华, 邬元娟, 张慧, 等. 啶虫脒在梨中的残留检测与消解动态研究[J]. 山东农业科学, 2010(7): 70-73. WANG Yinghua, WU Yuanjuan, ZHANG Hui, et al. Residue determination and degradation dynamics of acetamiprid in pear[J]. Shandong Agric Sci, 2010(7): 70-73. (in Chinese) |
| [8] | 黄彧, 潘康标, 徐炜枫, 等. 啶虫脒在水稻和稻田水土中的残留及消解动态[J]. 现代农药, 2009, 8(6): 40-43. HUANG Yu, PAN Kangbiao, XU Weifeng, et al. Residues and degradation of acetamiprid in rice, water and soil[J]. Modern Agroch, 2009, 8(6): 40-43. (in Chinese) |
| [9] | NY/T 788—2004, 农药残留试验准则[S]. 北京: 中国农业出版社, 2004. NY/T 788—2004, Guideline on pesticide residue trials[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [10] | GAO J P, GARRISON W, HOEHAMER C, et al. Uptake and phytotransformation of organophosphorus pesticides by axenically cultivated aquatic plants[J]. Agric Food Chem, 2000, 48(12): 6114-6120. |
| [11] | GB 2763—2012, 食品安全国家标准食品中农药最大残留限量[S]. 2012. GB 2763—2012, National food safety standard maximum residue limits for pesticides in food[S].2012.(in Chinese) |
| [12] | 张志勇, 单炜力, 简秋, 等. 甲基硫菌灵及其代谢物在不同种植模式黄瓜和土壤中的残留[J]. 农业环境科学学报, 2012, 31(6): 1077-1081. ZHANG Zhiyong, SHAN Weili, JIAN Qiu, et al. Dissipation and residue of thiophanate-methyl and its metabolite in cucumber and soil under open land and greenhouse conditions[J]. J Agro-Environ Sci, 2012, 31(6): 1077-1081. (in Chinese) |
 2014, Vol.16
2014, Vol.16