2. 浙江省农业科学院 农产品质量标准研究所, 杭州 310021;
3. 辽宁大学 环境学院, 沈阳 110000
2. Institute of Quality Standards for Agricultural Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;
3. College of Environmental Sciences, Liaoning University, Shenyang 110000, China
毒死蜱是一种常用的有机磷类农药,是乙酰胆碱酯酶抑制剂,属中等毒性杀虫剂,具有胃毒、触杀及熏蒸作用,对多种咀嚼式和刺吸式口器害虫均具有较好的防效,主要用于防治褐飞虱和稻飞虱等水稻害虫,其施用后可通过农业灌溉及雨水淋溶等途径进入到池塘、河流等水体中,作用于“非靶标生物”而造成危害[1, 2 3, 4]。由于毒死蜱在水体中消解较慢,半衰期为25.6 d[5],其在水稻田的普遍应用已使之成为南方地区的重要污染源之一。关于毒死蜱对环境生物的毒性及危害已有一些报道,其对8种常规环境生物的毒性效应研究表明:毒死蜱对蜜蜂、家蚕、鱼类、鸟类、赤眼蜂、蛙类高毒,但对蚯蚓及土壤微生物安全[6, 7]。其对原生动物群落的48 h-LC50值为8.54 mg/L[8],对斑马鱼和鲫鱼的急性毒性96 h-LC50值为0.723和0.185 mg/L[9, 10]。而关于毒死蜱对我国特有鱼种稀有鮈鲫的急性毒性及对其胚胎发育的毒性作用等均尚未见报道。
稀有鮈鲫(Chinese rare minnow,Gobiocypris rarus)是我国特有的一种淡水鱼类,主要生活于支流的沟渠等小水体中,分布于我国四川省汉源县等地[11]。20世纪90年代,中国科学院水生生物研究所就开始对其进行了基本生物学研究[12]。2003年,我国颁布的《新化学物质环境管理办法》[13]中明确规定,“新化学物质的生态毒理学数据必须包括在中国境内用中国的供试生物完成的测试数据”,其中要求在鱼的毒性试验中应选择稀有鮈鲫为试验生物。王朝晖等[14]研究发现,8种拟除虫菊酯类农药对稀有鮈鲫的毒性均为剧毒。稀有鮈鲫具有性成熟快,易于饲养,实验室内可周年产卵、连续产卵等优点。本研究以其为供试生物,研究了毒死蜱对其不同生命阶段的毒性效应,试验结果可以补充、完善毒死蜱对水生生物尤其是我国特有鱼种影响的基础数据,为后续的有机磷杀虫剂毒性研究及环境监测提供参考。
毒死蜱(chlorpyrifos)原药由浙江新农化工股份有限公司提供,纯度为97%的粉末,采用分析纯吐温-80、N,N-二甲基甲酰胺(DMF)溶解并定容,配制成质量浓度为1.16 g/L的标准储备液。试验时加入标准稀释水,超声混匀,按相应倍数逐级稀释至所需浓度。
标准稀释水按照《化学品鱼类急性毒性试验》标准方法[15]配制。24孔细胞培养板和6孔细胞培养板均购自浙江拱东医疗科技有限公司,分别作为胚胎和仔鱼染毒器具;采用莱卡S8 APO型复消色差立体显微镜进行观察和拍照。
稀有鮈鲫Gobiocypris rarus种鱼购自江苏无锡中科水质环境技术有限公司,本试验所用胚胎、仔鱼、幼鱼和成鱼均系其繁殖所得。实验用水为曝气除氯并经活性炭过滤的自来水,水温为(25±1) ℃,pH控制在6.5~7.5,光/暗比为14 h/10 h。胚胎为同一天收集的健康胚胎,卵径1.35~1.70 mm,且透明无白色杂质;仔鱼为8日龄的鱼苗;幼鱼为孵化后50日龄;成鱼为120日龄,体长3.0~3.5 cm,体重0.3~0.4 g。仔鱼、幼鱼和成鱼均于正式试验前24 h 停止投饵。
参考世界经济合作与发展组织(OECD)(2013.04)方法[16]和Schulte等[17]的方法,通过立体显微镜观察,挑选发育正常的健康受精卵供试。采用24孔细胞培养板,每孔加入2 mL供试药液并放入1枚受精卵。根据预试验结果,分别设3.40、6.13、11.0、19.9、35.8、64.4和 116 mg/L 7个不同浓度,按最高浓度组的助溶剂浓度设置助溶剂对照(solvent control,SCK),以稀释水为空白对照(CK)。每浓度设2次重复,每重复为1块24孔板,共20枚卵(每孔1枚),剩余4个孔为板内对照(孔内为标准稀释水)。
染毒期间环境温度为(25±1) ℃,光/暗比为14 h/10 h。每24 h更换1次药液。受精3 h后染毒,至6、24、48、72 和96 h时,在立体显微镜(×20)下观察胚胎发育96 h内的毒理学终点并拍照记录。
根据OECD TG 203[18]方法,设计不同生长阶段鱼毒性试验。仔鱼、幼鱼和成鱼按照预备试验结果分别设0.296、0.385、0.501、0.651、0.846和1.10 mg/L,0.028 7、0.034 7、0.043 4、0.054 3、0.067 9和0.084 9 mg/L,0.012 6、0.015 8、0.019 8、0.024 7、0.030 9和0.038 6 mg/L 6个不同浓度处理,按最高浓度组的助溶剂浓度设助溶剂对照,以稀释水为空白对照。仔鱼急性毒性试验采用6孔板,设2次重复,每板为1个重复,共18条鱼(每孔3条);幼鱼和成鱼试验采用6 L鱼缸,均设2次重复,每缸为1个 重复,共15条鱼。仔鱼、幼鱼和成鱼的试验过程均采用“半静态法”[16],每24 h更换1次药液。
试验期间分别于6、24、48、72和96 h定期观察并记录各组稀有鮈鲫中毒症状及死亡情况,每隔24 h 检查1次各组的pH及溶解氧含量。用玻璃棒轻触鱼尾以判断是否死亡,及时清除死鱼。
采用DPS 7.05版软件计算稀有鮈鲫胚胎、仔鱼、幼鱼和成鱼的LC50值及其95%置信区间,分析毒死蜱对稀有鮈鲫各生长阶段的毒性差异,分析孵化率和脊柱弯曲率的相关性并用Graph Pad Prism 5软件制图。图片处理采用Adobe Photoshop CS4完成。
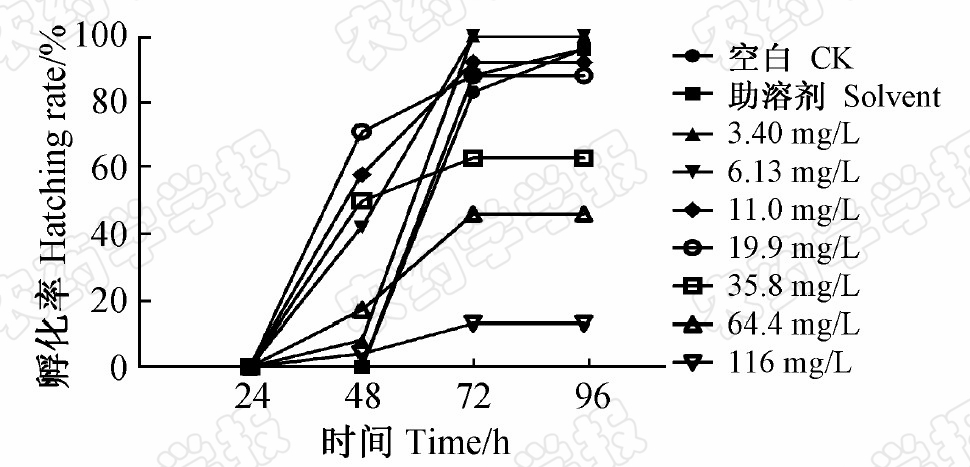 | 图1 毒死蜱对稀有鮈鲫胚胎死亡率的影响 Fig.1 Effect of chlorpyrifos on mortality of rare minnow embryo |
图1为稀有鮈鲫胚胎经不同质量浓度毒死蜱处理不同时间后的死亡率。结果表明,毒死蜱对稀有鮈鲫胚胎的毒性随处理浓度的增大而增加,同时随暴露时间的延长而增加,显示出明显的剂量-效应和时间-效应关系。其中,在24 h时,最高质量浓度116 mg/L处理组胚胎的死亡率为75%,低质量浓度(3.40~6.13 mg/L)组死亡率≤8%;在96 h时,高质量浓度(64.4~116 mg/L)处理组胚胎的死亡率为100%,最低质量浓度(3.40 mg/L)组死亡率为12%。在24 h 内观察到有凝结卵的质量浓度为≥19.9 mg/L;24~96 h内各浓度处理组死亡率均逐渐增加,72 h时各处理组死亡率均明显增加。稀有鮈鲫孵化时间约为卵产出后75 h,因此72 h为其孵化出卵壳的关键时间,48~72 h为毒死蜱对稀有鮈鲫胚胎毒性作用最明显的时间段。相对于药剂处理组,空白对照组和助溶剂对照组均无显著变化,24和96 h时的死亡率分别为4%和8%。
表1为24、48、72和96 h 时毒死蜱对稀有鮈鲫胚胎的半致死浓度(LC50)及95%置信区间。从中可看出,24与48 h时的LC50值差异不明显。
| 表1 毒死蜱对稀有鮈鲫胚胎的急性毒性 Table 1 Acute toxicity of chlorpyrifos to rare minnow embryo |
图2为不同浓度毒死蜱处理不同时间后稀有鮈鲫胚胎孵化率的变化趋势。在毒死蜱作用下,稀有鮈鲫胚胎孵化的最早时间为染毒后48 h,而此时空白对照及助溶剂对照均未出现孵化现象。染毒后72和96 h时,稀有鮈鲫胚胎孵化率随着毒死蜱质量浓度的增大而降低,其中死亡后未孵出卵壳的稀有鮈鲫胚胎呈现卵凝结现象;毒死蜱低质量浓度(3.40~11.0 mg/L)对稀有鮈鲫胚胎孵化的影响与空白对照和助溶剂对照组相近。由于毒死蜱高质量浓度(64.4~116 mg/L)组死亡率较高,试验结束时其孵化率≤50%。
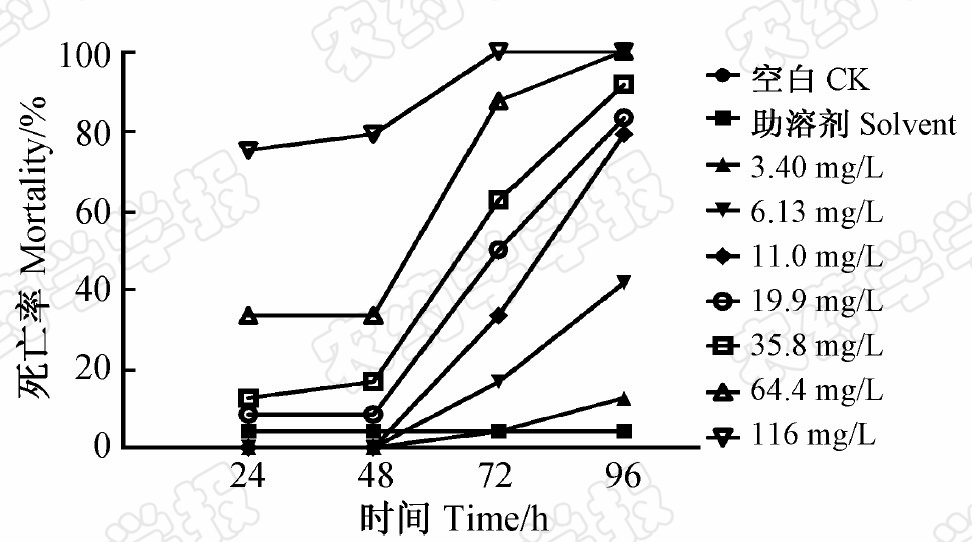 | 图2 毒死蜱对稀有鮈鲫胚胎孵化率的影响 Fig.2 Effect of chlorpyrifos on embryos hatching rate of rare minnow |
显微观察发现,空白对照组和助溶剂对照组胚胎发育较为正常(图3 a),其余各染毒处理组均出现了明显的畸形现象,主要表现为卵黄囊伸展不全、脊柱弯曲、尾部弯曲及心包囊水肿等(图3 b、c、d),表明毒死蜱对稀有鮈鲫胚胎有明显的致畸作用。图3 b为存活的多数稀有鮈鲫仔鱼,其头和尾部向背侧弯曲,尾部鳍状薄膜出现褶皱,整体形似“鸽子”状,这种形态变化在各浓度处理组中均较多见,且孵化后死亡的稀有鮈鲫仔鱼身体变白,并同样呈现向背部弯曲这一形态;图3 c为心包囊水肿的稀有鮈鲫仔鱼;图3 d中仔鱼卵黄囊伸展不全的现象在各浓度处理组中也较为多见。
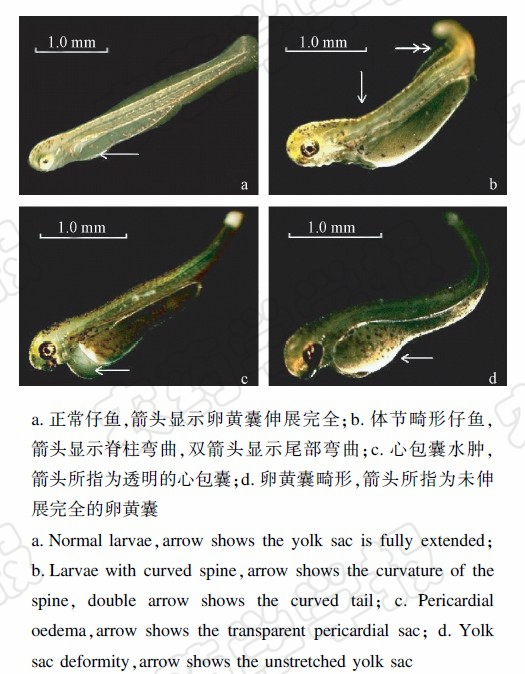 | 图3 毒死蜱暴露组稀有鮈鲫仔鱼畸形现象(×20) Fig.3 Abnormal rare minnow larvae in chlorpyrifos exposure group(×20) |
图4为将脊柱弯曲作为致畸率的一个指标,从而得出染毒72 h时稀有鮈鲫胚胎畸形率与孵化率之间的相关性。研究表明,一定浓度的毒死蜱对稀有鮈鲫胚胎有促进孵化和较明显的致畸作用。
观察发现,经毒死蜱染毒处理后,稀有鮈鲫主要 表现为游动迟缓、过度呼吸、体色变浅和脊柱弯曲等中毒症状,个别鱼出现侧翻失衡及沉底现象。毒死蜱对稀有鮈鲫仔鱼的毒性作用比较明显,可使其头部弯向腹侧以及尾部弯向背侧,整体形似“U”状。其中,低浓度处理组稀有鮈鲫幼鱼和成鱼出现中毒症状的时间较迟且症状不明显;高浓度组则主要以体色变浅和游动缓慢为主。毒死蜱对稀有鮈鲫3个不同生命阶段的急性毒性结果见表2,其毒性从高到低顺序依次为:成鱼>幼鱼>仔鱼。国家环境保护局1989年制定的《化学农药环境安全评价试验准则》[19]中将农药对鱼类的毒性划分为3个等级:高毒,LC50<1.0 mg/L;中毒,1.0<LC50<10 mg/L;低毒,LC50>10 mg/L。参照该标准,则97%毒死蜱原药对稀有鮈鲫仔鱼、幼鱼和成鱼的96 h急性毒性等级均为高毒。
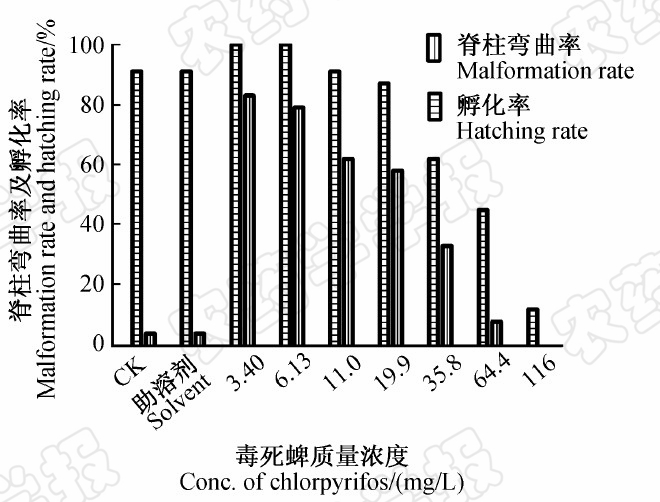 | 图4 毒死蜱暴露染毒72 h 时稀有鮈鲫仔鱼 畸形率与孵化率的相关性 Fig.4 Correlation between malformation rate and hatching rate of rare minnow larvae after exposure to chlorpyrifos for 72 h |
目前有关化学品对胚胎毒性的研究备受关注,尤其是对以小鼠为主的哺乳动物胚胎毒性的研究。近年来,对鱼类胚胎毒性的研究也已日益受到重视。研究化学品对鱼类胚胎发育的毒性效应,对水体污染的生物监测及制定相关标准均有一定的意义。以胚胎毒性试验替代鱼的毒性试验存在很多优势,在一定程度上减少了脊椎动物的使用量,符合动物福利的“3 R”原则[20]。
毒死蜱对稀有鮈鲫胚胎发育的急性毒性测定结果显示,染毒48 h后, 3.40~64.4 mg/L的毒死蜱可促进稀有鮈鲫胚胎的孵化,而35.8~64.4 mg/L高质量浓度的毒死蜱不仅可促进稀有鮈鲫胚胎的孵化,同时对已孵化的仔鱼还具有明显的致畸和致死效应。各浓度毒死蜱处理对稀有鮈鲫胚胎均有很强的致畸毒性,其畸形症状主要表现为脊柱弯曲、心包囊水肿和卵黄囊畸形等。稀有鮈鲫4个不同生命阶段对毒死蜱毒力的敏感性从高到低顺序依次为:成鱼>幼鱼>仔鱼>胚胎。其中,胚胎的敏感性最低,可能与胚胎卵膜的保护作用有关,其在一定程度上阻止了大分子物质穿透卵膜。此外,已有研究表明,有机磷类农药对人类、哺乳动物及鱼类的乙酰胆碱酯酶活性具有抑制作用,这是该类农药中毒戓环境污染的特异性生物标志[21]。由于乙酰胆碱酯酶主要参与细胞的发育和成熟[22],能促进神经元发育和神经再生,而仔鱼阶段的神经系统比较简单,因此,初步推测,毒死蜱对仔鱼的毒性应低于对神经系统发育较完全的成鱼,而其对幼鱼的毒性高于仔鱼、低于成鱼,可能也与其抑制乙酰胆碱酯酶活性这一致毒机理有关。
| 表2 毒死蜱对稀有鮈鲫仔鱼、幼鱼和成鱼的急性毒性 Table 2 Acute toxicity of chlorpyrifos to larvae, juvenile and adult stages of rare minnow |
已有报道显示,毒死蜱对斑马鱼的96 h急性毒性LC50值为0.723 mg/L[7],约为稀有鮈鲫成鱼LC50值的15倍,相对于斑马鱼成鱼,本研究所得数据显示,稀有鮈鲫成鱼和幼鱼对毒死蜱的毒性作用更敏感。一般情况下,若以一种非本土鱼类的急性毒性结果作为化学品的生态毒理学数据,可能会造成对本土生物的欠保护或过保护,因此需要增加一些本土物种作为受试生物,以完善相关毒性效应研究的基础数据,并为制定合理的测试导则提供参考。
本研究分别选取8日龄、50日龄和120日龄的稀有鮈鲫作为仔鱼、幼鱼和成鱼样本进行急性毒性试验,基本上涵盖了稀有鮈鲫的整个生命阶段,所得结果可为农药等化学品对稀有鮈鲫的毒性效应研究提供基础数据,为生物系统效应研究提供参考。关于稀有鮈鲫不同生命阶段对毒死蜱敏感性差异的具体原因,还有待进一步从蛋白质和基因等分子层面进行全面的研究。
| [1] | CASIDA J E, QUISTAD G B. Organophosphate toxicology: safety aspects of non-acetylcholinesterase secondary targets[J]. Chem Res Toxicol, 2004, 17(8): 983-998. |
| [2] | SCHIFF K, SUTULA M. Organophosphorus pesticides in storm-water runoff from southern California(USA)[J]. Environ Toxicol Chem, 2004, 23(8): 1815-1821. |
| [3] | HILDEBRANDT A, LACORTE S, BARCELÓ D. Assessment of priority pesticides, degradation products and pesticide adjuvants in groundwaters and top soils from agricultural areas of the Ebro river basin[J]. Anal Bioanal Chem, 2007, 384(4): 1459-1468. |
| [4] | YEN J, DONERLY S, LEVIN E D, et al. Differential acetylcholinesterase inhibition of chlorpyrifos, diazinon and parathion in larval zebrafish[J]. Neurotoxicol Teratol, 2011, 33(6): 735-741. |
| [5] | 石利利, 林玉锁, 徐亦钢, 等. 毒死蜱农药环境行为研究[J]. 土壤与环境, 2009, 9(1): 73-74. SHI Lili, LIN Yusuo, XU Yigang, et al. Studies on environmental behavior of chloryrifos pesticide[J]. Soil Environ Sci, 2009, 9(1): 73-74. (in Chinese) |
| [6] | 吴长兴, 赵学平, 吴声敢, 等. 丘陵地区水稻田使用毒死蜱对水体的污染及其生态风险[J]. 生态与农村环境学报, 2011, 27(3): 108-112. WU Changxing, ZHAO Xueping, WU Shenggan, et al. Pollution of waterbody by chlorpyrifos used in paddy rice field in hilly areas and its ecological risk[J]. J Ecol Rural Environ, 2011, 27(3): 108-112. (in Chinese) |
| [7] | 赵华, 李康, 吴声敢, 等. 毒死蜱对环境生物的毒性与安全性评价[J]. 浙江农业学报, 2004, 16(5): 292-298. ZHAO Hua, LI Kang, WU Shenggan, et al. Evaluation on toxicity and safety of chlorpyrifos to environmental organisms[J]. Acta Agriculturae Zhejiangensis, 2004, 16(5): 292-298. (in Chinese) |
| [8] | 刘国光, 徐海娟, 王莉霞, 等. 毒死蜱对淡水原生动物群落的急性毒性[J]. 农业环境科学学报, 2004, 23(4): 814-817. LIU Guoguang, XU Haijuan, WANG Lixia, et al. Acute toxicity of chlorpyrifos to freshwater protozoa community[J]. J Agro-Environ Sci, 2004, 23(4): 814-817. (in Chinese) |
| [9] | 季静, 肖斌, 李杨, 等. 两种不同剂型毒死蜱对四种环境生物的毒性评价[J]. 农业环境科学学报, 2010, 29(9): 1681-1686. JI Jing, XIAO Bin, LI Yang, et al. Toxicity assessment of two different formulations of chlorpyrifos to four environmental organisms[J]. J Agro-Environ Sci, 2010, 29(9): 1681-1686. (in Chinese) |
| [10] | 夏锦瑜, 王冬兰, 张志勇, 等. 毒死蜱和丙溴磷对鲫鱼的毒性效应及其在鱼体中的富集[J]. 江苏农业学报, 2010, 26(5): 1088-1092. XIA Jinyu, WANG Donglan, ZHANG Zhiyong, et al. Toxic effect and bioconcentration of chlorpyrifos and profenofos in crucian carp (Carassius auratus)[J]. Jiangsu J Agric Sci, 2010, 26(5): 1088-1092. (in Chinese) |
| [11] | 曹文宣, 王剑伟. 稀有鮈鲫:一种新的鱼类实验动物[J]. 实验动物科学与管理, 2003, 20(增刊1): 96-99. CAO Wenxuan, WANG Jianwei. Rare minnoe: a new laboratory animal in China[J]. Lab Anim Sci Administ, 2003, 20(Suppl.1): 96-99. (in Chinese) |
| [12] | 王剑伟. 稀有鮈鲫的繁殖生物学[J]. 水生生物学报, 1992, 16(2): 165-175. WANG Jianwei. Reproductive biology of Gobiocypris rarus [J]. Acta Hydrobiologica Sinica, 1992, 16(2): 165-175. (in Chinese) |
| [13] | 国家环境保护总局. 新化学物质环境管理办法.. http://www.zhb.gov.cn/gkml/hbb/bl/201002/t20100201_185231.htm SEPA. Measures for environmental management of new chemical substances.. http://www.zhb.gov.cn/gkml/hbb/bl/201002/t20100201_185231.htm (in Chinese) |
| [14] | 王朝晖, 尹伊伟, 许忠能, 等. 8 种拟除虫菊酯农药对稀有鮈鲫的急性、亚慢性毒性研究[J]. 应用与环境生物学报, 1998, 4(4): 379-382. WANG Zhaohui, YIN Yiwei, XU Zhongneng, et al. Acute and subchronic toxicity of pyrethroid insecticides to Gobiocypris rarus[J]. Chin J Appl Environ Biol, 1998, 4(4): 379-382. (in Chinese) |
| [15] | GB/T27861—2011, 化学品鱼类急性毒性试验[S]. 2011-12-30. GB/T27861—2011, Chemicals-fish acute toxicity test[S]. 2011-12-30. (in Chinese) |
| [16] | Organization for Economic Co-operation and Development(OECD). Draft test guideline on the fish embryo acute toxicity test[S]. 2013. |
| [17] | SCHULTE C, NAGEL R. Testing acute toxicity in the embryo of zebrafish, Brachydanio rerio, as an alternative to the acute fish test: preliminary results[J]. Alternatives to Laboratory Animals: ATLA, 1994, 22(1): 12-19. |
| [18] | Organization for Economic Co-operation and Development(OECD). Test No. 203: fish, acute toxicity test[S]. 1992. |
| [19] | 国家环境保护总局. 化学农药环境安全评价试验准则[S]. 2003. SEPA. Guidelines on environmental safety assessment for chemical pesticides[S]. 2003. (in Chinese) |
| [20] | 白晶. 动物实验"3R"原则的伦理论证[J]. 中国医学伦理学, 2007, 20(5): 48-50. BAI Jing. Ethical arguments for 3R principles for animal experimentation[J]. Chin Med Ethics, 2007, 20(5): 48-50. (in Chinese) |
| [21] | 孟范平, 亢小丹. 水环境中有机磷农药生物标志物的研究进展[J]. 农业生物技术学报, 2008, 16(2): 183-189. MENG Fanping, KANG Xiaodan. Advance on the study of biomarker for the detection of organophosphorus pesticides in waters[J]. J Agric Biotechnol, 2008, 16(2): 183-189. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


