2. 南京大学 化学化工学院, 南京 210093
2. School of Chemistry & Chemical Engineering, Nanjing University, Nanjing 210093, China
Mitchell等于1970年发现一种花粉粗提取物可以促进豆类秧苗生长,将其称之为Brassins[1]。1979年,Grove等从蜜蜂采集的40 kg油菜(Brassica napus)花粉中分离到4 mg高活性物质,经X-射线晶体衍射分析,首次确定其结构并命名为芸苔素内酯(brassinolide,BL)(图1a)[2]。此后,人们陆续发现了超过60种天然芸苔素内酯类化合物及其甾醇类似物,统称为芸苔素甾醇(brassinosteroids,BRs)[3]。1998年,在日本千叶举行的第16届国际植物生长物质学会会议上,BRs被正式确认为是继生长素、赤霉素、细胞分裂素、脱落酸、乙烯之后的第六类植物激素[4]。
在众多的芸苔素甾醇植物激素中,芸苔素内酯类化合物(BLs)因其活性最高而被广泛应用于农业生产[3]。BLs虽然在自然界中广泛存在,但含量极微,提取费时费力,因而使其应用受到限制[5]。以豆甾醇为原料可以合成芸苔素内酯,为芸苔素内酯的应用开辟了新的途径[6],但豆甾醇价格昂贵,不适合工业化。以自然界广泛存在的麦角甾醇为起始原料可合成芸苔素内酯的立体异构体24-表芸苔素内酯(24-epi BL,图1b)[7],而且24-表芸苔素内酯具有生物活性高和人工合成效率高等优势[8]。
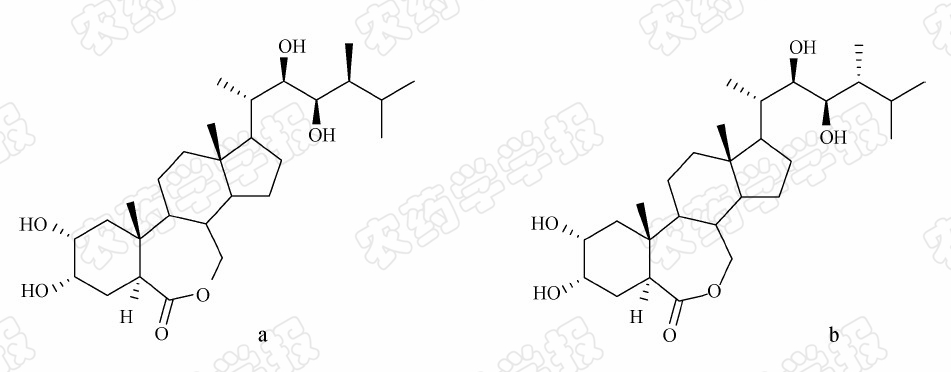 | 图1 芸苔素内酯(a)和24-表芸苔素内酯(b)化学结构 Fig.1 The chemical structures of brassinolide (a) and 24-epibrassinolide (b) |
由于BLs分子中缺乏对光、电高响应的基团,且挥发性差,较难离子化,其直接质谱响应值不高,因此通常利用BLs分子中特征的顺式邻二羟基与烃基硼酸结合,引入生色团或者电活性基团,以甲基硼酸[9]、苯硼酸[10]、萘硼酸[11]、菲硼酸[12]、二茂铁硼酸[13]为衍生化试剂,采用质谱、紫外、荧光或电化学检测器进行检测[14]。虽然利用硼酸衍生化分析可以大大提高检测的灵敏度,但是衍生化操作繁琐,不确定因素较多[15]。对于原药质量控制而言,如果其中的组分不含有双羟基官能团,则不能与硼酸衍生化试剂反应,在常规的紫外检测条件下没有足够的色谱响应,不能正确反映原药组分及质量信息,不利于24-表芸苔素内酯原药的质量控制和工艺优化,因此有必要开发简便高效的检测方法对其进行质量控制。
蒸发光散射检测器(evaporative light scattering detector,ELSD)是基于溶质光散射性质的检测器。色谱柱流出液导入雾化器后,辅助气将其雾化成微细液滴,液滴通过漂移管时,流动相中的溶剂被蒸发掉,只留下溶质,激光束照在溶质颗粒上产生光散射,由光捕集管收集散射光并通过光电倍增管转变成电信号。因为散射光强只与溶质颗粒大小和数量有关,而与溶质本身的物理和化学性质无关,所以ELSD属于通用型和质量型检测器,适用于无紫外吸收、无电活性和不发荧光的样品的检测[16]。关于高效液相色谱-蒸发光散射检测器测定BLs还未见报道,笔者通过对ELSD条件的优化,建立了24-表芸苔素内酯原药快速高效的色谱分析方法,以期为其他芸苔素甾醇植物激素的分析检测提供新思路。
Agilent 1200高效液相色谱系统,包括G1311A四元泵、G1329A自动进样器、G1316A柱温箱、G4218A 蒸发光散射检测器(ELSD)、G315D二极管阵列检测器(DAD)及Agilent ChemStation 色谱工作站,美国Agilent公司;MilliQ超纯水纯化系统,美国Millipore公司;KQ3200B型超声波清洗器,昆山市超声仪器有限公司;MS电子天平(精确到0.000 01 g),梅特勒-托利多仪器(上海)有限公司。
24-表芸苔素内酯标准品(纯度92.50%,百灵威科技有限公司);苯硼酸(纯度99.0%,百灵威科技有限公司);24-表芸苔素内酯原药(购于市场);甲醇、乙腈均为色谱纯(Fisher Scientific),水为色谱用超纯水,其余试剂均为国产分析纯。
准确称取24-表芸苔素内酯标准品约7 mg(精确至1×10-5 g),先用甲醇超声溶解并定容至10 mL,配制成约 700 mg/L的标准储备液,再用甲醇梯度稀释成700.7、350.3、175.2、87.6和43.8 mg/L 的系列标准溶液,用于24-表芸苔素内酯标准工作曲线的绘制。
将24-表芸苔素内酯原药充分混匀后,准确称取约10 mg(精确至1×10-5 g)置于50 mL容量瓶中,用甲醇溶解并定容,配制成质量浓度为200 mg/L的母液,作为原药测定的样品溶液。
色谱柱:Eclipse XDB C18柱(250 mm×4.6 mm×5 μm,超密键合及双封端,pH 2~9);柱温30 ℃;流速1.0 mL/min;进样量5 μL;流动相V (乙腈)∶V(水)=55∶45。ELSD参数:漂移管温度50 ℃,增益值10,过滤5 s,辅助气(氮气)压力350 kPa。
取配制好的标准溶液,按照1.4节的条件进行测定。以峰面积的对数(y)对质量的对数(x,mg)进行线性回归,得到24-表芸苔素内酯的线性回归方程和相关系数(r)。
按照1.3节方法,在1.4节的条件下,连续注入数针标准溶液,待相邻两针的相对响应值变化小于1.5 %时,进行样品溶液测定,7次重复。计算测定结果的相对标准偏差(RSD),并与Horwitz公式[17]计算出的RSDr进行比较。
分别准确称取已知含量的24-表芸苔素内酯原药约9、10和12 mg(精确至1×10-5 g)于50 mL容量瓶中,添加1 mL 700.7 mg/L芸苔素内酯标准储备液,用甲醇定容至刻度,按照1.4节的条件进行分析,测定方法的准确度。
称取24-表芸苔素内酯原药约0.01 g(精确至1×10-5 g)置于25 mL容量瓶中,用10 mL甲醇溶解,加入质量浓度为1.0 mg/mL 的苯硼酸-甲醇溶液10 mL,于室温下反应0.5 h。反应完毕,用甲醇稀释至刻度,摇匀,过0.45 μm滤膜即得试样溶液。
色谱柱:Eclipse XDB C18柱(250 mm×4.6 mm×5 μm,超密键合及双封端,pH 2~9);柱温为30 ℃;流速为1.0 mL/min;进样量为5 μL;流动相为V (乙腈)∶V (水)=80∶20;检测波长为222 nm。
冯埃生等[18]考察了影响ELSD检测性能的基本因素,发现漂移管温度过低时流动相得不到充分挥发,使基线水平较高;温度过高则可能带来更大的噪声。本研究考察了40、50、60、70和80 ℃ 5个温度下的信噪比。结果(见图2a)发现:随着温度升高信噪比呈先升后降的变化趋势,当温度为50 ℃时信噪比最高,因此,选择50 ℃作为最佳的漂移管温度。
调节增益可以使信号变大,一般当增益调整一个数值时信号强度变为原来的2倍,增益的数值较小时对基线噪音的影响比较小,但是当增益的数值较大时噪音也会明显增加,因此需筛选合适的增益值以提高灵敏度。本研究设置5、6、7、8、9、10、11和12共8个增益值,考察了其对信噪比的影响。结果(见图2b)发现:随着增益值的增大,信噪比逐渐变大,但达到一定值后则开始变小;其中增益值为11和12时,基线波动比较大,故确定最佳的增益值为10。
本研究考察了300、310、320、330、340、350、360、370、380、390和400 kPa 11个不同辅助气压力对信噪比的影响。结果(见图2c)发现:除300 kPa外,随压力增加信噪比开始逐渐变大,当信噪比达到一定值时,随着压力增加信噪比反而减小;当辅助气的压力为300 kPa时,基线不定时的在各处出现梯形峰,所以选择辅助气压力为350 kPa。
综合以上结果,最终确定24-表芸苔素内酯蒸发光散射检测器的最佳检测条件为漂移管温度50 ℃、增益值10和辅助气压力350 kPa。
 | 图2 漂移管温度、增益值和辅助气压力对信噪比的影响 Fig.2 The effect of evaporator temperature, gain value, auxiliary gas pressure on the ratio of signal to noise (S/N) |
根据24-表芸苔素内酯的合成工艺[7],除有效成分外,其他组分主要是异构体,其极性和24-表芸苔素内酯接近,为了使有效成分和其他组分充分分离,对流动相进行了优化。结果发现:当流动相为V (乙腈)∶V (水)=55∶45时,24-表芸苔素内酯的峰形对称,且保留时间适中,原药中组分可有效分离。典型的24-表芸苔素内酯标样和原药的HPLC-ELSD色谱图分别见图3和4。
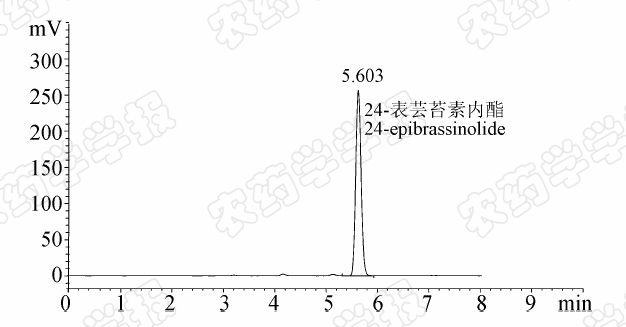 | 图3 典型24-表芸苔素内酯标样(350.3 mg/L) HPLC-ELSD色谱图 Fig.3 Typical HPLC-ELSD chromatogram of 24-epibrassinolide standard solution(350.3 mg/L) |
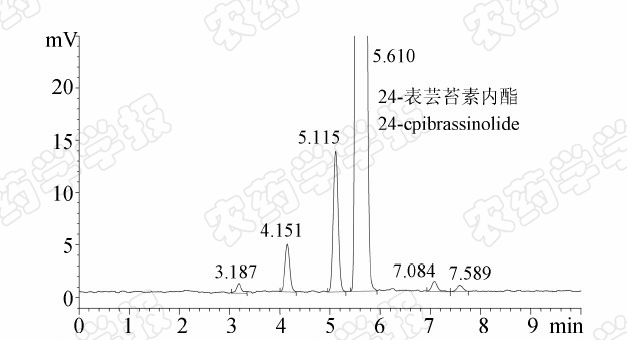 | 图4 典型24-表芸苔素内酯原药(715.5 mg/L) HPLC-ELSD色谱图 Fig.4 Typical HPLC-ELSD chromatogram of 24-epibrassinolide technical solution(715.5 mg/L) |
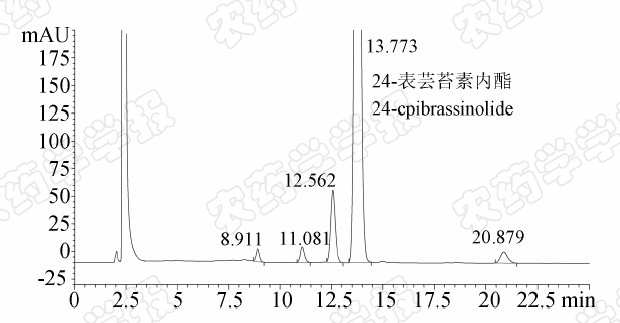 | 图5 典型24-表芸苔素内酯原药(1 950.5 mg/L) 苯硼酸衍生化 HPLC-DAD色谱图 Fig.5 Typical HPLC-DAD chromatogram of derivative of 24-epibrassinolide technical solution (1 950.5 mg/L)with phenylboronic acid |
本研究同时进行了24-表芸苔素内酯原药的HPLC-ELSD分析与苯硼酸衍生化的HPLC-DAD分析,典型的HPLC-DAD色谱图见图5。比较图4和图5发现:苯硼酸衍生化后的24-表芸苔素内酯原药HPLC-DAD色谱图中缺少一个色谱响应,表明其中一个组分未被衍生化,该组分可能不含有顺式邻二双羟基,不能与苯硼酸进行衍生化反应;而HPLC-ELSD分析中,24-表芸苔素内酯原药除了稀释溶剂外,没有引入其他组分,其检测也不依赖于特定的化学结构,因此更真实地体现了样品中的组分及含量。
结果表明,在43.8~700.7 mg/L范围内,24-表芸苔素内酯峰面积的对数(y)与质量的对数(x,mg)线性关系良好,y=1.519 5x + 7.435 4,r=0.999 3,符合定量分析要求[19]。
以3倍信噪比计算得本方法的检出限(LOD)为55 μg。芸苔素内酯类化合物苯硼酸衍生化后的LOD为20 ng,其他芳基硼酸的LOD甚至可以达到皮克级[14],远低于蒸发光散射方法的LOD。由于商品化的芸苔素内酯制剂中有效成分质量分数一般低于0.01%,因此本方法适合于24-表芸苔素内酯原药及其类似物的分析,对于低含量的制剂,可采用硼酸衍生化的分析方法。
结果(见表1和表2)表明:测定的 RSD小于RSDr,平均添加回收率为99.7%,表明该方法是准确可靠的,符合定量分析要求[19]。
本研究利用蒸发光散射检测器(ELSD)建立了高效、快捷的测定24-表芸苔素内酯原药含量的高效液相色谱(HPLC)分析方法,并对ELSD条件进行了优化,研究其最佳检测条件为:漂移管温度50 ℃、增益值10和辅助气压力350 kPa。当流动相为V (乙腈)∶V (水)=55∶45时,24-表芸苔素内酯的峰形对称,保留时间适中,原药中组分可有效分离。与硼酸衍生化方法相比较,本方法无需对样品进行前处理和衍生化,操作也相对简单易行,对于不含有顺式邻二双羟基官能团的组分也可以有效进行检测,同时在43.8~700.7 mg/L质量浓度范围内线性关系良好,精密度和准确度高,可作为24-表芸苔素内酯原药及其他芸苔素甾醇组分检测及含量测定的一种准确可行的方法。更重要的是,对不同物质,ELSD响应因子的变化比其他检测器(如紫外检测器)小得多,因此在缺乏标准品而无法作校正曲线的情况下,利用ELSD可以近似地提供原药中其他组分的定量测定,为优化合成工艺和质量控制提供了简便高效的方法。但由于本方法的LOD值较高,所以比较适宜于24-表芸苔素内酯原药及其类似物的分析,对于低含量的制剂,可采用硼酸衍生化的分析方法。
| 表1 方法精密度测定结果 Table 1 Results of precision studies (n=7) |
| 表2 方法准确度测定结果 Table 2 Results of accuracy studies |
| [1] | MITCHELL J W, MANDAVA N, WORLEY J F, et al. Brassins: A new family of plant ormones from rape pollen[J]. Nature, 1970, 225(5237): 1065-1066. |
| [2] | GROVE M D, SPENCER G F, ROHWRDDER W K, et al. Brassinolide, a plant growth-promoting steroid isolated from Brassica napus pollen[J]. Nature, 1979, 281(5728): 216-217. |
| [3] | ANTóNIO TEIXEIRA ZULLO M, ADAM G. Brassinosteroid phytohormones-structure, bioactivity and applications[J]. Braz J Plant Physiol, 2002, 14(3):143-181. |
| [4] | 霍飞凤, 白玉, 刘虎威. 两种油菜素内酯甾醇类植物激素的多级质谱分析[J]. 科学通报, 2010, 55(15): 1459-1464. HUO Feifeng, BAI Yu, LIU Huwei. Fragmentation study of two brassinolides by ion trap tandem mass spectrometry[J]. Chinese Sci Bull, 2010, 55(21): 2219-2224. |
| [5] | BAJGUZ A, TRETYN A. The chemical characteristic and distribution of brassinosteroids in plants[J]. Phytochemistry, 2003, 62(7): 1027-1046. |
| [6] | FUNG S, SIDDALL J B. Stereo selective synthesis of brassinolide: A plant growth promoting steroidal lactone[J]. J Am Chem Soc, 1980, 102(21): 6580-6581. |
| [7] | THOMSON M J, MANDAVA N, FLIPPEN-ANDERSON J L, et al. Synthesis of brassino steroids: new plant growth prornoting steroids[J]. J Org Chem, 1979, 44(26): 5002-5004. |
| [8] | 王广聚, 董服灿, 董建军. 24-表油菜素内酯的合成及应用研究[J]. 农药, 2001, 40(6): 12-15. WANG Guangju, DONG Fucan, DONG Jianjun. A study on the synthesis and application of 24-epibrassinolide[J]. Pesticides, 2001, 40(6): 12-15. (in Chinese) |
| [9] | KIM S K, ABE H, ANTHONY LITTLE C H, et al. Identification of Two brassinosteroids from the cambial region of Scots Pine (Pinus silverstris) by gas chromatography-mass spectrometry, after detection using a Dwarf Rice Lamina inclination bioassay[J]. Plant Physiol, 1990, 94(4): 1709-1713. |
| [10] | 刘国清, 张洪彬, 刘建平, 等. 高效液相色谱法测定22S, 23S, 24R表高油菜素内酯[J]. 色谱, 1995, 13(4): 290-291. LIU Guoqing, ZHANG Hongbin, LIU Jianping, et al. Determination of brasinolide by high performance liquid chromatography(HPLC)[J]. Chin J Chromatogr, 1995, 13(4): 290-291. (in Chinese) |
| [11] | GAMOH K, ABE H, SHIMADA K, et al. Liquid chromatography/mass spectrometry with atmospheric pressure chemical ionization of free brassinosteroids[J]. Rapid Commun Mass Spectrom, 1996, 10(8): 903-906. |
| [12] | GAMOH K, OMOTE K, OKAMOTO N, et al. High performance liquid chromatography of brassinosteroids in plants with derivatization using 9-phenanthreneboronic acid[J]. J Chromatogr, 1989, 469: 424-428. |
| [13] | GAMOH K, SAWAMOTO H, KAWATSUTO S, et al. Ferroceneboronic acid as a derivatization reagent for the determination of brassinosteroids by high-performance liquid chromatography with electrochemical detection[J]. J Chromatogr, 1990, 515: 227-231. |
| [14] | 潘加亮, 谭微, 李攻科, 等. 油菜素甾醇激素分析的研究进展[J]. 色谱, 2011, 29(2): 105-110. PAN Jialiang, TAN Wei, LI Gongke, et al. Progress in the analysis of brassinosteroids[J]. Chin J Chromatogr, 2011, 29(2): 105-110. (in Chinese) |
| [15] | LIU X, DONG F, HU H, ZHENG Y. Residue analysis of propionylbrassinolide in fruit and vegetables by GC-MS[J]. 2009, 69(11/12): 1453-1456. |
| [16] | 魏泱, 丁明玉. 蒸发光散射检测技术[J]. 色谱, 2000, 18(5): 398-401. WEI Yang, DING Mingyu. The technoly of evaporative light scattering detecor[J].Chin J Chromatogr, 2000, 18(5): 398-401. (in Chinese) |
| [17] | 范玉兰, 杨玮, 王美华, 等. Horwitz方程在比对试验质量评估中的应用[J]. 劳动医学, 2001, 18(4): 209-211. FAN Yulan, YANG Wei, WANG Meihua, et al. Application of Horwitz equation to quality assessment of verification testing[J]. J Labour Med, 2001, 18(4): 209-211. (in Chinese) |
| [18] | 冯埃生, 邹汉法, 汪海林, 等. 影响高效液相色谱/挥发激光散射检测器检测性能基本因素的考察[J]. 药物分析杂志, 1996, 16(6): 414-417. FENG Aisheng, ZOU Hanfa, WANG Hailin, et al. Investigation of the influencing factors on the basic performance of HPLC-ELSD[J]. Chin J Pharm Anal, 1996, 16(6): 414-417. (in Chinese) |
| [19] | THOMPSON M, ELLISON S L R, WOOD R. The International Harmonized Protocol for proficiency testing of analytical chemistry laboratories (IUPAC technical report)[J]. Pure Appl Chem, 2006, 78(1): 145-196. |
 2014, Vol.16
2014, Vol.16 


