新烟碱类杀虫剂具有触杀、内吸、胃毒、拒食和驱避作用,以及高效、低毒、安全和广谱的特点,对刺吸式口器害虫及一些鳞翅目和鞘翅目害虫有特效[1 , 2]。目前占市场份额较大的烟碱类杀虫剂品种主要有吡虫啉、啶虫脒、烯啶虫胺、噻虫啉、噻虫嗪、氟虫胺和噻虫胺等[3]。研究发现,此类药剂除有很好的杀虫作用外,还能刺激作物生长、提高抗病性、诱导植株的多种生理变化等。Thielert[4]在棉花上的试验表明,使用吡虫啉拌种不仅能够防治苗期蚜虫,还能提高棉花的株高和根长。仪美芹等[5]研究发现,有效成分2.5 mg/株的70% 吡虫啉水分散粒剂能显著促进番茄植株生长,并提高番茄叶片和根系中CAT、SOD活性以及根系活力。国外已有关于烟碱类杀虫剂诱导植株产生防御性反应的报道,如Ford等[6]研究指出,吡虫啉和噻虫胺等可以诱导植株产生与植物防御反应相关的水杨酸。Graham等[7]认为,土壤施用吡虫啉、噻虫嗪等可以诱导植株产生系统获得抗病性。
噻虫啉(thiacloprid)是由德国拜耳农化公司和日本拜耳农化公司合作开发的新型氯代烟碱类杀虫剂,具有较强的内吸、触杀和胃毒作用,是防治刺吸式和咀嚼式口器害虫的高效药剂[8]。笔者等将噻虫啉应用于土壤处理防治番茄根结线虫及烟粉虱,取得了显著的效果[9 , 10]。但有关噻虫啉对作物生长发育及代谢的影响目前尚未见报道。因此,笔者以番茄为试材,初步研究了噻虫啉对番茄生长指标、叶片中5种保护酶活性以及根系活力的影响,以期为噻虫啉的合理使用提供依据。
植物试材:番茄Solanum lycopersicum L.品种为荷兰8号,购自山东省房村镇丰源种苗有限公司。
药剂与试剂:36%噻虫啉水分散粒剂(WG),由山东省联合农药工业有限公司提供。0.3% TritonX\|100,美国进口,上海江莱生物科技有限公司销售;4%聚乙烯吡咯烷酮(PVP),美国国际特品公司生产;蛋氨酸,日本进口,山东众鑫生物科技有限公司销售;其余试剂均为国产分析纯。
主要仪器:UV-2201型紫外分光光度计,日本岛津公司;GXZ智能型光照培养箱,宁波江南仪器厂。
盆栽试验于山东农业大学植物保护学院日光温室内进行。选用上口直径15 cm、高17 cm的花盆。土壤为未施用过农药的试验田土壤,过筛后装入花盆,每盆装土量均为2 kg。每盆移栽番茄幼苗1株,于2叶1心期时施药。噻虫啉按有效成分用量共设计6个处理剂量:1.0、1.5、2.0、2.5、3.0和 5.0 mg/株,[JP]每个处理重复3次,每个重复10盆,共30盆,另设清水处理为对照。在番茄苗周围划一圈浅沟,将噻虫啉按设计剂量溶于100 mL水中,均匀浇灌到沟里,随后覆土。清水对照只浇100 mL水。处理后定期观察番茄长势,30 d时测定番茄展开叶片数、株高、主根长、地上和地下部鲜重;同时测定番茄叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)的活性及根系活力。
参照刘太国等[11]的方法,略有改动。取噻虫啉处理后30 d的番茄植株由下向上第5~7片展开叶(每个重复10株),于冰上剪碎,混匀,称取9 g,均匀分为3份(3个子重复),放入预冷的研钵中,在液氮中充分研磨后转移到10 mL 离心管中,用适量预冷的、pH 7.8的磷酸缓冲液(内含0.1 mmol/L乙二胺四乙酸(EDTA)、质量分数0.3% 的TritonX-100及质量分数4%的聚乙烯吡咯烷酮)冲洗研钵并转移至离心管中,最后定容至8 mL。将管内溶液振荡混匀后于4 ℃下静置2 h,在4 ℃下以15 000 r/min的转速离心25 min,上清液即为SOD、POD、CAT、PAL和PPO的粗提取液,于-20 ℃冰箱中保存备用。
采用四氮唑蓝(NBT)法[12]。以抑制NBT光化还原50%的酶量为1个酶活性单位U,结果以U/(min[DK]·g FW)表示。
采用愈创木酚比色法[12],并略加改进。取3 mL反应混合液(混合液配制:50 mL 0.05 mol/L、pH 6.0的磷酸缓冲液,28 [WTBZ]μ[WTB1]L 0.1%的愈创木酚和19 [WTBZ]μ[WTB1]L 30%的 H2O2)于试管中,加入1 mL稀释5倍的粗酶液。对照组不加酶液,而加入等体积的磷酸缓冲液。随后立即测定吸光度值A470的变化,每30 s读数1次,以1 min 内A470的变化值为1个酶活力单位U,结果以U/(min[DK]·g FW)表示。
参照邹琦[13]的方法,略有改动。向5 mL磷酸缓冲液(0.1 mol/L,pH 7.0)中加入0.2 mL粗酶液,于25 ℃预热后,加入1 mL 0.1%的 H2O2,并立即测定吸光度值A240在4 min内的变化,每30 s读数1次,以1 min内 1 g样品A240值改变0.01为1个酶活力单位U,结果以U/(min[DK]·g FW)表示。
参照汤章城[14]和刘太国等[11]的方法,略加改动。取2.4 mL硼酸钠缓冲液(0.l mol/L,pH 8.8)于试管中,加入0.l mL粗酶液,摇匀后加入1 mL以该硼酸钠缓冲液配制的 0.02 mol/L的L-苯丙氨酸,混匀, 于45 ℃水浴中反应15 min后,立即放入冰浴中终止反应。以不加酶液而加相同体积磷酸缓冲液为空白对照进行调零,测定A290值。以1 min内 A290值变化0.01为1个酶活力单位U,结果以U/(min[DK]·g FW)表示。
采用邻苯二酚法[15]。以1 min内 A420值变化0.01为1个酶活力单位U,结果以U/(min·g FW)表示。
采用氯化三苯基四氮唑(TTC)法[13]。
采用SPSS16.0 软件的最小显著差数法(LSD)对数据进行差异显著性分析。
由表1数据可以看出:5.0 mg/株噻虫啉处理后30 d,对番茄幼苗的展开叶片数、株高、根长和植株鲜重均有轻微的抑制作用;3.0 mg/株噻虫啉处理与清水的效果相当,对番茄幼苗生长基本无影响;1.0、1.5、2.0和2.5 mg/株噻虫啉处理则可显著促进番茄幼苗生长,株高均高于对照,幼苗根长分别比对照增加15.5%、27.0%、39.0%和35.5%,但1.0 mg/株处理组番茄幼苗地上部和地下部鲜重与对照无显著差异,而2.0 mg/株处理的促进作用最显著,番茄植株地上部和地下部鲜重分别比对照增加36.8%和54.5%。
| 表 1 噻虫啉处理番茄幼苗后30 d对植株生长量的影响 Table.1 Effects of thiacloprid on the tomato growth at 30 days after treatments |
由 图1 可知,在处理后30 d,不同剂量的噻虫啉处理均提高了番茄叶片中SOD、POD、CAT、PAL和PPO的活性,且5种酶的活性均随噻虫啉施用剂量的增加呈现出先升高后降低的趋势。其中,SOD活性在2.0 mg/株处理时达到最大值[JP]14.2 U/(min·g FW),比对照高49.5% (图1A);POD活性增加了13.7%~47.0%,在2.5 mg/株处理时达到最大值46.0 U/(min[DK]·g FW) (图1B);CAT活性在2.5 mg/株处理时最高,为62.4 U/(min·g FW),比对照高36.7%,但与2.0和3.0 mg/株处理没有显著差异 (图1C);除1.0 mg/株处理PAL的活性与对照差异不显著外,其他处理与对照之间均达显著性差异水平,但各处理之间差异不显著 (图1D)。1.0、1.5和5.0 mg/株处理的PPO活性与对照无显著差异,2.0、2.5和3.0mg/株处理PPO活性均显著高于对照,其中2.0 mg/株的处理比对照提高29.6%,为47.9 U/(min·g FW) (图1E)。
由由 图1F可看出,1.0、1.5、2.0、2.5、3.0和5.0 mg/株噻虫啉处理番茄幼苗后30 d,均在一定程度上提高了番茄根系活力,比对照分别提高了2.7%、8.7%、33.1%、17.5%、15.9%和13.0%,其中2.0 mg/株处理组根系活力最高,显著高于对照。
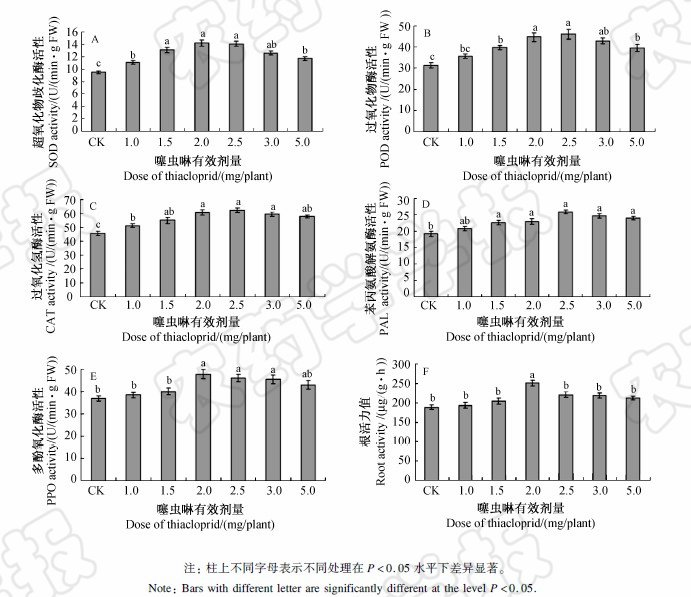 | 图 1 噻虫啉不同处理对番茄幼苗叶片保护酶活性及根系活力的影响 Fig.1 Effects of thiacloprid on protective enzyme activities in leaves and root vigor of tomato seedlings |
植株展开叶片数、株高、根长、鲜重等是评价作物生长态势的最基本指标。本研究发现,噻虫啉在1.0~2.5 mg/株范围内,均可明显促进番茄植株的展开叶片数、株高、根长及鲜重,其中2.0 mg/株的促进效果最明显。以1.0~5.0 mg/株噻虫啉处理番茄幼苗后,幼苗株高、根长、鲜重、保护酶活性及根系活力等各项生理生化指标均随噻虫啉处理剂量的增高呈现出先升高后降低的变化趋势,不同之处在于,3.0 mg/株噻虫啉处理组番茄幼苗各项生理指标与对照相比无显著性差异,而5.0 mg/株处理对番茄植株生长已有轻微的抑制作用,但这2个剂量处理组保护酶活性和根系活力仍高于对照。若噻虫啉剂量继续增加,番茄幼苗的生化指标则有可能被抑制。这表明噻虫啉在适当的剂量范围内可以促进作物的生长和代谢,而高剂量则可能会产生抑制作用,因此在实际用药过程中需要选择合适的施药剂量。
番茄叶片保护酶的活性与植物的抗逆性有关。SOD、POD、CAT能有效清除O-·2、OH·等自由基,从而使细胞膜免受其伤害,并延缓植株衰老[ 16,17, 18, 19, 20, 21]。PAL是植物苯丙烷类代谢途径的关键酶之一,在植物色素形成、细胞分化和木质化过程中发挥重要作用,并参与植物抗病与抗虫过程。多数研究认为,PAL活性的增强与抗病性呈正相关[22]。PPO可以催化酚类物质合成木质素的反应,促进细胞壁木质化以抵抗病原菌的侵害[ 23 - 24]。植物根系是植物体重要的吸收和合成器官,根的生长情况和活力水平直接影响植株地上部的营养状况及产量水平,根系活力是指植物根系生理机能(包括吸收能力、合成代谢能力等)的活动能力[25]。仪美芹等[5]的研究表明,吡虫啉对番茄生长的促进作用与其对番茄叶片和根系中的CAT、 SOD及根系活力的影响有关。噻虫啉可促进番茄的生长可能也得益于其对番茄叶片保护酶活性和根系活力的促进作用。本研究中,不同剂量的噻虫啉处理均提高了番茄叶片保护酶的活性,而保护酶活性的增强可提高番茄植株对病虫害的抗逆性,从而促进番茄植株体内活性氧代谢平衡,减轻有毒物质对细胞的毒害作用,从而在一定程度上促进番茄的生长。
本研究只考察了噻虫啉处理后30 d对番茄植株的影响,随着番茄的生长发育,其对不同生育期番茄植株生长量、各种保护酶活性及作物产量的影响还有待进一步研究,噻虫啉在田间使用的最佳剂量、施用时间以及施药次数等也还需进一步研究,以获得最佳的应用效果。
| [1] | JESCHKE P, NAUEN R. Neonicotinoids-from zero to hero in insecticide chemistry[J]. Pest Manag Sci, 2008, 64(11): 1084-1098. |
| [2] | 须志平. 新烟碱类杀虫剂在作物保护方面的应用[J]. 世界农药, 2009, 31(1): 18-21. XU Zhiping. Applied aspects of neonicotinoid uses in crop protection[J]. World Pestic, 2009, 31(1): 18-21. (in Chinese) |
| [3] | JESCHKE P, NAUEN R, SCHⅡDLER M, et al. Overview of the status and global strategy for neonicotinoids[J]. J Agric Food Chem, 2011, 59(7): 2897-2908. |
| [4] | THIELERT W. A unique product: the story of the imidacloprid stress shield[J]. Pflanzenschutz Nachrichten-Bayer-English Edition, 2006, 59(1): 73-84. |
| [5] | 仪美芹, 姜兴印, 李学锋, 等. 吡虫啉对番茄幼苗根系活力及生理生化指标的影响[J]. 植物保护, 2010, 36(2): 71-74. YI Meiqin, JIANG Xingyin, LI Xuefeng, et al. Effects of imidacloprid on tomato growth, physiology and biochemistry[J]. Plant Protection, 2010, 36(2): 71-74. (in Chinese) |
| [6] | FORD K A, CASIDA J E, CHANDRAN D, et al. Neonicotinoid insecticides induce salicylate-associated plant defense responses[J]. Proc Natl Acad Sci USA, 2010, 107(41): 17527-17532. |
| [7] | GRAHAM J H, MYERS M E. Soil application of SAR inducers imidacloprid, thiamethoxam, and acibenzolar-S-methyl for citrus canker control in young grapefruit trees[J]. Plant Dis, 2011, 95(6): 725-728. |
| [8] | 张冲, 葛峰, 单正军, 等. 噻虫啉环境行为研究[J]. 农药, 2010, 49(11): 830-833. ZHANG Chong, GE Feng, SHAN Zhengjun, et al. Study on environmental behavior of thiacloprid[J]. Agrochemicals, 2010, 49(11): 830-833. (in Chinese) |
| [9] | DONG S, QIAO K, WANG H Y, et al. Dissipation rate of thiacloprid and its control effect against Bemisia tabaci in greenhouse tomato after soil application[J/OL]. Pest Manag Sci, 2014. http://onlinelibery. wiley.com/doi/10.1002/ps.3690/fall |
| [10] | DONG S, QIAO K, ZHU Y, et al. Managing Meloidogyne incognita and Bemisia tabaci with thiacloprid in cucumber crops in China[J]. Crop Prot, 2014, 58: 1-5. |
| [11] | 刘太国, 石延霞, 文景芝, 等. 水杨酸诱导烟草对TMV的抗性和PAL活性变化研究[J]. 植物病理学报, 2003, 32(2): 190-191. LIU Taiguo, SHI Yanxia, WEN Jingzhi, et al. Changes of the PAL activity and induced resistance to TMV in tobacco treated with SA and inoculated with TMV[J]. Acta Phytopathologica Sinica, 2003, 32(2): 190-191. (in Chinese) |
| [12] | 郝再彬, 苍晶, 徐仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2004. HAO Zaibin, CANG Jing, XU Zhong. Plant Physiology Experiment[M]. Harbin: Harbin Institute of Technology Press, 2004. (in Chinese) |
| [13] | 邹琦. 植物生理生化试验指导[M]. 北京: 中国农业出版社, 1995. ZOU Qi. Experimental Guidance of Plant Physiology and Biochemistry[M]. Beijing: China Agricultural Press, 1995. (in Chinese) |
| [14] | 汤章城. 现代植物生理学实验指南[M]. 北京: 科学出版社, 1999. TANG Zhangcheng. Guide of Experiments on Modern Plant Physiology[M]. Beijing: Science Press, 1999. (in Chinese) |
| [15] | 于凤鸣, 田文琳. 葡萄叶片中多酚氧化酶的研究[J]. 黑龙江八一农垦大学学报, 1999, 11(1): 32-34. YU Fengming, TIAN Wenlin. The study on the activity of PPO in leave of grape[J]. J Heilongjiang August First Land Reclamation Univ, 1999, 11(1): 32-34. (in Chinese) |
| [16] | 朱友林, 刘纪麟. 受玉米大斑病菌侵染后玉米抗感近等基因系SOD动态变化的研究[J]. 植物病理学报, 1996, 26(2): 133-137. ZHU Youlin, LIU Jilin. Dynamic changes of SOD in resistant and susceptible near isogenic lines of maize during infection with Exserohilum turcicum[J]. Acta Phytopathologica Sinica, 1996, 26(2): 133-137. (in Chinese) |
| [17] | GARCIA P, SOLORZANO E, PETEIRA B, et al. Induction of peroxidase and chitinase activity by Altemaria solani in five tomato cultivars with different susceptibility degree to this fungus[J]. Revista de Protección Vegetal, 1998, 13(2): 91-95. |
| [18] | 余淑文, 汤章城. 植物生理与分子生物学[M]. 北京: 科学出版社, 1998. YU Shuwen, TANG Zhangcheng. Plant Physiology and Molecular Biology[M]. Beijing: Science Press, 1998. (in Chinese) |
| [19] | 潘汝谦, 黄旭明, 古希昕. 活性氧清除酶类在黄瓜感染霜霉病过程中的活性变化[J]. 植物病理学报, 1999, 29(3): 287-288. PAN Ruqian, HUANG Xuming, GU Xixin. Activity change in active-oxygen scavenging enzymes in cucumber infected by downy mildew[J]. Acta Phytopathologica Sinica, 1999, 29(3): 287-288. (in Chinese) |
| [20] | 田敏, 饶龙兵, 李纪元. 植物细胞中的活性氧及其生理作用[J]. 植物生理学通讯, 2005, 41(2): 235-238. TIAN Min, RAO Longbing, LI Jiyuan. Reactive oxygen species (ROS) and its physiological functions in plant cells[J]. Plant Physiology Communications, 2005, 41(2): 235-238. (in Chinese) |
| [21] | 王关林, 邢卓, 潘凌子, 等. 蜂毒肽对农作物生理指标及防御系统酶影响的研究[J]. 作物学报, 2006, 32(4): 593-596. WANG Guanlin, XING Zhuo, PAN Lingzi, et al. Effects of melittin on the physiological indices and defensive enzymes in crops[J]. Acta Agronomica Sinica, 2006, 32(4): 593-596. (in Chinese) |
| [22] | 刘喜存, 刘红彦, 倪云霞, 等. 不同化学诱抗剂对金银花叶片防御酶系的影响[J]. 植物保护, 2009, 35(2): 75-77. LIU Xicun, LIU Hongyan, NI Yunxia, et al. Effects of different chemical inducers on the defense-related enzymes in honeysuckle[J]. Plant Protection, 2009, 35(2): 75-77. (in Chinese) |
| [23] | 丁志勇, 许崇任, 王戍疆. 转Bt基因抗虫棉与常规棉中几种同工酶的比较–转基因植物安全性评价生理指标初探[J]. 生态学报, 2001, 21(2): 332-336. DING Zhiyong, XU Chongren, WANG Shujiang. Comparison of several important isoenzymes between Bt cotton and regular cotton[J]. Acta Ecologica Sinica, 2001, 21(2): 332-336. (in Chinese) |
| [24] | 张雪梅, 陈雁君, 谷昊明, 等. 吡虫啉对生菜多酚氧化酶活性的影响[J]. 中国卫生检验杂志, 2008, 18(3): 549-550. ZHANG Xuemei, CHEN Yanjun, GU Haoming, et al. Effects of imidacloprid on PPO of lettuce[J]. Chinese J Health Lab Technol, 2008, 18(3): 549-550. (in Chinese) |
| [25] | 冯玉龙, 张亚杰, 朱春全. 根系渗透胁迫时杨树光合作用光抑制与活性氧的关系[J]. 应用生态学报, 2003, 14(8): 1213-1217. FENG Yulong, ZHANG Yajie, ZHU Chunquan. Relationship between photo-inhibition of photosynthesis and reactive oxygen species in leaves of poplars suffering root osmotic stress[J]. Chinese J Appl Ecol, 2003, 14(8): 1213-1217. (in Chinese) |
 2014, Vol.16
2014, Vol.16 


