硫色满酮类化合物存在于百合科等天然产物中,具有广泛的生理活性[1]。索海涛等[2]合成了6-氟硫色满酮类化合物,发现其具有一定的抗肿瘤活性;方林等[3]合成了6,8-二氯硫色满酮类衍生物,发现其具有一定的抗菌活性,其中 3 位引入取代基后能使其抗真菌活性显著增强。近年来,对3-次苄基取代[1]、3-Mannich碱取代[3]、3-溴取代[3, 4]、3-亚甲基卤代[5]的硫色满酮衍生物的合成及其在医药领域的抑菌活性研究很多,尚未见有关其在农药领域进行抑菌活性研究的报道。笔者以亚甲二氧基为起始原料,经过溴化、硫化、环化和羟醛缩合反应,设计合成了19个未见文献报道的6,7-亚甲二氧基硫代苯并二氢吡喃-4-酮类目标化合物,对其结构进行了确认,并初步测定了其抑菌活性。目标化合物的合成路线见Scheme 1。
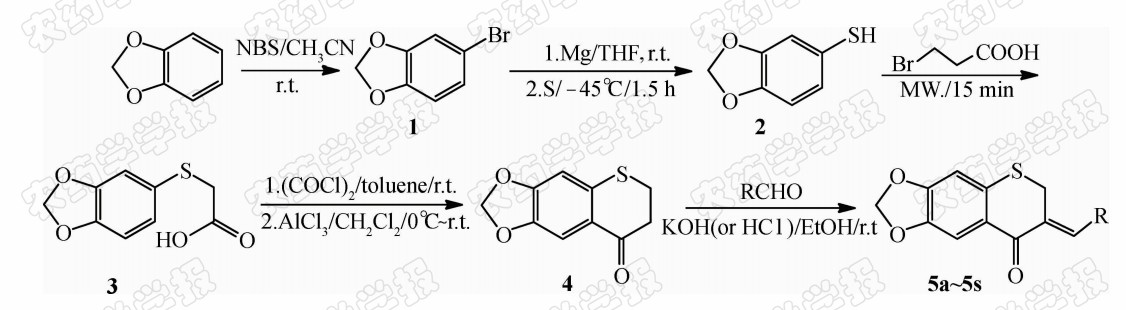 | Scheme 1 |
XT-4型显微熔点测定仪(温度未校正,北京泰克仪器有限公司);Bruker Tensor 27 FF-IR型红外光谱仪和Bruker Avance Ⅲ 500核磁共振仪(瑞士Bruker BioSpin公司生产)(以TMS为内标,CDCl3为溶剂);Finnigan Trace型质谱仪(美国Thermo Fisher公司)。
对照药剂噻菌灵(thiabendazole)和 NFDA1 霉灵(hymexazol)原药,由北京颖泰嘉和科技股份有限公司生产,纯度均为98.5%。胡椒环、NBS、升华硫和溴丙酸,均为上海海曲化工有限公司产品,有效成分质量分数>98%;其余试剂均为市售分析纯。
参考文献[9]方法制备。得白色粉末状固体,m.p.148~150℃,收率89%。
参考文献[10]方法制备。得白色针状晶体,m.p.101~103 ℃,收率83%。1H NMR, δ: 2.91(t,2H,J=6.5 Hz,- CO-CH2 -),3.20(t,2H,J=6.5 Hz,-SCH2-),5.99(s,2H,-OCH2-O-),6.72(s,1H,Ar-H),7.56(s,1H,Ar-H)。
参考文献[11]方法制备。以 5a 为例:室温下,将0.208 g (1 mmol)化合物 4 、1.5 mL 10%的氢氧化钾水溶液和3 mL无水乙醇分别加入25 mL圆底烧瓶中,混合均匀后加入0.138 g(1.3 mmol) 苯甲醛,室温下反应5 h后,在冰水浴中冷却10 min,抽滤得黄色固体。硅胶柱层析纯化[V(石油醚) ∶V(乙酸乙酯)=2 ∶1),得黄色片状晶体 5a (0.231 g,收率为78%),m.p.131~133 ℃。同法合成化合物 5b~5q 。
参考文献[12]方法制备。以 5r 为例:室温下将0.208 g (1 mmol)化合物 4 、3 mL的浓盐酸和3 mL无水乙醇分别加入至25 mL的圆底烧瓶中,混合均匀后加入0.159 g(1.3 mmol)对羟基苯甲醛,室温下反应8 h后抽滤,滤液旋干后用硅胶柱层析纯化([V(石油醚) ∶V(乙酸乙酯)=3 ∶1),得黄色晶体(0.172 g,收率55%),m.p.200~202 ℃。同法合成化合物 5s 。
7种供试病原菌均由西北农林科技大学农药研究所提供。以噻菌灵和 NFDA1 霉灵为药剂对照,丙酮为空白对照,采用菌丝生长速率法[13]测试目标化合物在50 mg/L下对7种供试病菌的抑菌活性。
羟醛缩合反应有酸催化和碱催化2种反应机理,通常情况下,碱催化的效果(反应时间和产率)优于酸催化,因此本研究中大部分目标化合物的制备均采用了碱催化的方法,只对于羟基取代醛的反应,采用了酸催化。中间体 2 产率较低的原因是,在后处理减压蒸馏过程中未控制好温度,因此产物损失较多。
目标化合物的理化数据及ESI-MS数据见表1, 1H NMR数据见表2。在1H NMR谱图中,二氧亚甲基(-O-CH2-O-)的质子表现为单峰,化学位移在6.03左右;与苯环相连的双键(=CH-)的质子表现为单峰,化学位移在7.67附近;与硫相连的亚甲基(-S-CH2-)上的质子表现为单峰,化学位移在 4.04附近。红外光谱数据未列出。目标化合物的波谱数据与预期的分子结构相吻合。
| 表1 化合物5a~5s的理化性质及质谱数据 Table 1 Physico-chemical and ESI-MS data of 5a-5s |
| 表2 化合物5a~5s的核磁共振氢谱Table 2 1H NMR data of 5a-5s compounds |
在50 mg/L 下,19个目标化合物对供试病原菌均有不同程度的抑菌活性(见表3)。经过3次重复实验,化合物 5h、5i、5j和5q 对番茄灰霉的抑制率均超过60%,化合物 5b~5e、5h~5l、5n~5r 对马铃薯干腐病菌的抑制作用尤佳,均超过了对照药剂'Û 霉灵。此类化合物深入的结构-活性关系值得进一步研究。
| 表3 化合物5a~5s在50 mg/L下的抑菌活性 (抑制率/%,72 h) Table 3 The antifungal activity of compounds 5a-5s under 50 mg/L(Inhibition rate/%,72 h) |
| [1] | NAKIB A T, BEZJAK V, MEEGAN M J, et al.Synthesis and antifungal activity of some 3-benzylidenechroman-4-ones, 3-benzylidenethiochroman-4-ones and 2-benzylidene-1-tetralones[J]. Eur J Med Chem, 1990, 25(5):455-462. |
| [2] | 索海涛, 李春钠, 李海晶.(顺)-3-(氯代亚甲基)-6-氟-硫色满-4-酮抗肿瘤机理的初步研究[J]. 科技咨询, 2012(35):1-3. SUO Haitao, LI Chunna, LI Haijing.The study on anti-tumor mechanism of(z)-3-(chloromethylene)-6-fluorothiochroman-4-one[J].Sci Technol Inf, 2012(35):1-3.(in Chinese) |
| [3] | 方林, 郭春, 张炜.6, 8-二氯硫色满酮衍生物的合成及抗真菌活性[J]. 沈阳药科大学学报, 1998, 15(1):8-12. FANG Lin, GUO Chun, ZHANG Wei.Synthesis and antifungal activity of 6, 8-dichlorthiochromanones[J].J Shenyang Pharm Univ, 1998, 15(1):8-12.(in Chinese) |
| [4] | 齐平, 靳颖华, 郭春, 等.3-次苄基硫色满酮类化合物的合成及其体外抗真菌活性[J]. 中国新药杂志, 2004, 13(2):141-143. QI Ping, JIN Yinghua, GUO Chun, et al.Synthesis of 3-benzylthiochromanones and their in vitro antifungal activity[J].Chin New Drugs J, 2004, 13(2):141-143.(in Chinese) |
| [5] | FANG B L, MA Z Y, Wang G, et al.Synthesis and antifungal activity of(Z)-3-(bromomethylene) thiochroman-4-ones[J]. Internet J Chem, 2010, 2(1):143-146. |
| [6] | ZYSMAN-COLMAN E, ARIAS K, SIEGELA J S.Synthesis of arylbromides from arenes and N-bromosuccinimide(NBS) in acetonitrile-A convenient method for aromatic bromination[J]. Can J Chem, 2009, 87(2):440-447. |
| [7] | HITOTSUYANAGI Y, KOBAYASHI M, TAKEYA K.Synthesis of 4-thia-2-azapodophyllotoxin, a new analogue of the antitumour lignan podophyllotoxin[J]. J Chem Soc Perkin Trans, 1995, 1(11):1387-1389. |
| [8] | 肖立伟, 李慧章.微波辐射下 β -芳硫丙酸和硫色满酮的合成[J]. 有机化学, 2006, 26(7):979-982. XIAO Liwei, LI huizhang.Synthesis of β -arylthioethers of propionic acid and thiochromanones under microwave irradiation[J].Chin J Org Chem, 2006, 26(7):979-982.(in Chinese) |
| [9] | TRIDIB M, NANDAN J, NANDA S.Chemoenzymatic synthesis and resolution of compounds containing a quaternary stereocenters adjacent to a carbonyl group[J]. Tetrahedron:Asymmetry, 2008, 19(10):1224-1232. |
| [10] | THAPA U, THAPA P, KARKI R, et al.Synthesis of 2, 4-diaryl chromenopyridines and evaluation of their topoisomerase I and Ⅱ inhibitory activity, cytotoxicity, and structure-activity relationship[J]. Eur J Med Chem, 2011, 46(8):3201-3209. |
| [11] | CHENG X M, HUANG Z T, ZHENG Q Y.Topochemical photodimerization of (E)-3-benzylidene-4-chromanone derivatives from β -type structures directed by halogen groups[J]. Tetrahedron, 2011, 67(47):9093-9098. |
| [12] | 吴文君.植物化学保护实验技术导论[M]. 西安:陕西科技出版社, 1988. WU Wenjun.Introduction to Plant Chemical Protection Experiment Technology[M].Xi'an:Shaanxi Science and Technology Press, 1988.(in Chinese) |
 2013, Vol.15
2013, Vol.15 


