我国除草剂使用量约占所有农药使用量的47%左右,其中酰胺类除草剂的生产和使用量均排在几大除草剂品种前列,而乙草胺是目前酰胺类除草剂中销量最大的一种[1]。乙草胺是由美国孟山都公司开发的选择性芽前除草剂,其作用机制主要是通过干扰植物体内核酸代谢及蛋白质合成,使幼芽和幼根停止生长。研究表明,乙草胺是一种环境内分泌干扰物[2],能影响两栖类动物甲状腺激素的代谢作用,进而对其大脑发育产生影响,可对泥鳅肝脏中乙酰胆碱脂酶及蝌蚪肝脏内超氧化物歧化酶、谷胱甘肽过氧化物酶产生抑制作用,对热带爪蟾胚胎具有致畸性,可引起爪蟾腹部水肿,面部畸形,脊柱、尾巴弯曲等[3, 4, 5, 6, 7, 8];此外,乙草胺对土壤中的微生物也具有危害作用[9]。孟山都公司在推出乙草胺时,由于被怀疑有致癌的危害性,美国环保局担心其会通过地下水进入饮水系统,直到1994年才予以登记进入市场[10]。我国从20世纪90年代初开始将乙草胺产业化,现已有多家企业进行生产[10],年生产能力达到5万吨[1]。
农药生产厂在生产过程中排放的废水、废气等对周边环境具有较大的危害。余世清等[11]研究了某废弃农药厂周边土壤中六六六和滴滴涕的污染特征,发现六六六和滴滴涕的残留量很大且在垂直方向发生了迁移,虽然有一定的降解,但该区域对人仍有致癌风险;汪光等[12]研究了北京东南化工区土壤中有机氯农药的污染状况,发现厂区及周边土壤中有机氯农药残留量明显高于一般农业及城市土壤;朱雪强等[13]研究发现,某农药厂废水中四氯化碳和氯仿对周边土壤污染较明显;韩文亚等[14]从不同风向、不同距离分别对某滴滴涕农药厂周边土壤及农作物取样检测,发现其均受到了不同程度的污染。但目前对于污染在环境中的分布(如不同土层深度、不同距离、不同区域等)尚缺少综合的分析,也未见有关土壤与农作物残留检出量对比分析的报道。因此,笔者选择具有代表性的乙草胺生产企业,根据不同影响因素分别对土壤及农作物进行取样,通过气相色谱[15, 16]检测,并运用统计学(单因素方差分析、回归分析)方法对数据进行分析,旨在探明厂区周边土壤和农作物中的污染分布情况及其影响因素,以及土壤和农作物污染程度之间的相关关系。
我国规定乙草胺在玉米中的最大允许残留限量(MRL)标准为50 μ g/kg,大豆和花生(仁)中为100 μ g/kg,油菜籽中为200 μ g/kg[17],但未见关于乙草胺在小麦及其他谷物中的MRL标准,因此本研究引用了日本制定的小麦及其他谷物中乙草胺的MRL标准(20 μ g/kg)[18]。
研究对象是位于江苏省无锡市某乙草胺农药厂周边的土壤及农作物。该地区年均降雨量为1 025.6 mm,平均气温15.2 ℃,该区域耕地一直种植水稻及少部分小麦、油菜,没有乙草胺用药史。该农药厂是国家农药生产定点企业,占地约4.5×104 m2,其所产生的废水经简单处理后输送到本市污水处理厂统一处理,厂内污水处理区位于厂区南部,处理设备为非全封闭设施。农药厂东面依次为林地(0~40 m范围,内有一条污水沟)、耕地(40 m以外),南面依次为水塘(0~40 m范围)、耕地(40 m 以外)。由于其西面和北面土地已被开发为道路建设用地,因此只针对东面、南面和东北方向的情况进行了研究。取样点分布具体如图1所示。土壤样品从距离工厂围墙0、10、50和100 m处依次取点,每个点从上向下分3层(0~3 cm、5~10 cm和15~20 cm)分别取样;取样点共分为3个区域:东北区域(EN)3个点,东面2个区域(E1、E2)共8个点,南面2个区域(S1、S2)共4个点;另外东北区域从污水沟中再取1个土样(EW);最终共取土壤样品46份。农作物样品分别从距离工厂围墙50和100 m点取样,共9个取样点,每个点取3份平行样品,共27份样品(包括油菜花3份、小麦麦穗部分6份及水稻茎叶部分18份)。取样时间为2013年4月。
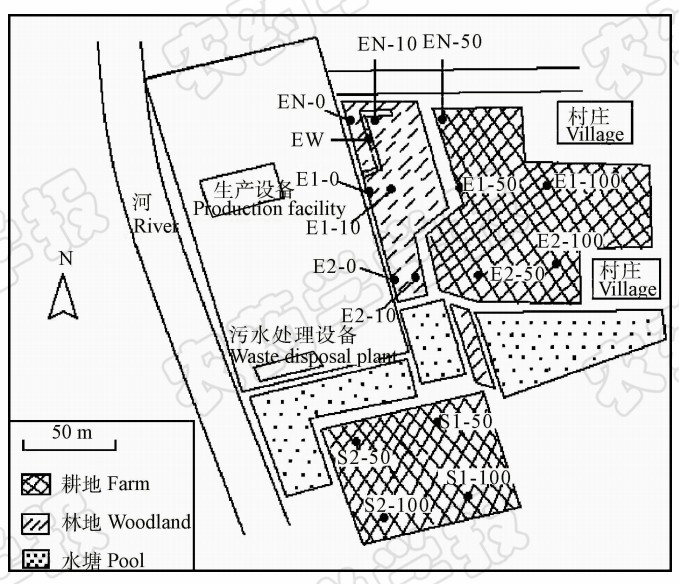 | 图1取样点分布 Fig.1 Sampling sites |
土壤中乙草胺的提取:土样经真空冷冻干燥后,过80 mm筛,称取15 g加入30 mL乙腈-水[ V (乙腈) ∶ V (水) =5 ∶1],超声提取20 min,其他步骤参考王建华等[15]的提取方法,最后用2 mL石油醚溶解,待净化。
油菜、小麦和水稻样品的提取:参考王建华等[15]的方法并进行了改进。样品经真空冷冻干燥后粉碎,用乙腈-水[ V (乙腈) ∶ V (水)=1 ∶1]超声提取;取 10 mL旋蒸至干,用2 mL石油醚溶解,待净化。
样品净化:参考文献[19]方法,改用石油醚-乙酸乙酯[ V (石油醚)∶ V (乙酸乙酯)=9 ∶1]作洗脱液,最后用1 mL正己烷定容。
进样口温度250 ℃;程序升温:150 ℃(3 min),以 5 ℃/min 升至203 ℃(5 min),后运行 250 ℃(5 min);检测器温度280 ℃;流速1 mL/min[16]。
采用色谱纯己烷配制乙草胺质量浓度分别为0.02、0.05、0.1、0.2、0.5、1和2 μ g/mL 的标准工作溶液,以进样质量浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线,得标准曲线方程为 y = 41 690 x-873.22, R 2 = 0.999 7;于1、10和50 μ g/kg添加水平下分别进行添加回收试验,重复5次,得回收率为80.1% ~95.4%,相对标准偏差( RSD )为2.24% ~5.43%。
表1为土壤样品中乙草胺的检出量。其中,农药厂东北区域(EN系列取样点)土壤中乙草胺的检出量最高,其EN-0和EN-10取样点15~20 cm深土样所对应的最高检出量分别为151和141 μ g/kg;农药厂东面区域(E1、E2系列取样点)土壤中乙草 胺的检出量最低,在8.93~33.3 μ g/kg之间;南面区域(S1、S2系列取样点)只在距离农药厂50和100 m的耕地中取了土样,其乙草胺的检出量较高,在31.7~49.1 μ g/kg 之间;于农药厂东北部林地污水沟中所取土样中乙草胺的检出量为976 μ g/kg。
| 表1 土壤中乙草胺的残留量
Table 1 Acetochlor residues in soils |
分析原因,首先南面区域乙草胺的检出量均值较高,可能与距离农药厂污水处理设施较近有关,该区域受其影响较大,这与东北区域的情况相似,由于东北区域有一条农药厂的排污沟,厂区沉积的乙草胺经雨水冲刷作用通过该排污沟排出(沟内土壤中乙草胺的检出量高达976 μ g/kg),造成东北区域的均值也偏高。因此,根据统计分析,东北区域与南面区域差异性不显著;而东北区域与东面区域相比,虽然其个别采样点的检出量较高,但由于其他位点检出量与东面区域相近,所以统计显示两者之间差异也不显著;而E1和E2之间、S1和S2之间属于区域内部比较,因其受农药厂影响状况相似,所以结果显示差异特别不显著。
东面区域与南面区域间差异较显著,南面区域土壤中乙草胺的检出量均值大约是东面区域的2倍。其原因可能有两个:一是水体传播,南面区域耕地位置距离农药厂污水处理设备较近,根据调查,该污水处理设施属非封闭型,且工厂只是进行简单的处置,大量污水被简单储存于此等待输送到市区进一步处理,因此易造成挥发、扩散,同时由于南方降雨较多,乙草胺很容易通过渗透作用迁移到农药厂围墙和耕地之间的水塘,继而通过耕地用水进入土壤,造成残留;而东面区域耕地用水主要来自村庄前面受污染相对较轻的水塘,一定程度上避免了乙草胺通过水体进行传播。二是空气传播,根据天气网历史统计数据,该地区2012年10月到2013年3月期间每天(白天及晚上)的风向结果(各风向所占比例)为:北风17.2%,南风 4.9%,东风19.8%,西风5.2%,东南风13.0%,西南风1.6%,东北风15.6%,西北风10.9%。其中影响南面区域的风向有北风、东北风和西北风,所占比例为43.7%;影响东面区域的风向有西风、西南风和西北风,占17.7%。因此,厂区内部漂浮的污染颗粒通过空气对流作用对南面区域土壤及农作物造成的影响可能大于东面区域;此外,由于东面区域有一块宽40 m、长150 m左右的林地,树木的遮挡作用可能也阻止了部分污染颗粒的扩散。
分析其原因,首先,不同深度间差异不显著,可能是由于该区域地处南方,气候湿润多雨,而乙草胺有一定的水溶性,可在土壤中垂直方向上发生迁移,经过长时间积累,不同深度土层间浓度趋于平衡,所以未表现出差异性。其次,不同距离采样点之间差异不显著,一方面可能是因为通过空气传播、沉降作用等对农药厂周围100 m范围内土壤造成的影响程度相近,另一方面可能是由于该区域土地灌溉用水都是来自于农药厂周围的池塘,而池塘水受污染的程度相近,进而造成不同距离土壤样品中乙草胺的检出量差异不显著。
农作物样品(EN-50为油菜花,E1-50和E2-50为小麦麦穗,E1-100、E2-100、S1-50、S1-100、S2-50和S2-100为水稻茎叶)分别取自距离农药厂50和100 m的采样点。从表2中可看出,农作物中乙草胺的平均检出量范围为21.6~46.0 μ g/kg,其中南面区域的均值为39.5~46.0 μ g/kg,高于东部区域的21.6~30.1 μ g/kg,说明乙草胺在农作 物中造成了一定的蓄积。根据日本制定的乙草胺在小麦及其他粮谷中的MRL标准(20 μ g/kg),由于乙草胺具有一定的水溶性,且可以随水分发生迁移,所以该农药厂附近出产的油菜籽、小麦和稻米等具有潜在的安全风险。
分析乙草胺在农作物中沉积的原因,可能主要受两方面因素共同影响:一是乙草胺通过空气对流作用直接在植物体上吸附、沉积;二是乙草胺通过植物的传导作用,从土壤迁移到了植物体中。
| 表2 作物中乙草胺的残留量 Table2 Acetochlor residues in crops |
同一采样点土壤和农作物中乙草胺的平均检出量比较见图2。首先对2组数值进行相关性分析,从图3散点图可看出,作物中乙草胺含量与土壤中含量之间呈正相关,相关系数 r =0.91,对相关关系进行差异显著性检验,得| r |=0.91>0.666 4= r 0.05 (7),证明两者间相关性显著。进一步对其进行线性回归分析,求得线性回归方程为 y = 1.077 x -4.274, R 2=0.842 9。该结果表明,当土壤样品中乙草胺的检出量较高时,其相应的农作物样品中乙草胺的检出量也较高,即该区域土壤的环境质量影响了农作物的质量安全。农作物产地土壤环境质量作用于农产品生产的全过程,对于农产品安全起着至关重 要的作用,因此关注产地土壤环境有着重要的意义。
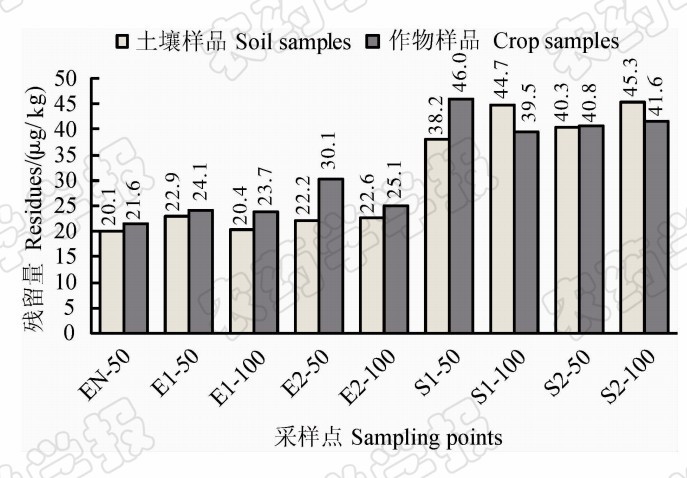 | 图2 同一采样点土壤和作物中乙草胺的残留量 Fig.2 Acetochlor residues in crops and soils in the same place |
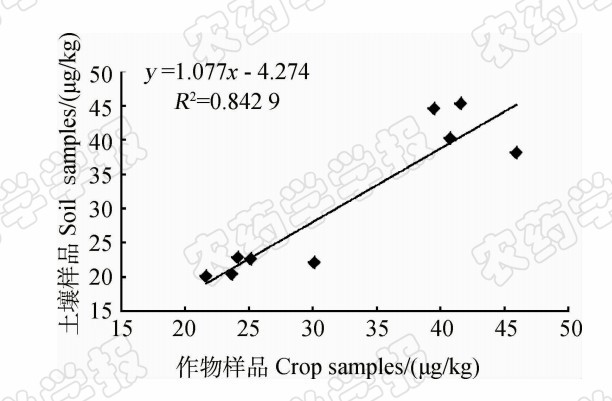 | 图3 土壤和农作物样品残留量散点分布图 Fig.3 The scatter diagram of acetochlor residues in soils and crops |
化学农药为现代农业的发展起到了巨大的推动作用,但农药生产所造成的环境污染问题也不容小觑。根据调查,某大型农药厂造成的环境污染使其周围地区新生儿的缺陷率明显增加[20]。本研究从几个方面对农药厂周边污染分布特征进行了分析,发现污染分布受多种因素(风向、灌溉水、降雨量等)影响。其中,受风向影响,农药厂南面区域乙草胺的检出量明显高于东面区域,表明所产生的污染可通过空气对流传播作用对环境造成影响,这与韩文亚等[14]的研究结果相吻合。但根据不同区域(东面与南面)土壤中乙草胺的检出量差异较显著,而东面区域不同距离(0~100 m范围内)土壤及农作物样品中乙草胺的检出量并未出现明显差异,则表明空气对流传播并非惟一的影响因素,其他如生产灌溉活动等也会对其造成影响。郑和辉等[21]研究了乙草胺在土壤中的移动性,认为乙草胺属于移动性较弱的农药,其迁移能力受土壤性质、农药量多少及降雨等因素影响。本研究发现,在耕作层土壤中,垂直方向上并未出现明显的污染差异,考虑到当地降雨较多,分析乙草胺可能在土壤中随水发生了垂直迁移。而东北区域15~20 cm深层土壤中乙草胺的浓度较高主要是受排污渠的影响,这与朱雪强等[13]的研究结果相吻合,即排污渠中农药对周围土壤具有横向渗透作用。
该农药厂周围农作物样品中乙草胺的残留量均超出了日本规定的相应MRL标准(20 μ g/kg),尽管由于时间原因未采集检测成熟的小麦穗、稻穗及油菜籽样品,但根据油菜花、小麦和水稻茎叶样品的检测结果,该地区的农产品质量安全问题令人担忧。此外,对农药厂周边近距离内存在的污染,实际生产中一般可通过不种植农作物的方式加以解决,因此后续还需重点研究中远距离范围内的农田污染情况及对农作物种植的影响。
| [1] | 陆明若.酰胺类除草剂国内外市场状况及未来前景[J]. 农药市场信息, 2009(16):11-13. LU Mingruo.The market profile and future prospect of acetamide-group herbicides[J].Pestic Mar Inf, 2009(16):11-13.(in Chinese) |
| [2] | 刘先利, 刘彬, 邓南圣.环境内分泌干扰物研究进展[J]. 上海环境科学, 2003(1):57-63. LIU Xianli, LIU Bin, DENG Nansheng.Study progress of environmental endocrine disruptors[J].Shanghai Environ Sci, 2003(1):57-63.(in Chinese) |
| [3] | 胡伟军.除草剂乙草胺对雄性小鼠生殖毒性的研究.长春:吉林大学, 2010. HU Weijun.The study on reproductive toxicity of herbicide acetochlor in male mice.Changchun:Jilin University, 2010.(in Chinese) |
| [4] | CRUMP D, WERRY K, VELDHOEN N, et al.Exposure to the herbicide acetochlor alters thyroid hormone-dependent gene expression and metamorphosis in xenopus laevis[J]. Environ Health Perspec, 2002, 110(12):1199-1205. |
| [5] | 李贤宾, 李少南, 袁丙强, 等.乙草胺对热带爪蟾的早期致畸效应及遗传毒性研究[J]. 农药学学报, 2011, 13(1):40-46. LI Xianbin, LI Shaonan, YUAN Bingqiang, et al.Teratogenic effect and genotoxicity of acetochlor on embryos and tadpoles of West-African clawed frog (Xenopus tropicalis)[J].Chin J Pestic Sci, 2011, 13(1):40-46.(in Chinese) |
| [6] | HILLER E, ER ANSK Y ' S, KRASCSENITS Z, et al.Effect of soil and sediment composition on acetochlor sorption and desorption[J]. Environ Sci Pollut Res, 2009, 16(5):546-554. |
| [7] | XIAO N W, SONG Y, GE F, et al.Biomarkers responses of the earthworm Eisenia fetida to acetochlor exposure in OECD soil[J]. Chemosphere, 2006, 65(6):907-912. |
| [8] | XIAO N W, JING B B, GE F, et al.The fate of herbicide acetochlor and its toxicity to Eisenia fetida under laboratory conditions[J]. Chemosphere, 2006, 62(8):1366-1373. |
| [9] | 张惠文, 张倩茹, 周启星, 等.乙草胺及铜离子复合施用对黑土农田生态系统土著微生物的急性毒性效应[J]. 农业环境科学学报, 2003, 22(2):129-133. ZHANG Huiwen, ZHANG Qianru, ZHOU Qixing, et al.Combined effects of acute toxicity of acetochlor and copper on soil microbial population and biological characteristics in maize-wheat-soybean agroecosystem[J].J Agro-Environ Sci, 2003, 22(2):129-133.(in Chinese) |
| [10] | 柳梅, 王天斌, 沈小德.我国乙草胺市场现状及技术进展[J]. 化工技术经济, 2005, 23(3):14-16. LIU Mei, WANG Tianbin, SHEN Xiaode.Market and technical process of acetochlor in China[J].Chem Techno-Eco, 2005, 23(3):14-16.(in Chinese) |
| [11] | 余世清, 唐伟, 卢滨, 等.某农药厂废弃场地六六六和滴滴涕污染分布特征及风险评价[J]. 环境科学, 2011, 32(9):2645-2653. YU Shiqing, TANG Wei, LU Bin, et al.Distribution and risk assessment of HCH and DDT in an abandoned pesticide factory site[J].Environ Sci, 2011, 32(9):2645-2653.(in Chinese) |
| [12] | 汪光, 吕永龙, 史雅娟, 等.北京东南化工区土壤有机氯农药污染特征和分布规律[J]. 环境科学与技术, 2010, 33(9):91-96. WANG Guang, LYU Yonglong, SHI Yajuan, et al.Characterization and distribution of organochlorine pesticides in soils from Beijing southeast chemical[J].Environ Sci Tech, 2010, 33(9):91-96.(in Chinese) |
| [13] | 朱雪强, 韩宝平, 周东来, 等.某农药厂周围土壤四氯化碳污染特征研究[J]. 农业环境科学学报, 2006, 25(2):393-397. ZHU Xueqiang, HAN Baoping, ZHOU Donglai, et al.Pollution characteristics of carbon tetrachloride in soils near a pesticide plant[J].J Agro-Environ Sci, 2006, 25(2):393-397. |
| [14] | 韩文亚, 黄俊, 杨波, 等.华北某农药厂周边的滴滴涕污染状况初步研究[J]. 环境污染与防治, 2008, 30(1):76-78. HAN Wenya, HUANG Jun, YANG Bo, et al.DDTs contamination around a pesticide plant in northern China[J].Environ Pollu Control, 2008, 30(1):76-78.(in Chinese) |
| [15] | 王建华, 储晓刚.凝胶渗透色谱-气相色谱-质谱测定花生中乙草胺的残留量[J]. 分析试验室, 2007, 26(12):31-34. WANG Jianhua, CHU Xiaogang.Determination of residual acetochlor in peanut by gel permeation chromatography and gas chromatography/mass spectrometry[J].Chin J Anal Lab, 2007, 26 (12):31-34.(in Chinese) |
| [16] | 胡敏, 李二虎, 吴兵兵, 等.气相色谱法测定大豆中氟乐灵、甲草胺和乙草胺农药残留[J]. 现代农药, 2006, 5(6):27-28. HU Min, LI Erhu, WU Bingbing, et al.Determination of residues of trifluralin, alachlor and acetochlor in soybean by GC[J].Modern Agrochem, 2006, 5(6):27-28.(in Chinese) |
| [17] | GB 2763—2012, 食品安全国家标准:食品中农药最大残留限量[S]. 北京:中国标准出版社, 2012. GB 2763—2012, National food safety standard:maximum residue limits for pesticides in food[S].Beijing:China Standards Press, 2012.(in Chinese) |
| [18] | The Japan Food Chemical Research Foundation. Maximum residue limits (MRLs) of agricultural chemicals in foods (2013-03-18). |
| [19] | SN/T 2322—2009, 进出口食品中乙草胺残留量检测方法[S]. 北京:中国标准出版社, 2009. SN/T 2322—2009, Determination of acetochlor residue in foods for import and export[S].Beijing:China Standards Press, 2009.(in Chinese) |
| [20] | 刘守庆, 石增宝, 张玉启, 等.临沂市某农药厂环境污染与新生儿出生缺陷的流行病学调查[J]. 预防医学文献信息, 2002, 8(3):273-274. LIU Shouqing, SHI Zengbao, ZHANG Yuqi, et al.An epidemiological investigation of pesticide plant environmental pollution with birth defects in Linyi[J].Liferatue and Information on Preventine, 2002, 8(3):273-274.(in Chinese) |
| [21] | 郑和辉, 叶常明.乙草胺和丁草胺在土壤中的移动性[J]. 环境科学, 2001, 22(5):117-121. ZHENG Hehui, YE Changming.The transferability of acetochlor and butachlor in soil[J].Chin J Environ Sci, 2001, 22(5):117-121.(in Chinese) |
 2013, Vol.15
2013, Vol.15 


