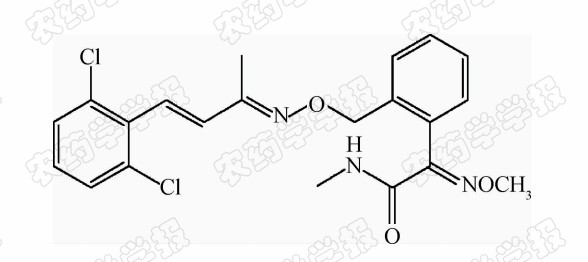
烯肟菌胺( Scheme 1 ),英文名fenaminstrobin(SYP-1620),化学名为(E,E,E)-N-甲基-2-[((((1-甲基-3-(2,6,-二氯苯基)-2-丙烯基)亚氨基)氧基)甲基)苯基]-2-甲氧基亚氨基乙酰胺,分子式为:C21H21Cl2N3O3,相对分子质量为433.10,易溶于丙酮、乙腈、乙酸乙酯和二氯甲烷[1],是由沈阳化工研究院于1999年自主创制的甲氧基苯烯酸酯类杀菌剂,于2003年获得中国发明专利(专利号:ZL00110143.9),2004年完成原药及5%乳油的临时登记并进入中国市场[2],对小麦、蔬菜、果树上的主要真菌病害具有较好的防治效果[2, 3, 4, 5, 6]。目前市售产品有5%乳油和20%悬浮剂,环境生物毒性评价显示其为低毒[1],但最近的研究报道提示其对生态环境可能存在一定的潜在风险[7]。目前,国内外尚未规定其在食品中的最大残留限量值(MRL)。
|
Scheme 1 |
当前,对烯肟菌胺的研究报道主要是采用高效液相色谱法(HPLC)对其原药和制剂进行检测和分析[8, 9],尚未见关于其残留量检测的报道。气相色谱-质谱(GC-MS)联用仪对新物质检测具有较强的定性功能[10],但目前未见有关应用GC-MS分析检测烯肟菌胺残留量的研究报道,也未见有关烯肟菌胺有机质谱解析的研究报道。本研究采用乙酸乙酯高速分散提取,固相萃取法(SPE)净化,GC-MS测定,建立了蔬菜中烯肟菌胺残留量的检测方法,并对其裂解机理进行了探讨。
Agilent 6890N-5975B气相色谱-质谱联用仪,美国Agilent公司;IKA T-25高速分散器,德国IKA公司;Turbovap Ⅱ样品快速浓缩工作站,美国Biotage公司;RV10旋转蒸发仪,德国IKA公司;ZM200超离心研磨仪,德国Retsch公司;3K-15冷冻离心机,德国Sigma公司;AFS-7400 凝胶渗透净化系统,北京莱伯泰科仪器有限公司。
烯肟菌胺(fenaminstrobin)原药,纯度98%,沈阳化工研究院生产。二氯甲烷、环己烷为色谱纯,德国默克公司;其余试剂均为国产分析纯。盐析剂:m(无水硫酸镁)∶ m(乙酸钠)=4∶1 混合;净化剂Ⅰ:m(无水硫酸镁) ∶m(PSA) ∶m(C18) ∶m(GCB)=3 ∶1 ∶1 ∶1混合;净化剂Ⅱ:m(无水硫酸镁) ∶m (中性氧化铝) ∶m(GCB)=3 ∶2 ∶1混合;净化剂Ⅲ:m(无水硫酸镁) ∶m(硅胶) ∶m(GCB)=3 ∶2 ∶1混合。
供试芹菜、菠菜、黄瓜、甘蓝和番茄样品购自当地农贸市场或超市,取可食部分制成糜样,于-20 ℃冰箱中冷冻保存,备用。
准确称取0.01 g(精确到0.000 01 g)烯肟菌胺原药,用丙酮溶解并配制成10.0 mg/L的标准储备液,于-20 ℃冰箱中保存,备用。使用前根据检测要求使用空白基质提取液(乙酸乙酯)稀释成相应浓度的基质匹配标准工作溶液。
提取:参考文献[10]的方法并稍作改动。准确称取解冻样品10.00 g加入到50 mL具塞离心管中,依次加入盐析剂5.0 g 和乙酸乙酯20.0 mL,在10 000 r/min下高速分散提取1.0 min;另取1支50 mL离心管,加入20.0 mL 乙酸乙酯清洗刀头;合并2次提取液,在4 000 r/min下离心5 min,取全部上清液于40 ℃下旋转蒸发至约1 mL,待净化。
净化:参考文献[10]的方法并稍作改动。用5 mL V(正己烷) ∶V(丙酮)=1 ∶1 混合溶液活化装有0.50 g净化剂的固相萃取小柱,吸取上述待净化溶液加入到活化后的固相萃取小柱中, 待液面没入柱体后加入5 mL V(正己烷) ∶V(丙酮)=1 ∶1 混合溶液洗脱,收集全部洗脱液,于40 ℃下氮吹至近干,以丙酮定容至1.0 mL,经0.22 μ m滤膜过滤,待分析。
GC条件: DB-5 MS毛细管色谱柱(30 m×0.25 mm×0.25 μ m);载气为高纯氦气(99.999%);恒流模式,柱流速为1.1 mL/min;进样量为1.00 μ L,不分流进样;进样口温度270 ℃; 柱温升温程序:初始温度70 ℃,保持1 min,以25 ℃/min升至280 ℃,保持2 min,以20 ℃/min升至300 ℃,保持5 min。
MS条件:电子轰击离子源(EI源),电子轰击能量70 eV,单级四极杆质量分析器;离子源温度230 ℃;四级杆温度 150 ℃;传输线温度 280 ℃;全扫描模式:扫描范围m/s
50~500,确定待测化合物扫描离子、保留时间和检查目标峰有无杂质干扰;溶剂延迟15.0 min;选择离子模式(SIM):定量离子m/z 116,定性离子m/z 132、221、205;驻留时间:100 ms。
选择色素含量较高的空白菠菜为样品基质,在0.05 mg/kg添加水平下,借鉴文献[11]设计正交试验方案L9(34),考察提取方法、提取溶剂、净化方式和净化剂等对添加回收率和相对标准偏差的影响。即1)3种提取方法:振荡提取30 min(简称OE)、超声波辅助萃取15 min(UAE)和高速分散提取1 min(HSTE);2)3种提取溶剂:乙腈(A)、乙酸乙酯(EA)和V(正己烷) ∶V(丙酮)=1 ∶1(HA);3)3种净化方式:固相萃取法(SPE)、凝胶渗透色谱法(GPC)[12]和QuEChERS法(Q)[13];4)3种净化剂:Ⅰ、Ⅱ和Ⅲ(组成成分见1.1.2节)。根据正交试验方案得到9种组合条件:1)OE+A+SPE+Ⅰ;2) OE+EA+GPC+Ⅱ;3)OE+HA+Q+Ⅲ;4)UAE+A+GPC+Ⅲ; 5)UAE+EA+Q+Ⅰ;6)UAE+HA+SPE+Ⅱ;7)HSTE+A+Q+Ⅱ;8)HSTE+EA+SPE+Ⅲ;9)HSTE+HA+GPC+Ⅰ。
在上述3种净化方式中:SPE按照1.2.2节方法进行提取和净化; GPC是在按照1.2.2节中的方法完成提取和离心后,将全部上清液倒入50 mL梨形瓶中,于40 ℃下旋转蒸发至近干,用6 mL V(二氯甲烷) ∶V(环己烷)=1 ∶1混合溶液溶解并转移至离心管中,离心后取4.8 mL上清液,依照文献[12]中GPC的净化条件进行净化:检测波长254 nm,V(二氯甲烷) ∶V(环己烷)=1 ∶1,流量5 mL/min,切割点为11.5 min,收集切割点后流动相90 mL;QuEChERS法是按照文献[13]方法对添加样品用乙腈作为提取液进行提取离心后,称取0.5 g净化剂Ⅰ于5.0 mL离心管中,加入1.0 mL乙腈提取液,涡旋、离心并过滤后,待分析。
采用外标法定量。使用空白基质提取液(乙酸乙酯)将烯肟菌胺标准储备液梯度稀释成0.02、0.04、0.1、0.5和1 mg/L的标准工作溶液,按照1.2.3节条件进行分析。以标准溶液的峰面积为纵坐标(y)、质量浓度(x)为横坐标绘制校正曲线。
分别称取10.0 g空白样品,加入适量质量浓度为1.0 mg/L 的烯肟菌胺标准工作溶液,混匀后静置老化30 min,制成添加水平分别为0.02、0.04、0.2 mg/kg的添加样品[14],按照1.2.2节方法进行前处理和1.2.3节条件进行分析测试。每个水平重复6次,计算添加回收率和相对标准偏差(RSD)。
配制质量浓度为0.05 mg/L 的基质匹配标准溶液和同样浓度的溶剂标准溶液,分别按照1.2.3节选择SIM方式进行测定,依照公式 η =Ai 基质标样/Ai 溶剂标样计算基质效应[14],考察 η 与1的关系,判定基质效应。其中,Ai为烯肟菌胺的峰面积。
取适量质量浓度为1 mg/L的烯肟菌胺标准溶液按照1.2.3节条件在m/z 50~450范围内进行全扫描,确定烯肟菌胺的保留时间并得到全扫描质谱图。
表1为正交试验所得的添加回收率和RSD结果。可见:应用QuEChERS方法回收率较低,不宜采用;虽然使用SPE和GPC方法均能取得较好的 试验结果,其中HSTE+EA+SPE+Ⅲ组合与HSTE+ HA+GPC+Ⅰ组合结果较优,但使用GPC净化的操作过程过于繁琐,且有机溶剂用量大,既增加了检测成本又对环境、实验人员健康易产生不利影响。因此,最终确定前处理条件为:以乙酸乙酯为提取溶剂进行高速分散提取,以m(无水硫酸镁) ∶m(硅胶) ∶m(GCB)=3 ∶2 ∶1(净化剂Ⅲ)为净化剂,采用SPE净化方法。其添加色谱图见图1。从中可见目标峰未受杂质峰干扰,表明净化效果较好。
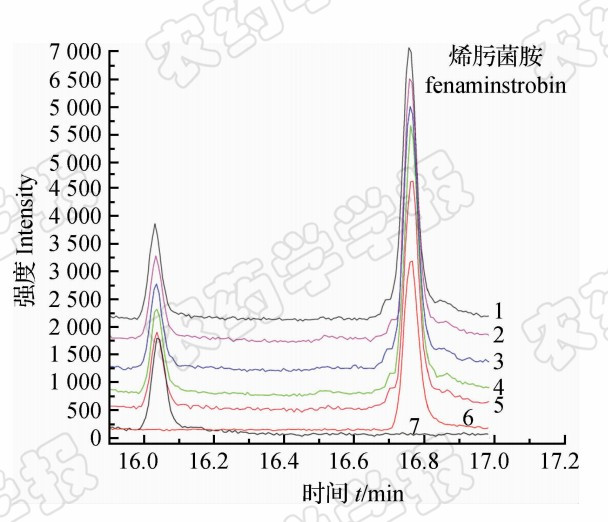 | 图1 烯肟菌胺标准溶液、基质空白及其在蔬菜中 添加(0.05 mg/kg)色谱图 Fig.1 The chromatograms of fenaminstrobin standard,sample blank and spiked samples(0.05 mg/kg) 注:1.芹菜;2.番茄;3.菠菜;4.甘蓝;5.黄瓜;6.空白; 7.标准溶液。 Note:1.Celery;2.Tomato;3.Spinach;4.Cabbage;5.Cucumber;6.Blank sample;7.Standand. |
| 表1 正交试验所得的烯肟菌胺添加回收率 (n=3) Table 1 Recoveries of fenaminstrobin from orthogonal experiments(n=3) |
外标法定量分析结果表明:在质量浓度0.02~1 mg/L内,烯肟菌胺标准溶液的峰面积(y)与质量浓度(x)间有良好的线性关系,线性方程为y=170 044 x-1 092,r=0.999。以稀释标准溶液进行样品添加的方式测得方法的检出限(S/N=3)为0.006 mg/kg,定量限(S/N=10)为0.02 mg/kg。
结果(表2)显示:在0.02、0.04和0.2 mg/kg添加水平下,烯肟菌胺平均回收率为94% ~99%,RSD(n=6)为2.3% ~2.9%。结果符合农药残留分析的要求[15]。
| 表2 烯肟菌胺的添加平均回收率和相对标准偏差 (n=6) Table 2 Recoveries and RSD of fenaminstrobin (n=6) |
基质效应考察试验结果表明,5种基质的 η 在0.97~1.03之间,接近1,表明基质效应不明显,说明这5种基质经过本方法净化后对质谱检测不会产生显著影响。
烯肟菌胺的总离子流色谱图和质谱图见图2。由于烯肟菌胺属于新型农药,无标准谱库数据可查询,因此需对其进行解析加以确证。
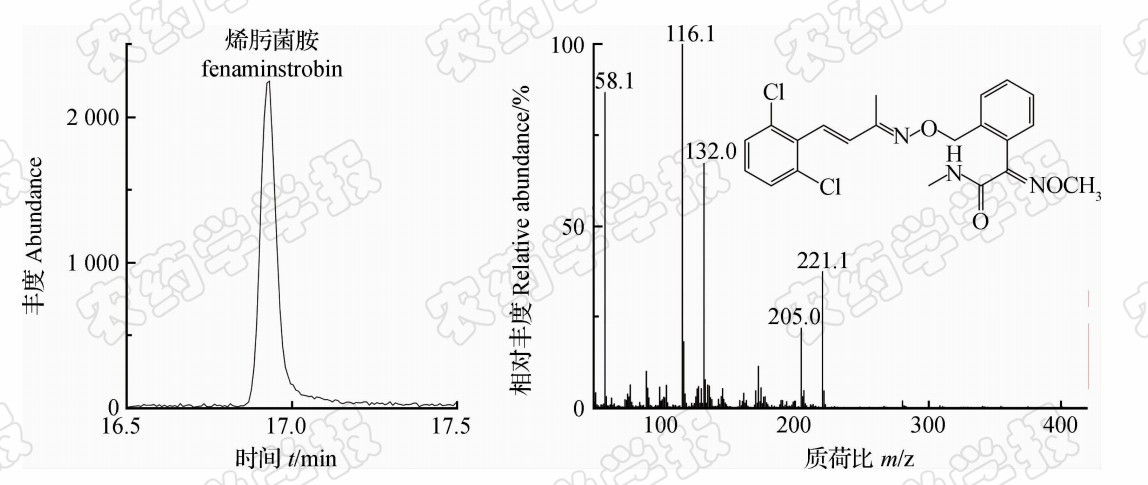 | 图2 烯肟菌胺标准品(0.05 mg/L)的总离子流色谱图及质谱图 Fig.2 Total ion chromatogram and mass spectrum of fenaminstrobin(0.05 mg/L) |
从图2可见:在质谱图高质量端未见分子离子峰,表明其分子离子均已发生裂解,并发生了以下裂解反应。即当氨基氮上的n电子丢失时,则产生奇电子离子,并发生取代反应(rd),产生碎片离子m/z 205。当羰基氧上的n电子丢失时,则产生奇电子离子并有2条二次裂解反应途径:1)发生 α 断裂,产生碎片离子m/z 58;2)发生氢重排(rH)反应、 α 断裂产生碎片离子m/z 221,之后该离子经过环化反应(rc)、消去反应(re)产生碎片离子m/z 132和116。以上途径的断裂过程及机理见图3。由于在m/z<100的低质量端碎片离子峰易受进样溶剂、样品中杂质和色谱柱流失等因子干扰,不易判别,一般不作为定量和定性离子用,故选择m/z 116作为定量离子,m/z 132、221、205作为定性离子。
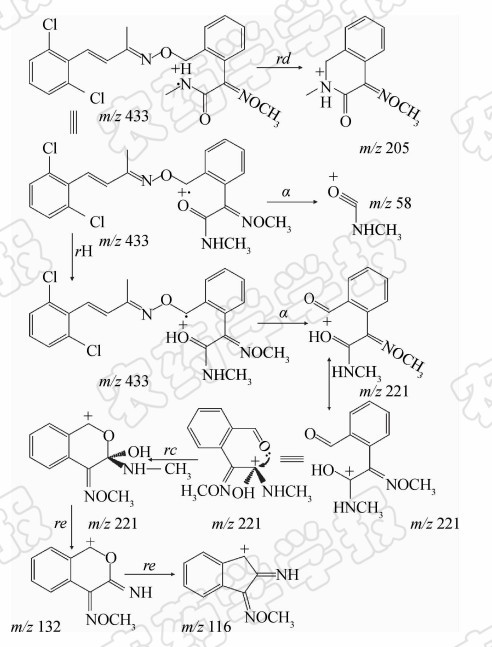 | 图3 推断的烯肟菌胺特征碎片离子裂解机理 Fig.3 The inferred fragmentation mechanism of fenaminstrobin characteristic fragment ions |
本研究以乙酸乙酯为提取剂进行高速分散提取,以无水硫酸镁、硅胶和石墨化炭黑为净化剂进行固相萃取,结合GC-MS检测,外标法定量,建立了蔬菜中烯肟菌胺的残留量有效检测方法。所建方法方便、快捷、可靠,对其他蔬菜中烯肟菌胺的快速检测有借鉴作用。通过对其裂解机理的探讨,确定了烯肟菌胺测试分析所要求的定性和定量离子,为烯肟菌胺的检测确证提供了依据,同时所得到的质谱图进一步丰富了国际通用质谱库。
| [1] | 《农药科学与管理》编辑部.新农药介绍[J].农药科学与管理, 2005, 26(5):45. Editorial Department of Pesticide Science and Administration.Introduction of new pesticides[J].Pestic Sci Admin, 2005, 26(5):45.(in Chinese). |
| [2] | 司乃国, 刘君丽, 陈亮, 等.创制杀菌剂烯肟菌胺的产业化开发进程//中国化工学会农药专业委员会第十四届年会论文集.沈阳, 2010:70-81. SI Naiguo, LIU Junli, CHENG Liang, et al.Discovery and development of a new fungicide SYP-1620//Agriculture Committee of the Chinese Chemical Society Fourteenth Annual Meeting Proceedings.Shenyang, 2010:70-81.(in Chinese). |
| [3] | 司乃国, 刘君丽, 郎兆光, 等.新型杀菌剂烯肟菌胺及应用技术[J].新农业, 2010(1):47-48. SI Naiguo, LIU Junli, LANG Zhaoguang, et al.New fungicide SYP-1620 and its application technology[J].Mod Agric, 2010(1):47-48.(in Chinese). |
| [4] | 司乃国, 刘君丽, 陈亮, 等.创制杀菌剂烯肟菌胺生物活性及应用(Ⅰ):小麦白粉病[J].农药, 2008, 47(10):712-714. SI Naiguo, LIU Junli, CHEN Liang, et al. The research of biological activity and application of novel fungicide SYP-1620(Ⅰ):wheat powdery mildew[J].Agrochemicals, 2008, 47(10):712-714.(in Chinese). |
| [5] | 司乃国, 金春兰, 刘君丽, 等.创制杀菌剂烯肟菌胺生物活性及应用研究(Ⅱ):瓜类白粉病[J].农药, 2009, 48(1):10-12. SI Naiguo, JIN Chunlan, LIU Junli, et al.The research of biological activity and application of novel fungicide SYP-1620(Ⅱ):powdery mildew of cucurbit crops[J].Agrochemicals, 2009, 48(1):10-12.(in Chinese). |
| [6] | 何献声, 姚娜.20%烯肟菌胺·戊唑醇悬浮剂对辣椒白粉病的防治效果[J].农药, 2011, 50(1):73-74. HE Xiansheng, YAO Na.Control effect of SYP-1620·tebuconazole suspension concentrate against capsicum powdery mildew[J].Agrochemicals, 2011, 50(1):73-74.(in Chinese). |
| [7] | 杨红莲, 崔新仪, 闫峻, 等.新型杀菌剂烯肟菌胺对斑马鱼胚胎发育毒性的研究[J].环境与健康杂志, 2012, 29(5):410-412. YANG Honglian, CUI Xinyi, YAN Jun, et al.Developmental toxicity of SYP-1620 to zebrafish embryo[J].J Environ Health, 2012, 29(5):410-412.(in Chinese). |
| [8] | 袁野, 蔡磊明, 李莹, 等.烯肟菌胺原药的高效液相色谱分析[J].农药, 2010, 49(1):37-38. YUAN Ye, CAI Leiming, LI Ying, et al.Analysis method of SYP-1620 technical by HPLC[J].Agrochemicals, 2010, 49(1):37-38.(in Chinese). |
| [9] | 丑靖宇, 李超, 鞠光秀, 等.29%吡虫啉·多菌灵·烯肟菌胺悬浮种衣剂的高效液相色谱分析[J].农药, 2012, 51(4):275-277. CHOU Jingyu, LI Chao, JU Guangxiu, et al.Analysis of imidacloprid·carbendazim·fenaminstrobin 29% FSC by HPLC[J].Agrochemicals, 2012, 51(4):275-277.(in Chinese). |
| [10] | 丁立平, 方祥, 吴文凡.固相萃取-气相色谱-质谱联用法测定黄瓜和番茄中毒氟磷的残留及其裂解机理[J].农药学学报, 2013, 15(5):523-527. DING Liping, FANG Xiang, WU Wenfan.Determination of Dufulin residues in cucumber and tomato by gas chromatography-mass spectrometry with solid phase extraction and its fragmentation mechanism[J].Chin J Pestic Sci, 2013, 15(5):523-527.(in Chinese). |
| [11] | 丁立平, 魏云昊.茶叶中哒螨灵和噻嗪酮残留量的测定[J].农药, 2011, 50(5):352-354. DING Liping, WEI Yunhao.Determination of pyridaben and buprofezin residues in tea[J].Agrochemicals, 2011, 50(5):352-354.(in Chinese). |
| [12] | 李樱, 储晓刚, 仲维科, 等.凝胶渗透色谱和固相萃取净化-气相色谱分离组合法测定糙米中的残留农药[J].分析化学, 2004, 32(10):1325-1328. LI Ying, CHU Xiaogang, ZHONG Weike, et al.Determination of pesticides in unpolished rice by a combined approach of gel permeation chromatography and solid phase extraction purification and gas chromatography[J].Chinese J Anal Chem, 2004, 32(10):1325-1328.(in Chinese). |
| [13] | ANASTASSIADES M, LEHOTAY S J.Fast and easy multi-residue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J].J AOAC Int, 2003, 86(2):412-431. |
| [14] | 许鹏军, 高晓莎, 陶晡, 等.分散固相萃取-气相色谱四极杆质谱联用测定9种果品中的螺螨酯残留[J].分析化学, 2008, 36(11):1515-1520. XU Pengjun, GAO Xiaosha, TAO Pu, et al.Determination of spirodiclofen residue in nine fruits by gas chromatography-quadrupole mass spectrometry with dispersive solid phase extraction[J].Chinese J Anal Chem, 2008, 36(11):1515-1520.(in Chinese ). |
| [15] | Commission of European Communities.Commission Decision 2002/657/EC of 12 August 2002 Implementing Council Directive 96/23/EC Concerning the Performance of Analytical Methods and the Interpretation of Result[M].European Union Official Bulletin, 2002, 221:8-36. |
 2013, Vol.15
2013, Vol.15 


