2. Department of Resource Management and Geography, Melbourne School of Land and Environment, the University of Melbourne, Victoria 3010, Australia
2. Department of Resource Management and Geography, Melbourne School of Land and Environment, the University of Melbourne, Victoria 3010, Australia
农药的应用使农作物产量大幅度增加,但农田施用的化学农药大部分残留在土壤中,对土壤微生物种群变化和酶活性影响很大[1-4]。不同品种的农药对土壤微生物的影响不同,如有些杀菌剂能杀死土壤中某些有害细菌,而另一些农药则能影响土壤微生物的正常活动,甚至危及固氮菌、根瘤菌等有益微生物[5-6]。
氮肥的有效性与其在土壤中的转化过程息息相关,而这些转化过程又受到土壤微生物的影响和调节。因此,农药进入土壤中可能会对土壤氮素的转化过程及其有效性产生影响,从而影响土壤的肥力水平。目前相关的研究主要集中在农药施用对土壤微生物种群和数量的影响上[7, 8, 9],而关于农药对土壤中尿素氮整个转化过程影响的综合研究还比较缺乏,少数的报道也仅针对其中某一两个转化途径(脲酶水解或硝化反硝化过程)展开[10, 11]。从笔者前期的研究结果看,施用10 mg/kg的除草剂草甘膦和丁草胺均对尿素的水解无影响,但草甘膦对尿素氮的反硝化作用表现出显著的抑制作用,而丁草胺则对其具有极显著的促进作用[12]。因此,不同农药品种对氮转化过程的影响效果不同, 有的产生促进作用,有的产生抑制效果。杀虫剂和除草剂同属于农药的三大类型之一,每年的用量很大,因此,针对杀虫剂对土壤氮转化的影响开展研究十分必要,本文通过研究吡虫啉和毒死蜱这两种常用杀虫剂对土壤中尿素的水解、土壤氮的硝化及反硝化作用的影响,考察杀虫剂施用下土壤氮素的转化过程,旨在为氮肥和农药的施用效应及安全施用评价提供科学依据。
10%吡虫啉(imidacloprid)可湿性粉剂,易克斯特农药有限公司生产;48%毒死蜱(chlorpyrifos)乳液,江苏快克农化股份有限公司生产;尿素(N, a.i. , 46%)。 供试土壤取自福州市郊菜田土,土壤类型为灰泥土,有机质质量分数为26.30 g/kg、全氮质量分数为1.55 g/kg、碱解氮质量分数为 147.70 mg/kg、土壤容重为1.22 g/cm3、pH 5.9。
| 表 1 试验设计 Table 1 Experimental design |
将新鲜土壤样品微风干(土壤仍含有一定水分,以便使其中的微生物保有活性),过2 mm筛,测定其含水量。称取折合150 g烘干土的微风干土,装入300 mL的广口瓶中。尿素和杀虫剂按比例混合溶于水后加入土壤中,使土壤水分含量达到土壤体积分数的60%。用封口膜封口,保持瓶内外自由通气,在28 ℃恒温好气条件下培养。取样时间分别为培养的第1、3、5、8、12、16、20、24、30、36 天。本试验为破坏性取样,每次取样设8次重复(即每次8个处理各取8瓶,取10次样,共640瓶),其中4瓶用于测定土壤硝态氮和铵态氮质量分数变化,另4瓶用于测定反硝化作用。
采用乙炔抑制培养法进行直接测定[13]。在取样前1 d揭开封口膜,用带有2根玻璃管的软木塞塞住瓶口并密封,2根玻璃管分别连接1段硅胶管,其中1根连接三通阀,然后密封2根通气管并检查气密性。其中用于测定反硝化作用的4瓶培养瓶,均用干净乙炔气体置换瓶中的空气,使瓶中乙炔气体体积比达到10%(具体方法为:用针筒连接三通阀,先从培养瓶中抽出体积分数为10%的空气,然后抽取体积分数为10%的乙炔气,通过三通阀注入培养瓶中,来回推拉几次针管,使瓶中的气体混合均匀,关闭三通阀),另外4瓶不充乙炔,作为对照。然后再将培养瓶放回28℃培养箱中恒温培养1 d。次日,用注射器通过培养瓶上的三通阀将瓶中气体充分混匀,然后取气体约20 mL放入气样瓶中,用704胶封口。将气样带回实验室分析N2O浓度。气样分析采用经中国科学院大气物理所改装美国Agilent 公司生产的GC7890气相色谱仪测定N2O浓度,即为反硝化损失量。检测条件:色谱柱为填充porapak Q的填充柱,柱温55 ℃,检测器温度330 ℃,电子捕获检测器(ECD)检测。定量六通阀进样,进样量1 mL,载气为N2,流速30 mL/min。
单位时间反硝化损失速率的计算方法:F[ μ g N/(kg土·h)]=C×28/22.4×V/1 000×1 000/m/t。F为单位时间反硝化损失速率,C为气体质量浓度测定值, μ g/mL;28为1 mol的N2O气体所含氮的质量分数;22.4为大气标准状态下阿伏伽德罗常数;V为培养瓶内总的自由体积,mL;1 000为mL换算成L;m为培养土壤质量,kg;1 000为土壤质量g化成kg;t为密闭培养的时间,h。
反硝化损失总量的计算方法:F[ μ g N/(kg土)]=∑(F1+F2)/2×t×24。F1为前一次测定值,F2为后一次测定值,t为相隔天数,24为每天小时数。
上述各处理在每次取完气样后,弃去充乙炔的土壤,将未充乙炔的土壤全部取出,每瓶土壤单独充分混合均匀后各称取12.00 g,置于150 mL三角瓶中,加入100 mL 2 mol/L的氯化钾溶液,置于振荡器上振荡提取1 h。用定性滤纸过滤后立即采用靛酚蓝比色法测定土壤铵态氮质量分数,采用紫外分光光度法测定土壤硝态氮质量分数[14]。
采用SPSS 13.0和Excel 2003对试验数据进行统计分析和图表制作。
由于土壤中的尿素在脲酶作用下可水解成铵态氮(NH+4-N),因此土壤中铵态氮的变化可直接反映尿素水解作用的快慢。从图1中可以看出,第1天各施肥处理间的铵态氮含量无差异,第3天时添加吡虫啉和毒死蜱的6个处理其土壤中铵态氮含量均显著高于单独的尿素处理( P <0.05)。 说明土壤中添加 5、10和50 mg/kg 的吡虫啉和毒死蜱对尿素水解均具有一定的促进作用。第5天时各处理土壤中的铵态氮含量达到最高峰,此后铵态氮逐渐由硝化作用转化为硝态氮,土壤中的铵态氮含量逐渐降低。
土壤中铵态氮在硝化微生物作用下转化成硝态氮(NO-3-N)。在整个培养过程中,各施肥处理土壤中氮素的硝化率均随着培养时间的延长而升高,但不同处理在不同时期的变化趋势呈现明显的差异性(图 2)。添加5 mg/kg吡虫啉和毒死蜱的处理在培养前期具有显著促进硝化作用,培养至第8天,二者土壤氮素的硝化率分别为31.28%和29.98%,显著高于尿素处理( P <0.05),此后各处理间的硝化率无差异。添加10 mg/kg吡虫啉的处理,在整个培养过程中,土壤中的硝态氮含量与尿素处理均无差异( P <0.05),表明吡虫啉在该浓度下对土壤氮素的硝化作用无明显影响;而添加10 mg/kg毒死蜱的处理在第3天时的硝化率显著低于尿素处理( P < 0.05),表现出一定抑制硝化的作用。添加50 mg/kg 吡虫啉或毒死蜱的处理均显著抑制了土壤的硝化作用,第8天时吡虫啉和毒死蜱处理的硝化率分别为20.46%和16.96%,显著低于尿素处理(25.65%)( P <0.05),且毒死蜱的抑制作用强于吡虫啉。从图 2A也可以看:吡虫啉50 mg/kg处理的抑制效果仅维持了8 d,到12 d时和尿素处理土壤的NO-3-N浓度已无差异;而毒死蜱50 mg/kg处理的抑制作用则一直维持到了培养结束(图 2B),培养结束时该处理的硝化率仅为74.75%,显著小于尿素处理( P <0.05)。从图1B的结果也可以发现,直到培养结束时毒死蜱50 mg/kg处理的铵态氮含量仍显著高于其他各处理,说明毒死蜱50 mg/kg处理明显抑制了土壤中铵态氮向硝态氮转化的过程。
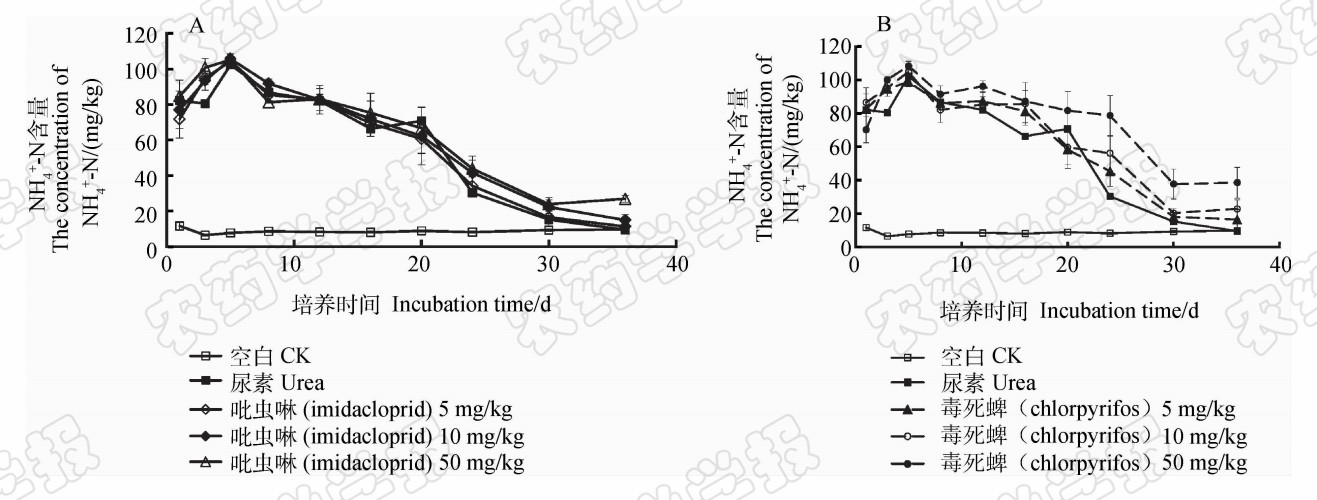 | 图1 吡虫啉 (A) 和毒死蜱 (B) 对土壤中铵态氮含量的影响 Fig.1 Effects of imidacloprid(A) and chlorpyrifos(B) on temporary changes of NH+4-N content in soil |
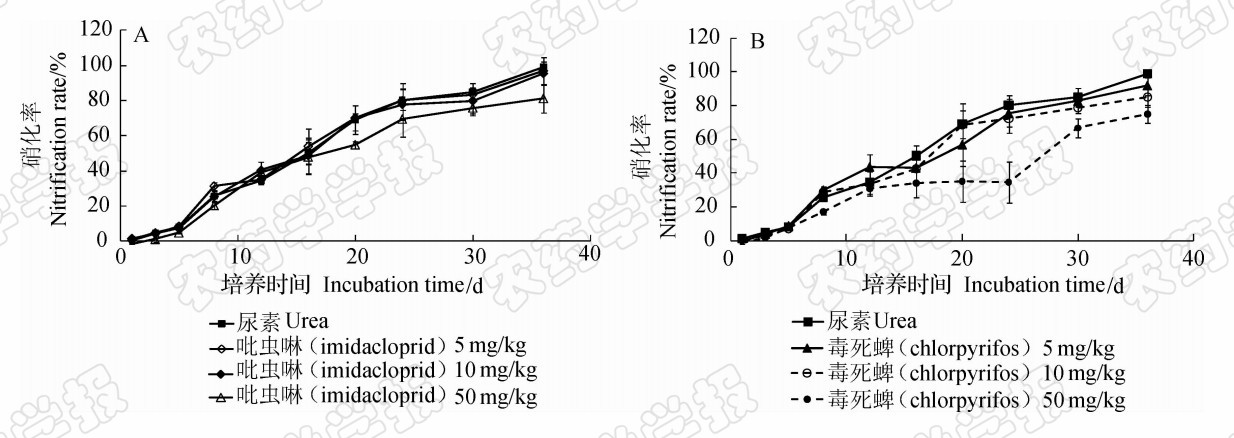 | 图 2 吡虫啉 (A)和 毒死蜱 (B) 对土壤氮硝化率影响 Fig.2 Effects of imidacloprid(A) and chlorpyrifos(B) on nitrification rate in soil |
土壤反硝化作用是在反硝化微生物作用下将硝态氮转化成N2O和N2的过程。从图 3中可以看出:在培养前5 d,各处理间的反硝化损失速率无明 显差异;第8天时,尿素+吡虫啉或毒死蜱50 mg/kg 处理的氮素反硝化损失速率分别为0.47和0.43 μ g/(kg土·h),显著低于其他各施肥处理( P <0.05);第12天时,尿素处理以及尿素+吡虫啉(5、10、50 mg/kg)处理的氮素反硝化损失速率达到峰值,其中尿素处理的反硝化损失速率为5.85 μ g/(kg土·h),显著高于其他处理( P <0.05);而尿素+毒死蜱(5、10、50 mg/kg)处理则将反硝化损失的高峰期向后延迟至第16天。
表 2显示:吡虫啉的使用显著降低了土壤氮素的反硝化损失量,5、10和50 mg/kg 3个处理氮素反硝化损失的有效氮总量分别为669.23、638.03和334.11 μ g/kg,分别占施氮量的0.28%、0.27%和0.12%,极显著地低于尿素处理( P <0.01),且吡虫 啉浓度越高,抑制效果越明显。毒死蜱5和10 mg/kg 处理,在培养期间其氮素的反硝化有效氮损失量分别为845.91和849.11 μ g/kg,与尿素处理无差异,表明在这2个浓度下,毒死蜱对土壤氮素的反硝化 作用无明显影响;而当毒死蜱的用量上升至50 mg/kg 时,其反硝化损失有效氮量为为 640.51 μ g/kg,极显著低于尿素处理( P <0.01),明显地抑制了土壤氮素的反硝化损失。
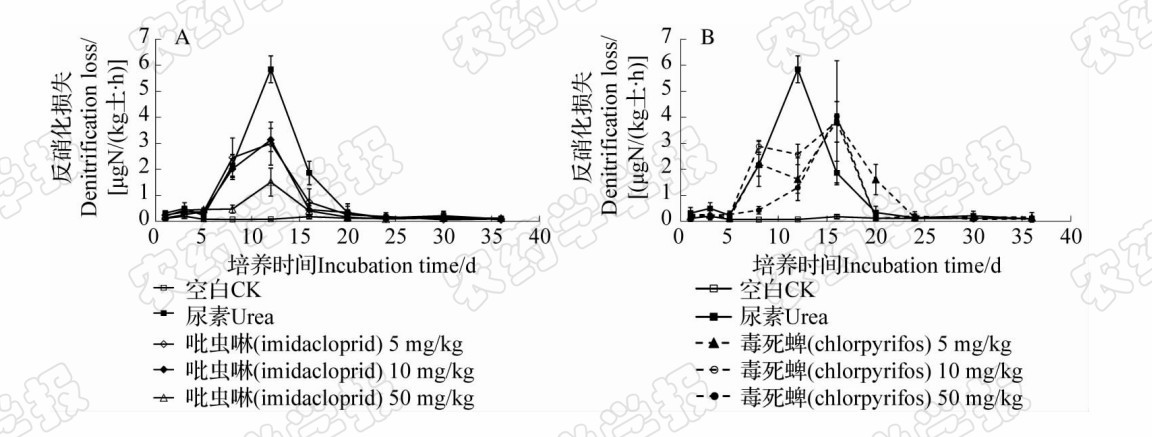 | 图 3 吡虫啉 (A) 和毒死蜱 (B) 对土壤氮反硝化作用的影响 Fig.3Effects of imidacloprid(A) and chlorpyrifos(B) on temporary changes of denitrification in soil |
| 表 2 尿素氮肥反硝化作用损失量 Table 2 Loss amount of urea nitrogen by denitrification |
由于施用的农药会对土壤微生物和酶的活性产生影响,进而影响土壤中氮素的转化。脲酶是惟一一种能够将酰胺态氮肥(尿素)中氮进行转化的酶,其活性与土壤中营养物质转化能力、肥力水平关系密切[15]。不同杀虫剂及其不同施用浓度对土壤脲酶的影响效果不同。有些杀虫剂能抑制土壤脲酶的活性,而有的却能激活其活性,还有的则随着时间的延长其活性表现出先抑制后激活的作用[7, 8],即使是同一种杀虫剂不同研究的结果也会出现差异[16, 17]。本研究结果表明,吡虫啉和毒死蜱对尿素的水解作用有显著的促进作用,这有可能会增加土壤氮肥的流失,而不利于土壤肥力的保持。周世萍等[16]研究发现,土壤中的毒死蜱在2和10 mg/kg下对其脲酶活性无明显影响,而当其含量大于20 mg/kg时,则对脲酶活性有一定的激活作用,本研究结果与之接近。但赵志强等[17]的研究却表明,在2.5、5和10 mg/kg下毒死蜱对土壤脲酶活性均以抑制作用为主,这可能与供试土壤为沙壤土,土壤有机质含量比较低(仅为13.1 g/kg),对污染物质的缓冲能力较小有关,也可能与该试验所采用的毒死蜱浓度较低有一定关系。
从土壤的硝化、反硝化活性来看,杀虫剂对土壤的硝化作用多呈现抑制效应。王芝山等[18]发现,土壤中的多噻烷在50、250和750 mg/kg下对硝化作用的抑制率分别为23.9%、34.7%和51.1%,而本研究也表明,吡虫啉和毒死蜱50 mg/kg处理对土壤的硝化作用均产生了一定的抑制作用。陈中云等[9]的研究结果表明,呋喃丹在低剂量(1 mg/kg)时能刺激反硝化菌的生长及其反硝化活性,而在10 mg/kg时表现出明显的抑制作用。本研究结果显示:吡虫啉能明显降低土壤氮素的反硝化损失,且药剂用量越大,这种降低作用越明显;毒死蜱在中、低浓度时对反硝化损失无明显影响,高浓度时则表现出一定的抑制作用。由于反硝化作用能使硝酸盐还原成氮气和氮氧化合物,从而不仅会降低土壤中氮素的含量,而且会增加温室气体的排放。若施用的杀虫剂能减少土壤氮素的反硝化损失,则对于提高土壤肥力和温室气体减排研究具有一定的意义。因此,选择施用的农药时,既要考虑其有益效果,又要考虑其对土壤生物化学过程的影响,且农药用量不宜过大,否则会对土壤肥力和农作物生长产生潜在威胁。
由于不同的杀虫剂对土壤氮素转化过程的影响存在很大差别,而且即使是同一杀虫剂品种作用于不同的土壤类型(土壤质地、pH值、有机质含量)也有可能表现出不同的效果。所以有必要针对不同杀虫剂品种及不同剂型、土壤类型进一步展开深入研究。
1)吡虫啉和毒死蜱对土壤氮素的转化均有明显影响,且不同品种、同一品种的不同用量其作用效果也存在较大差异。
2)土壤中的吡虫啉和毒死蜱在质量分数5、10和50 mg/kg下对土壤尿素水解作用的前期均有促进作用。
3)土壤中的吡虫啉和毒死蜱在5 mg/kg时,在培养前期均具有显著的促进土壤氮硝化作用,第8天时硝化率分别比尿素处理提高5.63和4.33个百分点,随后各处理间无显著差异;吡虫啉10 mg/kg的处理对土壤氮硝化作用无明显影响,而毒死蜱10 mg/kg的处理则仅在第3天时表现出显著的抑制作用( P <0.05);2种杀虫剂50 mg/kg的处理均具有显著的抑制土壤氮硝化作用( P <0.05),第8天时硝化率分别比尿素处理降低了5.18和8.69个百分点。
4)吡虫啉5、10和50 mg/kg的处理能极显著地降低土壤氮素的反硝化损失,且随着用量的增大降低作用明显;而毒死蜱在5和10 mg/kg时对土壤氮素的反硝化损失无明显影响,50 mg/kg时则表现出极显著的抑制作用。
| [1] | CISAR J L, SNYDER G H. Mobility and persistence of pesticides applied to a USGA green. III: Organophosphate recovery in clippings, thatch, soil, and percolate[J]. Crop Sci, 1996, 36(6): 1433-1438. |
| [2] | MIN H, Y E Y F, CHEN Z Y, et al. Effects of butachlor on microbial populations and enzyme activities in paddy soil[J]. J Environ Sci Health B, 2001, 36(5): 581- 595. |
| [3] | EKUNDAYO E O. Effect of Common pesticides used in the Niger Delta Basin of southern Nigeria on soil microbial populations[J]. Environ Monit Assess, 2003, 89(1): 35-41. |
| [4] | 闰颖, 袁星, 樊宏娜. 五种农药对土壤转化酶活性的影响[J]. 中国环境科学, 2004, 24(5): 588-591. |
| [5] | JHONEN B G, DREW E A. Ecological effects of pesticides of soil microorganisms[J]. Soil Sci, 1977, 123(5): 319-324. |
| [6] | 余柳青, 徐福强, 俞圣康, 等. 丁草胺和杀草丹对稻田土壤放线菌及其白色链霉菌的影响[J]. 中国农业科学, 1997, 30(6): 81-83. |
| [7] | 关松荫. 化学农药对土壤脲酶活性抑制作用的研究[J]. 土壤通报, 1992, 23(5): 232-233. |
| [8] | 杨惠芳, 王宝军, 林力, 等. 单甲脒农药对土壤微生物种群和土壤酶活性的影响[J]. 应用与环境生物学报, 1996, 2(1): 58-65 |
| [9] | 陈中云, 闵航, 吴伟祥, 等. 农药污染对水稻田土壤反硝化细菌种群数量及其活性的影响[J]. 应用生态学报, 2003, 14(10): 1765-1769. |
| [10] | 和文祥, 蒋新, 余贵芬, 等. 杀虫双对土壤脲酶活性特征的影响[J]. 土壤学报, 2003, 40(5), 750-755. |
| [11] | 丁洪, 王跃思. 除草剂对氮肥反硝化损失和N2O排放的影响[J]. 中国环境科学, 2004, 24(5): 596-599. |
| [12] | 丁洪, 郑祥洲, 雷俊杰, 等. 除草剂对尿素氮在土壤中转化的影响[J]. 生态环境学报, 2012, 21(3): 551-554. |
| [13] | RYDEN JC, SKINNER J H, NIXON D J. Soil core incubation system or the field measurement of denitrification using acety-lene-inhibition[J]. Soil Biol Biochem, 1987. 19: 753-757. |
| [14] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 150-160. |
| [15] | Bending G D, Turner M K, Rayns F, et al. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes[J]. Soil Biol & Biochem, 2004, 36(11): 1785-1792. |
| [16] | 周世萍, 段昌群, 余泽芬, 等. 毒死蜱对土壤酶活性的影响[J]. 土壤通报, 2008, 39(5): 1486-1488. |
| [17] | 赵志强, 侯宪文, 李勤奋, 等. 毒死蜱和丁硫克百威对香蕉根际土壤酶活性的影响[J]. 农业环境科学学报, 2010, 29(增刊): 98-103. |
| [18] | 王芝山, 王家玲. 新农药多噻烷的土壤生态毒性研究[J]. 同济医科大学学报, 1994, 23(1): 184-186. |
 2013, Vol. 15
2013, Vol. 15 


