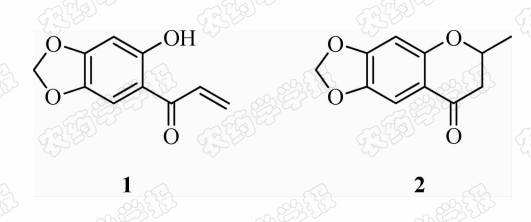
色满酮类化合物存在于多种植物的花、根、茎、果皮及一些植物内生菌的次级代谢产物中,参与生物体新陈代谢的调节,具有抗癌、抗炎、抗血小板凝聚等多种生物活性[1, 2, 3, 4, 5, 6, 7, 8],但在农用杀菌活性方面尚未见相关研究报道。有研究发现,当卡枯醇的羰基 α 位被C=C双键取代后,形成的1-(4,5-亚甲二氧基-2-羟基)苯基-2-甲基丙烯酮( 1 )具有优异的抑菌活性,推测C=O与C=C之间的共轭效应是显著提高化合物活性的主要因素[9]。此外,本研究小组在前期的工作中合成了化合物 2 -甲基-6,7-亚甲二氧基-4-色满酮( 2 ),初步抑菌活性测试表明,其对番 茄灰霉病菌Botrytis cinerea、黄瓜炭疽病菌Gloeosporium orbiculare Ars. 和水稻稻瘟病菌Magnaporthe grisea具有较强的抑制活性,在100 mg/L时抑制率分别为100%、91.2 %和93.5%[10]。
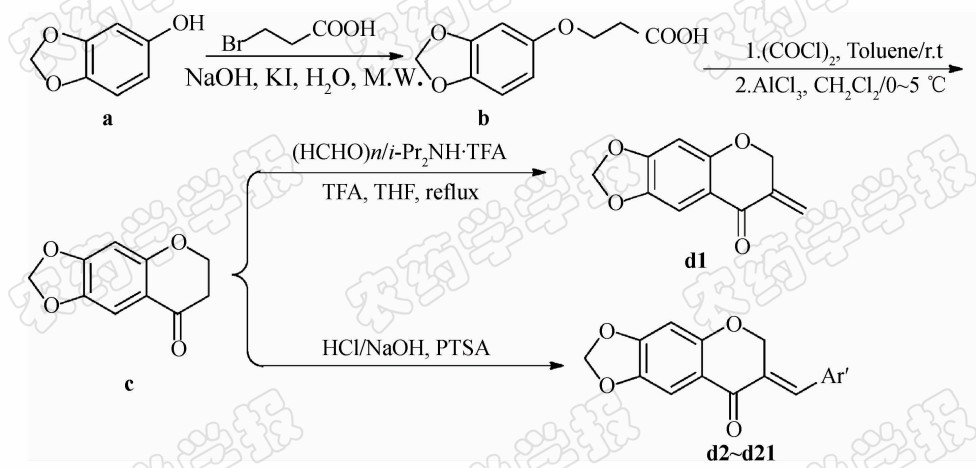
为了寻找新型、高效的色满酮类杀菌剂,笔者以芝麻酚为原料,经醚化和关环反应,先合成了色满酮
中间体,再通过活性基团拼接法,将色满酮与 α,β -不饱和双键嵌入同一分子中,通过亚甲基化、羟醛缩合等反应,设计合成了21个未见文献报道的3-取代-4-色满酮类衍生物(合成路线见 Scheme 1 ),对其结构进行了确认,并初步测定了其抑菌活性。
 | Scheme 1 |
XT-4型显微熔点测定仪(温度未校正,北京泰克仪器有限公司);Bruker Tensor 27 FT-IR红外光谱仪(瑞士Bruker公司);Bruker Avance 500 核磁共振仪(瑞士Bruker公司);Waters Quattro Premier XE 质谱仪(美国Waters公司)。 芝麻酚(苏州大新助剂厂,纯度98%),噻菌灵(thiabendazole)(北京颖泰嘉和科技股份有限公司,纯度98.5%)。其他试剂均为市售国产分析级。
参考文献[14]方法。冰水浴下,向25 mL圆底烧瓶中依次加入1 mmol(0.192 g)化合物 c 、4 mmol(0.120 g)多聚甲醛、1 mmol(0.215 g)二异丙胺三氟乙酸盐(自制[15])和10 mL四氢呋喃(THF),搅拌均匀后缓慢滴入0.012 mmol(0.92 mL)三氟乙酸,冰水浴下搅拌10 min,升温至回流反应8 h,薄层层析(TLC)[V(二氯甲烷) ∶V(甲醇)=100 ∶1]跟踪检测至反应 完毕。将反应液投入50 mL水中淬灭,用乙酸乙酯萃取(30 mL×3),有机相依次用饱和食盐水和饱和碳酸氢钠溶液洗涤,减压除去溶剂,硅胶柱层析[V(二氯甲烷) ∶V(甲醇)=200 ∶1]分离,得0.137 g黄色片状晶体,m.p.118~119 ℃,产率67%。
参考文献[16]方法。 以 d2 为例:向50 mL单口瓶中依次加入1 mmol(0.192 g)化合物 c 、20 mL甲醇、 1.4 mmol(0.15 mL)苯甲醛和1 mL 质量分数为50%的氢氧化钾溶液,室温下搅拌18 h,TLC[V(石油醚) ∶V(乙酸乙酯)=4 ∶1]跟踪检测至反应完毕。将反应液用冰水浴冷却15 min,析出黄色沉淀,抽滤,用冷甲醇洗涤,无水乙醇重结晶,得0.149 g黄色针状晶体,m.p.147~148 ℃,产率53%。同法合成 d3~d21 。
目标化合物的理化性质及质谱数据见表 1;核磁共振氢谱、碳谱数据和红外光谱数据见表 2。从质谱数据可见,目标化合物具有不同强度的分子离 子峰。在 1H NMR数据中,亚甲二氧基(-OCH2O-) 上的H由于吸电子诱导效应化学位移值在6.00左右;目标化合物 d1 的-C=CH2基团,与羰基同侧的H由于形成了分子内氢键,化学位移移向低场, δ 在6.26处,而与羰基异侧H因不能形成分子内氢键,故化学位移处于高场, δ 在5.53处;目标化合物 d2~d21 的结构相似,只是与-C=所连的苯亚甲基上苯环取代基有差异,核磁共振谱图呈现一定的规律性。以 d8 为例,Ar上与氧相近的H由于氧的给电子诱导效应,化学位移移向高场, δ 在6.42处;Ar上与羰基相近的H由于羰基的吸电子诱导效应,化学位移移向低场, δ 在7.38;在HMBC谱中,-OCH2-上的C( δ 在68.03处)仅与 δ 在7.80的H相关,故 δ 在7.80处的H为双键上的H质子,在HSQC谱中,7.80与136.72相关,故双键端基归属为(7.80,136.72)。根据化学位移可以知道,双键端基上的H与羰基上的氧形成分子内氢键,化学位移移向低场,目标化合物均为E式构型。在13C NMR数据中,当Ar′ 环含有F原子时,19F会与13C发生偶合,邻近的C峰会裂分,如 d6 中与F相连的Ar′-C化学位移值为163.01,J=250.8 Hz;又如 d15 中F原子与-OCH2-在空间上距离很近,由于范德华效应,使-OCH2-的峰裂分为d峰,J=5.6 Hz。在IR数据中,羰基在1 625~1 671 cm-1有很强的吸收峰;苯环的骨架振动在1 600、1 580、1 480、1 450 cm-1附近有4个中等到强的吸收峰;双键在1 615~1 632 cm-1处有中等强度的吸收峰;羟基在3 153~3 526 cm-1处出现弱且宽的峰。 从以上数据可以看出,目标化合物的光谱数据与预期的结构相符合。
| 表 1 色满酮和d1~d21的理化性质及质谱数据 Table 1 Physico-chemical properties and ESI-MS data of c and d1-d21 compounds |
| 表 2 化合物d1~d21的核磁共振氢谱、碳谱及红外光谱数据 Table 2 1H NMR,13C NMR and IR data of d1-d21 compounds |
结果(表 3)表明,在50 mg/L时所有目标化合物对8种供试病原菌均有不同程度的抑制作用,其中中间体 c (色满酮)对番茄灰霉病菌的抑制率为87.9%; d1 对水稻稻瘟病菌、番茄灰霉病菌和烟草赤星病菌的抑制率高于60%; d6 对玉米弯胞病菌和水稻稻瘟病菌的抑制率分别为75.2%和63.2%; d9 对苹果腐烂病菌的抑制率为70.7%; d13 对棉花枯萎病菌的抑制率为67.8%。经过初筛可以初步判断目标化合物 d1、d6和d13 抑菌活性较好,其构效关系有待进一步研究。
| 表 3 化合物d1~d21在50 mg/L下的抑菌活性 (抑制率/%,72 h) Table 3The antifungal activity of compounds d1-d21 under 50 mg/L(Inhibition rate/%,72 h) |
| [1] | PERJESI P, DAS U, DE CLERCQ E, et al. Design, synthesis and antiproliferative activity of some 3-benzylidene-2, 3-dihydro-1-benzopyran-4-ones which display selective toxicity for malignant cells [J]. Eur J Med Chem, 2008, 43(4): 839-845. |
| [2] | 高河勇, 王丽, 徐莉英, 等. 7-甲磺酰胺基-6-苯氧基-4-色满酮衍生物的合成及抗炎活性研究[J]. 中国药物化学杂志, 2003, 13(5): 19-22. |
| [3] | 胡春, 肖高铿, 于新章, 等. 4-色满酮Mannich碱类化合物的合成及其抗炎活性[J]. 中国药物化学杂志, 2004, 14(4): 21-26. |
| [4] | 郑伟, 孙光, 孙宝佳, 等. 色满酮类化合物的合成及其抗炎活性研究[J]. 精细化工中间体, 2009, 39(1): 30-33. |
| [5] | 胡春, 邱志远, 王永永, 等. 4-色满酮曼尼希碱类化合物的合成及其抗血小板凝集活性[J]. 精细化工中间体, 2010, 40(2): 18-21, 40. |
| [6] | 李慧媛, 张琳琳, 张传明, 等. 4-色满酮芳环Mannich碱类化合物的合成及其抗血小板凝集活性研究[J]. 精细化工中间体, 2008, 38(1): 13-17 . |
| [7] | MAZZEI M, BALBI A, ROMA G. Synthesis and anti-platelet activity of some 2-(dialkylamino) chromones [J]. Eur J Med Chem, 1988, 23(3): 237-242. |
| [8] | MORRIS J, WISHKA D G, LIN A H. Synthesis and biological evaluation of antiplatelet 2-aminochromones [J]. J Med Chem, 1993, 36(14): 2026-2032. |
| [9] | MUSSO L, DALLAVALLE S, MERLINI L, et al. Synthesis and antifungal activity of 2-hydroxy-4, 5-methylenedioxyaryl ketones as analogues of kakuol [J]. Chemistry & Biodiversity, 2010, 7(4): 887-897. |
| [10] | 师伟. 卡枯醇衍生物的合成及抑菌活性研究 (Ⅱ) [D]. 杨凌: 西北农林科技大学. 2011. |
| [11] | 李红亚, 刘卉闵, 吴国江, 等. 微波辐射下β-芳氧丙酸和色满酮的合成 [J]. 河北大学学报: 自然科学版, 2008, (4): 399-402. |
| [12] | Cueva, Juan Pablo. Journal of Medicinal Chemistry 2006, 49(23): 6848-6857. CAPLUS . |
| [13] | MAHAPATRA T, JANA N, NANDA S. Chemoenzymatic synthesis and resolution of compounds containing a quaternary stereocenters adjacent to a carbonyl group [J]. Tetrahedron: Asymmetry, 2008, 19(10): 1224-1232. |
| [14] | BUGARIN A, JONES K D, CONNELL B T. Efficient, direct alpha-methylenation of carbonyls mediated by diisopropylammonium trifluoroacetate [J]. Chem Commun, 2010, 46(10): 1715-1717. |
| [15] | GRACIANI N R, SWANSON D S, KELLY J W. Phosphomonoesters and phosphodiesters derived from the photohydrolysis of 2-methoxy-5-nitrophenyl substituted phosphotriesters [J]. Tetrahedron, 1995, 51(4): 1077-1086. |
| [16] | LEE C Y, CHEW E H, GO M L. Functionalized aurones as inducers of NAD(P)H: quinone oxidoreductase 1 that activate AhR/XRE and Nrf2/ARE signaling pathways: synthesis, evaluation and SAR [J]. Eur J Med Chem, 2010, 45(7): 2957-2971. |
| [17] | 吴文君. 植物化学保护实验技术导论[M]. 西安: 陕西科学技术出版社: 1988: 3. |
| [18] | 张琨. 含噻嗪酰胺的新三唑类化合物的合成及抑菌活性研究[D]. 杨凌: 西北农林科技大学. 2012 |
 2013, Vol. 15
2013, Vol. 15 


