文章信息
- 张信童, 何永军, 刘杨, 陈火英
- ZHANG Xintong, HE Yongjun, LIU Yang, CHEN Huoying
- 茄果皮着色光敏性dCAPS标记开发与验证
- Development and validation of molecular marker for photosensitivity of anthocyanin production in eggplant fruit
- 南京农业大学学报, 2021, 44(4): 637-645
- Journal of Nanjing Agricultural University, 2021, 44(4): 637-645.
- http://dx.doi.org/10.7685/jnau.202009022
-
文章历史
- 收稿日期: 2020-09-28
茄(Solanum melongena L.)在世界范围内广泛栽培[1], 目前大多栽培品种为紫茄。作为为数不多富含花青素的紫色蔬菜, 紫茄果皮的颜色和均匀程度直接影响茄果的商品价值[2]。花青素是果实着色的物质基础[3], 其合成和积累容易受到光照、温度等环境条件的影响[4]。研究表明, 品种不同, 茄果中花青素合成受光诱导的敏感程度也不同, 据此, 茄可被分类为光敏感型和光不敏感型[5]。在套袋模拟黑暗条件下, 光敏感茄果皮无花青素积累, 呈白色; 而光不敏感茄果皮着色不完全依赖光, 即使完全遮光, 果皮中仍有花青素积累, 呈现出不同程度的紫色[6-7]。在生产中, 早春设施栽培的弱光环境常导致茄果皮着色不均, 因此, 培育光不敏感茄对于提高茄商品价值意义重大。
在传统的茄育种工作中, 选择光不敏感茄品种主要是在开花后对果实进行套袋, 摘袋后依据表型进行鉴定。前期田间观察发现, 萼片下果皮是一个特殊位置, 无法接触光照, 光敏感茄萼片下无花青素积累, 颜色为白色或绿色, 而光不敏感茄萼片下有花青素积累, 颜色表现为不同程度的紫色, 这与套袋验证结果一致。因此, 通过萼片下颜色可判断茄果皮着色对光的敏感程度[7-8]。这种方法往往需要到结果期才可进行选择, 周期长, 筛选效率较低, 且费时费力。分子标记辅助选择能极大地缩短育种年限, 提高育种效率[9]。目前, 茄中与果皮着色光敏性相关的报道较少。陈雪平[10]利用萼片下果色不同的茄构建F2群体, 并构建了总图距为1 454.63 cM、平均图距0.82 cM的高密度遗传图谱, 在第6连锁群上检测到3个大小为1.105~3.001且与萼片下果色相关的QTL, 贡献率均在10%以上, 均表现为主效QTL。He等[6]通过数量遗传研究方法对果萼下颜色为浅紫色和绿色的茄及其F2进行遗传规律探究, 发现茄果萼下颜色主要由以加性效应为主的2对主基因控制, 在F2中2对主基因遗传率为93.96%, 并在第6连锁群上发现1个与果萼下颜色极显著相关的SSR标记E06-5。Toppino等[11]在第5和第10染色体上定位到2个控制萼片下果皮颜色的QTL位点Undcal10和Undcal05, 在Montanaso Lombardo试验地的贡献率分别为77.00%和13.80%。目前关于茄萼片下颜色相关标记已有相关成果, 但仍需进一步研究。
本研究以果皮着色光敏感茄'蓝山禾线'和光不敏感茄'145'及其后代为材料, 利用群体分离分析法(BSA)混池测序, 开发茄果皮着色光敏性相关分子标记, 并经F2群体材料及茄品种进行验证, 旨在为加快优质茄品种的选育提供技术支持, 为解析茄萼片下紫色形成的分子机制提供参考。
1 材料与方法 1.1 供试材料以光敏感茄品种'蓝山禾线'、光不敏感茄品种'145'以及30个光敏感和30个光不敏感F2单株的DNA为BSA混池测序的材料, 以192个F2单株和123个茄品种为验证标记的材料。所有供试材料于2019年12月播种于上海航育种子基地(121.504°E, 31.049°N), 常规方法种植和管理。亲本材料及F2群体由上海交通大学园艺植物资源与种质创新团队提供; 123个品种来源于上海市农业科学院(表 1)。
| 编号Code | 品种Variety | 产地Place | 类型Type | 编号Code | 品种Variety | 产地Place | 类型Type | |
| 1 | Feb-96 | 不详Unknown | 光敏感Photosensitive | 23 | XIN31359 | 上海Shanghai | 光敏感Photosensitive | |
| 2 | Arka Keshav | 印度India | 光敏感Photosensitive | 24 | XIN31988 | 上海Shanghai | 光敏感Photosensitive | |
| 3 | B75 | 不详Unknown | 光敏感Photosensitive | 25 | 禾线茄Hexianqie | 湖南Hunan | 光敏感Photosensitive | |
| 4 | DiFirenze | 意大利Italy | 光敏感Photosensitive | 26 | 荷包茄Hebaoqie | 不详Unknown | 光敏感Photosensitive | |
| 5 | YZ-10 | 河南Henan | 光敏感Photosensitive | 27 | NK-6 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 6 | Local-1 | 印度India | 光不敏感Non-photosensitive | 28 | NK-7 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 7 | YZ-11 | 山东Shandong | 光敏感Photosensitive | 29 | NK-8 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 8 | YZ-14 | 湖北Hubei | 光敏感Photosensitive | 30 | 红茄Hongqie | 不详Unknown | 光不敏感Non-photosensitive | |
| 9 | NK-1 | 上海Shanghai | 光不敏感Non-photosensitive | 31 | 绿长茄Lüchangqie | 山东Shandong | 光敏感Photosensitive | |
| 10 | NK-2 | 上海Shanghai | 光不敏感Non-photosensitive | 32 | 紫荷包茄Zihebaoqie | 不详Unknown | 光敏感Photosensitive | |
| 11 | NK-3 | 上海Shanghai | 光不敏感Non-photosensitive | 33 | 麻薯长茄Mashuchangqie | 台湾Taiwan | 光敏感Photosensitive | |
| 12 | YZ-22 | 山东Shandong | 光敏感Photosensitive | 34 | 墨娇龙Mojiaolong | 江苏Jiangsu | 光敏感Photosensitive | |
| 13 | YZ-24 | 江苏Jiangsu | 光敏感Photosensitive | 35 | 墨茄Moqie | 四川Sichuan | 光敏感Photosensitive | |
| 14 | YZ-4 | 韩国Korea | 光敏感Photosensitive | 36 | 墨长茄Mochangqie | 不详Unknown | 光敏感Photosensitive | |
| 15 | 扬州1号Yangzhou 1 | 江苏Jiangsu | 光不敏感Non-photosensitive | 37 | NK-9 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 16 | 线长茄Xianchangqie | 湖北Hubei | 光不敏感Non-photosensitive | 38 | NK-10 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 17 | YZ-9 | 江苏Jiangsu | 光敏感Photosensitive | 39 | NK-12 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 18 | XIN34895 | 上海Shanghai | 光敏感Photosensitive | 40 | 青牛奶茄Qingniunaiqie | 不详Unknown | 光敏感Photosensitive | |
| 19 | 敦和茄Dunheqie | 广东Guangdong | 光敏感Photosensitive | 41 | 三月茄Sanyueqie | 重庆Chongqing | 光敏感Photosensitive | |
| 20 | 二红茄Erhongqie | 四川Sichuan | 光敏感Photosensitive | 42 | Q061 | 上海Shanghai | 光敏感Photosensitive | |
| 21 | NK-4 | 上海Shanghai | 光不敏感Non-photosensitive | 43 | Q064 | 上海Shanghai | 光敏感Photosensitive | |
| 22 | NK-5 | 上海Shanghai | 光不敏感Non-photosensitive | 44 | 松江茄子Songjiangqie | 上海Shanghai | 光敏感Photosensitive | |
| 45 | 台湾茄Taiwanqie | 台湾Taiwan | 光敏感Photosensitive | 85 | XIN24147 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 46 | Q062 | 上海Shanghai | 光敏感Photosensitive | 86 | XIN41024 | 上海Shanghai | 光敏感Photosensitive | |
| 47 | 线茄Xianqie | 浙江Zhejiang | 光敏感Photosensitive | 87 | XIN35509 | 上海Shanghai | 光敏感Photosensitive | |
| 48 | YZ-8 | 广东Guangdong | 光敏感Photosensitive | 88 | XIN31360 | 上海Shanghai | 光敏感Photosensitive | |
| 49 | 香蕉茄Xiangjiaoqie | 浙江Zhejiang | 光敏感Photosensitive | 89 | XIN13475 | 上海Shanghai | 光敏感Photosensitive | |
| 50 | 新长崎Xinchangqi | 日本Japan | 光敏感Photosensitive | 90 | XIN35713 | 上海Shanghai | 光敏感Photosensitive | |
| 51 | 胭脂茄Yanzhiqie | 台湾Taiwan | 光敏感Photosensitive | 91 | XIN41027 | 上海Shanghai | 光敏感Photosensitive | |
| 52 | YZ-5 | 山东Shandong | 光敏感Photosensitive | 92 | 交茄1号Jiaoqie 1 | 上海Shanghai | 光敏感Photosensitive | |
| 53 | 窑头茄Yaotouqie | 江西Jiangxi | 光敏感Photosensitive | 93 | 交茄2号Jiaoqie 2 | 上海Shanghai | 光敏感Photosensitive | |
| 54 | 鹰嘴茄Yingzuiqie | 浙江Zhejiang | 光敏感Photosensitive | 94 | 紫长茄Zichangqie | 不详Unknown | 光敏感Photosensitive | |
| 55 | 早紫茄Zaoziqie | 不详Unknown | 光敏感Photosensitive | 95 | NK-11 | 上海Shanghai | 光不敏感Non-photosensitive | |
| 56 | 长虹早茄Changhongzaoqie | 浙江Zhejiang | 光敏感Photosensitive | 96 | 紫茄Ziqie | 云南Yunnan | 光敏感Photosensitive | |
| 57 | 长茄Changqie | 不详Unknown | 光敏感Photosensitive | 97 | 黑龙Heilong | 江苏Jiangsu | 光敏感Photosensitive | |
| 58 | 长身紫茄Changshenziqie | 广东Guangdong | 光敏感Photosensitive | 98 | YZ-16 | 辽宁Liaoning | 光敏感Photosensitive | |
| 59 | 珍珠茄Zhenzhuqie | 不详Unknown | 光敏感Photosensitive | 99 | 皇姬Huangji | 日本Japan | 光敏感Photosensitive | |
| 60 | 竹茄Zhuqie | 不详Unknown | 光敏感Photosensitive | 100 | YZ-19 | 台湾Taiwan | 光敏感Photosensitive | |
| 61 | 屏东长茄Pingdongchangqie | 台湾Taiwan | 光敏感Photosensitive | 101 | YZ-20 | 江苏Jiangsu | 光敏感Photosensitive | |
| 62 | 平湖小红茄Pinghuxiaohongqie | 浙江Zhejiang | 光敏感Photosensitive | 102 | XIN36448 | 上海Shanghai | 光敏感Photosensitive | |
| 63 | 济南早小长茄Jinanzaoxiaochangqie | 山东Shandong | 光敏感Photosensitive | 103 | XIN36449 | 上海Shanghai | 光敏感Photosensitive | |
| 64 | NK-13 | 上海Shanghai | 光不敏感Non-photosensitive | 104 | XIN36450 | 上海Shanghai | 光敏感Photosensitive | |
| 65 | NK-14 | 上海Shanghai | 光不敏感Non-photosensitive | 105 | XIN37684 | 上海Shanghai | 光敏感Photosensitive | |
| 66 | NK-15 | 上海Shanghai | 光不敏感Non-photosensitive | 106 | XIN37685 | 上海Shanghai | 光敏感Photosensitive | |
| 67 | NK-16 | 上海Shanghai | 光不敏感Non-photosensitive | 107 | XIN37708 | 上海Shanghai | 光敏感Photosensitive | |
| 68 | NK-17 | 上海Shanghai | 光不敏感Non-photosensitive | 108 | XIN38304 | 上海Shanghai | 光敏感Photosensitive | |
| 69 | NK-18 | 上海Shanghai | 光不敏感Non-photosensitive | 109 | XIN38496 | 上海Shanghai | 光敏感Photosensitive | |
| 70 | NK-19 | 上海Shanghai | 光不敏感Non-photosensitive | 110 | XIN40896 | 上海Shanghai | 光敏感Photosensitive | |
| 71 | NK-20 | 上海Shanghai | 光不敏感Non-photosensitive | 111 | 杭茄2010 Hangqie 2010 | 浙江Zhejiang | 光敏感Photosensitive | |
| 72 | XIN35712 | 上海Shanghai | 光不敏感Non-photosensitive | 112 | 杭茄1号Hangqie 1 | 浙江Zhejiang | 光敏感Photosensitive | |
| 73 | XIN36736 | 上海Shanghai | 光不敏感Non-photosensitive | 113 | 渝茄五号Yuqie 5 | 重庆Chongqing | 光敏感Photosensitive | |
| 74 | XIN36737 | 上海Shanghai | 光不敏感Non-photosensitive | 114 | 春秋长茄Chunqiuchangqie | 不详Unknown | 光敏感Photosensitive | |
| 75 | XIN36738 | 上海Shanghai | 光不敏感Non-photosensitive | 115 | 驻茄14号Zhuqie 14 | 河南Henan | 光敏感Photosensitive | |
| 76 | XIN37157 | 上海Shanghai | 光不敏感Non-photosensitive | 116 | 吉茄9号Jiqie 9 | 吉林Jilin | 光敏感Photosensitive | |
| 77 | XIN37158 | 上海Shanghai | 光不敏感Non-photosensitive | 117 | 吉茄8号Jiqie 8 | 吉林Jilin | 光敏感Photosensitive | |
| 78 | XIN37548 | 上海Shanghai | 光不敏感Non-photosensitive | 118 | 海棠2号Haitang 2 | 不详Unknown | 光敏感Photosensitive | |
| 79 | XIN39403 | 上海Shanghai | 光不敏感Non-photosensitive | 119 | 略阳牛奶茄Lüeyangniunaiqie | 陕西Shaanxi | 光敏感Photosensitive | |
| 80 | XIN41023 | 上海Shanghai | 光不敏感Non-photosensitive | 120 | 海城长茄Haichengchangqie | 辽宁Liaoning | 光敏感Photosensitive | |
| 81 | 鄂茄五号Eqie 5 | 湖北Hubei | 光不敏感Non-photosensitive | 121 | 旺步紫长茄Wangbuzichangqie | 广东Guangdong | 光敏感Photosensitive | |
| 82 | 鄂茄六号Eqie 6 | 湖北Hubei | 光不敏感Non-photosensitive | 122 | 十姐妹茄Shijiemeiqie | 不详Unknown | 光敏感Photosensitive | |
| 83 | 布利塔Bulita | 荷兰Netherlands | 光不敏感Non-photosensitive | 123 | 上海本地长茄Shanghaibendichangqie | 上海Shanghai | 光敏感Photosensitive | |
| 84 | 耐寒金刚Naihanjingang | 不详Unknown | 光不敏感Non-photosensitive |
1.2.1田间表型鉴定
在开花14 d后对所有单株进行表型鉴定。选取每个单株中较大的茄果实, 掀开萼片, 观察萼片下果皮的颜色。若萼片下果皮颜色为紫色或淡紫色, 即有花青素积累, 则归类为光不敏感型; 若萼片下果皮颜色为白色或绿色, 即无花青素积累, 则归类为光敏感型。
1.2.2 DNA提取采用CTAB法提取茄材料基因组DNA[12], 用琼脂糖凝胶电泳检测DNA质量。
1.2.3 混池构建及测序分析提取亲本'蓝山禾线'和'145'DNA各1份, 光敏感和光不敏感的F2单株DNA各30份, 构建光敏感型和光不敏感型DNA混池。样品基因组DNA检测合格后, 每个混池中DNA等量混合, 利用超声波将亲本和混池DNA序列片段化形成随机片段, 对片段化的DNA依次进行末端修复、3′端加A、连接测序接头, 再利用磁珠吸附富集基因组长度为400 bp左右的片段, 经过PCR扩增形成测序文库。建好的文库先进行文库质检, 质检合格后再用Illumina HiSeq TM平台进行测序, 测序策略为Illumina PE150, 总测序读长为300 bp。建库、简化基因组测序由上海美吉生物医药科技有限公司完成。比对参考基因组(http://http://eggplant.kazusa.or.jp/)进行变异检测分析。根据混池中基因型频率的差异, 在全基因组进行混池关联分析, 筛选与目标性状相关联的位点, 获得目的基因候选区间。
1.2.4 dCAPS标记开发在BSA重测序获得的初定位区间内, 挑选2亲本中相异且纯合的SNP位点, 均匀设计引物30对(表 2)。利用dCAPS Finder 2.0 Program(http://helix.wustl.edu/dcaps/dcaps.html)进行dCAPS引物开发和内切酶的选择, 同时利用Primer Premier 5.0软件设计相应的下游引物。引物由生工生物工程(上海)股份有限公司合成。
| 引物名称Primer | 正向序列Forward primer(5′→3′) | 反向序列Reverse primer(5′→3′) | 产物长度/bp Product size | 酶切种类Cut type | 内切酶Quickcut enzyme |
| dCAPS-1 | ACATAAACTCAAATAAACAACATAT | ATTGATTGAGATAATTCTTGGTACG | 193 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-2 | GTGCAAAGGACTTGAGGAAAAATCT | AAATATTGATAGGAGGGTTCCACGA | 290 | 光不敏感型Non-photosensitive | PstⅠ |
| dCAPS-3 | AATATAAAAGAGAAGGATGAGAATT | ATACCGTGAAGTGTGTTCTATCTCT | 222 | 光不敏感型Non-photosensitive | EcoRⅠ |
| dCAPS-4 | TTTTTTATAACTCGAAAGTATTAAA | AAATTTTCACTAAATCAATCGAATT | 207 | 光敏感型Photosensitive | EcoRⅠ |
| dCAPS-5 | ATTGAGAAAGTGCTGGATTTCATAT | AAAGACACTCCCGTTGTGATTAG | 90 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-6 | CCCCCTGGCTTCAAATACATACATA | GTATTGGATGATGCAGGACAACTGC | 216 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-7 | CCCCTGGCTTCAAATACATACATAT | GCGGGCGACTATTCCAACTCAAC | 121 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-8 | CCGATGTATCAGACAGTCCAAAT | ACATCTACATGCAACACTCAACAGC | 175 | 光敏感型Photosensitive | AluⅠ |
| dCAPS-9 | GATGTGGAAGCAGTGGCTGTGAA | TATGGTCACAATCTTCGGCTGAATT | 120 | 光敏感型Photosensitive | EcoRⅠ |
| dCAPS-10 | TCTATTTATGGAATATCTATTGAAG | GCTCAATTACTCAAAGAAGATAAGA | 184 | 光不敏感型Non-photosensitive | SacⅠ |
| dCAPS-11 | ATTGAGAAAGTGCTGGATTTCATAT | AAAGACACTCCCGTTGTGATTAG | 90 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-12 | TGGTGACTTAAAAAGTATTTAGGTA | TAATAACAAAAGTTTGCCTAAGGTG | 232 | 光敏感型Photosensitive | KpnⅠ |
| dCAPS-13 | CCCCCTGGCTTCAAATACATACATA | GTATTGGATGATGCAGGACAACTGC | 216 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-14 | CCCCTGGCTTCAAATACATACATAT | GCGGGCGACTATTCCAACTCAAC | 121 | 光敏感型Photosensitive | NdeⅠ |
| dCAPS-15 | CCGATGTATCAGACAGTCCAAAT | ACATCTACATGCAACACTCAACAGC | 175 | 光敏感型Photosensitive | AluⅠ |
| dCAPS-16 | ACCAAATGGCTTTAACTTTATGTGA | ATACACAATTTACGCATAACGAATT | 252 | 光敏感型Photosensitive | EcoRⅠ |
| dCAPS-17 | TCTGTCTCACCTTAGCATGCTTAGC | GATTGGGTAGAACCTCGTGCTGATA | 256 | 光敏感型Photosensitive | AluⅠ |
| dCAPS-18 | TGATGCAAAATCAACTATTGCTAGA | CAGAGGCACTTTTTTCTTTGGTCGA | 242 | 光敏感型Photosensitive | SalⅠ |
| dCAPS-19 | GGTTTTTGAAGAAAATTGTGCTCGA | TCGTTCCAATAATAGGATCTTAGCA | 185 | 光敏感型Photosensitive | XhoⅠ |
| dCAPS-20 | AGCACATATAAATTTTTGAGGAATT | AACATTGCCTAAATGGGATAACG | 134 | 光敏感型Photosensitive | EcoRⅠ |
| dCAPS-21 | CATGGTGAAATCATACACATTAATC | AATTAATGATTTAACAATAAATAGC | 197 | 光敏感型Photosensitive | AluⅠ |
| dCAPS-22 | GAAGCATCAATGTTGGATATTGGAT | CGAACATTGTTGAATAGTAATTCCA | 230 | 光不敏感型Non-photosensitive | BamHⅠ |
| dCAPS-23 | CGTGCCAGAGTTAAATACCAAGTCA | TGGGATTAGTTGGGGCTGTAAGAGC | 238 | 光不敏感型Non-photosensitive | AluⅠ |
| dCAPS-24 | CTTTTCTTTATACATTAAAATCTAG | TACAATATAATTCTCAAGATCTCTA | 207 | 光敏感型Photosensitive | XbaⅠ |
| dCAPS-25 | ATAAGTATTGCTCTCTTTGTCTCTA | TTATGACACAATACATACATATCTA | 235 | 光不敏感型Non-photosensitive | XbaⅠ |
| dCAPS-26 | ACAAAATCATAAGGTGAATTGCATT | CGTCGTGCTGCATGAGAGAGGGAGC | 221 | 光敏感型Photosensitive | SacⅠ |
| dCAPS-27 | TCTATTTATGGAATATCTATTGAGC | CTCAATTACTCAAAGAAGATAAGAC | 258 | 光不敏感型Non-photosensitive | AluⅠ |
| dCAPS-28 | ATGTATTTCTGAATGGTCATTTTAG | ATACAAAGATATTGCACAGGGAATT | 214 | 光敏感型Photosensitive | EcoRⅠ |
| dCAPS-29 | TGGGTACAAACCCCCCATCTCGGTT | TTCTTCTCTAAATCACTACAAAGCT | 219 | 光不敏感型Non-photosensitive | HindⅢ |
| dCAPS-30 | ATAAGGAGGAGAAATTCAAGAAG | ATTATCCAATACAACATAATTGTCT | 250 | 光不敏感型Non-photosensitive | XbaⅠ |
分别以两亲本基因组DNA为模板进行PCR扩增, 并选择相应内切酶进行酶切, 通过80 g · L-1聚丙烯酰胺凝胶电泳对酶切产物进行检测, 选择能在双亲中表现出不同条带的多态性引物。PCR扩增体系10 μL: 0.5 μL模板DNA, 5 μL Easy Taq, 4 μL ddH2O, 正、反向引物各0.25 μL(10 μmol · L-1)。扩增程序为: 98 ℃ 10 s; 98 ℃ 10 s, 55 ℃ 30 s, 72 ℃ 40 s, 35个循环; 4 ℃保存。PCR产物经15 g · L-1琼脂糖凝胶电泳检测合格后, 分别对相应PCR产物进行酶切。酶切体系10 μL: 2 μL PCR产物, 0.2 μL限制性内切酶(10 U · mL-1), 1 μL Buffer, 6.8 μL ddH2O, 酶切体系置于37 ℃恒温2 h, 即可获得酶切后产物。
1.2.5 dCAPS标记验证分别以192份茄F2单株及123个茄品种的基因组DNA为模板, 以开发出的分子标记为引物进行PCR扩增, 酶切并电泳检测。
2 结果与分析 2.1 田间表型统计用于dCAPS多态性引物验证的192个F2单株中, 有148份光敏感型, 44份光不敏感型, 表型如图 1所示。采用卡方检验, 发现F2群体表型符合3 ∶ 1分离比例, 说明茄光敏性是质量性状。在123个茄子种质资源中, 85份为光敏感型, 38份为光不敏感型(表 1)。通过田间观察发现, F2群体中不同光不敏感茄萼片下花青素积累量不同, 表现为紫色程度不一: 有些单株萼片下为淡紫色, 有些为紫红色, 有些为深紫色。这一现象也出现在不同品种中。推测萼片下果皮着色光敏感是质量性状, 而敏感程度是数量性状。

|
图 1 F2群体单株表型 Fig. 1 Phenotype of individuals in F2 population a、b. 光不敏感茄萼片下颜色为紫红色或深紫色; c、d. 光敏感茄萼片下颜色为浅绿色或白色。 a, b. Non-photosensitive eggplants in F2 population ' s color under calyx are purplish red or deep purple; c, d. Photosensitive eggplants in F2 population ' s color under calyx are light green or white. |
BSA-seq结果显示: 当置信度为0.99时, 在10号染色体上共得到3个定位区间, 定位区域为87.080~88.090 Mb、91.475~92.475 Mb、92.785~93.785 Mb, 总长度为3.01 Mb。基于基因组数据分析, 区间内共得到54个SNP, 9个Indel。
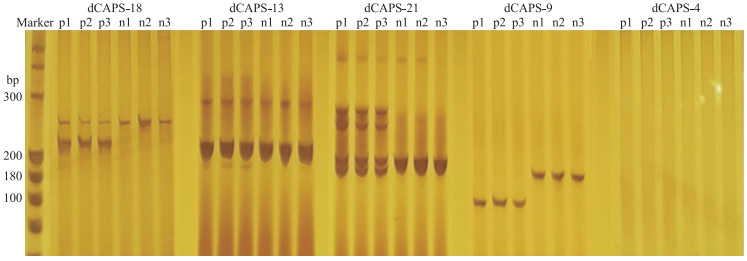
2.3 引物特异性检测分别以光敏感亲本'蓝山禾线'与光不敏感亲本'145'的基因组DNA为模板, 进行特异性检测。部分结果如图 2所示, 有6对引物在亲本间表现多态性, 10对引物在亲本间带型无区分, 8对引物在亲本间表现杂带, 6对引物无条带。
|
图 2 部分标记在亲本'蓝山禾线'和'145'中的特异性检测结果 Fig. 2 Specificity identification results of some primers in parental line 'Lanshanhexian'and'145' p1—p3和n1—n3分别为亲本'蓝山禾线'和'145'的3个重复, 下同。条带从左至右使用的引物分别为dCAPS-18、dCAPS-13、dCAPS-21、dCAPS-9、dCAPS-4。 p1-p3, n1-n3 are three repeats of parental line 'Lanshanhexian'and '145', respectively. The same as follows. The primer used from left to right are dCAPS-18, dCAPS-13, dCAPS-21, dCAPS-9, dCAPS-4. |
在该3.01 Mb区段设计的引物中, dCAPS-9在差异亲本中表现出较好的特异性。测序结果(图 3)显示: 在纯合光敏茄基因组中该位点SNP为G, 纯合光不敏感茄基因组中该位点SNP为A, 利用dCAPS技术, 在该SNP附近2 bp处引入突变碱基A, 从而引入1个EcoRⅠ的酶切位点。理论上由光敏茄DNA扩增出来的谱带有1个酶切位点, 可以被EcoRⅠ限制性内切酶切成17和113 bp, 光不敏感茄DNA扩增出来的谱带无酶切位点, 条带长度为120 bp。

|
图 3 dCAPS-9酶切位点 Fig. 3 Restriction sites in dCAPS-9 |
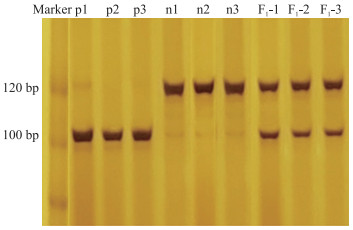
使用亲本及F1对该dCAPS标记进行验证, 结果(图 4)显示, 扩增后酶切共有3种带型: A(113 bp)、B(120 bp)、H(113+120 bp), 而17 bp的条带在胶上基本不可见。扩增并酶切后的条带大小与引物设计时的一致。
|
图 4 dCAPS-9在'蓝山禾线''145'和F1中的酶切结果 Fig. 4 Enzyme digestion results of dCAPS-9 in 'Lanshanhexian''145'and F1 |
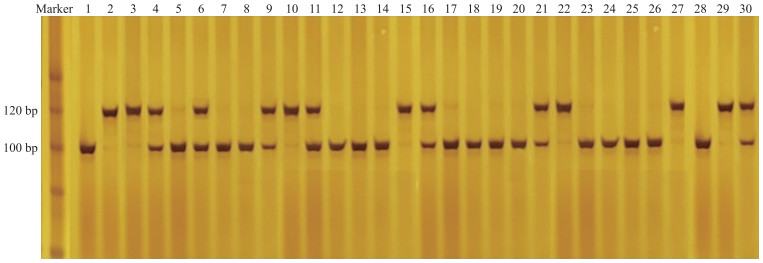
由表 3可见: 在茄F2群体的44份光敏材料中, 有41份材料酶切后带型为A, 分子标记的检测结果与表型的准确率达到93.2%;148份光不敏感材料中, 48份材料酶切后带型为B, 96份材料酶切后带型为H, 分子标记的检测结果与表型的准确率达到100.0%, 部分检测结果如图 5所示。在192个F2群体中, 分子标记的检测结果与表型的平均准确率达到98.4%。F2分离群体中基因型分布满足1∶2∶1, 符合孟德尔遗传规律, 这也再次验证了茄果皮着色光敏性这一性状为单基因控制的显性遗传。
| 表型Phenotype | 样本总数Total number of samples | 带型Genotype | 样本数Number of samples | 准确率/% Accuracy |
| 光敏型Photosensitive | 44 | A | 41 | 93.2 |
| B | 1 | |||
| H | 2 | |||
| 光不敏感型Non-photosensitive | 148 | A | 0 | 100.0 |
| B | 48 | |||
| H | 96 |
|
图 5 dCAPS-9标记在部分F2群体中酶切结果 Fig. 5 Enzyme digestion results of dCAPS-9 in F2 population 1~30为F2群体中30个随机植株。 1-30 represent 30 random plants in F2 population. |
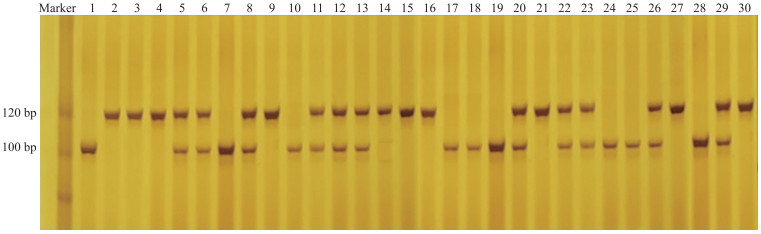
由表 4可见: 在用于标记检验的85份光敏感茄品种中, 82份材料酶切后带型为A, 准确率为96.5%;38份光不敏感茄品种中, 31份材料酶切后带型为B或H, 准确率为81.6%, 部分检测结果如图 6所示。在123份茄品种中, 分子标记的检测结果与表型的平均准确率达到91.9%。
| 表型Phenotype | 样本总数Total number of samples | 带型Genotype | 样本数Number of samples | 准确率/% Accuracy |
| 光敏型Photosensitive | 85 | A | 82 | 96.5 |
| B | 1 | |||
| H | 2 | |||
| 光不敏感型Non-photosensitive | 38 | A | 7 | 81.6 |
| B | 10 | |||
| H | 21 |
茄作为仅次于马铃薯和番茄的第三大茄科作物, 具有重要的经济价值。但由于茄子栽培种内遗传背景狭窄[8]、重要经济性状的关联标记开发和基因挖掘滞后等原因, 相较于其他已经构建高密度连锁图谱的茄科作物, 茄中分子遗传研究相对落后。目前, 茄子中用于遗传多样性研究和基因图谱研究的分子标记有SSR、ISSR、RAPD、AFLP和SRAP[13-15]等类型, 且多集中在前2种类型。自2011年马铃薯基因组序列被公布以来[16], 其他茄科作物全基因组测序工作陆续开展, 2014年茄基因组测序草图完成[17], 部分基因组测序的完成为茄分子标记开发及基因定位等提供了新的途径。对不同茄种质资源进行全基因组重测序并挖掘全基因组SNP位点, 开发重要经济性状的关联标记, 构建遗传连锁图谱定位重要农艺性状的主效基因, 已成为茄分子遗传育种研究中一个重要研究内容。
本研究中所使用的dCAPS标记是基于亲本重测序数据开发获得, 更具有针对性, 且准确有效。董淑芳等[18]采用Super BSA测序技术获得1个与粉红色番茄高度相关的SNP位点, 并根据该位点开发出1个符合度达到95%以上的dCAPS标记; 迟莹莹等[19]基于西瓜全基因组重测序数据在普通栽培西瓜品系'W1-1'和黏籽西瓜品系'PI186490'亲本间开发了450个CAPS分子标记, 筛选出具有多态性的CAPS标记200个, 并通过QTL分析定位到与种子性状相关的QTL位点15个; 王学征等[20]利用群体分离分析法(BSA)与双亲材料基因重测序相结合, 将甜瓜果面沟基因定位于第11号染色体后半段, 并在定位区域上开发出2对CAPS标记, 分子数据与田间性状符合率为74.67%和75.99%。
在众多的分子标记方法中, SNP标记遗传稳定性高, 位点分布广泛且富有代表性, 已成为当前研究最多的分子标记之一[21-22]。酶切扩增多态性序列(CAPS)标记和衍生限制性内切酶多态性序列(dCAPS)标记作为SNP标记[23], 因为具有共显性、低成本、操作简单、检测的样品量较少等优点, 被广泛应用于辅助育种中[24]。随着高通量测序技术的发展, 大量SNP位点被挖掘, CAPS分子标记技术已经在柑橘[25]、玉米[26]、木薯[27]、黄麻[28]等作物中得到广泛应用。
分子标记的准确性是分子辅助育种的关键, 直接决定着育种的成功与否[29]。本研究中, dCAPS-9在茄F2分离群体中有着更高的筛选准确率, 但在品种的群体验证中还有少量个体表型鉴定与基因型鉴定结果不一致, 推测这些个体可能为重组单株, 或参照茄基因组新测序结果设计的引物存在检测不完全准确的问题等。
本研究以光敏感和光不敏感茄为研究对象, 基于茄全基因组重测序, 结合BSA混池构建和关联分析, 在第10号染色体上鉴定出总长度为3.01 Mb的3个候选区段, 选择候选区域内的差异SNP位点, 开发出1个衍生限制性内切酶多态性标记dCAPS-9, 在192个F2单株及123个茄品种材料中的检测准确率分别达到98.4%和91.9%, 可以很好地鉴别茄F2群体及茄品种的光敏性, 显著提高了光不敏感茄选择的准确性和育种效率。研究结果为茄果色光敏性辅助选择奠定了理论依据。后期试验着力于将标记与群体相结合, 通过图位克隆等方式进一步精细定位茄中光诱导花青素合成相关性状的主效基因。
| [1] |
刘富中, 连勇, 陈钰辉, 等. "十五"期间我国茄子遗传育种研究进展[J]. 中国蔬菜, 2006(3): 31-34. Liu F Z, Lian Y, Chen Y H, et al. Review of eggplant breeding during the 10th 'five-year' plan[J]. China Vegetables, 2006(3): 31-34 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-6346.2006.03.013 |
| [2] |
张映, 赵悦琪, 陈钰辉, 等. 茄子紫色形成的分子研究进展[J]. 园艺学报, 2019, 46(9): 1779-1796. Zhang Y, Zhao Y Q, Chen Y H, et al. Progress in molecular research on purple formation of eggplant[J]. Acta Horticulturae Sinica, 2019, 46(9): 1779-1796 (in Chinese with English abstract). |
| [3] |
Pojer E, Mattivi F, Johnson D, et al. The case for anthocyanin consumption to promote human health: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2013, 12(5): 483-508. DOI:10.1111/1541-4337.12024 |
| [4] |
万东璞, 于卓, 吴燕民, 等. 花青素代谢调控植物彩叶研究进展[J]. 中国农业科技导报, 2020, 22(2): 30-38. Wan D P, Yu Z, Wu Y M, et al. Regulation of anthocyanin metabolism on colored leaves of plants[J]. Journal of Agricultural Science and Technology, 2020, 22(2): 30-38 (in Chinese with English abstract). |
| [5] |
Jiang M M, Ren L, Lian H L, et al. Novel insight into the mechanism underlying light-controlled anthocyanin accumulation in eggplant(Solanum melongena L.)[J]. Plant Science, 2016, 249: 46-58. DOI:10.1016/j.plantsci.2016.04.001 |
| [6] |
He Y J, Chen H, Zhou L, et al. Comparative transcription analysis of photosensitive and non-photosensitive eggplants to identify genes involved in dark regulated anthocyanin synthesis[J]. BMC Genomics, 2019, 20(1): 678. DOI:10.1186/s12864-019-6023-4 |
| [7] |
相丛超, 张巍巍, 罗双霞, 等. 茄子果萼下颜色的遗传分析和SSR标记的相关性分析[J]. 河北农业大学学报, 2015, 38(4): 50-55. Xiang C C, Zhang W W, Luo S X, et al. Genetic analysis on fruit color under calyx and correlation analysis of SSR markers in eggplant[J]. Journal of Agricultural University of Hebei, 2015, 38(4): 50-55 (in Chinese with English abstract). |
| [8] |
陈杭. 光诱导光不敏感型茄子花青素合成调控机制[D]. 上海: 上海交通大学, 2018: 10-20. Chen H. Molecular regulation mechanism of light signal induced anthocyanin biosynthesis in light-insensitive eggplant[D]. Shanghai: Shanghai Jiaotong University, 2018: 10-20(in Chinese with English abstract). |
| [9] |
Sharma S, Sharma A. Molecular markers based plant breeding[J]. Advances in Research, 2018, 16(1): 1-15. |
| [10] |
陈雪平. 茄子遗传多样性研究与遗传连锁图谱构建[D]. 保定: 河北农业大学, 2015: 54-60. Chen X P. Study on genetic diversity and genetic linkage map construction in eggplant[D]. Baoding: Hebei Agricultural University, 2015: 54-60(in Chinese with English abstract). |
| [11] |
Toppino L, Barchi L, Scalzo R L, et al. Mapping quantitative trait loci affecting biochemical and morphological fruit properties in eggplant(Solanum melongena L.)[J]. Frontiers in Plant Science, 2016, 7: 256. |
| [12] |
闫庆祥, 黄东益, 李开绵, 等. 利用改良CTAB法提取木薯基因组DNA[J]. 中国农学通报, 2010, 26(4): 30-32. Yan Q X, Huang D Y, Li K M, et al. Genomic DNA extraction in cassava by modified CTAB method[J]. Chinese Agricultural Science Bulletin, 2010, 26(4): 30-32 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-7774.2010.04.014 |
| [13] |
何倚剑, 刘卫东, 柳李旺, 等. 茄子种质资源遗传多样性和群体结构分析[J]. 南京农业大学学报, 2013, 36(5): 13-20. He Y J, Liu W D, Liu L W, et al. Genetic diversity and population structure of eggplant(Solanum melongena L.) germplasm[J]. Journal of Nanjing Agricultural University, 2013, 36(5): 13-20 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2013.05.003 |
| [14] |
王秋锦, 高杰, 孙清鹏, 等. 茄子品种遗传多样性的RAPD检测与聚类分析[J]. 植物生理学通讯, 2007, 43(6): 1035-1039. Wang Q J, Gao J, Sun Q P, et al. Clustering analysis and identification of genetic diversities in eggplant(Solanum melongena L.) varieties with RAPD[J]. Plant Physiology Communications, 2007, 43(6): 1035-1039 (in Chinese with English abstract). |
| [15] |
Isshiki S, Suzuki S, Yamashita K I, et al. RFLP analysis of mitochondrial DNA in eggplant and related Solanum species[J]. Genetic Resources and Crop Evolution, 2003, 50(2): 133-137. DOI:10.1023/A:1022954229295 |
| [16] |
Xu X, Pan S, Cheng S, et al. The Potato Genome Sequencing Consortium. Genome sequence and analysis of the tuber crop potato[J]. Nature, 2011, 475(7355): 189-195. DOI:10.1038/nature10158 |
| [17] |
Hirakawa H, Shirasawa K, Miyatake K, et al. Draft genome sequence of eggplant(Solanum melongena L.): the representative Solanum species indigenous to the old world[J]. DNA Research, 2014, 21(6): 649-660. DOI:10.1093/dnares/dsu027 |
| [18] |
董淑芳, 王孝宣, 高建昌, 等. 番茄粉红色果实相关基因的dCAPS和InDel标记开发与应用[J]. 中国蔬菜, 2016(1): 24-29. Dong S F, Wang X X, Gao J C, et al. Development and application of dCAPS and InDel markers in pink tomato fruitrelated genes[J]. China Vegetables, 2016(1): 24-29 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-6346.2016.01.005 |
| [19] |
迟莹莹, 高鹏, 朱子成, 等. 基于CAPS标记的西瓜果实与种子相关性状QTL分析[J]. 中国农业科学, 2017, 50(7): 1282-1293. Chi Y Y, Gao P, Zhu Z C, et al. The QTL analysis of fruit and seed associated traits in watermelon based on CAPS markers[J]. Scientia Agricultura Sinica, 2017, 50(7): 1282-1293 (in Chinese with English abstract). |
| [20] |
王学征, 邱果, 陈克农, 等. 基于BSA法开发CAPS标记定位甜瓜果面沟相关基因研究[J]. 东北农业大学学报, 2018, 49(5): 17-23. Wang X Z, Qiu G, Chen K N, et al. Study on develop CAPS markers to locate genes related to melon fruit surface groove based on BSA method[J]. Journal of Northeast Agricultural University, 2018, 49(5): 17-23 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-9369.2018.05.003 |
| [21] |
朱国忠, 戴伟民, 陈晓锋, 等. 基于基因组数据库的杂草稻叶绿体分子标记开发[J]. 南京农业大学学报, 2015, 38(2): 240-247. Zhu G Z, Dai W M, Chen X F, et al. Development of molecular markers in weedy rice chloroplast based on genomic database[J]. Journal of Nanjing Agricultural University, 2015, 38(2): 240-247 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2015.02.010 |
| [22] |
Tao A F, Huang L, Wu G F, et al. High-density genetic map construction and QTLs identification for plant height in white jute(Corchorus capsularis L.) using specific locus amplified fragment(SLAF) sequencing[J]. BMC Genomics, 2017, 18(1): 355. DOI:10.1186/s12864-017-3712-8 |
| [23] |
杨广阔, 陈子强, 陈在杰, 等. 基于二代测序数据开发以93-11为亲本的水稻SNP-dCAPS标记的研究实例[J]. 分子植物育种, 2014, 12(6): 1288-1295. Yang G K, Chen Z Q, Chen Z J, et al. Developing rice SNP-d CAPS markers based on next generation resequencing data of 93-11 as parental line, a case study[J]. Molecular Plant Breeding, 2014, 12(6): 1288-1295 (in Chinese with English abstract). |
| [24] |
束永俊, 李勇, 朱振雷, 等. 大豆CAPS标记快速开发方法的建立与优化[J]. 东北农业大学学报, 2009, 40(12): 62-65. Shu Y J, Li Y, Zhu Z L, et al. Establishment and optimization of the rapid method to develop soybean CAPS molecular markers[J]. Journal of Northeast Agricultural University, 2009, 40(12): 62-65 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-9369.2009.12.014 |
| [25] |
雷天刚, 何永睿, 彭爱红, 等. 柑橘CAPS标记和AS-PCR引物的开发[J]. 园艺学报, 2012, 39(6): 1027-1034. Lei T G, He Y R, Peng A H, et al. Development of CAPS markers and allele-specific PCR primers in Citrus[J]. Acta Horticulturae Sinica, 2012, 39(6): 1027-1034 (in Chinese with English abstract). |
| [26] |
阚帅帅. 玉米主效抗丝黑穗病候选基因预测及dCAPS标记开发[D]. 哈尔滨: 东北农业大学, 2012. Kan S S. Major resistance candidate gene prediction and dCAPS marker development of head smut in maize[D]. Harbin: Northeast Agricultural University, 2012(in Chinese with English abstract). |
| [27] |
尚小红, 周慧文, 严华兵, 等. 木薯块根肉质颜色基因CAPS标记的开发与验证[J]. 分子植物育种, 2018, 16(3): 873-879. Shang X H, Zhou H W, Yan H B, et al. Development and verification of a CAPS marker for color gene in cassava tuber[J]. Molecular Plant Breeding, 2018, 16(3): 873-879 (in Chinese with English abstract). |
| [28] |
陶爱芬, 游梓翊, 徐建堂, 等. 基于黄麻转录组序列SNP位点的CAPS标记开发与验证[J]. 作物学报, 2020, 46(7): 987-996. Tao A F, You Z Y, Xu J T, et al. Development and verification of CAPS markers based on SNPs from transcriptome of jute(Corchorus L.)[J]. Acta Agronomica Sinica, 2020, 46(7): 987-996 (in Chinese with English abstract). |
| [29] |
陈峰, 周继华, 张士永, 等. 水稻抗条纹叶枯病基因Stv-bi的分子标记辅助选择[J]. 作物学报, 2009, 35(4): 597-601. Chen F, Zhou J H, Zhang S Y, et al. Marker-assisted selection for Stv-bi gene controlling resistance to rice stripe disease[J]. Acta Agronomica Sinica, 2009, 35(4): 597-601 (in Chinese with English abstract). |