文章信息
- 梁荣, 宋海鑫, 黄佳玲, 费荣梅, 张金秋
- LIANG Rong, SONG Haixin, HUANG Jialing, FEI Rongmei, ZHANG Jinqiu
- PEDV流行毒株JS2013诱导Vero细胞凋亡
- PEDV epidemic strain JS2013 induced apoptosis of Vero cells
- 南京农业大学学报, 2021, 44(3): 514-520
- Journal of Nanjing Agricultural University, 2021, 44(3): 514-520.
- http://dx.doi.org/10.7685/jnau.202010010
-
文章历史
- 收稿日期: 2020-10-09
2. 江苏省农业科学院动物免疫工程研究所, 江苏 南京 210014;
3. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 江苏 扬州 225009
2. Institute of Veterinary Immunology&Engineering, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. Jiangsu Co-Innovation Center for the Prevention and Control of Important Animal Infectious Disease and Zoonose, Yangzhou 225009, China
猪流行性腹泻(porcine epidemic diarrhea, PED)是一种严重危害猪群的病毒性传染病, 自发生起就一直困扰着全球畜牧业。其主要发病特征有呕吐、水样腹泻、严重脱水和体重减轻等[1], 对仔猪的致死率高达80%以上。该病主要由带毒猪及其粪便经粪-口途径传播, 呈现明显的季节性, 冬春季流行爆发, 夏秋季呈散在发生。近年来, PED的发病率呈逐年上升趋势。流行病学分析表明, 猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)是引起该病的主要病原。尤其2010年以来, 随着PEDV新变异株的出现, PED再次在美洲、欧洲及亚洲的多个国家爆发, 给养猪业造成巨大的经济损失[2]。
病毒感染机体后, 除应对宿主机体免疫外, 还参与多种细胞活动, 如影响细胞周期或导致细胞凋亡等, 为自身增殖和扩散创造条件。病毒感染与细胞凋亡之间存在着密切联系, 细胞凋亡对于病毒和宿主都有重要的意义。病毒通过诱导细胞凋亡以便子代病毒粒子向周围细胞扩散, 加速病毒的增殖、传播; 而宿主通过细胞凋亡响应病毒感染, 减弱病毒的复制, 保护机体免受进一步的损害。因此, 研究病毒诱导细胞凋亡的机制对于研究病毒致病机制具有重要的指导意义。PEDV是一种冠状病毒, 研究发现多种冠状病毒可以诱导细胞凋亡。如α冠状病毒属的猪传染性胃肠炎病毒(TGEV)可以诱导猪肾细胞(PK-15)凋亡并引起细胞周期阻滞[3]; β冠状病毒属的严重急性呼吸综合征病毒(SARS-CoV)、中东呼吸综合征冠状病毒(MERS-CoV)等在感染Vero细胞后, 可检测到染色体DNA的断裂片段、Bcl-2表达下调、Bax表达升高及Caspase-3被激活等凋亡信号[4-6]; γ冠状病毒属的传染性支气管炎病毒(IBV)可以诱导鸡的巨噬细胞(HD11)凋亡并引起周期阻滞[7-8]; δ冠状病毒属的猪δ冠状病毒通过线粒体途径诱导猪睾丸细胞(ST)凋亡[9]。尽管也有研究表明PEDV可以诱导Vero细胞凋亡, 但研究多针对疫苗株CV777[10-12], 尚缺乏对PEDV流行毒株引起细胞凋亡机制的分析。本试验采用流式细胞术、Hoechst染色等, 并结合Western blot和细胞活性分析, 探索PEDV流行毒株JS2013诱导Vero细胞凋亡的机制, 为进一步研究PEDV流行毒株的致病机制提供理论依据, 并为后期的疫苗研究、药物开发及PED的综合防控等提供理论参考。
1 材料与方法 1.1 试验材料PEDV流行毒株JS2013由江苏省农业科学院国家兽用生物制品工程技术研究中心分离、鉴定、保存。Vero细胞由本课题组保存。2.5 g·L-1胰酶、Accutase细胞消化液、DMEM细胞培养基、胎牛血清(FBS)购自Gibco公司; FITC Annexin V凋亡检测试剂盒购自BD公司; DAPI染液、细胞凋亡-Hoechst染色试剂盒购自碧云天生物技术有限公司; CCK-8试剂盒购自日本同仁化学; RIPA裂解液购自北京索莱宝科技有限公司; PAGE凝胶快速制备试剂盒购自上海雅酶生物技术有限公司; Caspase 3、Caspase 9单抗购自CST公司; Caspase 8单抗购自Santa Cruz公司; GAPDH单抗购自杭州贤至生物科技有限公司; 辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG、山羊抗兔IgG和FITC标记的山羊抗小鼠IgG购于Proteintech公司; ECL试剂盒购自上海天能科技有限公司; PEDV-N蛋白单抗由本课题组制备; T-25细胞瓶、细胞培养板均购自Corning公司。
1.2 试验方法 1.2.1 PEDV扩增胰酶浓度的筛选Vero细胞用含体积分数为10%胎牛血清的DMEM培养基培养, 待细胞密度长至80%~90%时, 用PBS清洗细胞2次, 换含有1~10 μg·mL-1不同胰酶浓度的维持液继续培养72 h, 观察细胞的生长状态, 确定72 h内对细胞生长影响最小的最高胰酶浓度为扩增PEDV JS2013的最适胰酶浓度。
1.2.2 PEDV的增殖从-80 ℃冰箱取出PEDV病毒原液, 静置至室温, 将生长良好的Vero细胞弃掉培养基, PBS清洗后, 用混合有5 μg·mL-1胰酶的PEDV感作细胞1 h, 弃去培养液, 换为含有5 μg·mL-1胰酶的DMEM维持液继续培养, 待细胞出现90%以上病变时, 收集细胞及上清液, 于-80 ℃反复冻融3次, 4 ℃、12 000 r·min-1离心5 min, 取病毒上清液, 小量分装后置于-80 ℃备用, 并按照Reed-Muench法测定病毒TCID50。
1.2.3 间接免疫荧光(IFA)观察PEDV感染在24孔细胞培养板中放入灭菌的细胞爬片, 接种对数生长期的Vero细胞, 当细胞密度长至80%时, 以感染复数(MOI)为0.1的PEDV感染Vero细胞, 分别于接毒后6、12、24、36和48 h, 利用冷甲醇固定细胞, 以抗PEDV-N蛋白单抗为一抗, FITC标记的山羊抗小鼠IgG为二抗, 用DAPI染液对细胞核进行染色, 夹出细胞爬片, 用滤纸吸干残余洗液, 轻轻置于含5 μL抗荧光淬灭剂的载玻片上, 4 ℃静置, 利用激光共聚焦显微镜进行拍照。
1.2.4 流式细胞术检测PEDV诱导细胞凋亡细胞经Accutase酶消化后, 用PBS洗涤, 用1×Binding Buffer调整细胞浓度为1×106 mL-1, 转移100 μL至流式管中, 加入5 μL FITC Annexin V, 避光孵育15 min后, 再加入5 μL碘化丙啶(PI), 避光孵育5 min。同时设立FITC Annexin V和PI单染组对照。用400 μL 1×Binding Buffer重悬细胞, 1 h内使用流式细胞仪进行检测。
1.2.5 Hoechst染色检测细胞凋亡将对数生长期的Vero细胞接种24孔细胞板, 细胞密度为80%时, 以MOI=0.1的PEDV JS2013感染Vero细胞, 感染48 h后, 弃培养基, PBS清洗细胞2次, 加入固定液固定细胞15 min后, PBS清洗3次, 加入Hoechst 33258染色液, 5 min后PBS清洗, 于荧光显微镜下拍照。
1.2.6 PEDV JS2013对细胞活性检测的影响将对数生长期的Vero细胞接种96孔板, 当细胞密度为80%时, 以MOI=0.1的PEDV感染细胞36 h后, 每孔加入10 μL CCK-8试剂, 继续孵育1~4 h, 用酶标仪测定450 nm处的吸光值(A450)。检测每个细胞孔的A450值, 减去本底(基础培养基加入CCK-8试剂, 无细胞)A450值。按如下公式计算细胞存活率: 细胞存活率=A450(试验组)/A450(对照组)×100%。
1.2.7 Western blot检测蛋白质表达蛋白样品经BCA法测定浓度后, 煮沸10 min使其变性, 进行SDS-PAGE电泳, 电泳结束后转移至PVDF膜, 用5%脱脂奶粉室温封闭2 h, 加入一抗(Caspase 3、Caspase 8、Caspase 9和GAPDH)后4 ℃孵育过夜, TBST洗膜3次后加入二抗(羊抗兔抗体、羊抗鼠抗体), 37 ℃孵育1 h, 用TBST洗膜后加ECL试剂显影并拍照。
1.3 数据处理与统计分析使用GraphPad Prism 7.0软件绘制柱状图; 对试验数据进行One-way ANOVA方差分析和差异显著性比较。
2 结果与分析 2.1 适宜PEDV JS2013扩增的胰酶浓度如图 1所示: 用含有1~10 μg·mL-1胰酶的维持液培养Vero细胞72 h, 每组设置3个重复, 每隔12 h观察细胞状态。当胰酶浓度为6 μg·mL-1及以上时, 细胞会出现不同程度的损伤, 出现拉网、脱落的现象, 而5 μg·mL-1以下的浓度则对细胞基本无损害, 并能有效促进PEDV JS2013在Vero细胞上增殖, 故选择5 μg·mL-1胰酶作为PEDV JS2013体外扩增的维持液浓度。
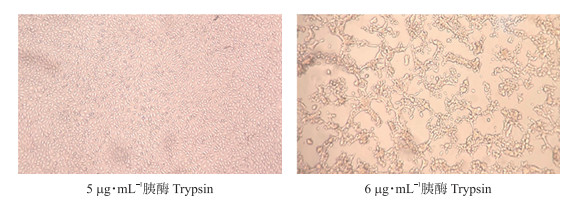
|
图 1 不同胰酶浓度对Vero细胞形态的影响(×100) Fig. 1 Effects of different trypsin concentrations on Vero cell morphology |
如图 2所示: PEDV JS2013感染Vero细胞后, 24 h出现细胞病变(CPE), 可观察到多个细胞融合, 形成典型的合胞体现象。感染36 h, CPE更为明显, 细胞开始出现空泡; 感染48 h, 约有90%以上细胞出现典型CPE, 空泡化进一步加剧, 且形成合胞体的部分细胞开始成片脱落。
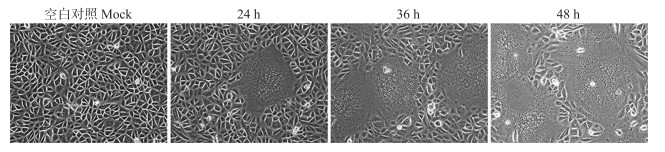
|
图 2 PEDV JS2013感染Vero细胞的病变观察 Fig. 2 Cytopathic effect(CPE)observation of Vero cells after infected with PEDV JS2013 |
通过间接免疫荧光试验进一步观察PEDV JS2013在Vero细胞的增殖情况。如图 3所示, 与对照细胞相比, 接种PEDV JS2013后6~12 h, 有小部分病毒成功感染Vero细胞; 接毒24~36 h后, 病毒感染程度更加广泛; 48 h后, 约90%的细胞被感染。
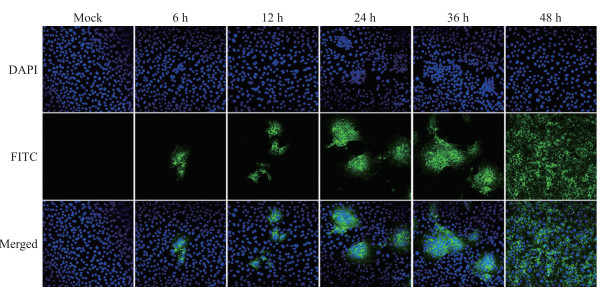
|
图 3 PEDV JS2013感染Vero细胞后的间接免疫荧光观察 Fig. 3 Indirect immunofluorescence assay(IFA)observation of Vero cells infected with PEDV JS2013 |
用Hoechst 33258对细胞核进行染色, 在荧光显微镜下, 对照组细胞核呈现正常的蓝色, 而被PEDV JS2013感染的细胞呈现凋亡细胞的典型特征, 即细胞核致密浓染, 颜色有些发白, 并且可见明显的凋亡小体(图 4)。
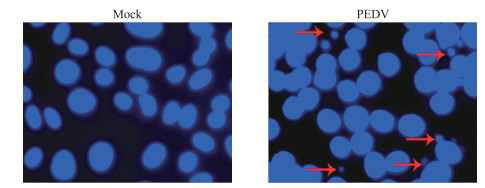
|
图 4 PEDV JS2013感染对Vero细胞核形态的影响 Fig. 4 Effects of PEDV JS2013 infection on the nuclear morphology of Vero cells 红色箭头表示凋亡小体。 The red arrows represent apoptotic bodies. |
以不同MOI值的PEDV JS2013感染Vero细胞, 用流式细胞仪检测凋亡率。由图 5可见: 与对照细胞相比, 细胞感染PEDV后, 凋亡细胞比例显著升高, 且细胞凋亡率随接毒剂量的增加而增加, 呈剂量依赖性。
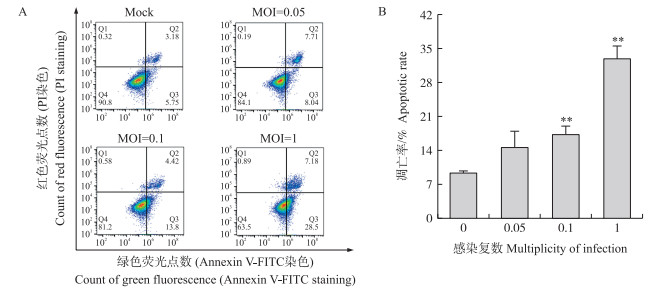
|
图 5 感染不同感染复数PEDV JS2013后Vero细胞凋亡率的检测
Fig. 5 The apoptotic rate of Vero cells measured after infected with different multiplicity of infection(MOI)PEDV JS2013
A. 流式细胞仪检测凋亡程度Flow cytometry to detect the apoptotic rate; B. 不同剂量JS2013导致细胞凋亡率柱状图Histogram of apoptotic rate in different dose of JS2013. Annexin V阳性, PI阴性代表早期凋亡细胞, Annexin V和PI双阳性代表晚期凋亡细胞和坏死细胞。**P < 0.01。下同。 Annexin V positive and PI negative represented early apoptotic cells, while Annexin V and PI double positive represented late apoptotic and necrotic cells. **P < 0.01. The same as follows. |
以MOI=0.1的PEDV JS2013感染Vero细胞, 用CCK-8试剂盒检测病毒对细胞活性的影响。结果如图 6所示: JS2013感染后36 h, Vero细胞活性下降约40%, 与对照组相比差异极显著(P < 0.01), 表明PEDV JS2013显著抑制Vero细胞生长, 这与流式细胞术检测的凋亡结果一致。
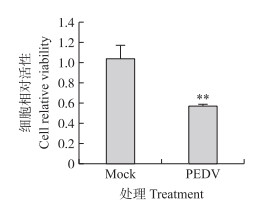
|
图 6 PEDV JS2013感染36 h对Vero细胞活性的影响 Fig. 6 Effect of PEDV JS2013 infectionfor 36 h on Vero cell viability |
Caspase的激活是凋亡过程中必不可少的, 为研究PEDV JS2013诱导细胞凋亡是否激活Caspase通路, 对病毒感染细胞后不同时间的Caspase相关蛋白进行Western blot检测分析。结果(图 7)显示: 感染后48 h, 可检测到激活的Caspase 8和Caspase 9, 其活化片段相对分子质量分别为18×103和35×103; 感染60 h后, 在相对分子质量约17×103处检测到Caspase 3的活化片段, 表明PEDV JS2013诱导Vero细胞凋亡激活Caspase通路。
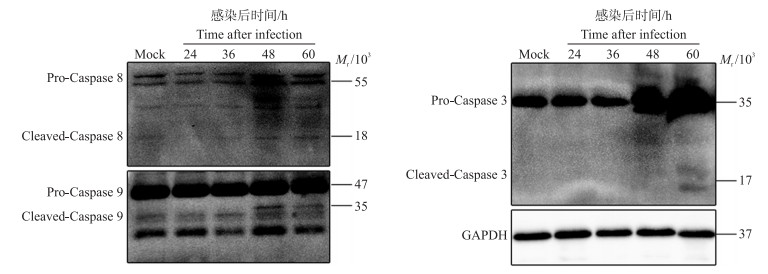
|
图 7 PEDV JS2013感染对Caspase通路的影响 Fig. 7 Effect of PEDV JS2013 infection on Caspase pathway |
PEDV的体外培养比较困难, 研究人员先后采用猪睾丸细胞(ST)、猪肾细胞(PK-15)等进行体外增殖, 但均未成功。直至1988年, 在培养基中添加胰酶后, 在Vero细胞上成功实现了PEDV的增殖, 仅第1代就观察到病变, 由此认为胰酶是PEDV进入Vero细胞所必需的条件[13], 并在后续试验中得到验证[14]。由于胰酶可能会对细胞产生一定的损伤作用, 本研究首先筛选体外培养时适宜的胰酶浓度, 选取5 μg·mL-1作为增殖PEDV流行毒株JS2013的合适胰酶浓度。接种病毒后发现, PEDV JS2013株可以造成Vero细胞合胞体病变, 且随感染时间的延长, 病变范围逐渐扩大。间接免疫荧光试验也表明PEDV JS2013可以成功感染Vero细胞, 且随接毒时间延长, 感染程度更加广泛。表明该流行毒株能在Vero细胞有效增殖。
细胞凋亡又称为程序性细胞死亡, 是细胞在基因调控下发生的主动程序性死亡过程, 是机体维持自身稳定和平衡的一种重要机制。细胞凋亡的典型特征包括细胞膜破裂、细胞皱缩、染色质浓缩、DNA断裂以及出现凋亡小体等[15]。本研究Hoechst染色结果表明, PEDV感染可引起Vero细胞皱缩及细胞核致密浓染, 并可观察到明显的凋亡小体。
此外, 当细胞发生早期凋亡时, 细胞膜内表面的磷脂酰丝氨酸(PS)外翻, 暴露于细胞膜外表, 这是细胞出现凋亡的生化特征之一。Annexin V是一种Ca2+依赖性的磷脂结合蛋白, 对PS有很高的亲和力, 能与暴露出PS的细胞结合, 而碘化丙啶(PI)能透过凋亡晚期和坏死细胞的膜而与细胞核结合呈红色, 因此将Annexin V和PI结合使用, 可以将凋亡细胞与坏死细胞区分, 也是目前一种比较成熟的凋亡细胞检测方法。本试验通过流式细胞术检测发现, PEDV JS2013感染后, Vero细胞凋亡比例显著升高, 且凋亡率与接毒剂量呈正相关。进一步通过CCK-8检测细胞活性, 发现病毒感染后显著抑制Vero细胞活性, 与流式细胞术结果一致。
半胱氨酸天冬氨酸蛋白酶Caspase家族是凋亡过程中的效应蛋白。正常情况下, Caspase以无活性的酶原(Pro-Caspase)形式存在, 但当发生凋亡时, Caspases分子内天冬氨酸残基后的肽键断裂, 游离的大、小亚基结合成活化酶(Cleaved-Caspase)。其中Caspase 9介导内部线粒体通路, Caspase 8介导死亡受体通路, 最终二者均激活效应凋亡蛋白酶Caspase 3, 引发凋亡过程的级联反应, 导致细胞凋亡[16-17]。目前, TGEV、SARS、IBV、PDCoV、SADS-CoV等病毒已被证实在其诱导凋亡过程中激活Caspase[3-5, 7, 9, 18-19]。本试验通过对Vero细胞感染PEDV JS2013后不同时间Caspase蛋白的检测, 发现感染后48 h, Caspase 8和Caspase 9被切割而激活, 感染后60 h, Caspase 3被切割而具有活性, 这表明Caspase在PEDV JS2013诱导的细胞凋亡过程中被激活, 病毒可能通过Caspase途径介导凋亡, 这也与之前的研究结果一致[11]。但也有研究表明PEDV诱导凋亡可以不依赖Caspase途径, 而是通过活化线粒体凋亡诱导因子(AIF)途径[20-21], 这是否与病毒株的特性有关尚需要进一步验证。
总之, 本试验证实PEDV流行株JS2013感染Vero细胞后能够激活一系列Caspase级联信号, 最终诱导细胞发生凋亡。然而, 病毒感染与细胞凋亡的关系非常复杂, 如一些病毒既能在感染早期抑制细胞凋亡, 避免细胞被过早瓦解而影响病毒自身复制, 同时也能在感染中后期诱导细胞凋亡, 以便于释放子代病毒粒子。本试验发现PEDV JS2013流行毒株在感染后期诱导细胞凋亡, 有利于病毒在细胞内完成复制和生活周期, 加速子代病毒颗粒的释放, 更有利于病毒增殖。关于PEDV及其编码蛋白究竟如何调控凋亡分子及相关凋亡通路, 将是下一步的研究重点。同时, 由于冠状病毒独特的复制机制, 其通常具有高频的变异性, 能够不断适应新宿主、新环境, 不断进化。因此, 研究流行病毒诱导细胞凋亡的分子机制, 对于研究病毒的致病机制具有重要的指导意义。
| [1] |
Pensaert M B, Bouck P. A new coronavirus-like particle associated with diarrhea in swine[J]. Archives of Virology, 1978, 58(3): 243-247. DOI:10.1007/BF01317606 |
| [2] |
黄文芳. 用胎猪小肠组织块绒毛上皮细胞培养猪流行性腹泻病毒的研究[J]. 家畜传染病, 1985(2): 11-13, 65. Huang W F. Study on the culture of porcine epidemic diarrhea virus by fetal pig small intestine villous epithelial cells[J]. Infectious Diseases of Domestic Animals, 1985(2): 11-13, 65 (in Chinese). |
| [3] |
丁利. TGEV诱导PK-15细胞凋亡信号转导通路研究[D]. 杨凌: 西北农林科技大学, 2012. Ding L. Signal transduction pathways of TGEV-induced apoptosis in PK-15 cells[D]. Yangling: Northwest A&F University, 2012(in Chinese with English abstract). |
| [4] |
鄢然, 沈超, 雷磊, 等. SARS-CoV感染Vero E6细胞诱导细胞凋亡[J]. 中国病毒学, 2003, 18(6): 541-543. Yan R, Shen C, Lei L, et al. SARS-CoV infection induces apoptosis of Vero E6[J]. Virologica Sinica, 2003, 18(6): 541-543 (in Chinese with English abstract). |
| [5] |
Yan H M, Xiao G F, Zhang J M, et al. SARS coronavirus induces apoptosis in Vero E6 cells[J]. Journal of Medical Virology, 2004, 73(3): 323-331. DOI:10.1002/jmv.20094 |
| [6] |
Chu H, Zhou J, Wong B H Y, et al. Middle east respiratory syndrome coronavirus efficiently infects human primary T lymphocytes and activates the extrinsic and intrinsic apoptosis pathways[J]. The Journal of Infectious Diseases, 2016, 213(6): 904-914. DOI:10.1093/infdis/jiv380 |
| [7] |
Han X X, Tian Y M, Guan R, et al. Infectious bronchitis virus infection induces apoptosis during replication in chicken macrophage HD11 cells[J]. Viruses, 2017, 9(8): E198. DOI:10.3390/v9080198 |
| [8] |
Liu C, Xu H Y, Liu D X. Induction of Caspase-dependent apoptosis in cultured cells by the avian coronavirus infectious bronchitis virus[J]. Journal of Virology, 2001, 75(14): 6402-6409. DOI:10.1128/JVI.75.14.6402-6409.2001 |
| [9] |
Lee Y J, Lee C. Porcine deltacoronavirus induces Caspase-dependent apoptosis through activation of the cytochrome c-mediated intrinsic mitochondrial pathway[J]. Virus Research, 2018, 253: 112-123. DOI:10.1016/j.virusres.2018.06.008 |
| [10] |
黄明明, 于海东, 郭龙军, 等. 猪流行性腹泻病毒感染Vero-E6细胞诱导凋亡机制的研究[J]. 中国预防兽医学报, 2014, 36(12): 926-929. Huang M M, Yu H D, Guo L J, et al. Induction of apoptosis in Vero-E6 cells infected with porcine epidemic diarrhea virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(12): 926-929 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0589.2014.12.03 |
| [11] |
王潇博, 石达, 陈建飞, 等. 猪流行性腹泻病毒诱导Vero E6细胞凋亡的动态研究[J]. 中国预防兽医学报, 2016, 38(3): 194-197. Wang X B, Shi D, Chen J F, et al. Dynamic analysis of apoptosis in Vero E6 cells induced by porcine epidemic diarrhea virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(3): 194-197 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0589.2016.03.06 |
| [12] |
徐滢. 猪流行性腹泻病毒引起Vero细胞凋亡的分子机制研究[D]. 杨凌: 西北农林科技大学, 2019. Xu Y. Molecular mechanism study on apoptosis in Vero cells induced by porcine epidemic diarrhea virus[D]. Yangling: Northwest A&F University, 2019(in Chinese with English abstract). |
| [13] |
Hofmann M, Wyler R. Propagation of the virus of porcine epidemic diarrhea in cell-culture[J]. Journal of Clinical Microbiology, 1988, 26(11): 2235-2239. DOI:10.1128/JCM.26.11.2235-2239.1988 |
| [14] |
Park J E, Cruz D J M, Shin H J. Clathrin- and serine proteases-dependent uptake of porcine epidemic diarrhea virus into Vero cells[J]. Virus Research, 2014, 191: 21-29. DOI:10.1016/j.virusres.2014.07.022 |
| [15] |
Savill J, Fadok V. Corpse clearance defines the meaning of cell death[J]. Nature, 2000, 407(6805): 784-788. DOI:10.1038/35037722 |
| [16] |
Jia L T, Chen S Y, Yang A G. Cancer gene therapy targeting cellular apoptosis machinery[J]. Cancer Treatment Reviews, 2012, 38(7): 868-876. DOI:10.1016/j.ctrv.2012.06.008 |
| [17] |
李敏, 林俊. 细胞凋亡途径及其机制[J]. 国际妇产科学杂志, 2014, 41(2): 103-107. Li M, Lin J. The apoptotic pathways and their mechanisms[J]. Journal of International Obstetrics and Gynecology, 2014, 41(2): 103-107 (in Chinese with English abstract). |
| [18] |
Zhang J Y, Han Y R, Shi H Y, et al. Swine acute diarrhea syndrome coronavirus-induced apoptosis is caspase- and cyclophilin D-dependent[J]. Emerging Microbes & Infections, 2020, 9(1): 439-456. |
| [19] |
李若楠, 康瑞芬, 沈丹, 等. 谷氨酰胺对呕吐毒素诱导IPEC-J2细胞凋亡和炎症的影响[J]. 南京农业大学学报, 2020, 43(4): 740-747. Li R N, Kang R F, Shen D, et al. Effects of glutamine on deoxynivalenol induced apoptosis and inflammation of IPEC-J2 cells[J]. Journal of Nanjing Agricultural University, 2020, 43(4): 740-747 (in Chinese with English abstract). DOI:10.7685/jnau.201907009 |
| [20] |
徐梦迪, 李文倩, 杨盛, 等. 鸭坦布苏病毒引起不同日龄鸭血-脾屏障及周围组织病理变化的比较研究[J]. 畜牧与兽医, 2020, 52(6): 50-56. Xu M D, Li W Q, Yang S, et al. A comparative study on the blood-spleen barrier and pathological variation of surrounding tissues caused by duck Tembusu virus infecting ducks at different ages[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(6): 50-56 (in Chinese with English abstract). |
| [21] |
Kim Y, Lee C. Porcine epidemic diarrhea virus induces Caspase-independent apoptosis through activation of mitochondrial apoptosis-inducing factor[J]. Virology, 2014, 460/461: 180-193. DOI:10.1016/j.virol.2014.04.040 |




