文章信息
- 黄维, 程雪, 潘妮, 沈振国, 陈亚华, 陆巍
- HUANG Wei, CHENG Xue, PAN Ni, SHEN Zhenguo, CHEN Yahua, LU Wei
- 甘露糖对镉胁迫下小麦生长、镉转运和氧化胁迫的影响
- Effects of mannose on wheat(Triticum aestivum L.) growth, cadmium transport and oxidative stress under cadmium stress
- 南京农业大学学报, 2021, 44(3): 468-476
- Journal of Nanjing Agricultural University, 2021, 44(3): 468-476.
- http://dx.doi.org/10.7685/jnau.202007021
-
文章历史
- 收稿日期: 2020-07-13
重金属镉(cadmium, Cd)广泛分布于地壳, 每年因自然(地质风化等)和人为(农业、采矿、冶炼工业、固体废物和汽车排放等)因素进入河流和土壤中, 已成为全球农业土壤中毒性最强的污染物之一[1], 全球约有2.35×1012 m2的农田土壤被痕量元素污染, 我国约有2.786×109 m2的农业土壤被Cd污染[2]。在Cd污染的土壤上生长的植物会吸收和积累Cd, 并转运到可食用的部分, 通过食物链危害人类健康[3]。
Cd是植物生长发育非必需元素, Cd污染会导致叶片黄化, 光合效率下降, 代谢紊乱, 产生过量活性氧(ROS), 膜通透性被破坏, 植物生长被抑制[4]。为减轻Cd对植物的毒性并阻隔其在作物经济器官积累, 外源施用生长调节剂、矿质元素和气体物质可明显缓解水稻、小麦和小白菜等受Cd胁迫[5-7]。甘露糖(mannose, Man)普遍存在于动植物体, 可作为前体物质合成糖蛋白和细胞壁多糖影响细胞壁组分来抵御胁迫。研究发现拟南芥的抗坏血酸中可以检测到来源于被标记甘露糖的碳原子, 甘露糖作为底物通过D-甘露糖/L-半乳糖途径合成抗坏血酸, 进入AsA-GSH循环参与胁迫应激反应[8]。外源甘露糖处理可恢复拟南芥内切-β-甘露聚糖酶基因(xcd1-2)突变体的Cd敏感表型, 提高野生型植株对Cd的耐受性[9]。甘露糖可调控小白菜和拟南芥的螯合肽生物合成途径相关基因的表达, 提高螯合肽含量, 区域化固定Cd[9-10]。此外, 甘露糖是天然产物, 对环境无害, 经济实惠, 因此可选择甘露糖作为外源试剂。
小麦(Triticum aestivum L.)是仅次于水稻和玉米的中国第三大粮食作物。农田中的Cd易被小麦根吸收并转运到地上部, 并在籽粒中积累[11]。一些叶面阻隔剂可有效减轻Cd胁迫和减少Cd积累, 然而关于甘露糖在减轻小麦Cd胁迫的研究很少, 因此研究甘露糖对小麦Cd胁迫的缓解效果及作用机制具有应用和理论意义。
1 材料与方法 1.1 试验材料小麦品种为‘苏科麦一号’。甘露糖购于Sigma-Aldrich公司, 常规化学试剂均为国产分析纯(AR)级。
1.2 样品收集小麦种子用2.5%(体积分数)次氯酸钠灭菌20 min后, 用去离子水洗净残留消毒液, 播种至漂浮在去离子水中的浮动网上, 于26 ℃培养箱中避光催芽。发芽后于1/2 Hoagland营养液培养, 光照强度为300 μmol·m-2·s-1, 昼/夜温度为26 ℃/18 ℃, 相对湿度为60%, 光/暗周期为16 h/8 h。每2 d更新1次培养液。移植生长状态一致的7 d龄幼苗到塑料杯中培养, 每杯8株苗。共设置4个处理: 1)Con处理, Hoagland培养液+喷施12.5 mL去离子水; 2)Man处理, Hoagland培养液+喷施12.5 mL 160 μmol·L-1甘露糖; 3)Cd处理, 含20 μmol·L-1 CdCl2的Hoagland培养液+喷施12.5 mL去离子水; 4)Cd+Man处理, 含20 μmol·L-1 CdCl2的Hoagland培养液+喷施12.5 mL 160 μmol·L-1甘露糖。每个处理设3个重复。每日07:00将12.5 mL 160 μmol·L-1甘露糖或去离子水均匀喷施在小麦叶面, 第1次喷施处理12 h后取样, 用于总RNA提取。连续处理15 d后取样, 用于提取总蛋白质和测定生长、生理生化指标与Cd含量。
1.3 幼苗生长指标与Cd含量的测定不同处理随机取9株小麦, 测量小麦地上、下部的长度及鲜重后, 105 ℃杀青30 min, 80 ℃烘干至恒重; 在电热消解炉系统(Milestone Ethos T, 意大利)用HNO3与HClO4的混合酸消解。采用电感耦合等离子体发射光谱仪(ICP-OES, Perkin Elmer Optima 2100DV)测定Cd含量。Cd的转运系数=(地上部Cd浓度/地下部Cd浓度)×100%。
1.4 幼苗ROS、MDA、GSH、GSSG含量和GR、CAT、SOD酶活性的测定依据Jabs等[12]的方法测定过氧化氢(H2O2)含量, 采用Hodges等[13]的方法测定丙二醛(MDA)含量, 采用Velikova等[14]的方法测定超氧阴离子(O2·-)的含量。用购自Solarbio公司(北京)的试剂盒测定谷胱甘肽(GSH和GSSG)含量[15]。用植物鲜样提取粗酶液, 参照王学奎等[16]的方法测定谷胱甘肽还原酶(GR)的活性。依据程艳[17]的方法测定超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。
1.5 根系总蛋白的提取消化、iTRAQ标记和液相二级质谱分析采用植物总蛋白提取试剂盒(Sigma-Aldrich公司)提取根系总蛋白。使用Bradford方法分析定量蛋白质浓度。通过改良的滤膜辅助样品制备方案生成肽, 离心收集消化的肽, 使用NanoDrop分光光度计进行定量。
使用iTRAQ 8-plex试剂盒(AB Sciex, MA)进行iTRAQ(isotope tagging for relative and absolute protein quantitation)标记。将100 μg消化的样品进行标记(样本Con: 标签113;样本Man: 标签114;样本Cd: 标签115;样本Cd+Man: 标签116)。使用带有馏分收集装置的Dionex UltiMate 3000高性能LC系统进行高pH反相色谱。
使用Ultimate 3000 RSLC纳米系统(Thermo Fisher Scientific)进行在线分离。首先将5 μL上清液加到捕集柱上(Acclaim PepMap100, C18, 75 μm×2 cm, 3 μm, 100 Å, Thermo Scientific), 然后在流动相上以3%~45%B(80%乙腈和0.1%甲酸)的梯度在分析柱(Acclaim PepMapⓇ RSLC, C18, 75 μm×15 cm, 3 μm, 100 Å, Thermo Scientific)上洗脱。使用配备纳米电喷雾离子源(Thermo)的LTQ-Orbitrap XL质谱仪进行液相二级质谱分析。
1.6 根系差异丰度蛋白(DAP)的筛选与生物信息学分析通过Proteome Discoverer软件(版本1.4)分析原始数据。使用Sequest HT引擎对UniprotKB小麦数据库鉴定蛋白质。搜索参数: 潜在变量修饰为Gln→pyro-Glu(N-term Q), 氧化(M), 脱酰胺化; 固定修饰为氨基甲酰甲基(C), iTRAQ 8-plex(N-term), iTRAQ 8-plex(K); 酶选择为胰蛋白酶, 最多允许2次错位切割; 完整肽的质量公差: 10 mg·kg-1; 碎片离子的质量公差: 0.02 g·mol-1。应用Percolator算法估算基于q值的错误发现率(FDR), 仅将置信区间为99%的肽作为鉴定的蛋白质。一种蛋白质必须包含至少2个独特的肽。与对照组(Con)相比, 试验处理组(Man/Con、Cd/Con和Cd+Man/Con)蛋白质的平均倍数变化不小于1.5, 该蛋白被认为是差异丰度蛋白(DAP)。
采用整合GO富集和KEGG途径分析的多基因组数据分析工具Omics Bean(http://www.omicsbean.cn)分析获得的DAP。用在线资源(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制维恩图, 寻找3个处理(Man、Cd和Cd+Man)共存的DAP。
1.7 RT-qPCR验证关键候选基因通过RT-qPCR验证蛋白组数据的可信性。使用MiniBEST Plant RNA Extraction Kit(TaKaRa)分离根和叶样品的总RNA。用带有gDNA Eraser的Prime ScriptTM RT试剂盒从RNA反转录合成cDNA。在实时PCR系统(Eppendorf AG 22331 Hamburg, 德国)上采用TB GreenⓇ Premix Ex TaqTM(Tli RNaseH Plus)(TaKaRa)进行qPCR, 以肌动蛋白为内参, 引物见表 1。
| 基因名称Gene name | 正向引物Forward primer | 反向引物Reverse primer |
| Prx135 | ACGAACAAGCATCGTCAACT | TCTGTTCCGTTTGCGTGGTA |
| GST | GGCTGGCTCGTATAATCACACCACAAC | GAGCAACGAACGGTGAGCGTAGGA |
| GLN1-2 | AAAGGCGTTCGGCCGCGACATCGTGGAC | CACTTGGTCAGCAGCGGCGATGCCAACT |
| Action | CCTTAGTACCTTCCAACAGATGT | CCAGACAACTCGCAACTTAGA |
试验均重复3次, 使用SPSS 25.0软件分析数据, 利用Duncan’s检验进行差异显著性分析(P < 0.05), 结果用x±SD表示, 然后用Origin 2018绘图。
2 结果与分析 2.1 甘露糖对小麦Cd含量和Cd转运系数的影响从图 1可知: 与单独Cd处理相比, Cd+Man处理根的Cd含量显著升高, 地上部的Cd含量显著下降。根的Cd含量增加20.2%, Cd总含量增加58.1%。地上部Cd含量减少36.8%, Cd总含量减少33.6%。Cd处理的Cd转移系数是10.0%, 甘露糖处理后Cd转移系数减少47.7%。以上结果表明甘露糖能阻隔小麦Cd转运, 减少地上部积累。
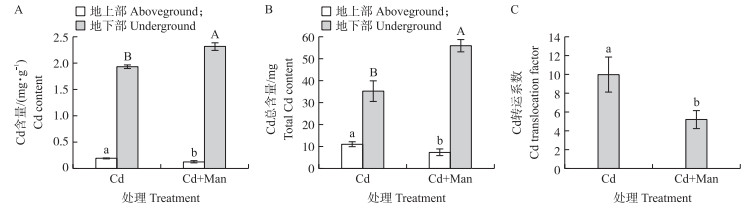
|
图 1 甘露糖对小麦Cd含量和转运系数的影响 Fig. 1 The effects of mannose on cadmium content and translocation factor in wheat 1)Cd、Cd+Man分别代表镉、镉和甘露糖处理。2)不同大、小写字母分别代表不同处理间同一指标在0.05水平差异显著。下同。 1)Cd, Cd+Man represent cadmium, cadmium and mannose treatments respectively; Different uppercase and lowercase letters indicate significant difference in the same index among treatments at 0.05 level, respectively. The same as follows. |
从图 2可知: Cd处理后小麦植株矮小, 叶片黄化, 根系变短, 生物量减少。株高和根长分别减小26.3%和53.3%。地上部和地下部鲜重分别降低49.3%和52.2%, 干重分别降低38.7%和33.3%。喷施甘露糖后, 小麦幼苗的植株生长状况优于单独Cd处理的植株。根长显著增加54.8%, 地下部鲜重和干重分别提高了43.5%和29.5%, 叶片发黄症状得到改善, 单独使用甘露糖对小麦没有明显影响。说明喷施甘露糖可以缓解Cd胁迫对小麦的抑制作用, 尤其对根的效果更为明显。
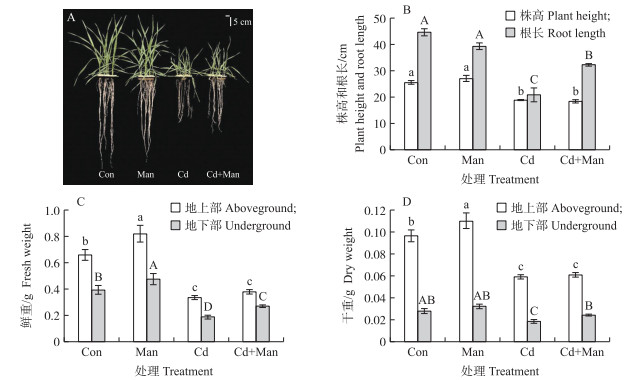
|
图 2 甘露糖对Cd胁迫下小麦株高、根长(A和B)、鲜重(C)和干重(D)的影响 Fig. 2 The effects of mannose on wheat plant height, root length(A and B), fresh weight(C) and dry weight(D)under cadmium stress Con、Man、Cd和Cd+Man分别代表对照、甘露糖、镉、镉和甘露糖处理。 Con, Man, Cd and Cd+Man represent control, cadmium, mannose, cadmium and mannose treatments respectively. |
采用基于iTRAQ的鸟枪定量方法, 获得Man、Cd、Cd+Man处理组蛋白质变化总体情况(图 3)。与Con处理相比, 在4个样品中, 共鉴定出2 690个错误发现率小于1%的蛋白, 至少有2个独特肽段评估出1 343种蛋白质丰度变化。按照增加积累的阈值为大于1.5倍, 减少的阈值为小于0.67倍为筛选标准。在3个处理中分别鉴定出差异积累蛋白质12、190和145种。在这些差异蛋白质中, Cd处理48种蛋白质上调, 142种蛋白质下调, Cd+Man处理60种上调, 85种蛋白质下调, 在Man处理中只有12种蛋白质下调(图 3-A)。使用维恩图检测3个处理中的常见DAP, 其中72个DAP是Cd胁迫条件下独有的, 30个DAP是Cd+Man处理样品独有的, 2个DAP是Man处理独有的(图 3-B)。
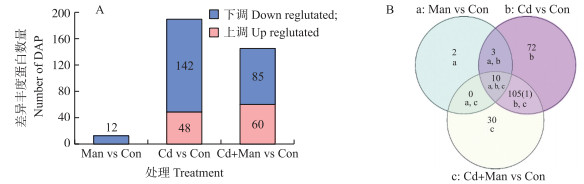
|
图 3 参与甘露糖抗Cd的差异丰度蛋白数量(A)和DAP维恩图(B) Fig. 3 Differential abundance proteins(DAP)number(A)and venn diagrams of DAP(B) involved in mannose's relief to cadmium stress |
对222个DAP进行分析, 生物过程(BP)、细胞成分(CC)、分子功能(MF)分别注释检索到150、76、148个蛋白质, 有显著差异丰度蛋白质的分别有141、35和89个(图 4-A)。基因本体层次结构显著富集术语中的前10名见图 4-B。单一生物代谢过程、氧化还原过程和小分子代谢过程是BP分析中最具代表性的前3个生物过程。CC分析表明注释的蛋白质中约30%属于细胞质, 催化和氧化还原是主要分子功能。KEGG分析显示大多数代谢途径, 包括谷胱甘肽、氮和氰氨基酸代谢, PPP途径, 糖酵解/糖异生, 次生代谢产物和苯丙烷生物合成等途径(图 4-C)。
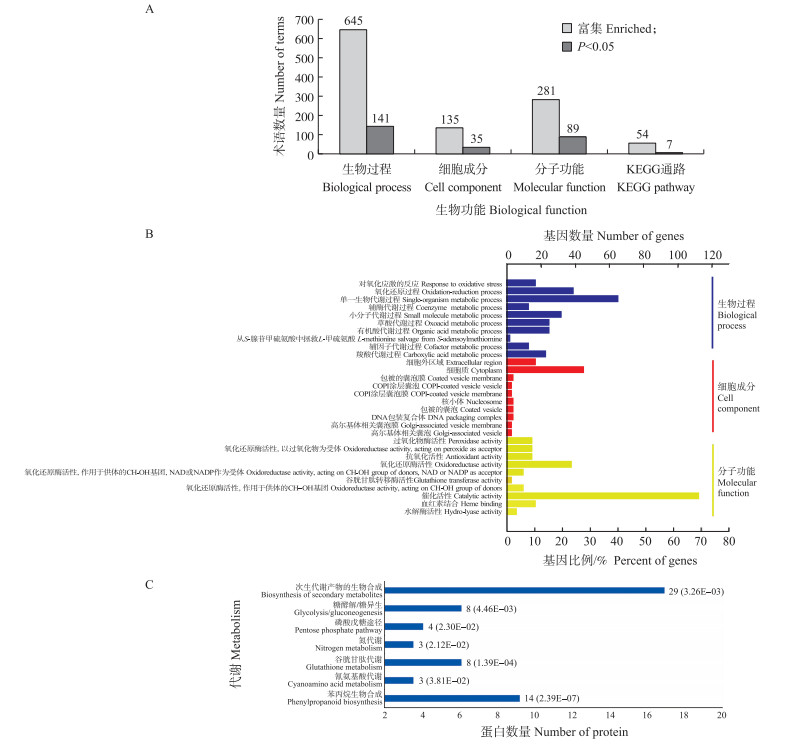
|
图 4 222个DAP的生物信息学分析 Fig. 4 Bioinformatics analysis of 222 identified DAP A. 数据库检索与查询蛋白列表关联的术语总数; B. 基因本体层次4级中10个最富显著性的术语; C. 富集的KEGG途径聚集在代谢子类别中所涉蛋白数量(P值)。 A. The total number of terms retrieved from the database and associated with the query protein list; B. The ten most significantly enriched terms in level 4 gene ontology hierarchy; C. The number of involved proteins(P-value)in enriched KEGG pathways that was clustered into the metabolism sub-categories. |
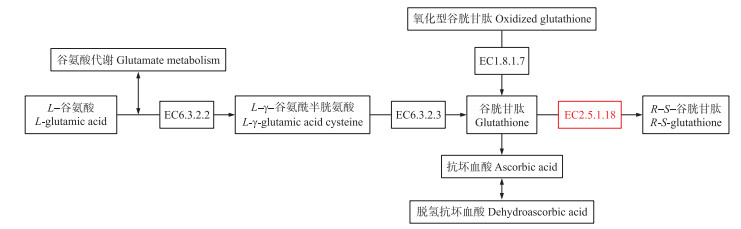
重点关注谷胱甘肽途径, 其中谷胱甘肽-S-转移酶(GST, EC2.5.1.18)在谷胱甘肽代谢途径中的位置如图 5所示。GST除有催化Cd与GSH结合, 以Cd-GSH形式转运到液泡中完成解毒和钝化的作用外[18], 还催化GSH与过氧化物发生反应, 使过氧化物被还原[19]。在本研究中, 与对照相比, Cd胁迫下GST上调, 在喷施甘露糖后GST进一步上调。
|
图 5 谷胱甘肽代谢途径 Fig. 5 Glutathione metabolism pathway 红色代表谷胱甘肽-S-转移酶。 Red represents glutathione-S-transferase. |
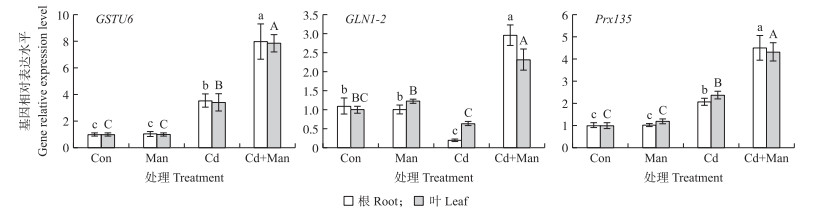
对谷胱甘肽途径相关的基因进行RT-qPCR定量分析。GST(谷胱甘肽-S-转移酶)、GLN1-2(谷氨酰胺合酶)和Prx135(过氧化物酶)基因的表达趋势和蛋白组学结果(表 2)一致。通过荧光定量检测处理组的转录本, 与Con处理相比, Cd、Cd+Man和Man处理的GSTU6表达量分别上调1.9、3.5和1倍, Prx135表达量分别上调2.1、4.5和1.0倍, Cd+Man和Man处理GLN1-2表达量分别上调3.0和1倍(图 6)。这说明甘露糖通过谷胱甘肽提高了小麦抗氧化能力。
| 序列编号 Accession No. |
功能描述 Function description |
基因 Gene |
独立肽段 Unique peptides |
覆盖率/% Coverage |
Cd/Con | (Man+Cd)/Con | Man/Con |
| A0A3B5XV82 | 谷胱甘肽代谢Glutathione metabolism | GSTF1 | 3 | 30.13 | 1.593 | 1.546 | 1 |
| A0A3B6LUL8 | 谷胱甘肽代谢Glutathione metabolism | GSTU1 | 2 | 34.23 | 2.2 | 2.19 | 1 |
| Q8RW01 | 谷胱甘肽转移酶Glutathione transferase | GSTU6 | 3 | 21.88 | 2.106 | 2.67 | 1 |
| A0A3B6JLQ7 | 谷胱甘肽代谢Glutathione metabolism | GSTZ5 | 6 | 28.33 | 2.18 | 2.106 | 1 |
| Q8GTC0 | 谷胱氨肽转移酶F3 Glutathione transferase F3 | P0043B10.43 | 3 | 35.13 | 1.766 | 2.183 | 1 |
| Q6RUJ1 | 谷氨酰胺合成酶Glutamine synthetase | GLN1-2 | 2 | 54.23 | 0.43 | 0.51 | 1 |
| A0A3B6HTP4 | 过氧化物酶Peroxidase | Prx135 | 3 | 24.76 | 2.143 | 2.116 | 1 |
| 注: Cd/Con、(Cd+Man)/Con、Man/Con表示Cd、Cd+Man、Man处理与对照处理相比差异丰度蛋白变化的倍数。 Note: Cd/Con, (Cd+Man)/Con, Man/Con represent the multiples of differential abundance proteins change in Cd, Cd+Man, and Man treatments compared with control treatments. |
|||||||
|
图 6 甘露糖对Cd胁迫下小麦的3个抗氧化基因表达的影响 Fig. 6 The effects of mannose on the expression of three anti-oxidative genes in wheat under cadmium stress |
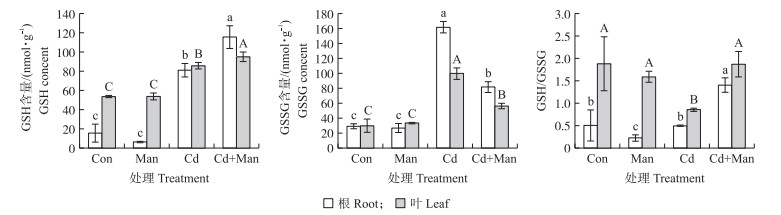
如图 7所示, 与Cd处理相比, Cd+Man处理小麦叶片和根中GSH含量分别增加11.1%和42.8%, GSSG含量分别减少43.2%和49.3%, GSH/GSSG比值分别增加2.2和2.8倍。这说明甘露糖调节根叶的氧化还原平衡, 增强活性氧非酶系统清除能力。
|
图 7 甘露糖对Cd胁迫下小麦GSH、GSSG含量及GSH/GSSG的影响 Fig. 7 The effects of mannose on the content of GSH, GSSG and GSH/GSSG in wheat under cadmium stress |
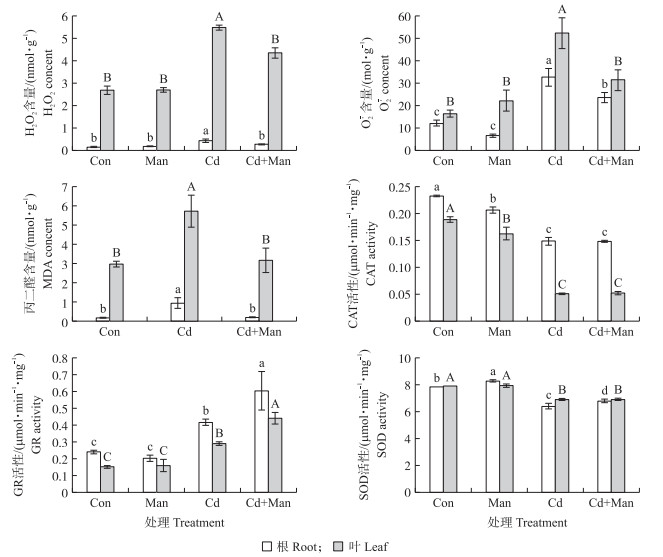
从图 8可知: 与Cd处理相比, Cd+Man处理显著降低小麦叶片和根中的O2·-和MDA含量, H2O2含量分别减少20.6%和38.2%, O2·-含量分别降低了40.4% 和28.1%, MDA含量分别降低44.7% 和91.8%。这表明甘露糖减少Cd胁迫产生的活性氧分子, 减轻氧化损伤。与Con处理相比, Cd处理的CAT和SOD活性降低, 甘露糖处理后CAT和SOD活性没有明显增加。这说明长期Cd胁迫在一定程度破坏小麦抗氧化酶系统, 且喷施甘露糖处理没有提高SOD、CAT和GR活性, 以缓解Cd对小麦造成的氧化胁迫。GR活性反映Asc-GSH循环的大小和转运的情况, 在Cd+Man处理中GR活性明显增强, 说明甘露糖可能促进Asc-GSH循环提高活性氧的非酶清除。
|
图 8 甘露糖对Cd胁迫下小麦H2O2、O2·-、MDA含量和GR、CAT、SOD酶活性的影响 Fig. 8 The effects of mannose on the contents of H2O2, O2·-, MDA and the enzyme activities of GR, CAT and SOD in wheat under cadmium stress |
植物体内Cd积累严重抑制植物生长发育[20], 显著抑制小麦幼苗生长。农业生产中喷施阻遏剂是减少农作物Cd胁迫和积累的有效方法。在本研究中, 喷施甘露糖能增加Cd胁迫下小麦的根长和生物量, 说明甘露糖可提高小麦(尤其是根部)对Cd胁迫的耐受能力。甘露糖处理后小麦积累的Cd总含量虽增加, 但Cd转运系数明显减小。甘露糖是有效的Cd阻遏剂, 可用于减少地上部和籽粒中的Cd积累, 使籽粒中Cd含量达到国家粮食安全标准。这与在拟南芥和小白菜上的研究结果[9-10]一致。此外, 在脊尾白虾中甘露糖凝集素(MBL)响应Cd胁迫, 在应答Cd2+胁迫过程中可对机体起到一定的保护作用[21]。
在正常情况下, 植物内部已经形成抗氧化系统维持ROS在较低水平, 避免植物受到过度氧化胁迫。Cd胁迫下植物体内细胞遭到破坏, 代谢失衡, 抗氧化系统不能立即消除产生的ROS, 细胞膜脂过氧化程度加深, 抗氧化系统受损。在本研究中, Cd处理显著增加小麦体内ROS和MDA含量, 降低CAT和SOD活性。研究表明, Cd胁迫下箭舌豌豆、拟南芥和大豆体内的ROS含量增加, 膜质过氧化加剧[22-24]。在长时间高浓度Cd胁迫下, 小桐子、大豆[20, 25]的POD、SOD、APX和CAT活性显著低于对照, MDA含量升高, 植物体无法通过自身抗氧化系统消除氧化胁迫, 生长受抑制。本研究中, 喷施甘露糖后, H2O2、O2·-和MDA含量显著减少, 但CAT和SOD活性变化不显著, 暗示酶系统可能不能解除氧化胁迫。甘露糖处理后, GR活性显著增加, GR将GSSG还原成GSH, GSH作为非酶系统在清除ROS方面也发挥重要作用, 说明GR可能使GSSG还原生成更多GSH。与Cd处理相比, 甘露糖处理后GSH/GSSG比值增加, 这与Ozfidan-Konakci等[26]的结果类似, 没食子酸是通过增强APX、GR、单脱氢/脱氢抗坏血酸还原酶和GSH活性, 从而消除SOD和NOX活化引起的H2O2含量增加, 进而缓解小麦所受Cd胁迫。这说明在长时间高浓度Cd胁迫下, 甘露糖增强小麦活性氧清除能力可能更多依赖GSH。
Cd胁迫下小麦根系危害最大, 甘露糖缓解镉胁迫的效果在根系中表现最明显, 因此本研究采用iTRAQ和联合液相色谱-串联质谱(LC-MS/MS)技术, 研究Cd胁迫下甘露糖处理后小麦根中蛋白质的响应特征。结果显示: Cd胁迫下甘露糖调控的蛋白中有属于谷胱甘肽代谢途径的, 其中5个差异蛋白(GST), 分别为GSTF1、GSTU1、GSTU6、GSTZ5和P0043B10.43。GSTU6变化最显著, 在Cd胁迫下表达量增加, 在甘露糖处理后进一步增加, 同时其转录表达也有相同结果。GST是GSH发挥清除有害物质作用的关键。这与在Cd、铝等胁迫下金鱼藻、荠菜和拟南芥体内GST活性和表达都增加的研究结果[23-24, 27]一致。同时, 蛋白组学数据显示Prx135会被Cd诱导上调, 甘露糖处理后无明显变化, 但其基因转录结果显示甘露糖会进一步上调其表达。本研究中用于检测基因转录表达的样本是处理12 h, 而用于蛋白质组学的样本是处理15 d, 进一步说明甘露糖影响CAT、SOD、POD等抗氧化酶可能是在Cd胁迫初期发挥作用。甘露糖介导调控长时间处于Cd胁迫的小麦更多依赖于谷胱甘肽途径, 这一点与小桐子受Cd胁迫后短时间内抗氧化酶活性增加的研究结果[19]一致。此外, GLN1-2参与谷氨酸代谢和氮的循环, 对谷氨酸代谢尤为重要。本实验中Cd胁迫下GLN1-2的表达下调, 而甘露糖处理虽然没有恢复到对照水平, 但明显增加, 这也说明甘露糖处理通过谷胱甘肽代谢途径以缓解Cd毒害。
综上所述, 叶面喷施甘露糖缓解小麦Cd胁迫症状, 减少Cd向地上部转运。长时间Cd胁迫下, 甘露糖主要通过增强谷胱甘肽途径, 加强活性氧清除能力, 减轻氧化胁迫的机制来提高小麦耐Cd胁迫能力。地上部甘露糖处理又是通过何种信号途径影响地下部的基因表达需要进一步研究。
| [1] |
Singh R P, Agrawal M. Effects of sewage sludge amendment on heavy metal accumulation and consequent responses of Beta vulgaris plants[J]. Chemosphere, 2007, 67(11): 2229-2240. DOI:10.1016/j.chemosphere.2006.12.019 |
| [2] |
綦峥, 齐越, 杨红, 等. 土壤重金属镉污染现状、危害及治理措施[J]. 食品安全质量检测学报, 2020, 11(7): 2286-2294. Qi Z, QI Y, Yang H, et al. Status, harm and treatment measures of heavy metal cadmium pollution in soil[J]. Journal of Food Safety & Quality, 2020, 11(7): 2286-2294 (in Chinese with English abstract). |
| [3] |
Dias M C, Monteiro C, Moutinho-Pereira J, et al. Cadmium toxicity affects photosynthesis and plant growth at different levels[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1281-1289. DOI:10.1007/s11738-012-1167-8 |
| [4] |
Lin Y F, Aarts M G M. The molecular mechanism of zinc and cadmium stress response in plants[J]. Cellular and Molecular Life Sciences, 2012, 69(19): 3187-3206. DOI:10.1007/s00018-012-1089-z |
| [5] |
Asgher M, Khan M I R, Anjum N A, et al. Minimising toxicity of cadmium in plantsroleof plant growth regulators[J]. Protoplasma, 2015, 252(2): 399-413. DOI:10.1007/s00709-014-0710-4 |
| [6] |
Wu Q, Su N N, Cai J T, et al. Hydrogen-rich water enhances cadmium tolerance in Chinese cabbage by reducing cadmium uptake and increasing antioxidant capacities[J]. Journal of Plant Physiology, 2015, 175: 174-182. DOI:10.1016/j.jplph.2014.09.017 |
| [7] |
Rizwan M, Meunier J D, Davidian J C, et al. Silicon alleviates Cd stress of wheat seedlings(Triticum turgidum L. cv. Claudio) grown in hydroponics[J]. Environmental Science and Pollution Research, 2016, 23(2): 1414-1427. DOI:10.1007/s11356-015-5351-4 |
| [8] |
Wheeler G L, Jones M A, Smirnoff N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683): 365-369. DOI:10.1038/30728 |
| [9] |
Chen J, Yang L B, Gu J, et al. MAN3 gene regulates cadmium tolerance through the glutathione-dependent pathway in Arabidopsis thaliana[J]. New Phytologist, 2015, 205(2): 570-582. DOI:10.1111/nph.13101 |
| [10] |
马文佳, 盛义保, 韩洋洋, 等. 甘露糖促进小白菜对重金属镉耐受研究[J]. 合肥工业大学学报(自然科学版), 2018, 41(8): 1130-1133, 1148. Ma W J, Sheng Y B, Han Y Y, et al. Promotion effect of mannose on soil heavy metal cadmium tolerance in Brassica campestris[J]. Journal of Hefei University of Technology(Natural Science Edition), 2018, 41(8): 1130-1133, 1148 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-5060.2018.08.022 |
| [11] |
Jafarnejadi A R, Homaee M, Sayyad G, et al. Large scale spatial variability of accumulated cadmium in the wheat farm grains[J]. Soil and Sediment Contamination, 2011, 20(1): 98-113. DOI:10.1080/15320383.2011.528472 |
| [12] |
Jabs T, Dietrich R A, Dangl J L. Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide[J]. Science, 1996, 273(5283): 1853-1856. DOI:10.1126/science.273.5283.1853 |
| [13] |
Hodges D M, DeLong J M, Forney C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207(4): 604-611. DOI:10.1007/s004250050524 |
| [14] |
Velikova V, Yordanov I, Edreva A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants: protective role of exogenous polyamines[J]. Plant Science, 2000, 151(1): 59-66. DOI:10.1016/S0168-9452(99)00197-1 |
| [15] |
Lei Q C, Bi J C, Wang X Y, et al. GLP-2 prevents intestinal mucosal atrophy and improves tissue antioxidant capacity in a mouse model of total parenteral nutrition[J]. Nutrients, 2016, 8(1): 33. DOI:10.3390/nu8010033 |
| [16] |
王学奎, 李合生, 刘武定. 光对小麦叶片谷氨酰胺合成酶调节机理初探[J]. 华中农业大学学报, 2000, 19(2): 102-105. Wang X K, Li H S, Liu W D. Preliminary study on mechanism of light regulated glutamine synthetase in wheat leaves[J]. Journal of Huazhong Agricultural, 2000, 19(2): 102-105 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-2421.2000.02.004 |
| [17] |
程艳, 陈璐, 米艳华, 等. 水稻抗氧化酶活性测定方法的比较研究[J]. 江西农业学报, 2018, 30(2): 108-111. Cheng Y, Chen L, Mi Y H, et al. Comparative study on various methods for determination of activity of antioxidant enzymes in rice[J]. Acta Agriculturae Jiangxi, 2018, 30(2): 108-111 (in Chinese with English abstract). |
| [18] |
Marrs K A, Walbot V. Expression and RNA splicing of the maize glutathione S-transferase bronze2 gene is regulated by cadmium and other stresses[J]. Plant Physiology, 1997, 113(1): 93-102. DOI:10.1104/pp.113.1.93 |
| [19] |
冯欣, 杜宇, 潘坤, 等. 谷胱甘肽硫转移酶与氧化应激[J]. 医学研究与教育, 2010, 27(5): 80-83. Feng X, Du Y, Pan K, et al. Glutathione S-transferases and its oxidative stress[J]. Medical Research and Education, 2010, 27(5): 80-83 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-490X.2010.05.025 |
| [20] |
王欣欣, 邓明华, 龚明, 等. Cd2+胁迫对小桐子幼苗叶片抗氧化系统的影响[J]. 西北植物学报, 2016, 36(3): 527-533. Wang X X, Deng M H, Gong M, et al. Effect of Cd2+ Stress on antioxidant system in the leaves of Jatropha curcas seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(3): 527-533 (in Chinese with English abstract). |
| [21] |
徐莞媛, 马杭柯, 孙金秋, 等. 脊尾白虾甘露糖结合凝集素(MBL)基因在抗镉胁迫中的生物学功能分析[J]. 渔业科学进展, 2020, 41(4): 174-180. Xu W Y, Ma H K, Sun J Q, et al. Biological functional analysis of MBL gene in resistance to cadmium stress in Exopalaemon carinicaud[J]. Progress in Fishery Sciences, 2020, 41(4): 174-180 (in Chinese with English abstract). |
| [22] |
Lv Y, Deng X P, Quan L T, et al. Metallothioneins BcMT1 and BcMT2 from Brassica campestris enhance tolerance to cadmium and copper and decrease production of reactive oxygen species in Arabidopsis thaliana[J]. Plant and Soil, 2013, 367(1/2): 507-519. DOI:10.1007%2Fs11104-012-1486-y |
| [23] |
Rui H Y, Chen C, Zhang X X, et al. Cd-induced oxidative stress and lignification in the roots of two Vicia sativa L. varieties with different Cd tolerances[J]. Journal of Hazardous Materials, 2016, 301: 304-313. DOI:10.1016/j.jhazmat.2015.08.052 |
| [24] |
Chmielowska-Bak J, Izbiańska K, Ekner-Grzyb A, et al. Cadmium stress leads to rapid increase in RNA oxidative modifications in soybean seedlings[J]. Frontiers in Plant Science, 2018, 8: 2219. DOI:10.3389/fpls.2017.02219 |
| [25] |
尚玉坤, 刘思凯, 陈杨晗, 等. 镉胁迫对东营野生大豆幼苗抗氧化系统及可溶性蛋白的影响[J]. 四川农业大学学报, 2019, 37(1): 15-21. Shang Y K, Liu S K, Chen Y H, et al. Effects of antioxidant system and soluble protein in Dongying wild soybean seedling under cadmium stress[J]. Journal of Sichuan Agricultural University, 2019, 37(1): 15-21 (in Chinese with English abstract). |
| [26] |
Ozfidan-Konakci C, Kabakci M. The impacts of gallic acid on redox state of antioxidants related to ascorbate: glutathione cycle in wheat(Triticum aestivum) grown under cadmium toxicity[J]. Agricultural Research, 2020, 9(4): 543-553. DOI:10.1007/s40003-020-00460-9 |
| [27] |
Mishra S, Tripathi R D, Srivastava S, et al. Thiol metabolism play significant role during cadmium detoxification by Ceratophyllum demersum L.[J]. Bioresource Technology, 2009, 100(7): 2155-2161. DOI:10.1016/j.biortech.2008.10.041 |




