文章信息
- 王冕, 丁羽萱, 王尧, 王沛, 顾振新, 杨润强
- WANG Mian, DING Yuxuan, WANG Yao, WANG Pei, GU Zhenxin, YANG Runqiang
- 乙烯利对大豆芽菜生长代谢和酚类物质合成的影响
- Effect of ethephon on growth and phenolic compounds synthesis of soybean sprouts
- 南京农业大学学报, 2021, 44(2): 359-365
- Journal of Nanjing Agricultural University, 2021, 44(2): 359-365.
- http://dx.doi.org/10.7685/jnau.202006028
-
文章历史
- 收稿日期: 2020-06-22
酚类物质是植物主要的次生代谢产物, 广泛分布于水果、蔬菜、谷物、豆类中, 其具有抗氧化、抗肿瘤、降血糖、预防心血管疾病等多种保健功能。目前, 酚类物质在植物体中的代谢和积累已有大量研究, 例如: Tian等[1]发现发芽糙米中游离酚类如阿魏酸、香豆酸和芥子酸均明显高于未发芽糙米, 且不溶性酚类含量增加; Xu等[2]研究发现燕麦发芽后香豆酸、阿魏酸和总酚含量显著增加。此外, 在籽粒萌发阶段逆境胁迫可有效提高酚类物质含量, 例如生菜在100 mmol·L-1 NaCl处理12 d后, 总酚和类黄酮含量分别增加1.3倍和14.5倍[3]; 适度的盐胁迫处理时, 烤烟幼苗中绿原酸、类黄酮、花青苷等酚类物质含量显著增加[4]; Wang等[5]研究发现, 亚麻籽萌发第8天时植物化学成分显著富集, 其中维生素C含量增加22.1倍, 酚类物质含量增加2.67倍, 类黄酮含量增加5.48倍。
乙烯(ETH)参与植物次生代谢过程, 可促进生菜、胡萝卜、绿豆中总酚酸的积累[6]。曲文颖等[7]研究发现, 乙烯利可有效促进蓝莓果实中黄酮类物质、酚类物质的积累, 提高超氧化物歧化酶(SOD)活性。刘红开[8]研究发现, 乙烯处理绿豆芽, 不仅促进绿豆芽下胚轴的横向生长, 改善其外观品质及营养价值, 亦可增强酶促氧化和非酶氧化系统, 提高SOD、过氧化物酶(POD)、过氧化氢酶(CAT)等抗氧化酶活性。此外, 发芽过程中葡萄糖-6-磷酸脱氢酶(G6PDH)和苯丙氨酸氨裂解酶(PAL)活性的增加促进酚类物质的合成[8]。由此可见, 乙烯不仅可有效促进植物芽苗生长发育, 而且作为一种信号分子, 促进酚类物质的积累及其抗氧化能力的提高。
大豆(Glycine max L.)籽粒富含酚类物质, 发芽过程中会经历复杂的生理生化变化, 使生理活性成分不断积累, 营养价值进一步提高。其中黄酮类物质是天然的抗氧化剂, 主要分布于大豆种子和胚轴部位, 并随着发芽过程含量不断增加; 此外, 异黄酮、β-葡萄糖苷、γ-氨基丁酸(GABA)[9]等功能性成分较发芽前大量累积, 抗氧化能力进一步提高[10]。研究发现大豆在发芽过程中酚类物质会发生不同程度的变化, 营养成分也会显著提高[11]。目前, 乙烯对大豆发芽过程中酚类物质的富集过程及其变化情况的研究较少, 相关机制还需深入研究。
因此, 本试验采用不同浓度乙烯利处理大豆芽菜, 分析其总酚、总黄酮、酚酸、异黄酮等物质的含量, 筛选适宜的乙烯利浓度, 旨在为高品质大豆芽菜生产提供理论依据。
1 材料与方法 1.1 试验材料及处理供试大豆品种‘云鹤’, 收获后置于-20 ℃保存备用。乙烯利(有效成分含量≥90%)购自北京索莱宝科技有限公司。
称取适量颗粒饱满的大豆种子, 先用去离子水洗去浮沉与污渍后, 置于1%(体积分数)次氯酸钠水溶液中浸泡消毒15 min, 然后再用去离子水冲洗3~5次至pH呈中性, 最后加入去离子水于30 ℃下浸泡6 h。将浸泡后的大豆籽粒均匀铺在发芽机(梦飞扬科技有限公司)苗盘上, 在30 ℃黑暗条件下恒温发芽, 分别用浓度为0.025、0.050、0.100和0.500 mmol·L-1的乙烯利培养液处理大豆, 以去离子水为对照, 每24 h换培养液1次, 每次2 L。取处理4 d时的大豆芽菜进行各项指标分析。
1.2 指标测定芽长: 随机选取25株大豆芽菜, 游标卡尺测定其芽长并取平均值。
鲜/干重比: 随机选取大豆芽菜50株, 称鲜重, 然后经真空冷冻干燥后称干重。重复3次, 计算鲜/干重比。
呼吸速率: 采用小篮子法[12]测定呼吸速率。
酚类物质提取: 采用Ma等[13]的方法。取发芽4 d大豆芽菜, 经真空冷冻干燥, 粉碎后过孔径380 μm的筛得到豆粉, 提取游离酚和结合酚。
总酚含量: 采用Ma等[13]的方法测定大豆芽菜的总酚含量。总酚含量以没食子酸(GAE)当量计, 单位为mg·100 g-1。结果以干重计。
酚酸含量: 采用Chen等[14]的方法测定大豆芽菜的酚酸含量。结果以干重计。
总黄酮含量: 采用Islam等[15]的方法。称取0.2 g豆粉, 测定大豆芽菜的总黄酮含量。总黄酮含量以芦丁(RE)当量计, 单位为mg·100 g-1。结果以干重计。
异黄酮含量: 采用Jiao等[16]的方法测定大豆芽菜的异黄酮含量。结果以干重计。
2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸)(ABTS)自由基清除能力的测定: 参考Islam等[17]的方法。将7 mmol·L-1 ABTS与2.45 mmol·L-1过硫酸钾等体积混合, 室温下避光反应12~16 h, 用纯甲醇稀释至734 nm下吸光度为0.7左右, 即A液。取100 μL适当稀释的样品提取液, 加入3 mL A液于室温下避光反应30 min, 测定734 nm下吸光值。以Trolox绘制标准曲线, 蒸馏水为对照。ABTS自由基清除能力以干重计。
1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定: 参考He等[18]的方法。称取11.8 mg DPPH, 纯甲醇定容至500 mL, 即60 μmol·L-1 B液。取200 μL适当稀释的样品提取液, 加入3.8 mL B液, 室温下避光反应30 min, 于515 nm处测定吸光值。以Trolox绘制标准曲线, 蒸馏水为对照。DPPH自由基清除能力以干重计。
1.3 数据统计与分析采用SPSS 23.0软件对数据进行方差分析、邓肯氏多重比较和相关性分析, 显著性水平为P < 0.05。试验设3次生物学重复, 数据以“平均值±标准差”表示。
2 结果与分析 2.1 不同乙烯利浓度对大豆芽菜生理代谢的影响由图 1可知: 不同乙烯利浓度处理下大豆芽菜生长形态存在差异。对照大豆芽菜芽长最长, 乙烯利处理后大豆芽菜生长受到抑制, 且随乙烯利浓度的增加, 大豆芽菜下胚轴的纵向生长抑制程度增加, 但对横向生长先促进后抑制。当乙烯利浓度为0.050 mmol·L-1时, 侧根生长最为旺盛。此后继续增加乙烯利浓度时, 大豆芽菜整体生长逐渐受到显著抑制。随着乙烯利浓度增加, 大豆芽菜鲜/干重比呈先增加后降低的趋势, 且当乙烯利浓度为0.050 mmol·L-1时, 其鲜/干重比达到最大值, 比对照增加18.25%(P < 0.05), 说明适宜的乙烯利浓度可有效促进大豆芽菜的鲜重累积。当乙烯利浓度为0.050 mmol·L-1时大豆芽菜的呼吸速率最高, 比对照增加43.57%。而乙烯利浓度进一步增加时, 大豆芽菜的呼吸速率与对照相比则无显著性差异, 说明一定浓度的乙烯利可有效提高大豆芽菜的呼吸速率和生长代谢水平。
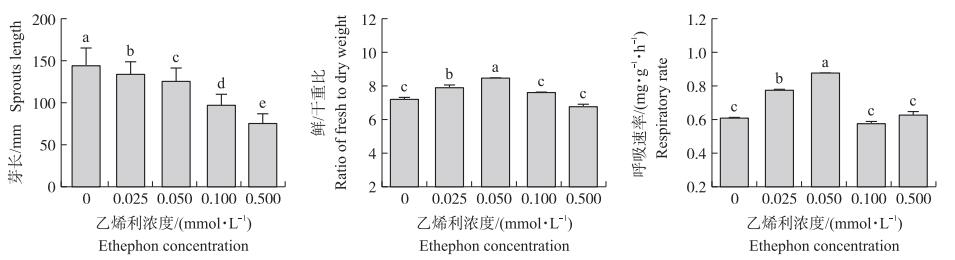
|
图 1 乙烯利对大豆芽菜生长发育的影响 Fig. 1 Effects of ethephon on the growth and development of soybean sprouts 不同小写字母表示不同处理之间存在显著差异(P < 0.05)。下同。 Different lowercase letters indicated significant difference at 0.05 level among different treatments. The same as follows. |
由图 2可知: 大豆芽菜中总酚含量随乙烯利浓度的增加呈先增加后降低的趋势, 当乙烯利浓度为0.050 mmol·L-1时总酚含量达到最大值, 说明适宜的乙烯利可促进大豆芽菜中总酚的合成, 但浓度过高时总酚合成会受到抑制。大豆芽菜中总黄酮含量与总酚含量变化基本一致。当乙烯利浓度为0.025和0.050 mmol·L-1时, 大豆芽菜中总黄酮显著富集, 比对照分别增加30.37%和30.43%, 说明一定浓度的乙烯利可有效促进大豆芽菜中总黄酮的合成水平。
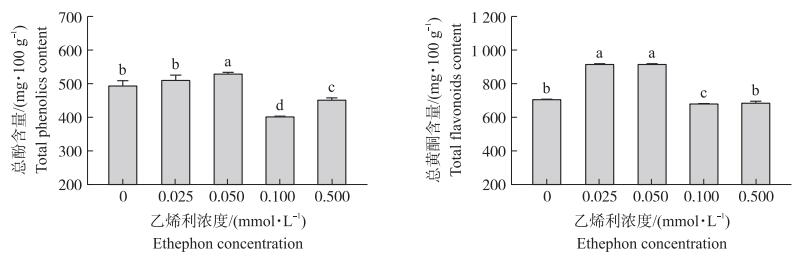
|
图 2 乙烯利对大豆芽菜总酚和总黄酮含量的影响 Fig. 2 Effect of ethephon on phenolics and flavonoids contents of soybean sprouts |
由表 1可知: 大豆芽菜中总异黄酮含量变化趋势与总黄酮基本一致, 乙烯利浓度为0.050 mmol·L-1时总异黄酮含量达最大值。大豆芽菜中异黄酮组分, 如: 黄豆苷、染料木苷、黄豆苷元含量均在0.025 mmol·L-1乙烯利处理时达到最大值。丙二酰基黄豆苷含量在乙烯利浓度为0.050 mmol·L-1时达到最大值, 比对照增加30.11%。丙二酰基黄豆黄苷和丙二酰基染料木苷含量随乙烯利浓度增加均有不同程度地下降, 说明一定浓度乙烯利处理可提高异黄酮总量, 但对各组分的调控作用存在差异, 主要表现为促进黄豆苷元、丙二酰基黄豆苷等组分的合成。
| 组分 Component |
乙烯利浓度/(mmol·L-1) Ethephon concentration | ||||
| 0 | 0.025 | 0.050 | 0.100 | 0.500 | |
| 黄豆苷含量/(μg·g-1)Daidzin content | 508.96±2.69c | 612.64±41.34a | 570.55±2.45b | 459.47±17.98d | 455.99±22.10d |
| 黄豆黄苷含量/(μg·g-1)Glycitin content | 9.53±0.00a | — | — | 5.04±0.00b | 7.92±0.00a |
| 染料木苷含量/(μg·g-1)Genistein content | 284.20±6.08bc | 350.40±12.26a | 304.57±5.60b | 298.79±10.04b | 262.56±13.85c |
| 丙二酰基黄豆苷含量/(μg·g-1)Malonyl daidzin content | 2 929.26±20.52c | 3 548.91±20.18b | 3 811.14±50.87a | 2 723.71±10.64d | 2 954.50±41.86c |
| 丙二酰基黄豆黄苷含量/(μg·g-1)Malonyl glycitin content | 309.70±14.26a | 289.76±0.16ab | 280.99±1.11b | 231.81±2.90c | 251.89±11.64c |
| 丙二酰基染料木苷含量/(μg·g-1)Malonyl genistin content | 1 717.24±47.19a | 1 514.54±13.08b | 1 458.52±37.45b | 1 395.79±23.57b | 1 190.58±78.16c |
| 黄豆苷元含量/(μg·g-1)Daidzein content | 40.80±0.13c | 159.67±3.62a | 55.01±2.91b | 36.14±1.35cd | 32.02±0.02d |
| 总异黄酮含量/(μg·g-1)Total isoflavones content | 5 794.92±97.36b | 6 475.92±90.63a | 6 480.76±87.45a | 5 150.74±52.32c | 5 155.45±112.20c |
由表 2可见: 大豆芽菜中总酚酸含量在乙烯利浓度为0.025 mmol·L-1时达到最大值, 比对照增加34.79%。当用0.050 mmol·L-1乙烯利处理后, 大豆芽菜中结合酚酸和总酚酸比对照分别增加47.43%和16.48%。乙烯利浓度为0.500 mmol·L-1时, 大豆芽菜中酚酸总量显著低于对照, 说明适宜乙烯利浓度可有效促进大豆芽菜中酚酸的富集, 过高的乙烯利浓度对酚酸的合成会产生抑制作用。
| 组分 Component |
乙烯利浓度/(mmol·L-1) Ethephon concentration |
酚酸含量/(μg·g-1) Phenolic acid content | ||
| 游离态Free | 结合态Bound | 总计Total | ||
| 没食子酸 Gallic acid |
0 | — | 0.25±0.00c | 0.25±0.00d |
| 0.025 | 27.57±0.15b | 0.47±0.02b | 28.04±0.16b | |
| 0.050 | 32.55±0.00a | 0.68±0.09a | 33.23±0.09a | |
| 0.100 | 14.32±0.40c | 0.34±0.02c | 14.66±0.38c | |
| 0.500 | — | 0.34±0.00c | 0.34±0.00d | |
| 原儿茶酸 Protocatechuic acid |
0 | 128.78±21.07ab | 0.85±0.05d | 129.63±21.13ab |
| 0.025 | 134.71±5.29a | 2.52±0.03a | 137.23±5.26a | |
| 0.050 | 80.62±2.79cd | 1.94±0.00b | 82.56±2.79c | |
| 0.100 | 75.86±9.73d | 1.00±0.01c | 76.87±9.75c | |
| 0.500 | 104.61±2.86bc | 0.44±0.08e | 105.05±2.94bc | |
| 对羟基苯甲酸 P-hydroxybenzoic acid |
0 | — | 2.34±0.14b | 2.34±0.14b |
| 0.025 | — | 3.70±0.40a | 3.70±0.40a | |
| 0.050 | — | 4.05±0.10a | 4.05±0.10a | |
| 0.100 | — | 1.77±0.14c | 1.77±0.14c | |
| 0.500 | — | 2.41±0.02b | 2.41±0.02b | |
| 香草酸 Vanillic acid |
0 | — | 23.96±0.17e | 23.96±0.17d |
| 0.025 | 8.03±0.08a | 42.17±0.20b | 50.20±0.12a | |
| 0.050 | 5.72±1.45b | 46.20±0.93a | 51.91±2.38a | |
| 0.100 | — | 26.61±1.91d | 26.61±1.91c | |
| 0.500 | 4.54±0.15b | 33.58±0.11c | 38.13±0.04b | |
| 丁香酸 Syringic acid |
0 | 11.90±0.80a | — | 11.90±0.80a |
| 0.025 | 12.13±0.70a | — | 12.13±0.70a | |
| 0.050 | 10.17±0.01b | — | 10.17±0.01b | |
| 0.100 | 7.95±0.00c | — | 7.95±0.00c | |
| 0.500 | — | — | — | |
| 对香豆酸 P-coumaric acid |
0 | — | 45.63±0.59c | 45.63±0.59c |
| 0.025 | — | 54.33±0.17b | 54.33±0.17b | |
| 0.050 | 5.41±1.64b | 62.41±2.22a | 67.82±3.86a | |
| 0.100 | 7.30±1.31b | 33.91±0.48d | 41.21±0.82c | |
| 0.500 | 11.16±0.06a | 31.53±0.07d | 42.70±0.13c | |
| 阿魏酸 Ferulic acid |
0 | — | 8.58±0.00c | 8.58±0.00d |
| 0.025 | 0.16±0.00c | 13.56±0.00a | 13.73±0.01b | |
| 0.050 | 0.75±0.00a | 13.68±0.19a | 14.44±0.19a | |
| 0.100 | 0.28±0.00b | 8.16±0.48c | 8.44±0.48d | |
| 0.500 | — | 11.19±0.04b | 11.19±0.04c | |
| 芥子酸 Erucic acid |
0 | — | 4.74±0.16c | 4.74±0.16d |
| 0.025 | 7.38±0.08d | 9.14±0.01a | 16.52±0.09b | |
| 0.050 | 9.23±0.00c | 9.18±0.00a | 18.41±0.00a | |
| 0.100 | 10.45±0.76b | 4.48±0.20c | 14.92±0.96c | |
| 0.500 | 12.59±0.00a | 5.81±0.15b | 18.40±0.15a | |
| 总酚酸 Total phenolic acids |
0 | 140.68±21.87b | 62.37±0.94c | 203.05±22.81c |
| 0.025 | 189.97±6.31a | 83.73±0.58b | 273.70±5.73a | |
| 0.050 | 144.56±6.02b | 91.95±2.41a | 236.51±8.43b | |
| 0.100 | 114.61±12.58b | 49.66±0.93d | 164.28±13.51d | |
| 0.500 | 132.90±2.77b | 51.73±0.32d | 184.63±3.09cd | |
乙烯利处理后大豆芽菜酚酸各组分含量变化趋势不同。大豆芽菜中没食子酸含量在乙烯利浓度为0.050 mmol·L-1时达到最大值; 原儿茶酸在乙烯利浓度为0.025 mmol·L-1时显著增加并达到最大值, 比对照增加5.86%。当乙烯利浓度大于0.025 mmol·L-1时, 原儿茶酸的合成受到抑制, 含量显著下降。在乙烯利浓度为0.050 mmol·L-1时, 大豆芽菜中香草酸、对香豆酸、阿魏酸、芥子酸含量均显著增加, 分别比对照增加1.17、0.49、0.68、2.88倍。大豆芽菜中对羟基苯甲酸含量极低, 且丁香酸主要以游离态存在。
2.5 不同乙烯利浓度下大豆芽菜抗氧化能力的变化由图 3可知: 当乙烯利浓度为0.025和0.050 mmol·L-1时, 大豆芽菜中ABTS和DPPH自由基清除能力均比对照显著提高; 而乙烯利浓度为0.500 mmol·L-1时, 大豆芽菜的ABTS自由基清除能力受到抑制, 说明一定浓度乙烯利可以有效提升大豆芽菜的抗氧化能力, 但浓度过高时会影响大豆芽菜的生长发育, 酚类物质积累水平受到影响, 从而降低自身抗氧化能力。
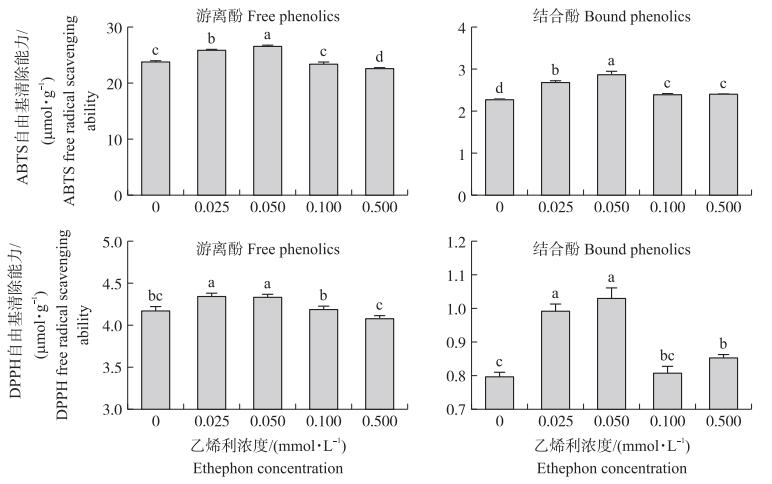
|
图 3 乙烯利对大豆芽菜抗氧化能力的影响 Fig. 3 Effect of ethephon on the antioxidant ability of soybean sprouts ABTS: 2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid; DPPH: 1,1-二苯基-2-三硝基苯肼1,1-diphenyl-2-picrylhydrazyl. |
经0.050 mmol·L-1乙烯利处理的大豆芽菜, 其游离酚、结合酚的ABTS、DPPH自由基清除能力均达到最大值, 其中大豆芽菜中游离酚和结合酚的ABTS自由基清除能力分别是对照的1.1和1.3倍, DPPH自由基清除能力分别是对照的1.04和1.3倍。大豆芽菜中总酚主要以游离酚形式存在, 经0.05 mmol·L-1乙烯利处理后, 其游离酚的ABTS、DPPH自由基清除能力显著增加, 是影响总酚抗氧化能力的重要因素。
3 讨论研究表明, 大豆芽菜在发芽形成芽苗过程中, 不仅保持部分原有营养成分, 而且膳食纤维、γ-氨基丁酸(GABA)和酚类等功能成分大量累积, 其营养和功能品质均得到提高[19]。本研究发现, 不同浓度乙烯利处理对大豆芽菜的芽长、鲜/干重比、呼吸速率等生理指标均有显著影响, 且适宜浓度的乙烯利可增强大豆芽菜中细胞的生长代谢水平, 改变外观及营养品质。刘红开[8]研究表明乙烯利处理绿豆芽可促进绿豆芽下胚轴的横向生长以及细胞壁的合成代谢, 从而增加其体积和鲜重, 改善外观品质及营养价值。此外, 施加外源乙烯利可促进植物内源乙烯的产生, 增加植物的呼吸强度[20]。Jiao等[16]研究发现, 一定浓度的乙烯利会引起蓝莓内源乙烯的积累, 提高蓝莓呼吸代谢速率, 本研究结果与之相一致。
本研究表明, 乙烯利不仅改善大豆芽菜的外观品质, 对其内部酚类物质的合成也有显著影响, 其中在乙烯利浓度为0.050 mmol·L-1时, 大豆芽菜的总酚含量比对照增加7.26%, 尤其结合酚比对照增加40%;总黄酮、异黄酮比对照分别增加30.43%、11.84%;酚酸中没食子酸含量变化较大, 比对照增加131.92倍。乙烯利(0.05 mmol·L-1)可调控大豆芽菜中酚类物质合成关键酶的活性, 如PAL、POD、肉桂醇脱氢酶(CAD)等, 促进酚类物质的富集, 显著提高ABTS、DPPH自由基清除能力, 增强植物自身抗氧化能力[21]。刘红开[8]研究发现, PAL活性与总酚含量成正相关, 绿豆芽经乙烯利处理后PAL活性显著提高, 总酚含量显著增加。Guo等[22]研究表明, 大豆发芽5 d后, PAL基因表达水平显著提高, 内源总酚和总黄酮大量富集。Tian等[23]发现, 发芽能够提高燕麦酚类物质的含量, 归因于谷物发芽时酶活性的提高。荞麦萌发过程中可生成酚酸、黄酮等重要的植物次生代谢产物, 主要通过苯丙烷代谢途径合成, 其中PAL是重要限速酶[24]。另有研究认为, PAL酶异构体亚细胞定位的特异性可能和该酶的代谢活性调节密切相关[25]。因此, PAL作为苯丙烷代谢过程的关键限速酶, 在酚类物质合成途径中具有重要作用。乙烯利可通过提高大豆芽菜中苯丙烷代谢途径的关键酶活性, 促进酚类物质的富集以及自身抗氧化能力的提高。本研究表明, 乙烯利可促进大豆芽菜中总酚、总黄酮及异黄酮的合成, 其中黄豆苷、染料木苷、丙二酰基黄豆苷、黄豆苷元等异黄酮单一组分均比对照显著增加, 但丙二酰基黄豆黄苷和丙二酰基染料木苷的含量有所降低, 说明乙烯利对大豆芽菜中异黄酮单一组分的富集作用存在差异。
综上, 浓度为0.050 mmol·L-1的乙烯利可促进大豆芽菜下胚轴的横向生长, 改善大豆芽菜的外观品质, 同时促进大豆芽菜中酚酸、黄酮等功能成分的累积, 有效提高大豆芽菜的营养品质。乙烯利浓度过高则会对大豆芽菜的生理代谢和酚类物质合成产生抑制。乙烯利是否通过影响苯丙烷代谢途径中关键酶的表达调控酚类物质的合成有待研究。
| [1] |
Tian S, Nakamura K, Kayahara H. Analysis of phenolic compounds in white rice, brown rice, and germinated brown rice[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4808-4813. DOI:10.1021/jf049446f |
| [2] |
Xu J G, Tian C R, Hu Q P, et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J]. Journal of Agricultural and Food Chemistry, 200957, 57(21): 10392-10398. |
| [3] |
Mahmoudi H, Huang J, Gruber M Y, et al. The impact of genotype and salinity on physiological function, secondary metabolite accumulation, and antioxidative responses in lettuce[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 5122-5130. DOI:10.1021/jf904274v |
| [4] |
胡庆辉. 盐与干旱胁迫诱导烤烟叶片细胞程序性死亡及多酚含量变化的研究[D]. 北京: 中国农业科学院, 2012. Hu Q H. The study of programmed cell death and polyphenols contents changes of flue-cured tobacco leaves induced by salt and drought stress[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012(in Chinese with English abstract). |
| [5] |
Wang H, Qiu C S, Abbasi A M, et al. Effect of germination on vitamin C, phenolic compounds and antioxidant activity in flaxseed (Linum usitatissimum L.)[J]. International Journal of Food Science & Technology, 2015, 50(12): 2545-2553. |
| [6] |
Heredia J B, Cisneros-Zevallos L. The effects of exogenous ethylene and methyl jasmonate on the accumulation of phenolic antioxidants in selected whole and wounded fresh produce[J]. Food Chemistry, 2009, 115(4): 1500-1508. DOI:10.1016/j.foodchem.2009.01.078 |
| [7] |
曲文颖, 刘真真, 谢琳淼, 等. 外源脱落酸和乙烯利对蓝莓重要品质的调控[J]. 江苏农业科学, 2017, 45(17): 126-129. Qu W Y, Liu Z Z, Xie L M, et al. Regulation of exogenous abscisic acid and ethephon on important quality of blueberries[J]. Jiangsu Agricultural Sciences, 2017, 45(17): 126-129 (in Chinese). |
| [8] |
刘红开. 乙烯对绿豆芽下胚轴生长代谢的调控效应研究[D]. 北京: 中国农业大学, 2014. Liu H K. Reasearch of ethylene in regulating growth and metabolism of mungbean[Vigna radiata (L. ) Wilczek]sprouts hypocotyl[D]. Beijing: China Agricultural University, 2014(in Chinese with English abstract). |
| [9] |
Vann K, Techaparin A, Apiraksakorn J. Beans germination as a potential tool for GABA-enriched tofu production[J]. Journal of Food Science and Technology, 2020, 57(11): 3947-3954. DOI:10.1007/s13197-020-04423-4 |
| [10] |
Kim M A, Kim M J. Isoflavone profiles and antioxidant properties in different parts of soybean sprout[J]. Journal of Food Science, 2020, 85(3): 689-695. DOI:10.1111/1750-3841.15058 |
| [11] |
Eum H L, Park Y, Yi T G, et al. Effect of germination environment on the biochemical compounds and anti-inflammatory properties of soybean cultivars[J]. PLoS One, 2020, 15(4): e0232159. DOI:10.1371/journal.pone.0232159 |
| [12] |
王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006. Wang X K. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. 2nd ed. Beijing: Higher Education Press, 2006 (in Chinese). |
| [13] |
Ma Y, Wang P, Zhou T, et al. Role of Ca2+ in phenolic compound metabolism of barley (Hordeum vulgare L.) sprouts under NaCl stress[J]. Journal of the Science of Food and Agriculture, 2019, 99(11): 5176-5186. DOI:10.1002/jsfa.9764 |
| [14] |
Chen Z J, Ma Y, Weng Y, et al. Effects of UV-B radiation on phenolic accumulation, antioxidant activity and physiological changes in wheat (Triticum aestivum L.) seedlings[J]. Food Bioscience, 2019, 30: 100409. DOI:10.1016/j.fbio.2019.04.010 |
| [15] |
Islam M Z, Park B J, Lee Y T. Effect of salinity stress on bioactive compounds and antioxidant activity of wheat microgreen extract under organic cultivation conditions[J]. International Journal of Biological Macromolecules, 2019, 140: 631-636. DOI:10.1016/j.ijbiomac.2019.08.090 |
| [16] |
Jiao C F, Yang R Q, Zhou Y L, et al. Nitric oxide mediates isoflavone accumulation and the antioxidant system enhancement in soybean sprouts[J]. Food Chemistry, 2016, 204: 373-380. DOI:10.1016/j.foodchem.2016.02.147 |
| [17] |
Islam M Z, Park B J, Kang H M, et al. Influence of selenium biofortification on the bioactive compounds and antioxidant activity of wheat microgreen extract[J]. Food Chemistry, 2020, 309: 125763. DOI:10.1016/j.foodchem.2019.125763 |
| [18] |
He W W, Wang Y X, Luo H, et al. Effect of NaCl stress and supplemental CaCl2 on carotenoid accumulation in germinated yellow maize kernels[J]. Food Chemistry, 2020, 309: 125779. DOI:10.1016/j.foodchem.2019.125779 |
| [19] |
Bueno D B, da Silva S I, J r, Chiarotto S A B, et al. The germination of soybeans increases the water-soluble components and could generate innovations in soy-based foods[J]. LWT: Food Science and Technology, 2020, 117: 108599. DOI:10.1016/j.lwt.2019.108599 |
| [20] |
Shao Y F, Xu F F, Sun X, et al. Phenolic acids, anthocyanins, and antioxidant capacity in rice (Oryza sativa L.) grains at four stages of development after flowering[J]. Food Chemistry, 2014, 143: 90-96. DOI:10.1016/j.foodchem.2013.07.042 |
| [21] |
Xie G F, Feng Y C, Chen Y, et al. Effects of 1-methylcyclopropene (1-MCP) and ethylene on postharvest lignification of common beans (Phaseolus vulgaris L.)[J]. ACS Omega, 2020, 5(15): 8659-8666. DOI:10.1021/acsomega.0c00151 |
| [22] |
Guo X B, Wang L Z, Chang X X, et al. Influence of plant growth regulators on key-coding genes expression associated with phytochemicals biosynthesis and antioxidant activity in soybean[Glycine max (L.) Merr]sprouts[J]. International Journal of Food Science & Technology, 2019, 54(3): 771-779. |
| [23] |
Tian B Q, Xie B J, Shi J, et al. Physicochemical changes of oat seeds during germination[J]. Food Chemistry, 2010, 119(3): 1195-1200. DOI:10.1016/j.foodchem.2009.08.035 |
| [24] |
Zhang G, Xu Z C, Gao Y Y, et al. Effects of germination on the nutritional properties, phenolic profiles, and antioxidant activities of buckwheat[J]. Journal of Food Science, 2015, 80(5): H1111-H1119. DOI:10.1111/1750-3841.12830 |
| [25] |
Bassard J E, Mutterer J, Duval F, et al. A novel method for monitoring the localization of cytochromes P450 and other endoplasmic Reticulum membrane associated proteins: a tool for investigating the formation of metabolons[J]. The FEBS Journal, 2012, 279(9): 1576-1583. DOI:10.1111/j.1742-4658.2011.08312.x |




