文章信息
- 郗蒙雪, 戴鹏远, 沈丹, 李春梅
- XI Mengxue, DAI Pengyuan, SHEN Dan, LI Chunmei
- 鸡胚原代肺泡Ⅱ型上皮细胞的分离培养与鉴定
- Isolation, culture and identification of primary alveolar type Ⅱ epithelial cells from chicken embryo
- 南京农业大学学报, 2021, 44(2): 353-358
- Journal of Nanjing Agricultural University, 2021, 44(2): 353-358.
- http://dx.doi.org/10.7685/jnau.202003005
-
文章历史
- 收稿日期: 2020-03-03
集约化畜禽养殖生产过程中可产生大量的颗粒物(particulate matter, PM)、氨气(NH3)、硫化氢(H2S)等空气污染物, 它们能够通过呼吸进入肺泡, 增加患呼吸系统疾病风险, 危害畜禽健康[1]。柏仕均等[2]研究报道, 鸡舍空气粉尘污染致鸡出现呼吸道黏膜干燥、萎缩等症状。申慧敏等[3]发现, 鸡舍中NH3、H2S等有害气体容易通过鼻腔进入呼吸道, 造成呼吸困难、气管炎和支气管炎、肺水肿、呼吸机能紊乱等现象, 严重危害鸡的机体健康和生产性能。肺泡Ⅱ型上皮细胞(type Ⅱ alveolar epithelial cells, AECⅡ)是肺泡内重要的功能和结构细胞[4]。AECⅡ细胞能够分化为肺泡Ⅰ型上皮细胞, 具有无限增殖能力, 促进肺泡上皮细胞再生与修复, 维持上皮细胞的完整性[5]。AECⅡ细胞还具有肺水转运功能, 可消除肺水肿[6]。AECⅡ细胞还可以分泌表面活性物质, 抵御病原体的入侵[7]。除此之外, 它还能够分泌一些抗炎、抗菌物质, 提高免疫功能[8-9]。因此, AECⅡ细胞是多种肺部疾病发病的攻击靶点[10-11], 已有大量研究表明, 许多肺部疾病的发生与发展伴有AECⅡ细胞的损伤, 甚至是死亡[12-13]。因此, 在有关鸡舍空气污染物对鸡肺泡功能及肺部炎症损伤的研究中, 鸡的AECⅡ细胞是非常重要的体外细胞模型。尽管目前国内外已有大量对大鼠、小鼠、牛等[14]的AECⅡ细胞分离培养方法的相关报道, 但是在禽类的研究较少。有试验表明, AECⅡ细胞在培养过程中贴壁速度慢, 不易增殖分裂, 不易传代[15], 而且随着培养时间的延长, 细胞形态和功能逐步丧失[16], 因此目前尚未有鸡AECⅡ细胞株, 这也限制了开展有关鸡AECⅡ细胞的相关研究[17]。鉴于此, 建立一套稳定的鸡AECⅡ细胞的分离培养方法十分重要。本试验拟采用16日龄的鸡胚, 用Ⅰ型胶原酶对其进行消化, 经差速离心、差速贴壁以及免疫吸附, 以建立一套稳定的鸡胚原代AECⅡ细胞分离、纯化和培养技术, 为进一步研究鸡AECⅡ细胞的生物学特性及鸡舍空气环境应激因素对鸡肺泡功能及肺部炎症损伤研究提供体外细胞研究模型。
1 材料与方法 1.1 材料 1.1.1 试验动物16日龄SPF鸡胚, 购自江苏省南京市特有机有限责任公司。
1.1.2 主要试剂与仪器DMEM培养基、胎牛血清(FBS)购自BI公司; D-Hank’s液、鸡免疫球蛋白G(IgG)、碱性磷酸酶染色试剂(偶氮偶联法)盒购自南京建成生物技术有限公司; Ⅰ型胶原酶购自鼎思生物科技有限公司; 细胞角蛋白19(cytokeratin-19, CK19)抗体购自北京博奥森生物技术有限公司。倒置显微镜(上海光学仪器一厂)。
1.2 试验方法 1.2.1 鸡AECⅡ细胞的分离取16日龄SPF鸡胚, 用体积分数为75%的乙醇消毒。在无菌条件下, 用眼科镊子钝端轻轻击碎胚蛋气室, 剥开壳膜, 将鸡胚取出放入超净台。斩首剖胸后, 轻轻将双肺移至装有D-Hank’s液的青霉素瓶中, 用无菌眼科剪将其剪成约1 mm3的小块并剔除气管、支气管以及血管等非肺组织, 不断清洗直至液体清亮。去除洗液后, 加入经37 ℃预温、体积分数为0.1%的Ⅰ型胶原酶(每只鸡胚约0.1~0.12 mL), 转移至37 ℃恒温振荡水浴锅中, 振荡消化15~25 min。待消化液颜色清亮, 用等量含10% FBS的DMEM终止消化, 依次用150 μm、76 μm筛网过滤后, 1 000 r·min-1低温离心5 min, 收集细胞沉淀。
1.2.2 鸡AECⅡ细胞的纯化与培养1) 鸡IgG包被培养皿。用D-Hank’s液配制1 mg·mL-1鸡IgG溶液, 将其按照0.15~0.20 mg·cm-2铺于培养皿中, 轻轻摇晃, 使其完全覆盖培养皿底部; 将培养皿移至37 ℃、5% CO2的培养箱中孵育5~6 h, 吸弃鸡IgG溶液, 用适量磷酸盐缓冲液(PBS)冲洗培养皿2~3次, 备用。2)纯化细胞。用含10% FBS的DMEM重悬细胞沉淀, 将其接种于不经特殊处理的细胞培养皿中, 置于37 ℃、5% CO2的培养箱中孵育1 h, 大部分成纤维细胞将会贴壁, 轻轻吸取培养液于离心管中, 800 r·min-1低温离心10 min。离心后, 弃上清液, 用含10% FBS的DMEM重悬细胞沉淀, 继续在培养箱中培养1 h, 重复2~3次, 去除成纤维细胞。吸出未贴壁的细胞, 将其接种于用鸡IgG包被的培养皿中, 在37 ℃、5% CO2的培养箱中孵育1 h, 以去除巨噬细胞。收集培养液于离心管中, 800 r·min-1低温离心10 min, 弃上清液, 用含20% FBS的DMEM重悬细胞沉淀, 用38 μm筛网过滤, 去除Ⅰ型上皮细胞。将分离纯化的细胞密度调整为(1.5~2.0)×106 mL-1, 接种于细胞培养瓶中, 在37 ℃、5% CO2的培养箱中孵育15~18 h后, 弃去培养液, 用含20% FBS的DMEM继续培养。每2~3 d更换1次培养液, 注意观察细胞形态变化。3)台盼蓝染色检测细胞活力。制备体积分数为0.4%的台盼蓝染液, 取100 μL纯化后的细胞悬液与等体积的0.4%台盼蓝染液混合, 取10 μL滴入到红细胞计数板上。镜下观察, 死细胞被染成明显的蓝色, 活细胞不被染色, 呈无色透明状, 在3 min内分别对活细胞和死细胞进行计数, 计算细胞活力。
1.2.3 鸡AECⅡ细胞的鉴定1) 免疫荧光染色鉴定。将细胞接种于放有盖玻片的六孔板中, 培养36~48 h后, 每孔加入1 mL含4%的多聚甲醛, 室温固定1 h后, 在0.5%TritonX-100中通透10 min, PBS清洗3次后, 用含1%牛血清白蛋白(BSA)的PBS室温封闭1 h, CK19一抗1∶100稀释, 37 ℃避光孵育1 h, 用PBS代替一抗作为阴性对照染色。用Alexa Fluox488标记的二抗(1∶200)37 ℃避光孵育1 h, PBS清洗3次后加入3 μg·mL-1 4′,6-二脒基-2-苯基吲哚(DAPI)避光孵育10 min, 滴加抗淬灭剂, 封片, 激光共聚焦显微镜下观察。2)碱性磷酸酶染色鉴定。制作细胞爬片, 24 h后用固定液固定3 min左右, 按照碱性磷酸酶染液试剂盒提供的方法配制底物应用液, 将底物应用液滴加到细胞爬片上, 37 ℃避光孵育15 min。同时, 用PBS代替底物应用液制作阴性对照。孵育完成后, 水洗2 min, 用复染液复染30 s, 蒸馏水洗1 min左右, 甩干, 镜检。
1.3 数据分析应用Graphpad prism 6.0软件进行数据分析, 试验数据以平均数±标准差(x±SD)表示。
2 结果与分析 2.1 鸡AECⅡ细胞的产量、纯度和活力本研究将16日龄鸡胚肺组织消化分离, 得到的细胞悬液再经过差速离心、差速贴壁、免疫吸附纯化细胞后, 最终每个鸡胚获得的鸡AECⅡ细胞数可达(1.75±0.25)×107, 细胞纯度在90%以上, 细胞活力为92%左右(表 1)。
| 每胚细胞产量/107 Cell yield per embryo |
细胞纯度/% Cell purity |
细胞活力/% Cell viability |
| 1.75±0.25 | 94.3±1.5 | 92.0±1.2 |
如图 1所示: 16日龄的鸡胚经过细胞提取、纯化培养后, 约18~24 h时细胞伸展贴壁, 呈多边形或立方形, 胞内有大量细小颗粒, 胞间紧密连接, 形成岛屿状; 培养24~72 h, 细胞增殖代谢旺盛, 胞核明显, 胞浆丰富, 细胞之间逐渐连接形成单层; 培养72 h后, 细胞内细小颗粒有所减少, 细胞形态逐渐变为扁平。
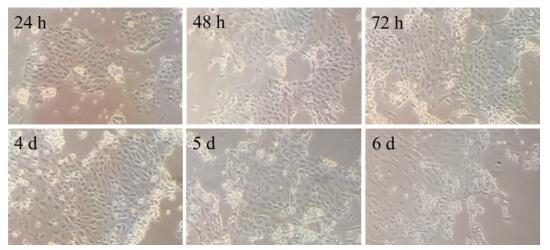
|
图 1 倒置显微镜下原代培养不同时间的鸡AECⅡ细胞(×100) Fig. 1 Morphology of primary cultured chicken AECⅡ cells at different time under an inverted microscope(× 100) |
如图 2所示: CK19是上皮细胞特有的标志蛋白, 在CK19+(阳性)染色组中, 细胞胞浆呈绿色荧光, 即CK19染色呈阳性, 细胞核被DAPI复染后呈现为蓝色, 且大部分细胞为CK19+DAPI+双阳性细胞, 也有个别未呈现绿色荧光的细胞; 而CK19-(阴性)染色组中, 细胞胞浆无着色, 细胞核被DAPI复染后呈现为蓝色。
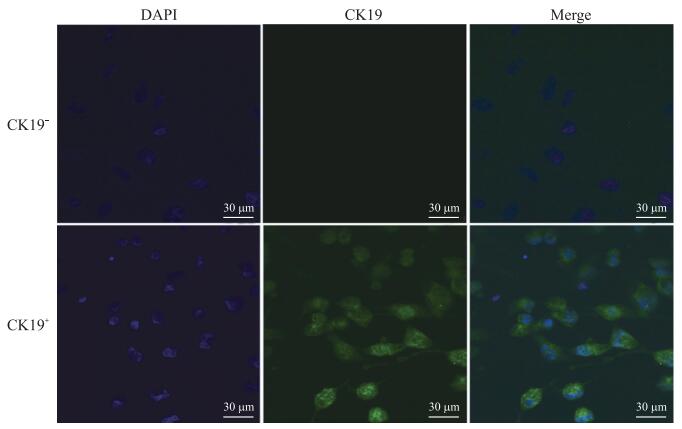
|
图 2 免疫荧光检测原代培养的鸡AECⅡ细胞 Fig. 2 Chicken AECⅡ cells detected in primary culture by immunofluorescence detection |
如图 3所示: 细胞经碱性磷酸酶染色后, 在倒置显微镜下观察, 细胞核被染成深紫色, 碱性磷酸酶活性部位呈弥散的红色或红棕色颗粒, 定位于细胞浆, 也有个别细胞胞浆未被染色; 而在阴性对照组中, 细胞核呈深紫色, 胞浆未见着色。
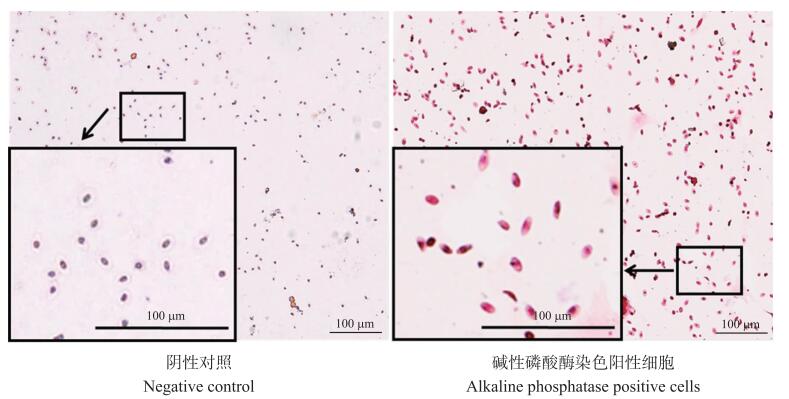
|
图 3 原代培养鸡AECⅡ细胞的碱性磷酸酶染色结果 Fig. 3 Chicken AECⅡ cells stained by alkaline phosphatase in primary culture |
目前, 肺脏AECⅡ细胞分离的方法主要包括全肺灌注消化法和肺组织块消化法[18]。由于鸡肺比较小, 不适宜采用全肺灌注消化法[19], 因此本试验采用肺组织块消化法。AECⅡ细胞分离时可选用多种消化酶, 一般包括胰蛋白酶、弹性蛋白酶以及胶原酶[20-21]。胰蛋白酶价格便宜, 适用范围广, 但是易受pH值、温度、酶浓度等因素的影响, 对细胞的损伤较大。弹性蛋白酶能够消化结缔组织中的弹性蛋白, 消化效果好, 几乎对细胞形态、活力、功能等无影响, 但是其价格昂贵, 不易获得[22]。胶原酶能够很好地消化细胞间质, 对细胞的损伤小, 消化效果好[19]。Ⅳ型胶原酶对哺乳动物组织具有广谱消化作用, 而Ⅰ型胶原酶主要用于消化肺、上皮等。本试验选用Ⅰ型胶原酶, 在37 ℃条件下消化鸡胚肺组织20 min左右可达到理想消化效果, 与侯海燕等[19]采用Ⅳ型胶原酶和胰酶相比, 对细胞损伤小, 消化效果好, 步骤简单, 易操作。
鸡胚肺组织消化后所得的细胞悬液中有多种不同类型的细胞, 因此需要进一步纯化。细胞纯化时常用的方法有差速离心、差速贴壁、流式细胞仪分选、密度梯度离心、免疫吸附等[23-25], 这些方法都有其各自的优缺点。本试验选用差速离心、差速贴壁以及免疫吸附相结合的方法进行细胞纯化, 所得细胞纯度高、活力强。800~1 000 r·min-1离心时, 部分成纤维细胞因无法沉淀而滞留在上清液中, 所以吸弃上清液可以去除部分成纤维细胞。因为成纤维细胞和AECⅡ细胞贴壁时间不同, 成纤维细胞贴壁时间约30~40 min, AECⅡ细胞贴壁时间约10~20 h, 经过2次贴壁, 可有效去除成纤维细胞。细胞悬液中还有巨噬细胞、中性粒细胞、淋巴细胞等, 这些细胞表面有IgG的Fc受体, 鸡IgG能够与之结合, 利用此特点进行免疫吸附纯化细胞[26]。此时, 所得细胞为鸡肺泡Ⅰ型上皮细胞(AECⅠ)和鸡AECⅡ细胞, AECⅠ大小为50~100 μm, 经过38 μm筛网过滤后, 即为纯化后的鸡AECⅡ细胞。
细胞骨架蛋白CK19是上皮组织来源的特异性标志物, 说明细胞具有上皮细胞的特质[27-28]。但是, 肺泡上皮细胞分为Ⅰ型上皮细胞和Ⅱ型上皮细胞[29-30]。为了进一步鉴定这些细胞为鸡AECⅡ细胞, 本试验选择碱性磷酸酶染色法。碱性磷酸酶可作为AECⅡ细胞分化的标志, 主要存在于细胞膜。采用碱性磷酸酶法染色后, 成纤维细胞、巨噬细胞、淋巴细胞和其他细胞均为阴性, AECⅡ细胞和中性粒细胞呈阳性, 但是, 中性粒细胞体积小, 细胞核呈分叶状, 明显区别于AECⅡ细胞[19, 31]。因此, 免疫荧光检测和碱性磷酸酶染色相结合的方法, 操作简单易行, 并且确保鉴定的准确性。
综上所述, 本试验利用16日龄鸡胚的肺组织, 采用Ⅰ型胶原酶进行消化, 差速离心、差速贴壁和免疫吸附方法纯化细胞, 并利用免疫荧光检测和碱性磷酸酶染色相结合的方法对细胞进行鉴定, 最终获得稳定、纯化的鸡AECⅡ细胞。建立的鸡AECⅡ细胞分离、纯化和培养体系, 操作简单, 易于推广, 可满足一般试验需求。
| [1] |
Radon K, Weber C, Iversen M, et al. Exposure assessment and lung function in pig and poultry farmers[J]. Occupational and Environmental Medicine, 2001, 58(6): 405-410. DOI:10.1136/oem.58.6.405 |
| [2] |
柏仕均, 牛辉. 加强鸡舍环境管理, 减少呼吸道疾病[J]. 畜牧兽医科技信息, 2018(1): 108. Bai S J, Niu H. Strengthen environmental management of chicken house and reduce respiratory diseases[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2018(1): 108 (in Chinese). DOI:10.3969/J.ISSN.1671-6027.2018.01.099 |
| [3] |
申惠敏, 杜娟, 贾秀珍. 鸡舍有毒有害气体的防控[J]. 养禽与禽病防治, 2014(12): 11-13. Shen H M, Du J, Jia X Z. Prevention and control of toxic and harmful gases in chicken house[J]. Poultry Husbandry and Disease Control, 2014(12): 11-13 (in Chinese). |
| [4] |
柳琪林. 肺泡Ⅱ型上皮细胞形态与功能的研究进展[J]. 中国危重病急救医学, 2003(7): 445-446. Liu Q L. Research progress in morphology and function of alveolar type Ⅱ epithelial cells[J]. Chinese Critical Care Medicine, 2003(7): 445-446 (in Chinese). |
| [5] |
Camelo A, Dunmore R, Sleeman M A, et al. The epithelium in idiopathic pulmonary fibrosis: breaking the barrier[J]. Frontiers in Pharmacology, 2014, 4: 173. |
| [6] |
Mason R J. Biology of alveolar type Ⅱ cells[J]. Respirology, 2006, 11: S12-S15. DOI:10.1111/j.1440-1843.2006.00800.x |
| [7] |
Wu Y, Ma J, Woods P S, et al. Selective targeting of alveolar type Ⅱ respiratory epithelial cells by anti-surfactant protein-C antibody-conjugated lipoplexes[J]. Journal of Controlled Release, 2015, 203: 140-149. DOI:10.1016/j.jconrel.2015.02.016 |
| [8] |
Xu X, Rock J R, Lu Y, et al. Evidence for type Ⅱ cells as cells of origin of K-Ras-induced distal lung adenocarcinoma[J]. Proc Natl Acad Sci USA, 2012, 9(13): 4910-4915. |
| [9] |
Lin C, Hai S, Cecilia H, et al. Alveolar type Ⅱ cells possess the capability of initiating lung tumor development[J]. PLoS One, 2012, 7(12): e53817. DOI:10.1371/journal.pone.0053817 |
| [10] |
Liang X, Wei S Q, Lee S J, et al. p62 sequestosome 1/light chain 3b complex confers cytoprotection on lung epithelial cells after hyperoxia[J]. American Journal of Respiratory Cell and Molecular Biology, 2013, 48(4): 490-496. |
| [11] |
Galam L, Parthasarathy P T, Cho Y, et al. Adenovirus-mediated transfer of the SOCS-1 gene to mouse lung confers protection against hyperoxic acute lung injury[J]. Free Radical Biology and Medicine, 2015, 84: 196-205. DOI:10.1016/j.freeradbiomed.2015.03.036 |
| [12] |
Li H P. The alveolar epithelium and pulmonary fibrosis[J]. Journal of Epithelial Biology & Pharmacology, 2009, 2(1): 30-35. |
| [13] |
Fukumoto J, Fukumoto I, Parthasarathy P T, et al. NLRP3 deletion protects from hyperoxia-induced acute lung injury[J]. American Journal of Physiology Cell Physiology, 2013, 305(2): C182-C189. DOI:10.1152/ajpcell.00086.2013 |
| [14] |
张婷, 白万富, 李璐, 等. 牛肺泡上皮细胞的体外分离培养与鉴定[J]. 中国兽医科学, 2016, 46(9): 1170-1176. Zhang T, Bai W F, Li L, et al. Isolation, culture and identification of bovine alveolar epithelial cells in vitro[J]. Chinese Veterinary Science, 2016, 46(9): 1170-1176 (in Chinese with English abstract). |
| [15] |
Demaio L, Tseng W, Balverde Z, et al. Characterization of mouse alveolar epithelial cell monolayers[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2009, 296(6): L1051-L1058. |
| [16] |
Bhaskaran M, Kolliputi N, Wang Y, et al. Trans-differentiation of alveolar epithelial type Ⅱ cells to typeⅠcells involves autocrine signaling by transforming growth factor β1 through the Smad pathway[J]. The Journal of Biological Chemistry, 2007, 282(6): 3968-3976. DOI:10.1074/jbc.M609060200 |
| [17] |
符跃强, 蒋静, 陈娟, 等. 大鼠肺泡Ⅱ型上皮细胞的培养、鉴定及体外特性初步研究[J]. 重庆医学, 2010, 39(15): 1988-1990. Fu Y Q, Jiang J, Chen J, et al. Isolation, purification, Culture and identification of primary rat alveolar type Ⅱ epithelial cells in vitro[J]. Chongqing Medicine, 2010, 39(15): 1988-1990 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-8348.2010.15.021 |
| [18] |
任奇杰, 程龙, 孙颖飞, 等. 豚鼠肺泡Ⅱ型上皮细胞的分离、纯化与培养[J]. 黑龙江畜牧兽医, 2015(21): 232-235, 294. Ren Q J, Cheng L, Sun Y F, et al. Isolation, purification and culture of type Ⅱ alveolar epithelial cells from the guinea pig[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(21): 232-235, 294 (in Chinese with English abstract). |
| [19] |
侯海燕, 赵立红, 乔健, 等. 鸡肺泡上皮Ⅱ型细胞的培养与鉴定[J]. 中国农业大学学报, 2008, 13(1): 6-10. Hou H Y, Zhao L H, Qiao J, et al. Culture and identification of alveolar epithelial type Ⅱ cells from chicken[J]. Journal of China Agricultural University, 2008, 13(1): 6-10 (in Chinese with English abstract). DOI:10.3321/j.issn:1007-4333.2008.01.002 |
| [20] |
Dobbs L G, Gonzalez R, Williams M C. An improved method for isolating type Ⅱ cells in high yield and purity[J]. The American Review of Respiratory Disease, 1986, 134(1): 141-145. |
| [21] |
Liu C, Yang L, Dang H X, et al. Effect of substance P on type Ⅱ alveolar epithelial cells exposed to hyperoxia and its regulation of the Sonic hedgehog signaling pathway[J]. Molecular Medicine Reports, 2014, 10(3): 1604-1608. DOI:10.3892/mmr.2014.2330 |
| [22] |
Lei J X, Wendt C H, Fan D S, et al. Developmental acquisition of T3-sensitive Na-K-ATPase stimulation by rat alveolar epithelial cells[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2007, 292(1): L6-L14. |
| [23] |
Laube M, Küppers E, Thome U H. Modulation of sodium transport in alveolar epithelial cells by estradiol and progesterone[J]. Pediatric Research, 2011, 69(3): 200-205. DOI:10.1203/PDR.0b013e3182070ec8 |
| [24] |
Buckley S, Driscoll B, Shi W, et al. Migration and gelatinases in cultured fetal, adult, and hyperoxic alveolar epithelial cells[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2001, 281(2): L427-L434. |
| [25] |
Leary J F, Finkelstein J N, Notter R H, et al. Isolation of type Ⅱ pneumocytes by laser flow cytometry[J]. The American Review of Respiratory Disease, 1982, 125(3): 326-330. |
| [26] |
Chen J, Chen Z, Narasaraju T, et al. Isolation of highly pure alveolar epithelial typeⅠand type Ⅱ cells from rat lungs[J]. Laboratory Investigation, 2005, 84(6): 727-735. |
| [27] |
Means A L, Xu Y, Zhao A, et al. A CK19 (CreERT) knockin mouse line allows for conditional DNA recombination in epithelial cells in multiple endodermal organs[J]. Genesis, 2008, 46(6): 318-323. DOI:10.1002/dvg.20397 |
| [28] |
Ferrero M, Spyratos F, Le Doussalg V, et al. Flow cytometric analysis of DNA content and keratins by using CK7, CK8, CK18, CK19, and KL1 monoclonal antibodies in benign and malignant human breast tumors[J]. Cytometry, 1990, 11(6): 716-724. DOI:10.1002/cyto.990110609 |
| [29] |
Gonzalez R, Yang Y H, Griffin C, et al. Freshly isolated rat alveolar typeⅠcells, type Ⅱ cells, and cultured type Ⅱ cells have distinct molecular phenotypes[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2005, 288(1): L179-L189. |
| [30] |
Ballard P L, Lee J W, Fang X H, et al. Regulated gene expression in cultured type Ⅱ cells of adult human lung[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2010, 299(1): L36-L50. |
| [31] |
蒋海鹰, 曾庆富. 一种简易的肺泡Ⅱ型上皮细胞染色方法[J]. 临床与实验病理学杂志, 1999, 15(3): 276-277. Jiang H Y, Zeng Q F. A simple staining method for alveolar type Ⅱ epithelial cells[J]. Chinese Journal of Clinical and Experimental Phthology, 1999, 15(3): 276 (in Chinese). DOI:10.3969/j.issn.1001-7399.1999.03.039 |




