文章信息
- 尹杭, 杜星, 潘增祥, 李强, 刘红林, 李齐发
- YIN Hang, DU Xing, PAN Zengxiang, LI Qiang, LIU Honglin, LI Qifa
- 苏淮猪BMP7基因3'-UTR多态性分析
- Polymorphism of the 3'-UTR of BMP7 gene in Suhuai pigs
- 南京农业大学学报, 2021, 44(2): 346-352
- Journal of Nanjing Agricultural University, 2021, 44(2): 346-352.
- http://dx.doi.org/10.7685/jnau.202008033
-
文章历史
- 收稿日期: 2020-08-26
2. 江苏省淮阴种猪场, 江苏 淮安 223322
2. Huaiyin Pig Breeding Farm of Jiangsu Province, Huai'an 223322, China
骨形态发生蛋白7(bone morphogenetic protein 7, BMP7)是BMP/SMAD信号通路的重要配体, 在哺乳动物胚胎发育、骨骼发育、神经发育、生殖生理乃至癌症等疾病发生等过程中均发挥关键的调控作用[1-4]。研究发现BMP7在雌性生殖器官如卵巢、输卵管和子宫等中表达, 特别是在卵泡膜细胞中高表达, 在颗粒细胞中也检测到其存在[5-6]。在卵巢组织中, BMP7主要通过旁分泌或自分泌形式调节类固醇激素生成、卵泡细胞(包括卵泡膜细胞、颗粒细胞和卵母细胞等)状态、卵泡发育和排卵等, 进而影响雌性动物生殖力。在类固醇激素生成方面, 添加BMP7融合蛋白可以刺激卵巢颗粒细胞释放雌激素(E2)[5]。利用BMP结合蛋白如gremlin、noggin、chordin和follistatin拮抗BMP7则可促进卵泡膜细胞的雄激素分泌[6]。在卵泡细胞状态方面, BMP7可促进大鼠卵巢中颗粒细胞的增殖[7]。在卵泡发育方面, 在大鼠卵巢中注射BMP7会增加各级卵泡(如原始卵泡、初级卵泡、腔前卵泡和有腔卵泡等)数量[7]。这些结果表明BMP7在卵泡发育和雌性生殖中具有重要作用。
卵巢组织中BMP7基因表达水平与家畜繁殖力密切相关, 研究发现多胎绵羊品种或个体卵巢组织中BMP7基因表达水平显著高于单胎绵羊品种或个体[8-9]。经全基因组亚硫酸氢盐测序(WGBS)发现卵巢组织中BMP7基因的DNA甲基化与绵羊高繁殖力关系密切[10]。在长白猪-杜洛克-大白猪家系中, 利用全基因组关联分析(GWAS)发现BMP7是排卵数性状的候选基因[11]。最近, 基因组重测序发现BMP7是大白猪产仔数性状(包括总产仔数和产活仔数)的候选基因[12]。然而, 目前在BMP7基因上发现的与猪繁殖性状关联的多态位点较少。本文以苏淮猪(1个以新淮猪为母本、大白猪为父本培育而成的瘦肉型新品种, 具有生长速度快、瘦肉率高、耐粗饲和肉质好等优点, 平均每胎产仔数10头以上, 3胎以后可达13头以上, 与高繁殖力猪种相比仍有一定的差距)[13]BMP7基因为研究对象, 采用PCR扩增和测序获得猪BMP7基因3′-UTR序列, 采用池DNA测序筛选BMP7基因3′-UTR中的突变位点, 并分析其多态性与繁殖性状的关系, 采用双荧光素酶报告系统分析突变对BMP7基因3′-UTR活性的影响, 以期为解析猪BMP7基因3′-UTR的调控机制、挖掘猪分子育种的遗传标记提供参考。
1 材料与方法 1.1 试验动物用于提取基因组DNA的苏淮猪183份耳组织样品来自于江苏省淮阴种猪场, 详细记录每头母猪的繁殖性能, 包括总产仔数(the total number of piglets born, TNB)、产活仔数(number of piglets born alive, NBA)和死胎数(number of stillborn, NSB)等。基因组DNA采取酚/氯仿抽提法提取, 提取的基因组DNA保存在-20 ℃冰箱中, 用于后续试验。
1.2 PCR扩增、测序和序列分析根据大白猪BMP7基因的3′-UTR序列[14], 利用Primer Premier 5软件设计引物扩增苏淮猪BMP7基因3′-UTR序列。上/下游引物对序列为: 5′-GTGTTCCAGGTCCACTTCAT-3′/5′-CCCAACTCCAAGCAGAAA-3′, 预期扩增片段长度为822 bp。PCR反应体系和反应程序见文献[14], 退火温度为54 ℃。PCR扩增产物经15 g·L-1琼脂糖凝胶电泳检测合格后, 送南京擎科生物科技有限公司测序。利用DNAMAN 5.22软件进行序列整理和同源性分析。利用在线网站miRBase(http://www.mirbase.org/)预测3′-UTR序列上的miRNA应答元件(MRE)。
1.3 突变位点筛选与分型将20头苏淮猪的基因组DNA等量混匀, 构建DNA池。以池DNA为模板, 利用1.2节中的引物进行PCR扩增。扩增产物经检测合格后, 送南京擎科生物科技有限公司测序, 筛选突变位点。利用直接测序法对每个个体进行基因分型。
1.4 关联分析根据每个个体的基因型数据, 计算基因型频率、遗传多样性参数, 进行哈代-温伯格平衡检验。采用SAS v9.2软件中的GLM程序对基因型与繁殖性状进行关联分析。分析模型如下:
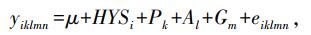
|
式中: yiklmn为性状的观察值; μ为群体均值; HYSi表示场-年-季的效应; Pk表示胎次的效应; Al表示日龄效应; Gm表示基因型效应; eiklmn为随机残差。
1.5 载体构建为构建猪BMP7基因3′-UTR的双荧光素酶报告载体, 利用Primer Premier 5.0软件筛选序列内的酶切位点, 设计含有双XbaⅠ位点的引物。上/下游引物序列分别为: 5′-GCTCTAGACAGGCGTGTGAGGGTATTT-3′/5′-GCTCTAGATCCTCTCGCACAGACACAA-3′, 预期扩增片段长度为276 bp, 退火温度为55 ℃。PCR产物经测序确认后, 用XbaⅠ核酸内切酶于37 ℃分别对目的片段和pGL3-basic载体(Promega公司)进行酶切, 酶切产物经纯化后连接, 再转化感受态细胞后涂板, 待长出单克隆菌落后挑菌, 测序确认。
1.6 细胞培养、转染和荧光素酶活性分析将本实验室保存的HEK293T细胞系置于37 ℃水浴中复苏, 离心后弃冻存液, 加入DMEM培养基(含有15%胎牛血清和20 g·L-1青/链霉素)(Gibio公司)并轻轻吹打, 重悬细胞后均匀接种T25瓶, 置于5% CO2细胞培养箱(Thermo公司)中37 ℃培养。待细胞量长满约90%时, 使用胰蛋白酶消化2 min后, 加入等量DMEM培养基并终止消化, 转移至15 mL离心管中, 离心后弃上清液, 再用DMEM培养基重悬, 均匀接种至12孔细胞培养板中。待细胞量长满约90%时, 用Lipofectamine 3000试剂(Invitrogen公司)对细胞进行转染。转染24 h后, 用裂解液收集12孔细胞培养板的细胞, 1 200 r·min-1离心1 min。在避光条件下, 利用双荧光素酶报告基因检测试剂盒(Promega公司)和酶标仪(Bio-Tek公司)对单个样品的萤火虫荧光和海肾荧光强度进行测定, 计算荧光强度相对值。
1.7 数据分析试验数据均以平均值±标准误(x±SE)表示。利用GraphPad Prism v5.0软件进行统计分析和制作图表。
2 结果与分析 2.1 苏淮猪BMP7基因3′-UTR序列分析PCR扩增产物经测序和序列整理后获得639 bp的苏淮猪BMP7基因3′-UTR部分序列, 同源性分析发现, 苏淮猪BMP7基因3′-UTR部分序列与杜洛克猪(GenBank ID: XM_005673044.3)、大白猪[14]的同源性均为99.84%, 因为杜洛克猪和大白猪相应序列完全一致(图 1)。为了解苏淮猪BMP7基因3′-UTR上的RNA调节元件, 首先采用在线预测网站miRBase预测miRNA应答元件(MRE), 在苏淮猪BMP7基因3′-UTR上发现5个miRNA(miR-658、miR-1373、miR-6794、miR-1934和miR-3067)的MRE(图 1)。另外, 在苏淮猪BMP7基因3′-UTR上还发现AU-富集元件(ARE)等RNA调节元件和polyA信号(PAS)。

|
图 1 苏淮猪BMP7基因3′-UTR与其他猪种的同源性比对 Fig. 1 Identical alignments of BMP7 3′-UTR sequence in Suhuai pig with other pig breeds 箭头表示突变位点; 下划线处表示RNA调节元件; ARE: AU富集元件; PAS: polyA信号。 The arrow indicates variation site; Underlines indicate RNA regulatory elements; ARE: AU-rich element; PAS: polyA signal. |
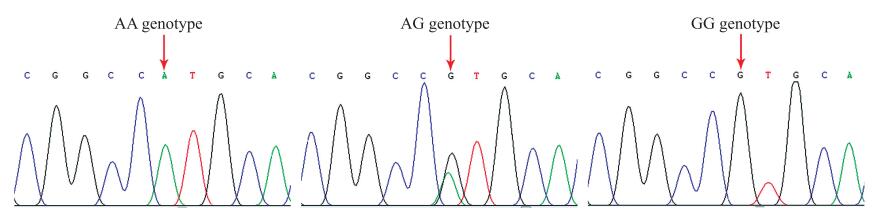
利用池DNA测序技术对苏淮猪BMP7基因3′-UTR上的突变位点进行筛选, 在终止密码子(TGA)后273 nt处发现1个AG套峰, 并将该位点命名为c.*273A>G。利用直接测序法对苏淮猪BMP7基因c.*273A>G突变位点进行基因分型, 结果发现在苏淮猪群体中存在3种基因型, 即AA、AG和GG型(图 2)。进一步分析发现, AG型为优势基因型, 基因型频率为0.448;A为优势等位基因, 等位基因频率为0.579(表 1)。
|
图 2 苏淮猪BMP7基因3′-UTR突变位点的基因型 Fig. 2 Genotype of mutations locus in the 3′-UTR of Suhuai pig BMP7 gene 箭头显示为突变位点。The arrows indicate mutation locus. |
| 样本数 Sample number |
基因型频率(n)Genotype frequency | 等位基因频率Allele frequency | ||||
| AA | AG | GG | A | G | ||
| 183 | 0.355(65) | 0.448(82) | 0.197(36) | 0.579 | 0.421 | |
| 注: 括号中数字表示样本数。The number in brackets indicates the number of sample. | ||||||
对苏淮猪BMP7基因c.*273A>G突变位点的遗传多样进行分析, 结果发现苏淮猪群体中BMP7基因c.*273A>G突变位点的多态信息含量(PIC)为0.488, 为中度多态性位点(0.25 < PIC < 0.50)。卡方检验发现, 苏淮猪群体中BMP7基因c.*273A>G突变位点的基因型分布符合哈代-温伯格平衡(Hardy-Weinberg equilibrium, HWE)定律(P>0.05)。
2.4 苏淮猪BMP7基因c.*273A>G突变位点多态性与繁殖性状的关联分析采用线性模型对c.*273A>G突变位点多态性与3个繁殖性状(总产仔数、产活仔数和死胎数)进行了关联分析。从结果(表 2)可以看出, AA型母猪的初产产仔数(10.98头)比GG型个体(10.15头)多0.83头, 且差异显著(P < 0.05);其他胎次各基因型间繁殖性状均差异不显著(P>0.05)。
| 胎次 Parity |
基因型(n) Genotype |
总产仔数 TNB |
产活仔数 NBA |
死胎数 NSB |
| 初产 First parity |
AA(65) | 10.98±0.23a | 9.79±0.24 | 1.19±0.24 |
| AG(82) | 10.40±0.20ab | 9.51±0.21 | 0.89±0.21 | |
| GG(36) | 10.15±0.32b | 9.34±0.33 | 0.76±0.33 | |
| 经产 Multiparities |
AA(65) | 12.03±0.18 | 11.12±0.19 | 0.92±0.14 |
| AG(82) | 12.49±0.16 | 11.43±0.17 | 1.06±0.12 | |
| GG(36) | 11.99±0.25 | 11.08±0.26 | 0.91±0.19 | |
| 所有胎次 All parities |
AA(65) | 11.81±0.14 | 10.81±0.15 | 1.00±0.12 |
| AG(82) | 11.94±0.13 | 10.93±0.13 | 1.01±0.11 | |
| GG(36) | 11.51±0.20 | 10.65±0.20 | 0.86±0.16 | |
| 注: 1)TNB: The total number of piglets born; NBA: Number of piglets born alive; NSB: Number of stillborn. 2)同一胎次数值上不同小写字母表示差异显著(P < 0.05)。Values in parity with different lowercase superscripts are significant difference at 0.05 level. | ||||
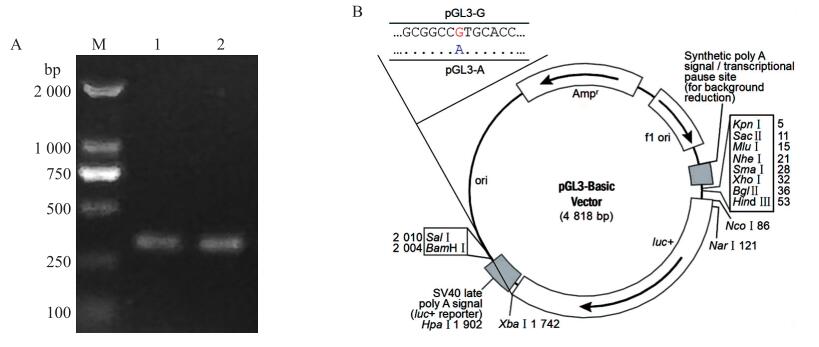
为了解c.*273A>G突变对猪BMP7基因3′-UTR活性的影响, 本试验拟构建2种不同等位型猪BMP7基因3′-UTR荧光素酶报告载体。首先, 以2种纯合型(AA基因型和GG基因型)个体基因组DNA为模板进行PCR扩增(图 3-A)。其次, 将扩增产物与pGL3-basic载体同时用限制性内切酶XbaⅠ进行酶切、纯化后连接。经测序验证后, 成功获得c.*273A>G位点的2种等位型BMP7基因3′-UTR荧光素酶报告载体, 即pGL3-A和pGL3-G(图 3-B)。
|
图 3 猪BMP7 3′-UTR双荧光素酶报告载体构建
Fig. 3 Construction of dual luciferase reporter vector of porcine BMP7 3′-UTR
A. PCR扩增产物PCR amplification products; B. 载体构建示意图Schematic diagram of vector construction. M. DAN标准品DNA marker; 1. AA基因型BMP7 3′-UTR扩增片段Fragments amplified of BMP7 3′-UTR in AA genotype; 2. GG基因型BMP7 3′-UTR扩增片段Fragments amplified of BMP7 3′-UTR in GG genotype. |
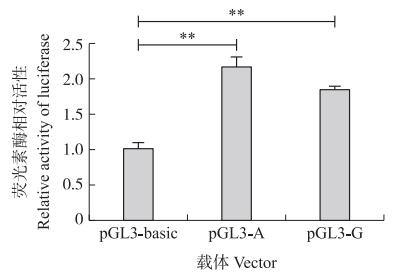
将空载pGL3-basic和pGL3-A、pGL3-G分别转染到HEK293T细胞中, 检测荧光素酶活性。结果显示, 与对照组(空载)相比, 2个BMP7基因3′-UTR报告载体pGL3-A和pGL3-G的荧光素酶活性均极显著升高(P < 0.01);pGL3-A载体的荧光素酶活性高于pGL3-G载体, 但两者差异不显著(P=0.113)(图 4)。A等位型BMP7基因3′-UTR活性高于G等位型, 这与AA型母猪总产仔数(TNB)高于GG型母猪(所有胎次和初产每胎分别高0.30头和0.83头, 表 2)的趋势是一致的。
|
图 4 c.*273A>G突变位点不同等位基因型BMP7基因3′-UTR报告载体的荧光素酶活性分析 Fig. 4 Luciferase activity assay of different allelic BMP73′-UTR reporter vector at mutation c.*273A>G **P < 0.01. |
BMP7是雌性生殖必需的细胞因子, 其在卵巢组织中的表达水平和基因多态性均与家畜的繁殖力有关[5, 8-9]。在高繁殖力绵羊品种GMM的卵巢组织中BMP7 mRNA水平显著高于单胎绵羊品种Malpura[8]。在GMM绵羊中, 携带高繁殖力基因FecB的母羊卵巢组织中BMP7 mRNA水平显著高于不携带FecB基因的个体[8]。在我国高繁殖力绵羊品种湖羊卵巢组织中, 多羔母羊卵泡中BMP7 mRNA水平显著高于单羔个体[9]。高通量测序证实BMP7是影响湖羊高繁殖力性状的候选基因[12]。BMP7基因启动子区g.58171886A>C突变位点多态性与我国著名的高繁殖力绵羊品种小尾寒羊的产羔数性状显著关联, 其中CC型个体的产羔数显著高于AC型和AA型[15]。经高通量技术发现BMP7是母猪繁殖性状(如排卵数、总产仔数和产活仔数等)的重要候选基因[11-12]。在大白猪、长白猪和杜洛克猪中, BMP7基因第3内含子的g.35161T>C位点多态性与繁殖性状(如产活仔数、出生窝重和21 d窝重)显著关联[16]。本文利用池DNA测序技术在苏淮猪BMP7基因的3′-UTR中检测到1个突变位点即c.*273A>G, 发现其多态性与苏淮猪繁殖性状显著关联, 说明BMP7基因是苏淮猪繁殖性状的候选基因。本实验室前期研究发现, 这个位点的多态性与大白猪的出生窝重显著关联, 且AA型个体的总产仔数比GG型个体平均每胎多0.61头[14], 与本文在苏淮猪中不同基因型个体中产仔数的趋势是一致的。这些结果表明, BMP7基因是母猪繁殖性状的重要候选基因。
编码基因3′-UTR上的碱基突变会通过改变mRNA稳定性、翻译、定位和多聚腺苷酸化等影响宿主基因的功能[17-19]。研究发现, 3′-UTR的rs2229611位点突变可以降低人肝癌细胞中葡萄糖6-磷酸酶催化亚基1(G6PC1)mRNA的稳定性, 并下调G6PC1基因的表达水平[17]。喉鳞癌相关基因SH3GL2BMP7 3′-UTR中SNP rs1049430的G等位基因与人喉鳞癌细胞中SH3GL2 mRNA稳定性下降、蛋白低表达及失活相关[20]。PD-L1(programmed death-ligand 1)是公认的肿瘤免疫治疗效果的预测标志物, 其3′-UTR上rs2297136位点多态性与胃癌患者血液中PD-L1蛋白表达水平以及患者的预后密切相关[21]。在人乳腺癌细胞中, RYR3(ryanodine receptor 3)基因3′-UTR的miR-367结合位点存在1个单碱基突变位点rs1044129A>G, 该位点突变可影响miR-367与RYR3基因3′-UTR的结合亲和力, 进而影响RYR3基因的表达[22]。本研究结果表明, c.*273A>G突变可使猪BMP7基因3′-UTR活性下降, 虽未达到显著水平, 但这与AA型母猪总产仔数高于GG型母猪的趋势是一致的。Liu等[23]研究发现细胞分裂周期蛋白42(CDC42)基因3′-UTR上rs55618224T>C突变影响胎盘中CDC42基因3′-UTR活性和mRNA水平, 进而影响大白猪的总产仔数性状。
总之, 本文获得苏淮猪BMP7基因3′-UTR部分序列, 发现其在不同猪种间的同源性较高, 并在苏淮猪BMP7基因3′-UTR中发现1个单核苷酸突变位点即c.*273A>G, 其多态性与苏淮猪产仔数性状显著关联, 说明BMP7是苏淮猪繁殖性状的候选基因。A等位型BMP7基因3′-UTR活性高于G等位型, 说明c.*273A>G突变部分通过影响BMP7基因3′-UTR活性影响苏淮母猪的繁殖性状。
| [1] |
Seifinejad A, Li S, Mikhail C, et al. Molecular codes and in vitro generation of hypocretin and melanin concentrating hormone neurons[J]. Proc Natl Acad Sci USA, 2019, 116(34): 17061-17070. DOI:10.1073/pnas.1902148116 |
| [2] |
Kim H S, Neugebauer J, McKnite A, et al. BMP7 functions predominantly as a heterodimer with BMP2 or BMP4 during mammalian embryogenesis[J]. BioRxiv, 2019. DOI: 10.1101/686758.
|
| [3] |
Veschi V, Mangiapane L R, Nicotra A, et al. Targeting chemoresistant colorectal cancer via systemic administration of a BMP7 variant[J]. Oncogene, 2020, 39(5): 987-1003. DOI:10.1038/s41388-019-1047-4 |
| [4] |
Kumar S, Lakshmi D H, Singh J N, et al. Expression and functional role of bone morphogenetic proteins (BMPs) in placenta during different stages of pregnancy in water buffalo (Bubalus bubalis)[J]. General and Comparative Endocrinology, 2020, 285: 113249. DOI:10.1016/j.ygcen.2019.113249 |
| [5] |
Rajesh G, Mishra S R, Paul A, et al. Transcriptional and translational abundance of bone morphogenetic protein (BMP) 2, 4, 6, 7 and their receptors BMPR1A, 1B and BMPR2 in buffalo ovarian follicle and the role of BMP4 and BMP7 on estrogen production and survival of cultured granulosa cells[J]. Research in Veterinary Science, 2018, 118: 371-388. DOI:10.1016/j.rvsc.2018.04.002 |
| [6] |
Glister C, Regan S L, Samir M, et al. Gremlin, noggin, chordin and follistatin differentially modulate BMP-induced suppression of androgen secretion by bovine ovarian theca cells[J]. Journal of Molecular Endocrinology, 2019, 62(1): 15-25. DOI:10.1530/JME-18-0198 |
| [7] |
Lee W S, Otsuka F, Moore R K, et al. Effect of bone morphogenetic protein-7 on folliculogenesis and ovulation in the rat[J]. Biology of Reproduction, 2001, 65(4): 994-999. DOI:10.1095/biolreprod65.4.994 |
| [8] |
Bahire S V, Rajput P K, Kumar V, et al. Quantitative expression of mRNA encoding BMP/SMAD signalling genes in the ovaries of Booroola carrier and non-carrier GMM sheep[J]. Reproduction in Domestic Animals, 2019, 54(10): 1375-1383. DOI:10.1111/rda.13535 |
| [9] |
Xu Y F, Li E L, Han Y D, et al. Differential expression of mRNAs encoding BMP/Smad pathway molecules in antral follicles of high- and low-fecundity Hu sheep[J]. Animal Reproduction Science, 2010, 120(1/2/3/4): 47-55. |
| [10] |
Zhang Y L, Li F Z, Feng X, et al. Genome-wide analysis of DNA methylation profiles on sheep ovaries associated with prolificacy using whole-genome Bisulfite sequencing[J]. BMC Genomics, 2017, 18(1): 759. DOI:10.1186/s12864-017-4068-9 |
| [11] |
Schneider J F, Nonneman D J, Wiedmann R T, et al. Genomewide association and identification of candidate genes for ovulation rate in swine[J]. Journal of Animal Science, 2014, 92(9): 3792-3803. DOI:10.2527/jas.2014-7788 |
| [12] |
Li X J, Ye J W, Han X L, et al. Whole-genome sequencing identifies potential candidate genes for reproductive traits in pigs[J]. Genomics, 2020, 112(1): 199-206. DOI:10.1016/j.ygeno.2019.01.014 |
| [13] |
马百全, 魏天雨, 吴艳, 等. 苏淮猪BMP4基因3'-UTR区克隆和多态性分析[J]. 南京农业大学学报, 2016, 39(5): 819-824. Ma B Q, Wei T Y, Wu Y, et al. Cloning and polymorphism of BMP4 gene 3'-UTR in Suhuai pig[J]. Journal of Nanjing Agricultural University, 2016, 39(5): 819-824 (in Chinese with English abstract). DOI:10.7685/jnau.201602002 |
| [14] |
Yin H, Du X, Li Q Q, et al. Variants in BMP7 and BMP15 3'-UTRs associated with reproductive traits in a large white pig population[J]. Animals, 2019, 9(11): 905. DOI:10.3390/ani9110905 |
| [15] |
Zhang Z B, Liu Q Y, Di R, et al. Single nucleotide polymorphisms in BMP2 and BMP7 and the association with litter size in Small Tail Han sheep[J]. Animal Reproduction Science, 2019, 204: 183-192. DOI:10.1016/j.anireprosci.2019.04.001 |
| [16] |
Feng X, Xie S Y, Zhou J S, et al. Polymorphisms of the bone morphogenetic protein 7 gene (BMP7) and association analysis with sow productive traits[J]. Animal Reproduction Science, 2013, 142(1/2): 56-62. |
| [17] |
Karthi S, Rajeshwari M, Francis A, et al. 3'-UTR SNP rs2229611 in G6PC1 affects mRNA stability, expression and glycogen storage disease type-Ia risk[J]. Clinica Chimica Acta, 2017, 471: 46-54. DOI:10.1016/j.cca.2017.05.016 |
| [18] |
Preussner M, Gao Q S, Morrison E, et al. Splicing-accessible coding 3'UTRs control protein stability and interaction networks[J]. Genome Biology, 2020, 21(1): 186. DOI:10.1186/s13059-020-02102-3 |
| [19] |
Shi L, Liu L, Lv X, et al. Identification of genetic effects and potential causal polymorphisms of CPM gene impacting milk fatty acid traits in Chinese Holstein[J]. Animal Genetics, 2020, 51(4): 491-501. DOI:10.1111/age.12936 |
| [20] |
Maiti G P, Ghosh A, Mondal P, et al. SNP rs1049430 in the 3'-UTR of SH3GL2 regulates its expression: clinical and prognostic implications in head and neck squamous cell carcinoma[J]. Biochimica et Biophysica Acta (BBA): Molecular Basis of Disease, 2015, 1852(5): 1059-1067. DOI:10.1016/j.bbadis.2015.02.009 |
| [21] |
Wu Y H, Zhao T C, Jia Z F, et al. Polymorphism of the programmed death-ligand 1 gene is associated with its protein expression and prognosis in gastric cancer[J]. Journal of Gastroenterology and Hepatology, 2019, 34(7): 1201-1207. DOI:10.1111/jgh.14520 |
| [22] |
Zhang L N, Liu Y X, Song F J, et al. Functional SNP in the microRNA-367 binding site in the 3'UTR of the calcium channel ryanodine receptor gene 3(RYR3) affects breast cancer risk and calcification[J]. Proc Natl Acad Sci USA, 2011, 108(33): 13653-13658. DOI:10.1073/pnas.1103360108 |
| [23] |
Liu R Z, Deng D D, Liu X D, et al. A miR-18a binding-site polymorphism in CDC423'UTR affects CDC42 mRNA expression in placentas and is associated with litter size in pigs[J]. Mammalian Genome, 2019, 30(1/2): 34-41. DOI:10.1007/s00335-018-9788-x |




