文章信息
- 高琛, 韩萍萍, 王彬彬, 张倩, 范丽娟, 王欢, 蒲广, 刘航, 张总平, 牛培培, 周娟, 黄瑞华, 李平华
- GAO Chen, HAN Pingping, WANG Binbin, ZHANG Qian, FAN Lijuan, WANG Huan, PU Guang, LIU Hang, ZHANG Zongping, NIU Peiei, ZHOU Juan, HUANG Ruihua, LI Pinghua
- 苏淮猪肉滴水损失相关候选基因突变位点的鉴别
- Identification of candidate genes and variants related to muscle drip loss in Suhuai pig
- 南京农业大学学报, 2021, 44(2): 338-345
- Journal of Nanjing Agricultural University, 2021, 44(2): 338-345.
- http://dx.doi.org/10.7685/jnau.202001043
-
文章历史
- 收稿日期: 2020-01-29
2. 南京农业大学淮安研究院, 江苏 淮安 223002;
3. 淮安市淮阴新淮种猪场, 江苏 淮安 223002;
4. 江苏省现代农业(生猪)产业技术体系集成创新中心, 江苏 南京 210095;
5. 淮安市南农大新农村发展研究有限公司, 江苏 淮安 223002
2. Huai'an Academy of Nanjing Agricultural University, Huai'an 223002, China;
3. Huaiyin Pig Breeding Farm of Huai'an City, Huai'an 223002, China;
4. Industrial Technology System Integration Innovation Center of Jiangsu Modern Agriculture(PIG), Nanjing 210095, China;
5. Nanjing Agricultural University's New Rural Research and Development Corporation of Huai'an City, Huai'an 223002, China
肌肉滴水损失是评价猪肉品质优劣的重要指标之一, 较高的滴水损失会严重降低猪肉的营养价值, Savage等[1]研究指出猪肉中每损失1 mL的液体会有大约112 mg蛋白随之流失。除此之外, 肌肉滴水损失也是重要的商业经济指标。滴水损失过高导致肉质变差、货架期缩短, 直接影响屠宰场的经济效益。我国是猪肉生产和消费大国, 然而我国冷鲜肉的汁液流失率平均比欧美发达国家高1%~2%[2], 每年因猪肉滴水损失造成的经济损失高达数亿元人民币。如何改善猪肉品质, 降低肌肉的滴水损失是生猪养殖和屠宰加工行业期望实现的重要目标, 也是保证肉品加工业经济利益的理论基础。苏淮猪是由淮猪和大白猪杂交培育而成的新品种, 其含有25%优良肉质的淮猪血缘和75%肉质相对较差的大白猪血缘[3], 因此其群体内在猪肉的滴水损失上可能存在分离, 但是目前关于苏淮猪群体肌肉滴水损失的研究报道相对较少。
随着基因组技术的发展, 已有涉及猪的近700个不同性状的29 685个数量性状基因座(quantitative trait loci, QTL)被成功定位, 其中与猪肉滴水损失性状相关的QTL有1 087个, 与猪肉系水力(water holding capacity, WHC)相关的QTL有28个(PigQTLdb, https://www.animalgenome.org/cgi-bin/QTLdb/SS/index)。研究发现含有SAP结构域(由33个氨基酸残基形成的保守模板)的肌肉增强因子2激活基因(myocyte enhancer factor-2 activating motif and SAP domain containing transcriptional regulator, MAMSTR)、抵抗素基因(resistin, RETN)、兰尼定受体基因(ryanodine receptor1, RYR1)、磷酸化酶激酶γ1基因(phosphorylase kinase gamma1, PHKG1)和一磷酸腺苷激活蛋白激酶γ3亚基基因(protein kinase AMP-activated non-catalytic subunit gamma3, PRKAG3)是影响滴水损失的候选基因[4-5]。韩雪蕾[6]在通城猪试验群体中发现MAMSTR基因的第4外显子上rs337473375位点处存在C>T突变, 该突变位点的多态性与猪肉滴水损失和WHC呈显著关联, 其中, CC型个体的滴水损失和WHC显著高于TT型个体。RYR1基因又称为钙离子释放通道基因或氟烷基因(HAL), 该基因编码区的突变(g.1843C>T)已被证实可引起猪应激综合征(porcine stress syndrome, PSS), 加快水分丢失, 导致PSE肉的产生[7]。Ma等[8]在杜洛克及其杂交群体中发现PHKG1基因可以影响肌肉糖原含量和糖酵解潜能可转化为乳酸化合物的量(glycolytic potential, GP), 并在其第9个内含子中发现1个突变(g.8283C>A), 该突变能够降低磷酸化酶激酶的活性, 导致糖酵解电位增加, 加快pH值下降, 从而增加肌肉中的滴水损失。Milan等[9]在汉普夏猪群体中发现PRKAG基因(也即RN基因)p.Arg200Gln突变在RN动物中会显著增加肌糖原含量, 且相比于野生型动物, RN动物表现出更高的滴水损失。除了在汉普夏猪群体中发现了PRKAG基因的p.Arg200Gln位点突变外, 在大白猪等其他品种猪的PRKAG3中还发现了新的等位基因, 如p.Ile199Val, 且该位点已被证实与猪肉的滴水损失有关[10]。RETN基因是Steppan等[11]发现的一种促进胰岛素抵抗的蛋白信号分子, 它能削弱胰岛素对细胞的刺激从而引起机体糖耐受量的降低。Otieno等[12]在巴克夏与大白猪杂交后代群体猪中发现RETN基因rs327132149位点与WHC、pH值等显著相关。尽管已鉴定出较多与滴水损失相关的主效功能位点和候选功能位点, 但研究结果存在一定的群体特异性, 且目前尚未见影响苏淮猪肉滴水损失的候选基因或QTL的报道。
为鉴别影响苏淮猪肌肉滴水损失的关键基因位点, 本研究选择了RYR1基因g.1843C>T位点、PHKG1基因g.8283C>A位点、PRKAG3基因的p.Arg200Gln位点和p.Ile199Val位点等4个已知的影响猪肉滴水损失的主效基因位点和MAMSTR基因rs37473375位点、RETN基因rs327132149位点等2个已知的与猪肉滴水损失相关的候选基因位点作为影响苏淮猪肉滴水损失的候选基因位点, 分析这6个位点在301头纯种苏淮猪中的多态性及其与肌肉滴水损失的关联性, 为寻找与苏淮猪肉滴水损失相关的分子标记奠定基础, 为苏淮猪肉品质的改善提供理论依据。
1 材料与方法 1.1 试验动物本试验在江苏省淮安市淮阴种猪场内筛选了301头日龄相近(平均219.1 d)、相同饲养管理和营养条件下的健康育肥苏淮猪, 其中236头阉公猪、65头母猪。待这些猪饲养达到上市体重(80~90)kg后, 分3个批次运输至淮安市金源肉品加工中心, 静置12 h后, 按现代化屠宰工艺进行电麻致晕后屠宰。
1.2 试验方法 1.2.1 样品采集试验苏淮猪经电麻、颈部放血处死后, 立即剪取猪只右耳耳样组织, 放入盛有1.5 mL体积分数为75%乙醇的2 mL离心管中, 注明耳号, -20 ℃保存; 随后烫毛, 去头、尾、蹄和内脏(保留板油和肾脏), 称量每个个体的胴体重; 采集左半胴体胸腰椎结合处背最长肌肌肉样品约200 g, 注明耳号, 置于含有冰袋的泡沫箱内带回实验室, 用于肌肉滴水损失的测定。
1.2.2 滴水损失表型测定参考中华人民共和国农业农村部标准《猪肌肉品质测定技术规范: NY/T 821—2004》, 采用袋测定法测定背最长肌滴水损失。具体试验步骤如下: 顺着肌纤维走向取一块长约5 cm、宽约3 cm、厚约2 cm的背最长肌样品, 除去样品表面肌膜; 用分析天平称量样品的质量(W1)并编号记录; 用干净的细铁丝勾住样品的一端使样品垂直悬吊于自封袋内, 向袋内充入气体(肉样不得与塑料袋接触), 扎紧口袋后吊挂置于4 ℃冰箱; 24 h后, 取出样品, 用吸水纸吸干样品表面的水分, 称量并记录挂后质量(W2)。滴水损失计算公式:
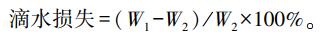
|
采用天根生物科技有限公司的基因组DNA提取试剂盒提取苏淮猪耳组织的DNA, 并用15 g·L-1的琼脂糖凝胶电泳法检测DNA的质量。利用NanoDrop 2000分光光度计测定DNA原液的浓度。取DNA原液20 μL于1.5 mL离心管中, 加入适量的超纯水将原液稀释到50 ng·μL-1, 3 000 r·min-1离心后放入-20 ℃冰箱备用。
1.2.4 PCR扩增利用Primer Premier 5.0软件设计引物, 引物由南京擎科生物有限公司合成。引物序列见表 1。PCR反应体系(25 μL): 1.1×T3 Super PCR Mix 22 μL, 模板DNA 1 μL, 上、下游引物各1 μL。PCR扩增程序: 98 ℃预变性2 min; 98 ℃变性10 s, 56~65 ℃退火10 s, 72 ℃延伸10 s, 共35个循环; 最后72 ℃延伸2 min, 4 ℃保存。
| 基因Gene | 单核苷酸多态位点SNP | 引物对序列Primer pairs sequences (5′→3′) |
| MAMSTR | rs337473375 | AGGAGATTCAGAATTCGGGT/GGGTTGCAGGGTTAGATTT |
| RETN | rs327132149 | GGGAGGGGTAGCTTGGTCTCAG/GGCAGGGACTTGTGGTCCTAGA |
| RYR1 | g.1843C>T | TGTTCCCTGTGTGTGTGCAATG/TTCACCGGAGTGGAGTCTCTGA |
| PHKG1 | g.8283C>A | ATCCCTGTGCTTGCTGGTG/CCCGGCGGTACTGGTAAT |
| PRKAG3 | p.Arg200Gln p.Ile199Val |
AAATGTGCAGACAAGGATCT/CACAGCTCTCCTACAGTTG |
| 注: SNP: Single nucleotide polymorphisms; MAMSTR: 含有SAP结构域的肌肉增强因子2激活基因Myocyte enhancer factor-2 activating motif and SAP domain containing transcriptional regulator gene; RETN: 抵抗素基因Resistin gene; RYR1: 兰尼定受体基因Ryanodine receptor 1 gene; PHKG1: 磷酸化酶激酶γ1基因Phosphorylase kinase gamma 1 gene; PRKAG3: 一磷酸腺苷激活蛋白激酶γ3亚基基因Protein kinase AMP-activated non-catalytic subunit gamma 3 gene. 下同。The same as follows. | ||
利用Excel 2007整理每个个体的耳号、年龄、屠宰日龄、性别、屠宰批次、胴体重、滴水损失值以及系谱等信息, 计算滴水损失的平均值、标准误和变异系数, 并用卡方检验来确定苏淮猪群体在MAMSTR基因rs337473375位点、RETN基因rs327132149位点、RYR1基因g.1843C>T位点、PHKG1基因g.8283C>A位点和PRKAG3基因p.Ile199Val位点处是否符合哈代-温伯格平衡。利用SAS 9.2软件中一般线性模型(GLM)计算性别在滴水损失中的效应值。
利用DNAMAN 9.0软件对测序结果进行统计。采用SAS 9.2软件中的混合线性模型分析各基因型与滴水损失之间的关联性, 然后采用Bonferroni方法进行多重比较和校正。由于发现性别、批次、日龄与猪肉滴水损失显著关联, 计算中以性别和批次作为固定效应, 日龄作为协变量, 计算模型如下:
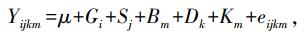
|
式中: Yijkm表示肌肉滴水损失测量值; μ为群体均值; Gi为第i个SNP的基因型固定效应; Sj为性别j的固定效应; Bm为批次m的固定效应; Dk是屠宰日龄为k的协变量; Km是基于系谱关系的多基因随机效应; eijkm代表随机残差效应。
2 结果与分析 2.1 苏淮猪试验群体肌肉滴水损失统计及性别的影响如表 2所示: 本试验共统计了236头阉公猪、65头母猪, 其肌肉滴水损失分别为1.97%和1.29%, 变异系数分别是65.85%和65.82%;母猪群体滴水损失平均为1.29%, 变异系数61.66%。整个试验群体中, 苏淮猪肌肉滴水损失平均为1.83%, 群体变异系数67.88%, 群体内滴水损失性状存在较大的差异。用SAS 9.2软件中GLM分析发现, 性别对肌肉滴水损失有极显著影响(P < 0.01), 性别可解释肌肉滴水损失6.48%的变异。母猪肌肉滴水损失极显著低于阉公猪(P < 0.01)。
| 性别Gender | 样本数Number | 滴水损失/%Drip loss | 最大值/% Maximum | 最小值/% Minimum | 变异系数/% CV |
| 阉公猪Barrows | 236 | 1.97±0.08** | 5.95 | 0.20 | 65.82 |
| 母猪Gilts | 65 | 1.29±0.10 | 3.98 | 0.41 | 61.66 |
| 总计Total | 301 | 1.83±0.07 | 5.95 | 0.20 | 67.88 |
| Note: **P < 0.01. | |||||
苏淮猪MAMSTR基因rs337473375位点、RETN基因rs327132149位点、RYR1基因g.1843C>T位点、PHKG1基因g.8283C>A位点和PRKAG3基因p.Arg200Gln、p.Ile199Val位点多态性分布结果如表 3所示。
| 基因位点 Gene loci |
基因型频率(n) Genotype frequency |
基因频率 Allele frequency |
P值 P-value |
基因位点 Gene loci |
基因型频率(n) Genotype frequency |
基因频率 Allele frequency |
P值 P-value |
|||||||||
| CC | CT | TT | C | T | GG | GA | AA | G | A | |||||||
| rs327132149 (RETN) |
0 | 0.063(19) | 0.937(281) | 0.032 | 0.968 | 0.852 | ||||||||||
| rs337473375 (MAMSTR) |
0.409(123) | 0.505(152) | 0.086(26) | 0.661 | 0.339 | 0.088 | ||||||||||
| rs697732005 (PHKG1) |
0.120(36) | 0.289(87) | 0.591(178) | 0.264 | 0.736 | 0 | ||||||||||
| g.1843C>T (RYR1) |
0.933(280) | 0.067(20) | 0 | 0.967 | 0.033 | 0.837 | ||||||||||
| p.Ile199Val (PRKAG3) |
0.704(212) | 0.259(78) | 0.037(11) | 0.834 | 0.166 | 0.533 | ||||||||||
| 注: 括号中的数字表示样本个体数。 Note: The number in parentheses indicates the number of individuals samples. | ||||||||||||||||
由表 3可见: 在该群体中MAMSTR基因rs337473375位点C、T等位基因频率分别为0.661和0.339, CT型个体最多, 其次是CC型, TT型个体最少; RETN基因rs327132149位点G、A等位基因频率分别为0.032和0.968;RYR1基因g.1843C>T位点C、T等位基因的基因频率分别是0.967和0.033, C等位基因占主导, CC基因型最多, 其次是CT型。在苏淮猪群体中未发现PHKG1基因g.8283C>A位点遗传多态性, 但我们在该位点前一个碱基处发现新的突变rs697732005(A>G)位点, 该位点G、A等位基因频率分别为0.264和0.736;未检测到PRKAG3基因p.Arg200Gln位点处的多态性, 但该基因p.Ile199Val位点有多态性, G、A等位基因频率分别为0.834和0.166。卡方检验发现PHKG1基因rs697732005位点显著偏离哈代-温伯格平衡, 而MAMSTR基因rs337473375位点、RETN基因rs327132149位点、RYR1基因g.1843C>T位点和PRKAG3基因p.Ile199Val位点均符合哈代-温伯格平衡。
2.3 苏淮猪候选基因SNP位点与滴水损失的关联性分析如表 4所示: 关联性分析和差异显著性多重比较结果表明, MAMSTR基因rs337473375位点基因型与猪肉滴水损失极显著关联(P < 0.01), CT型和CC型个体的滴水损失分别极显著和显著的低于TT型个体(P < 0.01, P < 0.05);RYR1基因g.1843C>T位点和PHKG1基因rs697732005位点基因型与猪肉滴水损失显著关联(P < 0.05), RYR1基因的CC型个体滴水损失显著低于CT型个体(P < 0.05), 而PHKG1基因的GG型个体的滴水损失显著低于AG型个体(P < 0.05)。PRKAG3基因p.Ile199Val位点基因型与猪肉滴水损失之间有显著关联的趋势(P=0.070), 而RETN基因rs327132149位点基因型与猪肉滴水损失之间没有表现出显著关联性。
| 基因位点 Gene loci |
基因型 Genotype |
个体 Number |
滴水损失/% Drip loss |
P值 P-value |
基因位点 Gene loci |
基因型 Genotype |
个体 Number |
滴水损失/% Drip loss |
P值 P-value |
|
| MAMSTR rs337473375 |
CC | 123 | 2.56±0.13ABb | 0.001 | PHKG1 rs697732005 |
AA | 178 | 2.31±0.10ab | 0.034 | |
| CT | 152 | 2.37±0.12Bb | AG | 87 | 2.58±0.12a | |||||
| TT | 26 | 3.03±0.19Aa | GG | 36 | 2.14±0.17b | |||||
| RETN rs327132149 |
GA | 19 | 2.64±0.22 | 0.528 | PRKAG3 p.Ile199Val |
GG | 212 | 2.85±0.16 | 0.070 | |
| AA | 281 | 2.51±0.12 | GA | 78 | 2.50±0.19 | |||||
| RYR1 g.1843C>T |
CC | 280 | 2.49±0.12b | 0.036 | AA | 11 | 2.43±0.39 | |||
| CT | 20 | 2.91±0.22a | ||||||||
| 注: 不同小写字母代表差异显著(P < 0.05), 不同大写字母代表差异极显著(P < 0.01)。 Note: Different lowercase letters mean significant difference(P < 0.05), and different uppercase letters mean extremely significant difference(P < 0.01). | ||||||||||
滴水损失是肌肉纤维结构、蛋白理化性质变化的外在体现, 不同品种间肌肉滴水损失差异较大, 且西方瘦肉型猪种滴水损失通常大于地方猪种。李华[13]研究发现, 莱芜猪、鲁莱黑猪和大白猪肌肉的滴水损失分别为0.69%、1.81%和2.87%, 品种间差异极显著。刘顺德[14]报道, 梅山猪、宁夏黑猪、长白猪、大白猪的滴水损失分别为1.27%、1.96%、2.87%和2.62%, 长梅、大梅、长宁和大宁杂交猪的滴水损失分别为2.61%、2.55%、2.71%和2.64%, 品种间差异显著。莱芜猪、梅山猪和宁夏黑猪均属于我国地方猪种, 其肌肉滴水损失都在2%以下, 而长白猪、大白猪是西方引进的瘦肉型猪种, 其滴水损失均大于2%。鲁莱黑猪、长梅猪、大梅猪、长宁猪以及大宁猪都属于中国地方猪与西方猪的杂交品种, 其肌肉滴水损失均介于各自的亲本之间且更接近于父本。苏淮猪是由淮猪和大白猪杂交培育而来的新品种, 在本试验群体中, 苏淮猪肌肉滴水损失平均1.83%, 接近大白猪的滴水损失2.28%[15], 这与李华[13]和刘顺德[14]的研究结果基本一致。有研究表明, 遗传因素可以解释系水力等指标20%左右的变异[16]。本试验群体中, 苏淮猪滴水损失变异系数高达67.88%, 说明该群体在滴水损失性状上不是很稳定, 这可能与控制该性状的基因的分离有关, 后期还需加强选育。由此可见, 通过遗传选择降低苏淮猪肌肉滴水损失具有一定的理论基础。
3.2 性别与滴水损失的相关性及影响本试验结果显示母猪的滴水损失极显著低于阉割公猪。而杨杰等[17]测定了莱芜猪和杜长大三元杂交猪的肌肉滴水损失, 在性别之间未发现显著差异; 张宏博[18]也发现性别对商品猪肉滴水损失的影响不显著。这种差异可能是由于滴水损失的测定方法不同造成的。前者用的是EZ-管测定法, 而后者使用保鲜膜包装, 于2 ℃环境中放置了5 d后再进行测定; 而本试验采用的是袋测定法, 在4 ℃环境中悬挂24 h后测定。Jeon等[19]报道, 性别对肌纤维的生长发育有较大影响。因此, 我们推测造成本试验公母猪之间滴水损失显著差异的原因可能是性别影响了肌纤维的类型, 从而影响了猪屠宰后糖酵解的速率, 最终导致猪肉pH值不同所致。
3.3 苏淮猪候选基因遗传多态性及其与滴水损失性状的关联性分析MAMSTR基因只在骨骼肌中特异性表达, 它可以激活生肌调节因子基因(myogenic regulatory factors, MRF)和成肌细胞决定基因1(myogenic differentiation1, MYOD1)从而提高骨骼肌基因的表达量[20-21]。韩雪蕾[6]研究发现, MAMSTR基因第4外显子上rs337473375位点处存在C>T突变, 这一突变能够使第156位氨基酸由丝氨酸转变为脯氨酸, 从而造成相应蛋白质结构功能的改变。同时, 他们在通城猪试验群体中发现该突变位点的多态性与猪肉滴水损失和WHC有着显著关联性, CC型个体的滴水损失和WHC显著高于TT型个体[6]。在本试验中, 基因MAMSTR的rs337473375位点多态性与猪肉滴水损失极显著关联, CC型个体滴水损失显著低于TT型个体。这与韩雪蕾[6]的研究正好相反。这种现象很可能是该位点不是影响滴水损失的因果突变位点, 仅仅是与影响滴水损失的因果突变位点连锁的位点, 或在通城猪和苏淮猪中存在不同的连锁相。
RYR1基因又称为钙离子释放通道基因或氟烷基因, 是造成PSS的一个主效基因[22]。朱砺等[23]在新荣昌猪群体中发现RYR1基因1 843处(g.1843C>T)的C>T突变能影响新荣昌猪胴体及肉品质, 且TT型个体的失水率显著高于CC型和CT型个体。我们在苏淮猪群体中也发现了该突变且该突变显著影响了苏淮猪肉的滴水损失, CC型个体猪肉滴水损失显著低于CT型个体, CC型为优势基因型。在苏淮猪试验群体中C等位基因频率达到0.967, 而T等位基因频率只有0.033, 这很有可能是因为RYR1基因能够影响应激等经济性状。育种人员在对苏淮猪的选育过程中通过表型间接对该基因进行了强烈的选择; 当然也有可能是因为苏淮猪育成的祖代个体的T等位基因频率比较低。但是考虑到群体中仍然存在不利T等位基因, 需要继续利用分子标记辅助手段来对苏淮猪群体进一步选择, 以准确快速淘汰不利T等位基因。
PHKG1基因是影响机体糖代谢的一个关键基因[24]。王圆圆等[25]发现PHKG1基因的表达具有组织特异性, 在背最长肌中的表达量最高。MA等[8]通过测序发现PHKG1基因9号内含子的剪接受体位点处(g.8283)存在一个C>A突变, 该突变能造成下游开放阅读框中32 bp碱基片段的缺失, 并导致终止密码子的提前出现。该位点的突变能够增加肌肉43%的糖酵解潜力, 至少降低肌肉20%的WHC; 他们还在苏太猪群体中发现该突变位点AA基因型个体的滴水损失、pH下降速率以及肉色的a*值和b*值都极显著高于CC型个体[8]。遗憾的是在苏淮猪群体中g.8283处并未发现C>A突变, 但在该位点前一个碱基(rs697732005)处却发现了A>G突变, 这很有可能是由于品种差异造成的, 暗示g.8283影响猪滴水损失存在群体异质性。本试验结果显示, 苏淮猪群体PHKG1基因的rs697732005位点A>G突变与苏淮猪肉滴水损失显著关联, 且GG型和AA型个体的滴水损失显著低于AG型个体, 而GG型与AA型个体间差异不显著, 这与传统加性效应的规律不相符, 暗示PHKG1基因的rs697732005位点可能不是影响滴水损失的因果突变位点, 仅仅是与影响滴水损失的因果突变位点连锁的位点。有待进一步挖掘PHKG1基因上与滴水损失相关的关键因果位点。卡方检验结果发现PHKG1基因的rs697732005位点在苏淮猪群体中极显著偏离哈代-温伯格平衡, 说明在历史选育的过程中该位点可能经历了定向选择, 也有可能是现有群体量偏小造成的。
PRKAG3基因是造成酸肉效应的主效基因[26]。Milan等[9]在汉普夏猪中发现PRKAG3基因的遗传密码子发生p.Arg200Gln突变后, 可导致肌肉糖原含量增加70%, 最终降低猪肉WHC(高滴水损失)。Ryan等[27]报道, PRKAG3的p.Arg200Gln和p.Ile199Val突变能降低猪胴体终末pH值, 增加猪肉的滴水损失。Barnes等[28]在小鼠上研究表明p.Ile199Val突变能够降低PRKAG3基因的表达量, 而李梦云等[29]研究发现PRKAG3基因表达量与猪肉滴水损失呈正相关。由此可见, PRKAG3基因对猪肉品质的影响是十分复杂的。本试验扩增了苏淮猪群体包括第199和200密码子在内的DNA片段, 通过测序发现苏淮猪群体中不存在p.Arg200Gln突变, 而含有p.Ile199Val突变, 这与Milan等[9]研究发现p.Arg200Gln突变仅存在于汉普夏猪种中是一致的。本试验结果显示, PRKAG3基因p.Ile199Val位点多态性与苏淮猪肉滴水损失有显著关联的趋势, 还有待进一步增加群体验证。
在以前的报道中, 对RETN基因的研究主要集中在脂肪沉积方面[30], 本研究显示该基因的rs327132149位点突变与猪肉滴水损失没有显著关联, 这与前人报道的基本一致[31], 进一步说明该位点的突变可能不会影响猪肉的滴水损失。
苏淮猪群体内肌肉滴水损失变异较大, 具有较大的选育改善空间。苏淮母猪肌肉滴水损失极显著低于阉公猪。MAMSTR基因rs337473375位点、RYR1基因g.1843C>T位点和PHKG1基因rs697732005位点是影响苏淮猪肉滴水损失的候选基因重要突变位点, 可以作为降低苏淮猪肉滴水损失的潜在分子标记。
| [1] |
Savage A W J, Warriss P D, Jolley P D. The amount and composition of the proteins in drip from stored pig meat[J]. Meat Science, 1990, 27(4): 289-303. DOI:10.1016/0309-1740(90)90067-G |
| [2] |
魏秀丽. 宰后Calpain介导的猪肉水分迁移机制研究[D]. 北京: 中国农业科学院, 2016. Wei X L. Study on mechanism of Calpain-mediated water mobility and distribution in postmortem porcine muscle[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016(in Chinese with English abstract). |
| [3] |
Wang B, Li P, Zhou W, et al. Association of twelve candidate gene polymorphisms with the intramuscular fat content and average backfat thickness of Chinese suhuai pigs[J]. Animals, 2019, 9(11): 858. DOI:10.3390/ani9110858 |
| [4] |
Li B, Liu K, Weng Q, et al. RNA-seq analysis reveals new candidate genes for drip loss in a Pietrain×Duroc×Landrace×Yorkshire population[J]. Animal Genetics, 2016, 47(2): 192-199. DOI:10.1111/age.12401 |
| [5] |
周利华, 郭源梅, 段艳宇, 等. 在白色杜洛克×二花脸资源家系中定位影响猪肉滴水损失的QTL[J]. 中国农业科学, 2011, 44(10): 2131-2138. Zhou L H, Guo Y M, Duan Y Y, et al. QTL mapping for drip loss in a white duroc×Erhualian F2 resource population[J]. Scientia Agricultura Sinica, 2011, 44(10): 2131-2138 (in Chinese with English abstract). |
| [6] |
韩雪蕾. 猪生长速度、背膘厚和肉质性状多个相关候选基因的效应分析及两个新候选基因的分离与功能研究[D]. 武汉: 华中农业大学, 2011. Han X L. Effect analysis of candidate genes related to growth rate, backfat thickness, meat quality and isolation, function of two novel candidate genes in pigs[D]. Wuhan: Huazhong Agricultural University, 2011(in Chinese with English abstract). |
| [7] |
Popovski Z T, Tanaskovska B, Miskoska-Milevska E, et al. Associations of biochemical changes and maternal traits with mutation 1843(C>T) in the RYR1 gene as a common cause for porcine stress syndrome[J]. Balkan Journal of Medical Genetics, 2016, 19(2): 75-80. DOI:10.1515/bjmg-2016-0039 |
| [8] |
Ma J W, Yang J, Zhou L S, et al. A splice mutation in the PHKG1 gene causes high glycogen content and low meat quality in pig skeletal muscle[J]. PLoS Genetics, 2014, 10(10): e1004710. DOI:10.1371/journal.pgen.1004710 |
| [9] |
Milan D, Jeon J T, Looft C, et al. A mutation in PRKAG3 associated with excess glycogen content in pig skeletal muscle[J]. Science, 2000, 288(5469): 1248-1251. DOI:10.1126/science.288.5469.1248 |
| [10] |
Ciobanu D, Bastiaansen J, Malek M, et al. Evidence for new alleles in the protein kinase adenosine monophosphate-activated gamma (3) -subunit gene associated with low glycogen content in pig skeletal muscle and improved meat quality[J]. Genetics, 2001, 159(3): 1151-1162. |
| [11] |
Steppan C M, Bailey S T, Bhat S, et al. The hormone resistin links obesity to diabetes[J]. Nature, 2001, 409(6818): 307-312. DOI:10.1038/35053000 |
| [12] |
Otieno C J, Bastiaansen J, Ramos A M, et al. Mapping and association studies of diabetes related genes in the pig[J]. Animal Genetics, 2005, 36(1): 36-42. DOI:10.1111/j.1365-2052.2004.01217.x |
| [13] |
李华. 莱芜猪和鲁莱黑猪肌肉抗氧化性能及肉质特性的研究[D]. 泰安: 山东农业大学, 2009. Li H. Study on antioxidant properties of muscle and meat quality for Laiwu and Lulai black pigs[D]. Tai'an: Shandong Agricultural University, 2009(in Chinese with English abstract). |
| [14] |
刘顺德. 宁夏黑猪背最长肌常规营养成分含量、组织学特性和肉质特性研究[D]. 兰州: 甘肃农业大学, 2006. Liu S D. Study on basic nutrition composition contents, histology characteristics and meat quality characteristics of longissimus muscle for Ningxia black swine[D]. Lanzhou: Gansu Agricultural University, 2006(in Chinese with English abstract). |
| [15] |
徐春瑛, 刘智, 傅颖滢, 等. 猪整联蛋白α9基因c.158+1731C>T突变与猪肉滴水损失性状相关性分析[J]. 南京农业大学学报, 2014, 37(3): 133-137. Xu C Y, Liu Z, Fu Y Y, et al. Identification of c.158+1731C>T mutation in ITGA-9 gene and its relationship with drip loss in pigs[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 133-137 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2014.03.020 |
| [16] |
Warner R D, Greenwood P L, Pethick D W, et al. Genetic and environmental effects on meat quality[J]. Meat Science, 2010, 86(1): 171-183. DOI:10.1016/j.meatsci.2010.04.042 |
| [17] |
杨杰, 周李生, 刘先先, 等. 莱芜猪与杜长大三元杂交猪肉质性状种质资源比较研究[J]. 畜牧兽医学报, 2014, 45(11): 1752-1759. Yang J, Zhou L S, Liu X X, et al. A comparative study of meat quality traits between Laiwu and DLY pigs[J]. Chinese Journal of Animal and Veterinary Sciences, 2014, 45(11): 1752-1759 (in Chinese with English abstract). DOI:10.11843/j.issn.0366-6964.2014.11.003 |
| [18] |
张宏博. 宰前因素和宰后处理对商品猪生长发育、屠宰及胴体质量和猪肉品质影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2015. Zhang H B. Effects of pre- and post-morten factors on growth performance, slaughter and carcass characteristics and meat quality of pig[D]. Hohhot: Inner Mongolia Agricultural University, 2015(in Chinese with English abstract). |
| [19] |
Jeon Y, Choi J, Kim H J, et al. Sex- and fiber-type-related contractile properties in human single muscle fiber[J]. Journal of Exercise Rehabilitation, 2019, 15(4): 537-545. DOI:10.12965/jer.1938336.168 |
| [20] |
Liu Y, Liu Y, Ma T, et al. A splicing mutation in PHKG1 decreased its expression in skeletal muscle and caused PSE meat in Duroc×Luchuan crossbred pigs[J]. Animal Genetics, 2019, 50(4): 395-398. DOI:10.1111/age.12807 |
| [21] |
Meadows S M, Warkman A S, Salanga M C, et al. The myocardin-related transcription factor, MASTR, cooperates with MyoD to activate skeletal muscle gene expression[J]. Proc Natl Acad Sci USA, 2008, 105(5): 1545-1550. DOI:10.1073/pnas.0703918105 |
| [22] |
Bates R O, Doumit M E, Raney N E, et al. Association of halothane sensitivity with growth and meat quality in pigs[J]. Animal, 2012, 6(9): 1537-1542. DOI:10.1017/S1751731112000134 |
| [23] |
朱砺, 李学伟, 帅素蓉. 兰尼定受体基因在新荣昌猪中的分布及其对胴体和肉质性状的效应分析[J]. 中国畜牧杂志, 2005, 41(4): 14-16. Zhu L, Li X W, Shuai S R. Distribution of RYR1 gene and its effect on carcass and meat traits in new Rongchang pig[J]. Chinese Journal of Animal Science, 2005, 41(4): 14-16 (in Chinese with English abstract). DOI:10.3969/j.issn.0258-7033.2005.04.006 |
| [24] |
Zappaterra M, Sami D, Davoli R. Association between the splice mutation g.8283C>A of the PHKG1 gene and meat quality traits in Large White pigs[J]. Meat Science, 2019, 148: 38-40. DOI:10.1016/j.meatsci.2018.10.003 |
| [25] |
王圆圆, 许厚强, 陈伟, 等. 从江香猪PHKG1和PHKG2基因克隆及其mRNA在组织中表达水平[J]. 农业生物技术学报, 2017, 25(10): 1643-1652. Wang Y Y, Xu H Q, Chen W, et al. Cloning of PHKG1 and PHKG2 genes in Congjiang pigs (Sus scrofa) and their m RNA expression in tissues[J]. Journal of Agricultural Biotechnology, 2017, 25(10): 1643-1652 (in Chinese with English abstract). |
| [26] |
Otto G, Roehe R, Looft H, et al. Associations of DNA markers with meat quality traits in pigs with emphasis on drip loss[J]. Meat Science, 2007, 75(2): 185-195. DOI:10.1016/j.meatsci.2006.03.022 |
| [27] |
Ryan M T, Hamill R M, O'Halloran A M, et al. SNP variation in the promoter of the PRKAG3 gene and association with meat quality traits in pig[J]. BMC Genetics, 2012, 13(1): 66. DOI:10.1186/1471-2156-13-66 |
| [28] |
Barnes B R, Marklund S, Steiler T L, et al. The 5'-AMP-activated protein kinase gamma3 isoform has a key role in carbohydrate and lipid metabolism in glycolytic skeletal muscle[J]. The Journal of Biological Chemistry, 2004, 279(37): 38441-38447. DOI:10.1074/jbc.M405533200 |
| [29] |
李梦云, 郑萍, 李婉涛, 等. PRKAG3基因在不同品种猪不同生长阶段骨骼肌中的表达差异及其表达量与肉质的关系[J]. 动物营养学报, 2017, 29(5): 1661-1669. Li M Y, Zheng P, Li W T, et al. The expression difference of PRKAG3 gene in skeletal muscle at different growth stages for different breeds of pigs and the relationship between PRKAG3 gene expression level and meat quality[J]. Chinese Journal of Animal Nutrition, 2017, 29(5): 1661-1669 (in Chinese with English abstract). |
| [30] |
Cieslak J, Nowacka-Woszuk J, Bartz M, et al. Association studies on the porcine RETN, UCP1, UCP3 and ADRB3 genes polymorphism with fatness traits[J]. Meat Science, 2009, 83(3): 551-554. DOI:10.1016/j.meatsci.2009.07.001 |
| [31] |
Cepica S, Ovilo C, Masopust M, et al. Four genes located on a SSC2 meat quality QTL region are associated with different meat quality traits in Landrace×Chinese-European crossbred population[J]. Animal Genetics, 2012, 43(3): 333-336. DOI:10.1111/j.1365-2052.2011.02252.x |




