文章信息
- 王宗秀, 戴霞, 叶珂祯, 陈熙, 张炜
- WANG Zongxiu, DAI Xia, YE Kezhen, CHEN Xi, ZHANG Wei
- 氧化石墨烯和多壁碳纳米管对莱茵衣藻光合产氢的影响
- Effects of graphene oxide and multi-wall carbon nanotubes on photosynthetic hydrogen production in Chlamydomonas reinhardtii
- 南京农业大学学报, 2021, 44(2): 278-286
- Journal of Nanjing Agricultural University, 2021, 44(2): 278-286.
- http://dx.doi.org/10.7685/jnau.202006040
-
文章历史
- 收稿日期: 2020-06-24
碳基纳米材料(carbon-based nanomaterials, CBN)具有比表面积大、强度及韧性高、光电性能优等特点, 在人工光合作用、生物传感器、生物成像、基因及药物载体等方面显示出巨大的应用潜力。尽管许多研究证明碳基纳米材料具有不同程度的生物毒性, 但均呈现明显的剂量效应, 而且对其进行表面功能化改性可以有效降低毒性, 提高生物相容度[1]。近年来, 植物与纳米材料的相互作用引起了人们的广泛关注。Liu等[2]证明单壁碳纳米管(SWCNT)可以穿透烟草悬浮细胞的细胞壁和质膜定位于细胞质; 用植物细胞内吞抑制剂(wortmannin)处理可以显著降低其在细胞质中的定位, 提示SWCNT可能是通过液相内吞机制进入细胞。Kwak等[3]利用壳聚糖-SWCNT复合物作为载体实现叶绿体遗传转化, 结果表明壳聚糖-SWCNT利用表面携带的高电荷穿过细胞壁、细胞膜和叶绿体被膜, 定位在叶绿体。目前的研究表明, CBN对植物生长的影响与其化学结构、大小、形状、浓度和表面积密切相关。例如, 带负电荷的多壁碳纳米管(MWCNT)比带正电荷的MWCNT能够更有效地促进种子萌发[4], 而较高浓度的MWCNT会产生毒性效应, 导致红苋菜根长减少[5]。氧化石墨烯(GO)对藻类的生物毒性则主要体现在遮光效应、氧化胁迫和机械损伤等方面[6]。Wang等[7]在可见光照射下研究了表面沉积有硫化镉纳米颗粒的大肠杆菌的产氢能力, 发现光催化硫化镉纳米颗粒激发的光电子与大肠杆菌产氢途径发生了相互作用, 胞内乳酸发酵受到抑制, 导致丙酮酸和甲酸浓度增加, NADH/NAD比例升高, 产氢酶活性提升, 进而导致产氢量显著增加。
作为生物制氢的优势藻种, 莱茵衣藻(Chlamydomonas reinhardtii)因其以乙酸盐为唯一碳源的非光合生长能力和在厌氧环境下的高氢化酶活性而受到人们的关注[8]。目前, 在莱茵衣藻体系中促进光合产氢主要在供氧水平和电子调节水平两个方面进行。在供氧水平上, 莱茵衣藻培养基中硫缺乏会影响光系统Ⅱ(PSⅡ)中D1蛋白的周转, 从而降低光合作用效率[9-10]。但与此同时, 缺硫并不影响衣藻的呼吸速率, 这样呼吸耗氧维持不变, 光合放氧逐渐下降, 从而导致细胞内逐渐形成厌氧环境, 厌氧条件有效诱导氢化酶表达, 进而增加产氢量。在缺硫培养的基础上, 其他微生物如日本慢生大豆根瘤菌和莱茵衣菌共培养可以提高产氢量[11]。在电子调节水平上, Tolleter等[12]自莱茵衣藻中分离了PGRL1蛋白缺失突变体, 该突变体中围绕光系统Ⅰ(PSⅠ)的环式电子流受到抑制, 导致更多电子流向氢化酶, 因此在缺氧条件下, 该突变体的产氢量大幅增加。此外人们还发现, Rubisco缺失导致CO2固定减少, 更多的电子流向氢化酶, 从而有效增加氢的产生[13]。Giraldo等[14]的研究已证明, SWCNT可定位于植物叶绿体并促进光合活性, 同时也提高最大电子传递速率。然而, CBN对藻类光合产氢是否具有同样的促进作用, 目前尚不清楚。
前期研究中我们分析了单链DNA修饰的SWCNT对莱茵衣藻光合产氢的影响, 初步证明ssDNA/SWCNT可有限提高光合产氢量[15]。本研究选择了3种具有良好水溶性的碳纳米管, 即ssDNA修饰的单壁碳纳米管(ssDNA/SWCNT)、羧基修饰的多壁碳纳米管(MWCNT)和氧化石墨烯(GO), 分别与衣藻细胞共培养, 分析3种不同类型CBN对莱茵衣藻生长和光合活性的影响, 阐明不同类型CBN影响莱茵衣藻光合产氢的机制, 为利用莱茵衣藻高效产氢提供新的方案。
1 材料与方法 1.1 试验材料SWCNT: 纯度95%, 外径×长度为(0.8~1.2)nm×(0.1~1.0)μm, 购自南京XFNANO材料科技有限公司。MWCNT: 纯度>95%, 外径×长度为(8~15)nm×50 μm, —COOH含量为2.56%。GO: 纯度>98%, 厚度为(0.55~1.20)nm, 尺寸为(0.5~3.0)μm, 层数 < 3, 购自成都有机化工有限公司。单链DNA聚(AT)15和ssDNA-HEX由通用生物系统公司(中国)合成。莱茵衣藻GY-D55购自上海光宇生物科技有限公司。其他化学物质均为分析纯。
1.2 碳基纳米材料(CBN)悬浮物的制备ssDNA/SWCNT的制备参照文献[16-18]。将1 mg SWCNT添加至1 mL ssDNA(MilliQ水溶解)溶液, 将所得溶液置于冰上并用超声波处理1 h, 然后以12 000 r·min-1离心30 min, 以去除独立SWCNT。然后溶液通过离心管(截留相对分子质量为1×105, Millipore)以4 500 r·min-1超滤15 min, 以去除未结合的游离ssDNA。在不添加任何分散剂的情况下, 在MilliQ水中分别制备浓度为1 mg·mL-1的MWCNT和GO悬浮液, 并在室温下超声处理30 min, 然后以12 000 r·min-1离心30 min, 去除上清液后将纳米材料重新悬浮。悬浮液在使用前均在紫外光下处理30 min以上。
1.3 CBN悬浮物的鉴定采用紫外-可见吸收光谱仪(BIOMATE 3S, Thermo Fisher Scientific, USA)测定200~800 nm SWCNT和ssDNA/SWCNT悬浮液的吸收波长。3种纳米材料悬浮液的形貌用装备CCD相机的透射电子显微镜(Hitachi H7650, Japan)观察。用拉曼光谱仪(InVia, Renishaw, England)测定3种材料悬浮液中碳结构缺陷程度。用Zetasizer纳米分析仪(Zetasizer Nano ZS90, Malvern panalytic, UK)表征3种材料悬浮液的电荷分布。
1.4 莱茵衣藻的培养莱茵衣藻GY-D55藻株在TAP(tris-acetate-phosphate, pH7.2)琼脂平板或液体培养基中进行光异养培养。培养物在恒温(25.0±0.5) ℃的光照培养箱中培养, 光/暗时间为14 h/10 h, 冷白色荧光强度约为60 μmol·m-2·s-1, 每6 d在液体培养基中继代培养1次。培养物每天摇动3次, 并在培养箱中仔细定位以尽量减少任何可能的光照和温度变化, 并确保最佳生长。固体培养基上的藻种每2周接种1次。制备缺硫TSP培养基(TAP-S)时硫酸盐化合物用氯化物替代。
1.5 莱茵衣藻与CBN共培养衣藻培养物在液体培养基中培养至指数后期离心收集, 用TAP培养基洗涤3次, 然后在新鲜TAP培养基中重悬至5×105 mL-1, 然后将3种纳米材料悬浮液与衣藻细胞分别混合, 以不添加纳米材料的细胞培养物为对照。所有培养物在(25.0±0.5) ℃、60 μmol·m-2·s-1光照下培养6 d, 3种纳米材料的悬浮液质量浓度分别设置为1、2、10、50或100 μg·mL-1。
1.6 CBN对莱菌衣藻生长的影响3种纳米材料分别与莱茵衣藻共培养不同时间后, 用95%乙醇提取衣藻细胞总叶绿素, 用分光光度法测定其含量。利用紫外可见分光光度计每隔24 h测定750 nm处的光密度(D), 同时在光镜下观察细胞聚集情况。所有试验均重复3次。
1.7 CBN在莱茵衣藻细胞中的分布为了研究CBN在C.reinhardtii细胞中的分布, 将罗丹明B(RhoB, 1 mg·mL-1, 0.3 mL)与CBN(0.1 mg·mL-1, 5 mL)在25 ℃的培养箱摇瓶中混合, 未结合的RhoB用蒸馏水透析48 h去除, 制备的混合物在4 ℃保存后使用。C.reinhardtii细胞与制备的混合物以终浓度为10 μg·mL-1孵育, 并使用激光共聚焦扫描显微镜(Confocal System-UitraView VOX, Perkin Elmer)在指数期进行观察。
1.8 叶绿素荧光和氢含量测定暗适应PSⅡ最大量子产率(Fv/Fm)和电子传输速率(ETR)采用脉冲调制成像PAM M系列荧光计(MAXI-version, Heinz Walz GmbH, Effeltrich, Germany)进行测量。测量前将细胞样本置于成像系统摄像机下进行30 min暗适应。测量光、光化光和饱和脉冲光强度分别为0.25、110和6 000 μmol·m-2·s-1。将3种CBN的悬浮液按终质量浓度10 μg·mL-1与莱茵衣藻共培养7 d, 使用叶绿素荧光法测定Fv/Fm和ETR。
衣藻细胞分别与3种10 μg·mL-1CBN在TAP培养基中培养, 并在指数晚期离心收集藻细胞, 用缺硫TAP-S培养基对细胞进行3次洗涤, 以保证彻底除硫。重悬后测定叶绿素含量, 将清洗后的细胞放入柱形玻璃瓶中并用气密隔膜密封, 在黑暗中培养24 h以诱导厌氧条件。从第2天起, 将密封瓶子放置在60 μmol·m-2·s-1的连续光照下, 利用注射器从瓶子顶部收集逸出的气体, 并注入带有热导检测器的气相色谱(GC7890, Techcomp)中检测H2浓度。以氩气作载气, 用外标法计算H2体积。所有测量均独立进行3次。
1.9 [Fe-Fe]氢化酶活性和光合放氧活性测定体内氢化酶活性测定采用文献[19-20]的方法。试验前测氢管充氩气1 min, 然后立即用橡皮塞密封以清除瓶中的氧气。在7、11和14 d分别测定相应样品细胞中的氢化酶活性。用注射器将5 mL培养物样品注入测氢管, 用蜡密封后在光照下摇动培养1 h, 然后用微注射器抽取瓶中0.5 mL气体, 用气相色谱法进行分析。根据测氢管中的总叶绿素含量计算产氢率。
用Clark氧电极(Lab-2, Hansatech, UK)在25 ℃下测量衣藻培养物中的放氧速率。从培养物中取2 mL细胞样本放置在氧电极室中, 添加0.5 mol·L-1 NaHCO3后, 在60 μmol·m-2·s-1的光照强度下照射5 min, 然后记录初始放氧水平用于计算光合速率。
1.10 统计分析采用Origin 8.5(Origin Lab, USA)和SPSS 18.0(IBM, USA)软件进行统计分析。本研究中的数据表示为平均值±标准差(x±SD)。采用单因素方差分析(ANOVA)对各处理间的差异进行统计分析(P < 0.05)。
2 结果与分析 2.1 多壁碳纳米管(MWCNT)和氧化石墨烯(GO)的性质鉴定ssDNA/SWCNT、MWCNT和GO的zeta电位分别为(-56.85±0.93)、(-32.97±1.19)和(-43.20±0.56)mV, 表明MWCNT和GO由于其结构中存在亲水的—COOH或—OH基团, 因此可以稳定地分散在水溶液中。3种CBN在水溶液中的分散度从大到小依次为ssDNA/SWCNT、GO、MWCNT。
MWCNT和GO悬浮液的拉曼光谱分别在1 586 cm-1显示出特征性G-带, 在1 336 cm-1显示出特征性D-带(图 1-A)。相比较而言, ssDNA/SWCNT的拉曼光谱中存在相对高强度的D-带, 这与ssDNA处理导致的纳米管壁缺陷相关。ssDNA/SWCNT、MWCNT和GO的ID/IG比值分别为0.17、0.81和0.79, 表明3种CBN的纯度从大到小依次为ssDNA/SWCNT、GO、MWCNT。进一步利用透射电镜(TEM)分析ssDNA/SWCNT、MWCNT和GO悬浮液的形貌和粒径(图 1-B)。经羧基化的MWCNT外径为8~15 nm, 长度约为50 μm, 显著大于ssDNA/SWCNT的外径(0.8~1.2 nm)和长度(0.1~1.0 μm); GO小于3层, 横向尺寸为0.5~3.0 μm。综上所述, 化学改性提高了CBN的纯度和溶解度, 适于进行后续生物学效应的研究。
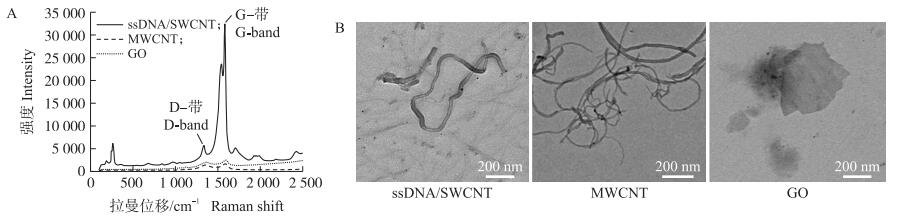
|
图 1 碳基纳米材料的性质鉴定 Fig. 1 Characterization of the carbon-based nanomaterials(CBN) A. ssDNA/SWCNT、MWCNT及GO的拉曼光谱; B. ssDNA/SWCNT、MWCNT和GO的高分辨透射电子显微镜图。 A. Raman spectra of single-stranded DNA wrapped single-walled carbon nanotube(ssDNA/SWCNT), multi-walled carbon nanotube(MWCNT)and graphene oxide(GO); B. High-resolution TEM images of ssDNA/SWCNT, MWCNT and GO. |
从图 2可知: 共培养的藻细胞与对照相比, 除了叶绿体的自发荧光外, Rho B荧光在细胞质中呈点状分布, 显示CBN能够穿过衣藻细胞壁和质膜, 定位于细胞质中。进一步将CBN与衣藻共培养3 d, 经透射电镜观察3种CBN在衣藻细胞中的分布。与对照相比, 与CBN共培养的衣藻细胞的细胞壁与细胞膜间隙和细胞质中均可检测到CBN颗粒(图 3), 证明3种CBN经与莱茵衣藻共培养, 均能定位在细胞质。
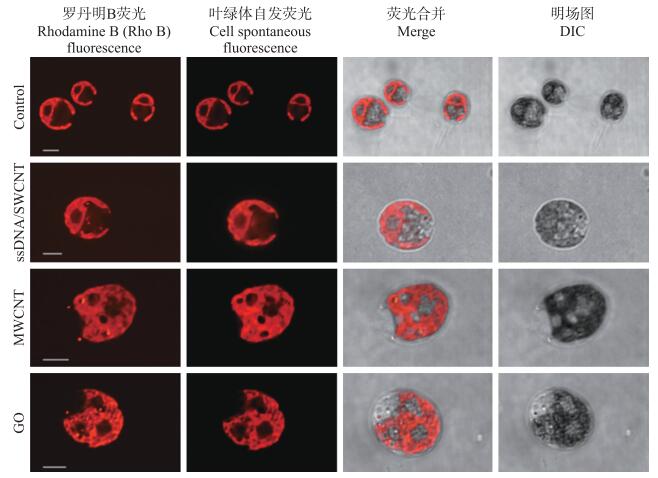
|
图 2 CBN/Rho B在莱茵衣藻细胞中的分布 Fig. 2 Distribution of CBN/Rho B in Chlamydomonas reinhardtii |
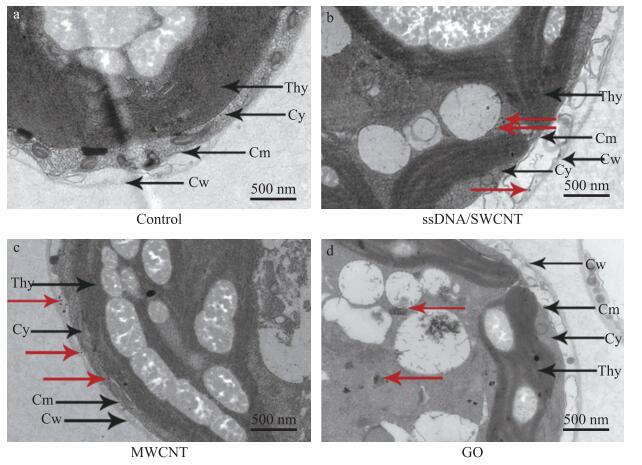
|
图 3 莱茵衣藻与碳基纳米材料孵育前、后的透射电子显微镜图 Fig. 3 Transmission electron microscopy images of C.reinhardtii cells incubated with/without three CBN a. 高倍视野下衣藻细胞(对照); b—d. 衣藻细胞分别与10 μg·mL-1 ssDNA/SWCNT、MWCNT和GO孵育。Cw: 细胞壁; Cm: 细胞膜; Cy: 细胞质; Thy: 类囊体。红色箭头所指为纳米材料。 a. High-magnification view of the cells(control); b-d. The cells incubated with 10 μg·mL-1 ssDNA/SWCNT, MWCNT and GO, respectively. Cw: Cell wall; Cm: Cell membrane; Cy: Cytoplasm; Thy: Thylakoid. Red arrows indicate the CBN. |
3种CBN对衣藻生长具有抑制作用且呈现剂量依赖。与对照相比, 在2 μg·mL-1或更低浓度下, 3种CBN对衣藻的生长没有显著影响(结果未列出)。从图 4可见: 在10 μg·mL-1时, 3种CBN均一定程度抑制细胞生长并诱导细胞聚集。与ssDNA/SWCNT类似, MWCNT处理后细胞生长密度和叶绿素含量只有轻微下降, 但GO处理前期, 藻细胞生长密度以及叶绿素含量明显低于对照(图 4-A), 说明GO相较碳纳米管对细胞的生长抑制更加明显。然而, 随着共培养3~4 d后, 衣藻生长逐渐恢复, 细胞生长密度及叶绿素含量达到或接近对照水平。形态观察也证明, 在共培养前期, GO诱导细胞发生聚集, 培养3~4 d后, 细胞团聚现象逐渐消失(图 4-B)。
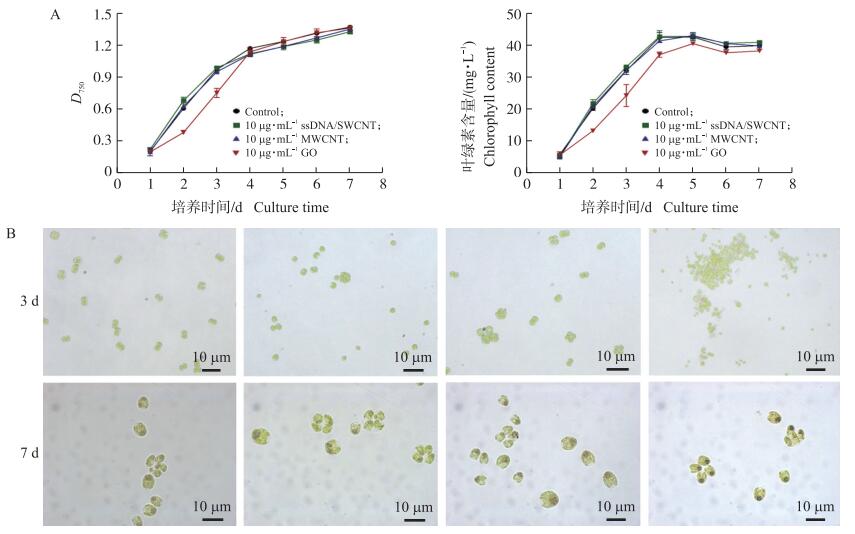
|
图 4 碳基纳米材料对莱茵衣藻生长状况的影响 Fig. 4 Effect of the CBN on the growth of C.reinhardtii A. 10 μg·mL-1 ssDNA/SWCNT、MWCNT和GO对衣藻细胞生长密度及叶绿素含量的影响; B. 莱茵衣藻与3种碳基纳米材料共培养不同时间的细胞形态。 A. The cell density and chlorophyll content of C.reinhardtii in the presence of 10 μg·mL-1 ssDNA/SWCNT, MWCNT and GO; B. Light microscopic images of C.reinhardtii cells in the presence of 10 μg·mL-1 ssDNA/SWCNT, MWCNT and GO at different time. |
我们进一步研究了MWCNT和GO对莱茵衣藻光合作用的影响。CBN在培养前期, ssDNA/SWCNT和GO分别处理的藻细胞最大量子产率(Fv/Fm)低于对照细胞(图 5-A), 表明GO和ssDNA/SWCNT具有比MWCNT更强的光合活性抑制能力。已有研究表明, Fv/Fm对某些环境应力不敏感, 因此我们又采用电子传递速率(ETR)评估3种CBN对光合活性的影响(图 5-B)。共培养7 d时, 与其他2种CBN相比, GO处理的藻细胞ETR显著降低。综合上述结果表明, GO具有比MWCNT更强的光合活性抑制能力。

|
图 5 碳基纳米材料对正常生长条件下莱茵衣藻光合活性的影响 Fig. 5 Effect of the CBN on photosynthetic activity of C.reinhardtii in TAP medium **P < 0.01, ***P < 0.001. The same as follows. |
对照培养物在缺硫密闭的条件下, 藻细胞PSⅡ的活力逐渐降低, 培养7 d时, Fv/Fm和ETR分别仅为0.49和3.17, 共培养物中, MWCNT、GO和ssDNA/SWCNT进一步降低了藻细胞的Fv/Fm和ETR(图 6), 而且加入GO的共培养物在培养11 d后, 已检测不到Fv/Fm和ETR(数据未显示)。
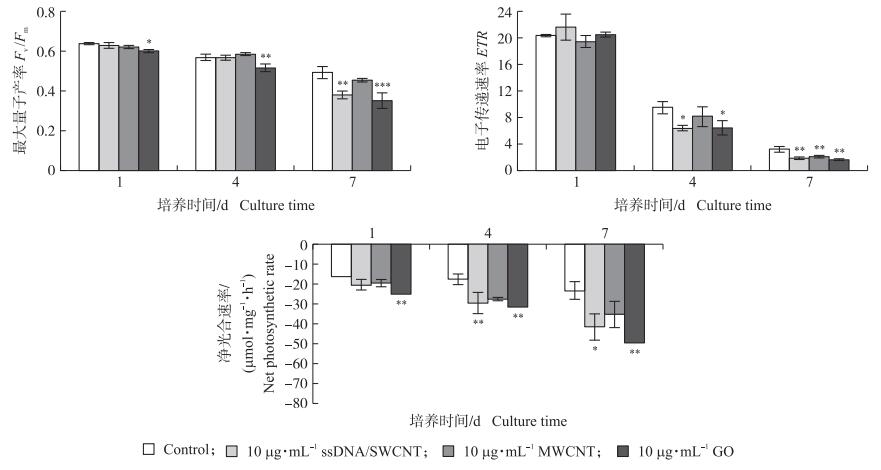
|
图 6 碳基纳米材料对缺硫培养条件下莱茵衣藻光合活性的影响 Fig. 6 Effects of the CBN on photosynthetic activity of C.reinhardtii in TAP-S medium *P < 0.05. The same as follows. |
为了进一步研究MWCNT和GO对衣藻光合产氢的影响, 我们用氧电极测定缺硫条件下共培养藻细胞的净光合速率。由于在缺硫条件下培养藻细胞的PSⅡ活性和光合放氧受到严重抑制(图 6), 净光合速率显示为负值, 表明在缺硫条件下衣藻细胞的呼吸速率大于光合放氧速率。在培养1 d时, 共培养物的净光合速率就低于对照组, 尤其是添加GO的藻细胞净光合速率更低。说明在培养前期缺硫效应的基础上, MWCNT和GO进一步降低了藻细胞的PSⅡ活性, 造成光合放氧速率下降, 从而诱导衣藻细胞加快建立缺氧状态。
2.5 MWCNT和GO对莱茵衣藻光合产氢的影响已知氢化酶的表达受无氧条件诱导, 根据上述研究结果, 我们测定了产氢条件下莱茵衣藻氢化酶活性。结果(图 7)表明: 在缺硫培养最初4 d内, MWCNT和GO共培养衣藻细胞及对照衣藻细胞的氢化酶活性几乎检测不到(数据未显示), MWCNT和GO共培养7 d时, 衣藻细胞内氢化酶活性显著高于对照组, 这与缺硫条件下MWCNT和GO抑制莱茵衣藻的光合活性相一致, 证明加快建立缺氧状态是诱导氢化酶表达的先决条件。未经CBN处理的对照组和MWCNT处理组的衣藻细胞, 培养11 d时, 它们的氢化酶活性最高, 随后呈下降趋势。在培养7 d时, GO和ssDNA/SWCNT处理组藻细胞的氢化酶活性最高。
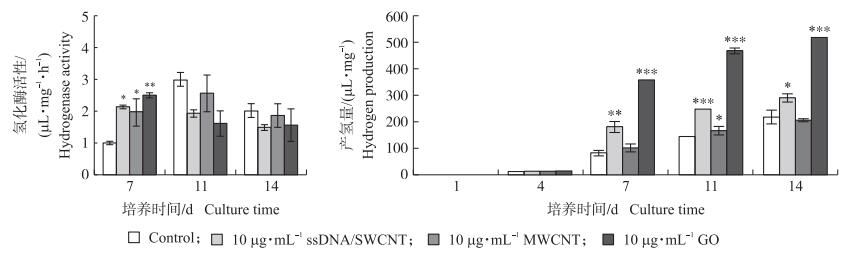
|
图 7 碳基纳米材料对缺硫培养条件下莱茵衣藻氢化酶活性及光合产氢的影响 Fig. 7 Effect of CBN on hydrogenase activity and photosynthetic hydrogen production ofC.reinhardtii in TAP-S medium |
由图 7可知: 对照组在缺硫培养前4 d基本没有氢的释放, 随后开始迅速增加, 14 d时产氢量达205.87 μL·mg-1。与对照相比, MWCNT、GO及ssDNA/SWCNT处理均提高了衣藻的产氢量。在缺硫培养7 d时, ssDNA/SWCNT或MWCNT共培养物的产氢量(179.10和100.53 μL·mg-1)分别比对照(78.22 μL·mg-1)高2.2和1.2倍, GO共培养物的产氢量(357.52 μL·mg-1)比对照高4.5倍左右。共培养物继续在缺硫条件下密闭培养, 产氢量持续增加, 但增幅减缓, 培养14 d后, ssDNA/SWCNT、MWCNT和GO共培养物的产氢量分别为289.12、205.58和519.83 μL·mg-1, 分别是对照的1.3、0.9和2.4倍。
3 讨论随着纳米材料的应用, 其对土壤、水体、有机体和食品的影响已引起广泛关注。衣藻中的研究主要集中在纳米材料在细胞中的积累以及其对衣藻生长、细胞形态、群体结构和光合作用的影响, 以此作为评估纳米材料对水体污染的一项指标。目前CBN毒性作用主要归因于纳米材料中金属催化剂的含量与类型、团聚程度与种类、物理特征(如形状和表面积)等[21-22]。研究表明, 对纳米颗粒进行修饰以提高纯度, 改善可溶性和分散度是降低或避免毒性的重要方法。Röhder等[23]研究结果表明, 团聚态纳米颗粒可造成衣藻细胞中活性氧的形成, 并轻度抑制光合作用; 相反, 可溶性分散态的纳米颗粒对衣藻的生长无显著影响。本研究中, 经单链DNA和羧基修饰后的单壁碳纳米管和多壁碳纳米管纯度及在水溶液中的分散度提高, 微观结构缺陷度减少, 对于莱茵衣藻在正常条件下的生长仅有轻微抑制, 这进一步证明碳基纳米材料对细胞的毒性与其生产过程中产生的杂质(如金属氧化物和无定形碳)密切相关[24]。对纳米材料进行纯化并提高其在溶液中的可溶性和稳定性, 可以有效降低细胞毒性, 扩大其在生物体系中的应用。
氧化石墨烯在水溶液中具有良好的分散性及表面反应活性, 因此对水生生物的毒性研究也是人们关注的焦点。Yin等[6]系统观察氧化石墨烯对绿藻、蓝藻、硅藻的毒性, 证明莱茵衣藻是对氧化石墨烯最具耐受性的藻种。本研究中, 10 μg·mL-1氧化石墨烯对衣藻细胞密度、叶绿素含量的影响有限, 处理早期会引起衣藻细胞发生一定程度的团聚, 但培养后期团聚现象逐渐消失。Wang等[25]研究TiO2和QDs NMs对莱茵衣藻的毒性, 也观察到类似的生长恢复现象。这些特征表明氧化石墨烯在用于莱茵衣藻生物产氢方面具有实际应用价值。
正常生理条件下绿藻的产氢过程只能短暂出现, 因此, 目前通用的产氢条件就是对衣藻进行缺硫胁迫。在此基础上, 人们提出不同方法来进一步提高缺硫状态下的莱茵衣藻产氢, 例如优化衣藻培养物的叶绿素浓度、培养基组成、光照和pH。Giraldo等[14]发现叶绿体定位的SWCNT显著提高植物叶片的光合作用活性, 最大电子传递速率提高30%。本研究发现, 不同类型的碳纳米管和氧化石墨烯在光照条件下并没有增加衣藻叶绿体中的电子产量及最大电子传递速率, 原因可能在于纳米材料仅定位在衣藻细胞质, 没有进入叶绿体, 因此即使纳米材料吸收光能并激发出更多光电子, 也无法有效传递至氢化酶。正常生理条件下GO处理的藻细胞中, PSⅡ的最大光化学效率和电子传递速率显著低于对照和碳纳米管处理组, 显示GO具有比ssDNA/SWCNT和MWCNT更强的PSⅡ活性抑制能力。缺硫培养条件下, 这一抑制效果更加明显, GO处理组在缺硫培养11 d后, 已检测不到Fv/Fm和ETR。对PSⅡ活性的抑制也导致藻细胞的光合放氧速率小于呼吸速率, GO处理组的净光合速率显著低于对照和碳纳米管处理组, 证明氧化石墨烯与产氢条件下的衣藻共培养, 可以加速建立缺氧环境, 为进一步提高产氢效率打下基础。检测缺硫培养过程中氢化酶活性也证明了这一点, 我们观察到氢化酶活性在缺硫培养期间经历一个先升后降的过程, 未经处理的衣藻细胞其氢化酶活性峰值出现在缺硫培养11 d, 但GO处理使该峰值提前到7 d, 这直接导致氢气产量比未经处理时提高4.5倍。Volgusheva等[26]的研究证明, 缺硫条件下衣藻PSⅡ的活性下降90%以上, 但仍保留约9%的水平以完成光照条件下电子的生成和传递。衣藻Stm6突变体可以在相同条件下维持25%的PSⅡ活性用于传递电子给氢化酶, 因此产氢量显著提升。这也证明, 在密闭缺硫的条件下有活性的PSⅡ越多, 产氢越多。因此, 氢化酶活性峰值提前出现可以在PSⅡ受伤害程度较轻时获得更多电子, 有利于氢的合成。
值得注意的是, 氧化石墨烯促进莱茵衣藻光合产氢在缺硫培养7 d后逐渐进入平台期, 培养14 d时产氢量仅为对照的2.4倍。可能的原因在于氧化石墨烯与缺硫条件对PSⅡ的影响存在叠加效应, 在培养后期PSⅡ的活性持续下降可能影响了对氢化酶的电子供应。后续研究将重点优化氧化石墨烯的工作浓度, 例如将目前的10 μg·mL-1降低到适当的浓度, 分析在缺硫培养过程中氧化石墨烯添加的时机, 以平衡缺氧环境与PSⅡ活性之间的关系。
综上所述, 本文对碳基纳米材料进行纯化及化学修饰, 可以显著提高其在溶液中的稳定性和分散度, 减少结构缺陷, 进而降低其细胞毒性。亲水的多壁碳纳米管、氧化石墨烯和经修饰的ssDNA/单壁碳纳米管可穿过衣藻细胞壁及细胞膜定位在细胞质。在标准光合产氢条件下, 上述纳米材料均可通过抑制PSⅡ光合活性、在细胞内提前建立缺氧状态、尽快诱导氢化酶活性的方式提高光合产氢量, 其中氧化石墨烯促进产氢的作用最强, 可显著提高光合产氢量达4倍以上。
| [1] |
陈志钢, 张丽莎, 田启威, 等. 碳基光热转换纳米材料的表面功能化和生物应用[J]. 材料导报, 2012, 26(23): 30-33, 50. Chen Z G, Zhang L S, Tian Q W, et al. Surface functionalization and biological application of carbon-based nanomaterials with photothermal effects[J]. Materials Review, 2012, 26(23): 30-33, 50 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-023X.2012.23.006 |
| [2] |
Liu Q L, Chen B, Wang Q L, et al. Carbon nanotubes as molecular transporters for walled plant cells[J]. Nano Letters, 2009, 9(3): 1007-1010. DOI:10.1021/nl803083u |
| [3] |
Kwak S Y, Lew T, Sweeney C J, et al. Chloroplast-selective gene delivery and expression in planta using chitosan-complexed single-walled carbon nanotube carriers[J]. Nature Nanotechnology, 2019, 14(5): 447-455. DOI:10.1038/s41565-019-0375-4 |
| [4] |
Villagarcia H, Dervishi E, de Silva K, et al. Surface chemistry of carbon nanotubes impacts the growth and expression of water channel protein in tomato plants[J]. Small, 2012, 8(15): 2328-2334. DOI:10.1002/smll.201102661 |
| [5] |
Begum P, Fugetsu B. Phytotoxicity of multi-walled carbon nanotubes on red spinach (Amaranthus tricolor L.) and the role of ascorbic acid as an antioxidant[J]. Journal of Hazardous Materials, 2012, 243: 212-222. DOI:10.1016/j.jhazmat.2012.10.025 |
| [6] |
Yin J, Fan W, Du J, et al. The toxicity of graphene oxide affected by algal physiological characteristics: a comparative study in cyanobacterial, green algae, diatom[J]. Environmental Pollution, 2020, 260: 113847. DOI:10.1016/j.envpol.2019.113847 |
| [7] |
Wang B, Zeng C P, Chu K H, et al. Enhanced biological hydrogen production from Escherichia coli with surface precipitated cadmium sulfide nanoparticles[J]. Advanced Energy Materials, 2017, 7(20): 1700611. DOI:10.1002/aenm.201700611 |
| [8] |
Sawyer A, Bai Y, Lu Y H, et al. Compartmentalisation of [Fe-Fe]-hydrogenase maturation in Chlamydomonas reinhardtii[J]. The Plant Journal, 2017, 90(6): 1134-1143. DOI:10.1111/tpj.13535 |
| [9] |
Melis A, Zhang L, Forestier M, et al. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green alga Chlamydomonas reinhardtii[J]. Plant Physiology, 2000, 122(1): 127-136. DOI:10.1104/pp.122.1.127 |
| [10] |
Ghirardi M L, Zhang L P, Lee J W, et al. Microalgae: a green source of renewable H (2)[J]. Trends in Biotechnology, 2000, 18(12): 506-511. DOI:10.1016/S0167-7799(00)01511-0 |
| [11] |
Wu S X, Li X, Yu J, et al. Increased hydrogen production in co-culture of Chlamydomonas reinhardtii and Bradyrhizobium japonicum[J]. Bioresource Technology, 2012, 123: 184-188. DOI:10.1016/j.biortech.2012.07.055 |
| [12] |
Tolleter D, Ghysels B, Alric J, et al. Control of hydrogen photoproduction by the proton gradient generated by cyclic electron flow in Chlamydomonas reinhardtii[J]. The Plant Cell, 2011, 23(7): 2619-2630. DOI:10.1105/tpc.111.086876 |
| [13] |
Hemschemeier A, Fouchard S, Cournac L, et al. Hydrogen production by Chlamydomonas reinhardtii: an elaborate interplay of electron sources and sinks[J]. Planta, 2008, 227(2): 397-407. |
| [14] |
Giraldo J P, Landry M P, Faltermeier S M, et al. Plant nanobionics approach to augment photosynthesis and biochemical sensing[J]. Nature Materials, 2014, 13(4): 400-408. DOI:10.1038/nmat3890 |
| [15] |
叶珂祯, 王宗秀, 陈熙, 等. 单壁碳纳米管对莱茵衣藻光合产氢的影响[J]. 南京农业大学学报, 2019, 42(1): 94-101. Ye K Z, Wang Z X, Chen X, et al. Effects of single-walled carbon nanotubes on photosynthetic hydrogen production in Chlamydomonas reinhardtii[J]. Journal of Nanjing Agricultural University, 2019, 42(1): 94-101 (in Chinese with English abstract). DOI:10.7685/jnau.201804018 |
| [16] |
Williams R M, Taylor H K, Thomas J, et al. The effect of DNA and sodium cholate dispersed single-walled carbon nanotubes on the green algae Chlamydomonas reinhardtii[J]. Journal of Nanoscience, 2014, 2014: 1-8. |
| [17] |
Youn S, Wang R, Gao J, et al. Mitigation of the impact of single-walled carbon nanotubes on a freshwater green algae: Pseudokirchneriella subcapitata[J]. Nanotoxicology, 2012, 6(2): 161-172. DOI:10.3109/17435390.2011.562329 |
| [18] |
Yuan Z D, Zhang Z M, Wang X P, et al. Novel impacts of functionalized multi-walled carbon nanotubes in plants: promotion of nodulation and nitrogenase activity in the Rhizobium-legume system[J]. Nanoscale, 2017, 9(28): 9921-9937. DOI:10.1039/C7NR01948C |
| [19] |
Ma W M, Chen M, Wang L J, et al. Treatment with NaHSO3 greatly enhances photobiological H2 production in the green alga Chlamydomonas reinhardtii[J]. Bioresource Technology, 2011, 102(18): 8635-8638. DOI:10.1016/j.biortech.2011.03.052 |
| [20] |
Rühle T, Hemschemeier A, Melis A, et al. A novel screening protocol for the isolation of hydrogen producing Chlamydomonas reinhardtii strains[J]. BMC Plant Biology, 2008, 8: 107. DOI:10.1186/1471-2229-8-107 |
| [21] |
Flahaut E, Sloan J, Friedrichs S, et al. Crystallization of 2H and 4H PbI2 in carbon nanotubes of varying diameters and morphologies[J]. Chemistry of Materials, 2006, 18(8): 2059-2069. DOI:10.1021/cm0526056 |
| [22] |
Freixa A, Acuña V, Sanchís J, et al. Ecotoxicological effects of carbon based nanomaterials in aquatic organisms[J]. Science of the Total Environment, 2018, 619/620: 328-337. DOI:10.1016/j.scitotenv.2017.11.095 |
| [23] |
Röhder L A, Brandt T, Sigg L, et al. Influence of agglomeration of cerium oxide nanoparticles and speciation of cerium (Ⅲ) on short term effects to the green algae Chlamydomonas reinhardtii[J]. Aquatic Toxicology, 2014, 152: 121-130. DOI:10.1016/j.aquatox.2014.03.027 |
| [24] |
Liu Y, Zhao Y L, Sun B Y, et al. Understanding the toxicity of carbon nanotubes[J]. Accounts of Chemical Research, 2013, 46(3): 702-713. DOI:10.1021/ar300028m |
| [25] |
Wang J X, Zhang X Z, Chen Y S, et al. Toxicity assessment of manufactured nanomaterials using the unicellular green alga Chlamydomonas reinhardtii[J]. Chemosphere, 2008, 73(7): 1121-1128. DOI:10.1016/j.chemosphere.2008.07.040 |
| [26] |
Volgusheva A, Styring S, Mamedov F. Increased photosystem Ⅱ stability promotes H2 production in sulfur-deprived Chlamydomonas reinhardtii[J]. Proc Natl Acad Sci USA, 2013, 110(18): 7223-7228. DOI:10.1073/pnas.1220645110 |




