文章信息
- 赵方舟, 胡平, 汪晶, 朱伟云
- ZHAO Fangzhou, HU Ping, WANG Jing, ZHU Weiyun
- 早期乳铁蛋白干预对哺乳仔猪盲肠菌群结构、短链脂肪酸含量及黏膜炎症因子水平的影响
- Effects of early life lactoferrin intervention on cecal microbiota, the concentration of short chain fatty acids and the level of mucosal cytokines in suckling piglets
- 南京农业大学学报, 2021, 44(1): 151-159
- Journal of Nanjing Agricultural University, 2021, 44(1): 151-159.
- http://dx.doi.org/10.7685/jnau.201912008
-
文章历史
- 收稿日期: 2019-12-03
猪肠道中, 尤其是在后肠中定殖大量的肠道微生物群, 它们在猪的生长发育过程中扮演着重要的角色。大量研究表明, 肠道微生物可通过调节肠道上皮细胞增殖分化、营养物质的吸收和代谢、免疫应答以及预防传染性疾病, 进而对猪的生长产生积极影响[1-2]。初生阶段的哺乳仔猪肠道菌群是动态且不稳定的, 很容易受到营养和其他环境因素影响[3]。研究表明, 早期营养组分的变化会对哺乳仔猪肠道的菌群定殖、消化功能和免疫系统发育产生重要影响[4]。因此, 早期营养干预是一种调节猪肠道菌群, 并可通过影响肠道菌群和肠道屏障从而改变肠道功能的有效方法。
乳铁蛋白(lactoferrin, LF)是一种具有多种功能的天然糖蛋白, 也是哺乳动物母乳中重要的活性物质之一。乳铁蛋白具有调节免疫和炎症反应以及抗菌等作用[5]。目前关于乳铁蛋白调节仔猪肠道菌群的研究多集中在断奶时期, 主要证实了乳铁蛋白可以提高肠道中乳酸杆菌的数量, 同时有效降低大肠杆菌的数量。而关于乳铁蛋白如何影响哺乳期仔猪肠道菌群结构和肠道功能的研究还鲜见报道。
仔猪盲肠处于小肠与大肠的交汇处, 是机体微生物定殖及发酵代谢食糜底物的重要场所。研究表明, 盲肠核心菌群有助于维持肠道正常功能和黏膜的完整性[6-8]。因此, 哺乳仔猪盲肠微生物的组成及其代谢产物可以对机体健康产生重要影响。本试验拟通过对初生哺乳仔猪进行乳铁蛋白灌喂的方式研究早期乳铁蛋白干预对哺乳仔猪的盲肠菌群结构和肠道功能的影响。
1 材料与方法 1.1 试验动物和试验材料试验于江苏省泰州市三寸草猪场完成。选取6窝(每窝10头)杜长大(杜洛克×长白×大白)新生仔猪(体重约1.51 kg), 试验用乳铁蛋白(法国Ingradia公司)是从牛奶中分离、提纯, 纯度为95%。
1.2 试验设计及饲养管理根据仔猪的初生体重相近原则, 并采用窝内分组以此减小母源差异, 将每窝仔猪均分为对照组和乳铁蛋白组。每组6个重复, 每个重复5头仔猪。在仔猪出生后1~7 d(日龄), 每天称体重, 根据仔猪体重配制不同浓度的乳铁蛋白溶液, 每天对乳铁蛋白组仔猪灌喂3次, 每次灌喂8~12 mL的乳铁蛋白溶液, 保证仔猪每天乳铁蛋白的有效灌喂量达到0.5 g·kg-1, 对照组仔猪灌喂相同剂量的生理盐水。试验8 d后, 不对仔猪进行额外处理。于试验8和21 d时, 从每窝仔猪中随机选取对照组仔猪和乳铁蛋白组仔猪各1头(n=6), 屠宰取样。其中, 试验8和21 d时的对照组仔猪分别标记为CON 8和CON 21组, 试验8和21 d时的乳铁蛋白组仔猪则标记为LF 8和LF 21组。试验期间仔猪可以自由采食、饮水, 其他管理措施如断牙、断尾、去势、常规补铁与免疫等均按照猪场相关规程操作。
1.3 测定指标屠宰后采集盲肠内容物用于对肠道菌群的高通量测序和短链脂肪酸含量的测定, 盲肠黏膜组织用于肠道功能和炎症因子等相关指标分析。
1.3.1 盲肠菌群的高通量测序按照Zoetendal等[9]的方法, 称取0.3 g左右的盲肠内容物, 通过bead-beating方法提取盲肠内容物中的总菌DNA。用Nano-Drop 1000分光光度计检测提取的DNA浓度和纯度, 然后将提取出的总菌DNA放入-80 ℃保存待测。前端引物341F(5′-CCTAYGGGRBGCASCAG-3′)和后端引物806R(5′-GGACTACNNGGGTATCTAAT-3′)用于相应的PCR程序来扩增细菌16S rRNA的V3-V4区域。PCR程序:95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s, 共27个循环; 最后72 ℃ 10 min。用20 g·L-1琼脂糖凝胶电泳检测PCR产物, 再采用DNA凝胶提取试剂盒(美国Axygen公司)纯化PCR产物, 然后在Illumina MiSeq平台上对纯化的PCR产物进行末端配对和测序(上海凌恩生物科技公司), 再将我们的16S rRNA原始测序数据上传至NCBI的GenBank, 登录号为SRP150977。
1.3.2 盲肠内容物中菌群的qPCR检测根据罗振等[10]的方法, 对盲肠内容物中的总菌、乳酸杆菌、大肠杆菌、梭杆菌4、梭杆菌14和瘤胃球菌进行qPCR。所用的引物由上海英骏生物科技公司合成。具体引物对序列如下:总菌[11], 5′-GTGSTGCAYGGYYGTCGTCA-3′/5′-ACGTCRTCCMCNCCTTCCTC-3′; 乳酸杆菌(Lactobacillus)[12], 5′-AGCAGTAGGGAATCTTCCA-3′/5′-ATTCCACCGCTACACATG-3′; 大肠杆菌(Escherichia coli)[13], 5′-CATGCCGCGTGTATGAAGAA-3′/5′-CGGGTAACGTCAATGAGCAAA-3′; 梭杆菌4(Clostridium cluster Ⅳ)[14], 5′-GCACAAGCAGTGGAGT-3′/5′-CTTCCTCCGTTTTGTCAA-3′; 梭杆菌14(Clostridium cluster ⅩⅣa)[15], 5′-CGGTACCTGACTAAGAAGC-3′/5′-AGTTTYATTCTTGCGAACG-3′; 瘤胃球菌(Ruminococcus)[16], 5′-GAAAGCGTGGGGAGCAAACAGG-3′/5′-GACGACAACCATGCACCACCTG-3′。PCR反应体系(20 μL):SYBR Premix 10 μL, 上、下游引物各0.4 μL(10 μmol·L-1), ROX Reference Dye 0.4 μL(50×), 灭菌水6.8 μL, DNA 2 μL。所用试剂均来自大连TaKaRa公司。PCR程序:95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环; 熔解曲线程序:95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。利用这些菌群代表菌的16S rRNA基因克隆作为模版制作相应的定量标准曲线。每个样品重复检测3次。
1.3.3 盲肠内容物中短链脂肪酸含量的测定根据秦为琳[17]的方法, 用日本岛津GC-14B气相色谱仪测定盲肠内容物中的短链脂肪酸含量。其中毛细管柱为美国Sigma公司产品, 30 m×0.32 mm×0.25 μm; 柱温度110 ℃, 进样器温度180 ℃, 检测器温度180 ℃。
1.3.4 盲肠黏膜炎症因子水平的测定将约0.1 g盲肠黏膜加入到900 μL冷磷酸盐缓冲液(PBS)中, 用匀浆机均匀粉碎后, 用涡旋仪涡旋约60 s, 然后将样品4 ℃、1 000 r·min-1离心15 min, 收集上清液用于ELISA分析。用蛋白质测定试剂盒(南京建成生物工程有限公司)测定蛋白质浓度, 然后用ELISA试剂盒(南京建成生物工程有限公司)测定盲肠黏膜中的白细胞介素8(IL-8)、白细胞介素10(IL-10)、肿瘤坏死因子α(TNF-α)和转化生长因子β(TGF-β)的含量。
1.4 数据统计分析试验数据用平均值±标准误(x±SE)表示, 用Excel 2010将数据初步整理后, 运用SPSS 22.0统计软件中Mann-Whitney U-test对非正态分布的独立样本进行分析, 即盲肠菌群结构的数据。运用双因素方差分析法分析盲肠菌群多样性、短链脂肪酸含量和炎症因子表达量, 并把乳铁蛋白作为试验的主因素。当观察到初生日龄和乳铁蛋白产生交互作用时, 进一步使用单因素方差分析法进行差异显著性检验, 并采用Duncan’s法进行多重比较。
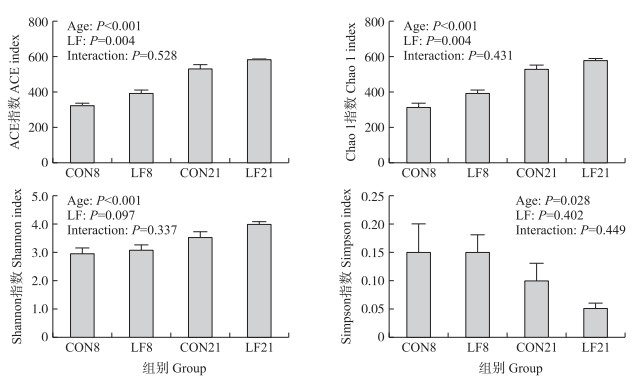
2 结果与分析 2.1 早期乳铁蛋白干预对哺乳仔猪盲肠菌群结构的影响由图 1可知:与对照组相比, 日龄影响哺乳仔猪盲肠菌群的α多样性, 显著提高ACE、Chao 1和Shannon指数(P<0.05), 降低Simpson指数(P<0.05)。而与对照组相比, 乳铁蛋白显著提升乳铁蛋白组仔猪盲肠菌群的ACE和Chao 1指数(P<0.05), 同时有提升Shannon指数的趋势(P>0.05)。
|
图 1 早期乳铁蛋白干预对哺乳仔猪盲肠菌群α多样性指数的影响 Fig. 1 Effects of early life lactoferrin(LF)intervention on the α-diversity indexes of ACE, Chao 1, Shannon, Simpson of cecal microbiota CON8:试验8 d时对照组; LF8:试验8 d时乳铁蛋白组; CON21:试验21 d时对照组; LF21:试验21 d时乳铁蛋白组。下同。 CON8:The control group on day 8;LF8:The LF group on day 8;CON21:The control group on day 21;LF21:The LF group on day 21. The same as follows. |
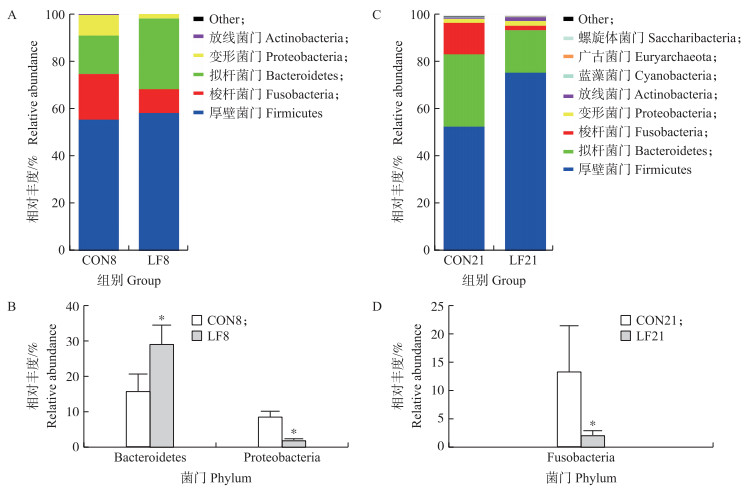
由图 2可知:在门水平上, 试验8 d时, 厚壁菌门(Firmicutes)是相对丰度最高的菌门, 而乳铁蛋白显著提高盲肠菌群中拟杆菌门(Bacteroidetes)的相对丰度(P<0.05), 显著降低变形菌门(Proteobacteria)的相对丰度(P<0.05)。试验21 d时, 厚壁菌门、拟杆菌门和梭杆菌门是相对丰度最高的3个菌门, 同时乳铁蛋白显著降低梭杆菌门(Fusobacteria)的相对丰度(P<0.05)。
|
图 2 早期乳铁蛋白干预8 d(A、B)和21 d(C、D)对哺乳仔猪盲肠微生物门水平的影响 Fig. 2 Effects of the early life LF intervention on the phylum level of cecal microbiota on day 8(A, B)and day 21(C, D) *表示与对照组相比差异显著(P<0.05)。下同。 * indicates the significant difference compared with the control group at 0.05 level. The same as follows. |
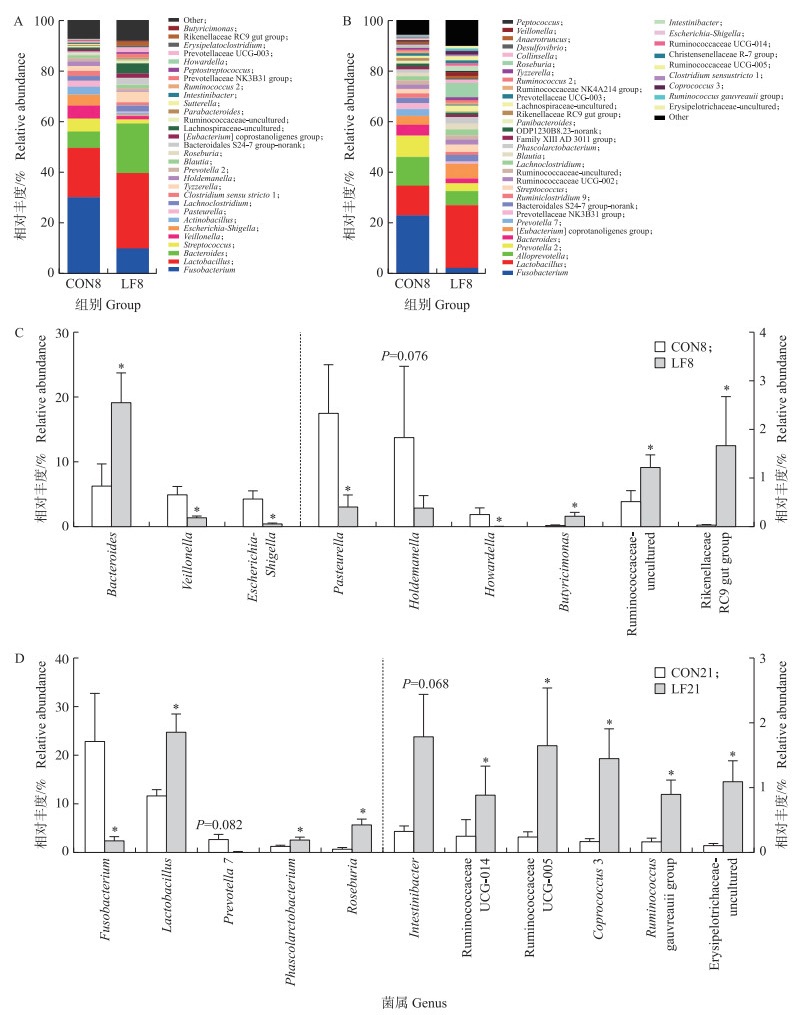
由图 3可知:在属水平上, 试验8 d时对照组中相对丰度最高的是梭杆菌属, 其次是乳杆菌属。与对照组相比, 乳铁蛋白组中的梭杆菌属相对丰度降低, 而乳杆菌属和拟杆菌属相对丰度增加。乳铁蛋白显著提高了盲肠菌群中拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcaceae-uncultured)、丁酸弧菌属(Butyricimonas)和Rikenellaceae RC9 gut group的相对丰度(P<0.05), 同时显著降低韦荣球菌属(Veillonella)、大肠杆菌属(Escherichia-Shigella)、巴氏杆菌属(Pasteurella)和Howardella的相对丰度(P<0.05)。在试验21 d时, 乳铁蛋白显著提高乳杆菌属(Lactobacillus)、考拉杆菌属(Phascolarctobacterium)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus gauvreauii group, Ruminococcaceae-UCG005, Ruminococcaceae-UCG014)、粪球菌属(Coprococcus 3)和Erysipelotrichaceae-uncultured的相对丰度(P<0.05), 同时显著降低梭杆菌属(Fusobacterium)的相对丰度(P<0.05)。
|
图 3 早期乳铁蛋白干预8 d(A、C)和21 d(B、D)对哺乳仔猪盲肠微生物属水平的影响 Fig. 3 Effects of early life LF intervention on genus level of cecal microbiota on day 8(A, C) and day 21(B, D) 虚线左边的菌属相对丰度参照左侧的纵坐标, 虚线右边的菌属相对丰度参照右侧的纵坐标。 The relative abundance of the genus on the left of the dotted line refers to the ordinate on the left, and the relative abundance of the genus on the right of the dotted line refers to the ordinate on the right. |
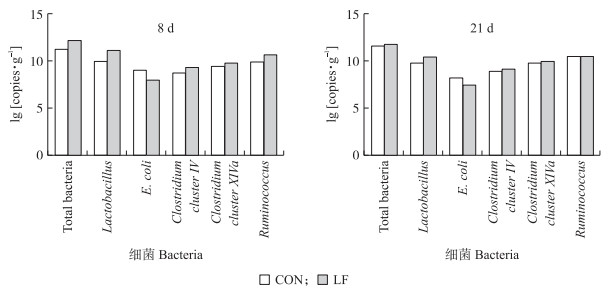
由图 4 qPCR结果可知:试验8 d时乳铁蛋白显著提升了哺乳仔猪盲肠内容物中总菌、乳酸杆菌和瘤胃球菌的16S rRNA拷贝数(P<0.05), 同时降低了大肠杆菌的拷贝数(P>0.05)。试验21 d时乳铁蛋白显著降低了大肠杆菌的16S rRNA拷贝数(P<0.05), 并增加乳酸杆菌16S rRNA的拷贝数(P>0.05)。
|
图 4 早期乳铁蛋白干预对8和21 d哺乳仔猪盲肠细菌拷贝数的影响 Fig. 4 Effects of early life LF intervention on gene copies of cecal bacteria in suckling piglets on day 8 and day 21 |
由表 1可知:日龄因素显著影响哺乳仔猪盲肠内容物中的乙酸、丙酸、戊酸和总短链脂肪酸含量(P<0.05)。与对照组相比, 乳铁蛋白显著提高乳铁蛋白组仔猪盲肠内容物中的乙酸、丙酸、丁酸、异戊酸和总短链脂肪酸的含量(P<0.05), 同时日龄和乳铁蛋白对哺乳仔猪盲肠内容物中乙酸的含量有产生交互作用的趋势(P>0.05)。
| 项目Items | 含量/(μmol·g-1) Content | 标准误 SE |
P值P-value | |||||
| CON8 | LF8 | CON21 | LF21 | LF | Age | LF×Age | ||
| 乙酸Acetate | 36.42 | 43.57 | 41.01 | 69.50 | 5.34 | 0.005 | 0.012 | 0.061 |
| 丙酸Propionate | 15.57 | 22.08 | 21.96 | 27.51 | 2.49 | 0.030 | 0.027 | 0.846 |
| 异丁酸Isobutyric | 2.24 | 6.24 | 6.18 | 6.23 | 1.62 | 0.237 | 0.222 | 0.234 |
| 丁酸Butyrate | 5.20 | 10.47 | 6.64 | 10.44 | 1.25 | 0.002 | 0.572 | 0.555 |
| 异戊酸Isovaleric | 1.89 | 3.87 | 3.26 | 3.79 | 0.49 | 0.021 | 0.198 | 0.151 |
| 戊酸Valerate | 0.64 | 0.99 | 2.54 | 4.07 | 0.68 | 0.180 | 0.002 | 0.397 |
| 总短链脂肪酸Total SCFA | 61.96 | 87.04 | 81.77 | 121.53 | 7.64 | 0.001 | 0.003 | 0.342 |
由图 5可知:日龄显著增加哺乳仔猪盲肠黏膜中IL-10和TNF-β水平(P<0.05)。与对照组相比, 乳铁蛋白显著提高了仔猪盲肠黏膜中的IL-10和TNF-β水平(P<0.05), 显著降低IL-8水平(P<0.05)。日龄和乳铁蛋白还对TNF-β有产生交互作用的趋势(P>0.05)。
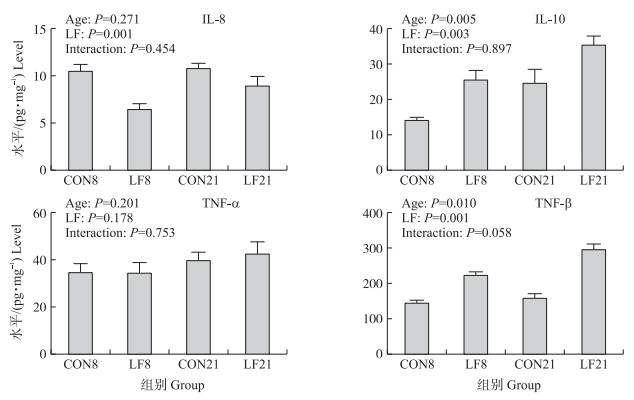
|
图 5 早期乳铁蛋白干预对哺乳仔猪盲肠黏膜炎症因子IL-8、IL-10、TNF-α、TGF-β水平的影响 Fig. 5 Effects of early life LF intervention on the cytokine level of IL-8, IL-10, TNF-α, TGF-β in cecal mucosa of suckling piglets |
仔猪出生后的第1周是肠道菌群定殖的关键时期, 而早期肠道菌群在先天适应性免疫调节、营养吸收和肠道屏障功能维持等方面起着重要作用[18]。研究表明乳铁蛋白具有抗菌以及调控肠道微生物等功能[5]。对菌群结构分析发现, 早期乳铁蛋白干预提高了仔猪盲肠菌群α多样性的ACE和Chao 1指数, 较高的多样性指数表明盲肠菌群的丰富度较高, 这也被认为是肠道菌群成熟的一个标志, 有助于维持仔猪肠道内环境的稳定性和抵抗力[8, 19]。菌群定量结果也表明, 早期乳铁蛋白干预提高了盲肠中总细菌数量, 这与α多样性的变化是一致的。因此, 早期乳铁蛋白干预可提高肠道菌群的丰富度和肠道内环境的稳定性。
盲肠菌群α多样性变化显著, 试验8 d时, 早期乳铁蛋白干预显著提升拟杆菌门相对丰度并降低变形菌门的相对丰度。拟杆菌门包含许多有益菌和产酸菌, 如拟杆菌属可以产生丁酸而被认为是一种保护肠道健康的菌门[20]。而变形菌门中包含多种条件性致病菌和有害菌, 如大肠杆菌和沙门氏菌。属水平菌群变化情况表明, 乳铁蛋白显著提高拟杆菌属和丁酸弧菌属等有益菌属的相对丰度, 并降低大肠杆菌属等条件性致病菌属的相对丰度, 大肠杆菌和巴氏杆菌通常被认为是致病菌, 韦荣球菌则被认为是条件性的致病菌[21]。盲肠菌群定量结果表明, 早期乳铁蛋白干预降低了盲肠中大肠杆菌数量, 这与大肠杆菌的相对丰度降低是一致的。
试验21 d时, 早期乳铁蛋白干预显著降低梭杆菌门的相对丰度, 而梭杆菌门包含梭杆菌属, 有研究表明梭杆菌属中包含与坏死性结肠炎等疾病密切相关的菌种[22], 梭杆菌门相对丰度的降低可能有利于宿主机体的健康。属水平菌群的变化情况表明, 早期乳铁蛋白干预显著提升乳杆菌属、罗斯氏菌属、瘤胃球菌属和粪球菌属等的相对丰度, 同时显著降低梭杆菌属的相对丰度。乳杆菌是一种广泛存在的益生菌, 它可以产生乳酸来发挥抗菌作用, 也可以通过缓解肠道炎症来保护肠道[23]。Yang等[24]研究发现乳铁蛋白提高了乳杆菌的拷贝数量。罗斯氏菌等可以通过产生短链脂肪酸, 从而对肠道产生保护作用。包含多种致病菌的梭杆菌属相对丰度的降低也可能有利于肠道内环境稳定。试验21 d时乳酸杆菌的拷贝数增加而大肠杆菌的拷贝数降低。这可能是由于乳铁蛋白可以与大肠杆菌等竞争铁离子从而抑制需铁微生物的生长, 同时乳铁蛋白还可以通过抑制大肠杆菌的黏附力来降低肠道中大肠杆菌的数量[25]。以上结果表明, 早期乳铁蛋白干预能提高哺乳仔猪盲肠内有益菌的相对丰度, 降低多种潜在致病菌的相对丰度, 改善哺乳仔猪盲肠的菌群结构。
肠道微生物在盲肠中发酵的同时, 能产生多种短链脂肪酸。短链脂肪酸在机体中发挥重要的作用, 它可以作为能源物质被肠道上皮细胞直接快速吸收利用, 同时还可以被转运进入血液被机体和器官利用, 也可以作为机体内重要的信号分子[26]。分析盲肠菌群结构发现, 早期乳铁蛋白干预提高了多种短链脂肪酸产生菌的相对丰度, 尤其是拟杆菌属、丁酸弧菌以及罗斯氏菌等丁酸产生菌。本试验结果表明, 早期乳铁蛋白干预提升了盲肠内容物中乙酸等短链脂肪酸的含量, 有利于仔猪肠道吸收利用短链脂肪酸, 也有助于抑制盲肠黏膜的炎症反应[27]。乳铁蛋白干预还显著增加哺乳仔猪盲肠中丁酸的含量。研究表明, 丁酸可以诱导肠道菌群中的有益菌增殖, 改善机体的代谢并增强肠道的屏障功能[20, 28]。以上结果表明, 早期乳铁蛋白干预提高了盲肠内的短链脂肪酸含量, 这将对仔猪盲肠产生保护作用并有助于维持肠道黏膜的免疫平衡。
早期乳铁蛋白干预可以通过增加肠道中短链脂肪酸水平来保护肠道健康以及免疫平衡。乳铁蛋白还可以影响机体固有免疫等方式, 通过促进T淋巴细胞成熟以及调节细胞因子的释放[29], 调节肠道以及机体免疫能力。而炎症因子的表达水平可反映肠道的免疫状态, 并在肠道炎症疾病中起关键性作用。炎症因子的表达水平与肠道中的共生菌有关, 而抗炎因子可以通过抑制免疫系统的过度激活来保证肠道黏膜的免疫平衡[30]。从本试验结果发现, 早期乳铁蛋白干预提高了哺乳仔猪盲肠黏膜中具有抗炎功能的IL-10和TGF-β的水平, 同时降低具有促炎性质的IL-8的水平。Comstock等[31]研究发现, 乳铁蛋白可以促进细胞中IL-10的分泌, 本研究结果与之相一致。TGF-β是一种抗炎因子, 对细胞的生长和免疫功能都有重要的调节作用, 而IL-8则是一种促炎因子。本试验显示抗炎因子TGF-β、IL-10水平增加且促炎因子IL-8水平降低, 表明盲肠黏膜的抗炎因子水平较高, 这可能因为乳铁蛋白改善了哺乳仔猪的肠道菌群结构, 乳杆菌等有益菌的增加以及短链脂肪酸的增多也保护了肠道黏膜健康。因此, 早期乳铁蛋白干预可以提升盲肠黏膜抗炎水平, 提高哺乳仔猪盲肠黏膜抵抗炎症和致病菌的能力, 并提升盲肠的免疫平衡能力和健康状况。
综上所述, 早期乳铁蛋白干预提高了仔猪盲肠菌群的多样性并改善盲肠菌群结构, 这可能是因为乳铁蛋白干预可以抑制潜在致病菌的定殖, 同时促进有益菌的定殖, 从而改善盲肠内环境。此外早期乳铁蛋白干预提高了盲肠内短链脂肪酸含量和黏膜内抗炎因子水平, 并降低了促炎因子水平。短链脂肪酸的增加进一步改善了盲肠黏膜的健康状况, 从而保持并改善了哺乳仔猪的盲肠免疫平衡状态, 有利于仔猪肠道以及机体的健康发育。
| [1] |
Bäckhed F, Manchester J K, Semenkovich C F, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proc Natl Acad Sci USA, 2007, 104(3): 979-984. DOI:10.1073/pnas.0605374104 |
| [2] |
Hooper L V, Littman D R, McPherson A J. Interactions between the microbiota and the immune system[J]. Science, 2012, 336(6086): 1268-1273. DOI:10.1126/science.1223490 |
| [3] |
Schokker D, Zhang J, Zhang L L, et al. Early-life environmental variation affects intestinal microbiota and immune development in new-born piglets[J]. PLoS One, 2014, 9(6): e100040. DOI:10.1371/journal.pone.0100040 |
| [4] |
Donovan S M. The role of lactoferrin in gastrointestinal and immune development and function:a preclinical perspective[J]. The Journal of Pediatrics, 2016, 173(Suppl): S16-S28. |
| [5] |
张海全, 谷琳琳, 姜海龙. 乳铁蛋白对仔猪肠道屏障功能的影响[J]. 养猪, 2015(4): 126-128. Zhang H Q, Gu L L, Jiang H L. Effects of lactoferrin on gut barrier function of piglets[J]. Swine Production, 2015(4): 126-128 (in Chinese with English abstract). DOI:10.3969/j.issn.1002-1957.2015.04.064 |
| [6] |
Chen H, Mao X B, Che L Q, et al. Impact of fiber types on gut microbiota, gut environment and gut function in fattening pigs[J]. Animal Feed Science and Technology, 2014, 195: 101-111. DOI:10.1016/j.anifeedsci.2014.06.002 |
| [7] |
Looft T, Johnson T A, Allen H K, et al. In-feed antibiotic effects on the swine intestinal microbiome[J]. Proc Natl Acad Sci USA, 2012, 109(5): 1691-1696. DOI:10.1073/pnas.1120238109 |
| [8] |
Turnbaugh P J, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 |
| [9] |
Zoetendal E G, Akkermans A D L, de Vos W M. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J]. Applied and Environmental Microbiology, 1998, 64(10): 3854-3859. DOI:10.1128/AEM.64.10.3854-3859.1998 |
| [10] |
罗振, 成艳芬, 朱伟云. 低蛋白日粮对育肥猪盲肠代谢产物及菌群的影响[J]. 畜牧与兽医, 2015, 47(10): 5-9. Luo Z, Cheng Y F, Zhu W Y. Effects of low protein diets on the metabolites and microbial community in the Caecum of fattening pigs[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(10): 5-9 (in Chinese with English abstract). |
| [11] |
Pieper R, Kröger S, Richter J F, et al. Fermentable fiber ameliorates fermentable protein-induced changes in microbial ecology, but not the mucosal response, in the colon of piglets[J]. The Journal of Nutrition, 2012, 142(4): 661-667. DOI:10.3945/jn.111.156190 |
| [12] |
Khafipour E, Li S C, Plaizier J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [13] |
Huijsdens X W, Linskens R K, Mak M, et al. Quantification of bacteria adherent to gastrointestinal mucosa by real-time PCR[J]. Journal of Clinical Microbiology, 2002, 40(12): 4423-4427. DOI:10.1128/JCM.40.12.4423-4427.2002 |
| [14] |
Matsuki T, Watanabe K, Fujimoto J, et al. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2004, 70(12): 7220-7228. DOI:10.1128/AEM.70.12.7220-7228.2004 |
| [15] |
Bartosch S, Fite A, MacFarlane G T, et al. Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J]. Applied and Environmental Microbiology, 2004, 70(6): 3575-3581. DOI:10.1128/AEM.70.6.3575-3581.2004 |
| [16] |
Verma R, Verma A K, Ahuja V, et al. Real-time analysis of mucosal flora in patients with inflammatory bowel disease in India[J]. Journal of Clinical Microbiology, 2010, 48(11): 4279-4282. DOI:10.1128/JCM.01360-10 |
| [17] |
秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农业大学学报, 1982, 5(4): 110-116. Qin W L. Determination of rumen volatile fatty acids by means of gas chromatography[J]. Journal of Nanjing Agricultural University, 1982, 5(4): 110-116 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.1982.04.013 |
| [18] |
Hooper L V, McPherson A J. Immune adaptations that maintain homeostasis with the intestinal microbiota[J]. Nature Reviews Immunology, 2010, 10(3): 159-169. DOI:10.1038/nri2710 |
| [19] |
Le Chatelier E, Nielsen T, Qin J J, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500(7464): 541-546. DOI:10.1038/nature12506 |
| [20] |
Ye J Z, Lü L, Wu W R, et al. Butyrate protects mice against methionine-choline-deficient diet-induced non-alcoholic steatohepatitis by improving gut barrier function, attenuating inflammation and reducing endotoxin levels[J]. Frontiers in Microbiology, 2018, 9: 1967. DOI:10.3389/fmicb.2018.01967 |
| [21] |
Lü L X, Fang D Q, Shi D, et al. Alterations and correlations of the gut microbiome, metabolism and immunity in patients with primary biliary cirrhosis[J]. Environmental Microbiology, 2016, 18(7): 2272-2286. DOI:10.1111/1462-2920.13401 |
| [22] |
Chen L M, Xu Y S, Chen X Y, et al. The maturing development of gut microbiota in commercial piglets during the weaning transition[J]. Frontiers in Microbiology, 2017, 8: 1688. DOI:10.3389/fmicb.2017.01688 |
| [23] |
Peran L, Sierra S, Comalada M, et al. A comparative study of the preventative effects exerted by two probiotics, Lactobacillus reuteri and Lactobacillus fermentum, in the trinitrobenzenesulfonic acid model of rat colitis[J]. The British Journal of Nutrition, 2007, 97(1): 96-103. DOI:10.1017/S0007114507257770 |
| [24] |
Yang C W, Zhu X, Liu N, et al. Lactoferrin up-regulates intestinal gene expression of brain-derived neurotrophic factors BDNF, UCHL1 and alkaline phosphatase activity to alleviate early weaning diarrhea in postnatal piglets[J]. The Journal of Nutritional Biochemistry, 2014, 25(8): 834-842. DOI:10.1016/j.jnutbio.2014.03.015 |
| [25] |
Naidu A S, Arnold R R. Influence of lactoferrin on host-microbe interactions[M]//Lactoferrin. Totowa, NJ:Humana Press, 1997:259-275.
|
| [26] |
den Besten G, van Eunen K, Groen A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [27] |
Ríos-Covián D, Ruas-Madiedo P, Margolles A, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology, 2016, 7: 185. |
| [28] |
Peng L Y, Li Z R, Green R S, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in caco-2 cell monolayers[J]. The Journal of Nutrition, 2009, 139(9): 1619-1625. DOI:10.3945/jn.109.104638 |
| [29] |
李秋玲.重组人乳铁蛋白奶粉对仔猪免疫应答和骨形成的影响[D].北京: 中国农业大学, 2014. Li Q L. Effects of transgenic cow's milk containing recombinant human lactoferrin on immune responses and bone formation in piglets[D]. Beijing: China Agricultural University, 2014(in Chinese with English abstract). |
| [30] |
Tian S Y, Wang J, Yu H, et al. Changes in ileal microbial composition and microbial metabolism by an early-life galacto-oligosaccharides intervention in a neonatal porcine model[J]. Nutrients, 2019, 11(8): 1753. DOI:10.3390/nu11081753 |
| [31] |
Comstock S S, Reznikov E A, Contractor N, et al. Dietary bovine lactoferrin alters mucosal and systemic immune cell responses in neonatal piglets[J]. The Journal of Nutrition, 2014, 144(4): 525-532. DOI:10.3945/jn.113.190264 |




