文章信息
- 李纯静, 周天缘, 于正青, 储稳, 徐立新, 宋小凯, 严若峰, 李祥瑞
- LI Chunjing, ZHOU Tianyuan, YU Zhengqing, CHU Wen, XU Lixin, SONG Xiaokai, YAN Ruofeng, LI Xiangrui
- 刚地弓形虫热休克蛋白21体外条件下对小鼠巨噬细胞功能的影响
- Effects of Toxoplasma gondii heat shock protein 21 on the function of mouse macrophage in vitro
- 南京农业大学学报, 2021, 44(1): 136-143
- Journal of Nanjing Agricultural University, 2021, 44(1): 136-143.
- http://dx.doi.org/10.7685/jnau.201912025
-
文章历史
- 收稿日期: 2019-12-13
刚地弓形虫(Toxoplasma gondii, Tg)是极为重要的人畜共患病病原, 能够感染大多数温血动物[1]。猫是弓形虫终末宿主, 人类和其他温血脊椎动物是中间宿主。在人体免疫系统正常时, 弓形虫的大多数原发感染为无症状或仅引起轻度症状, 如全身不适、淋巴结肿大和发烧等[2]; 而免疫力低下的人群, 如孕妇和新生儿易感染严重而发病, 有的甚至会导致死亡[3]。
巨噬细胞在先天免疫和获得性免疫应答中起着重要作用, 可以通过自身的凋亡、增殖、趋化性、吞噬作用以及分泌细胞因子和一氧化氮(NO)等, 消灭机体内的病原体。弓形虫感染正常宿主后, 巨噬细胞不仅是控制和杀死细胞内弓形虫的重要效应细胞, 还可以作为弓形虫复制和存活的长期宿主细胞。因此, 弓形虫蛋白在体外条件下对巨噬细胞功能的影响能够在一定程度上反映该蛋白在宿主体内的功能。
热休克蛋白(heat shock protein, HSP)依据分子质量、结构和性质而分为几类, 共同组成一个家族, 在正常和极端条件下参与蛋白质的正确折叠[4]。小分子热休克蛋白是相对分子质量为(12~43)×103的多种应激诱导蛋白, 几乎存在于所有研究的生物体中[5]。刚地弓形虫热休克蛋白21(TgHSP21)位于弓形虫细胞质中[6]。基因敲除突变体试验证明, 热休克蛋白30(HSP30)对于组织包囊形成及其功能发挥是非必需的[7]。而HSP21与HSP30的亚细胞定位相同, 因此, 有学者认为HSP21可能弥补敲除突变体中HSP30的部分功能[6]。de Miguel等[6]认为TgHSP21在弓形虫存活中起重要作用。但有关该蛋白对宿主免疫功能的影响尚不清楚。因此, 本研究选择重组TgHSP21(rTgHSP21)与小鼠巨噬细胞系(mouse macrophages, Ana-1)共同作用, 观察rTgHSP21对Ana-1细胞活性及免疫功能的影响, 以期对该蛋白在虫体与宿主免疫系统的相互作用有新的认识。
1 材料与方法 1.1 试验材料 1.1.1 试验动物180~220 g Sprague Dawley(SD)品系大鼠购自南京青龙山动物繁殖场, 并于南京农业大学实验动物中心饲养。本研究中动物饲养均按照南京农业大学动物伦理委员会的指导进行操作, 所有动物实验均遵循中国动物福利委员会的指导原则, 并经江苏省科学技术厅批准。
1.1.2 弓形虫虫株、细胞刚地弓形虫人源国际标准株(RH株)和Ana-1细胞保存于南京农业大学兽医寄生虫病学实验室。人皮肤成纤维细胞(human foreskin fibroblast, HFF)由华中农业大学申邦教授赠送。
1.1.3 载体与试剂原核表达载体pET-32a保存于南京农业大学兽医寄生虫病学实验室。无缝克隆试剂盒(ClonExpress Ultra One Step Cloning Kit)购自南京诺唯赞生物科技有限公司。Transwell细胞小室购自南京翼飞雪生物科技有限公司。Annexin V-FITC(异硫氰酸荧光素标记的磷脂酰丝氨酸蛋白V)细胞凋亡试剂盒购自南京福麦斯技术有限公司。FITC-dextran(异硫氰酸荧光素-葡聚糖, Wt40000)购自西格玛奥德里奇(上海)贸易有限公司。细胞因子ELISA检测试剂盒购自武汉博士德生物工程有限公司。免疫荧光染色试剂盒、Cell Counting kit-8(CCK-8)试剂盒购自南京有晴生物科技有限公司。总NO检测试剂盒(S0024)购自南京金益柏生物科技有限公司。其余试剂均为国产分析纯。
1.2 试验方法 1.2.1 细胞和虫体的培养将HFF细胞和Ana-1细胞从液氮中取出, 37 ℃水浴复苏后在含10% FBS(胎牛血清)和1%双抗的改良伊格尔培养基(DMEM)培养液中进行传代培养。HFF生长至80%融合时, 从液氮中取出弓形虫RH株, 于37 ℃水浴复苏, 离心后加入到HFF细胞中培养, 第2天更换新培养基。虫体生长至60%左右时, 刮下细胞, 注射器吹打使细胞破碎, 释出虫体, 5 μm过滤纯化。一部分继续培养, 一部分用于提取虫体可溶性蛋白和制备大鼠抗弓形虫血清。
1.2.2 重组质粒的构建与表达用RNA提取试剂盒提取纯化后的RH株速殖子的RNA并反转录(RT)获得cDNA。根据TgHSP21基因序列(GenBank ID:AY756061)运用Primer Premier 5.0设计如下引物对:HSP21-F:5′-GCCATGGCTGATATCGGATCCATGGCATCCCCAACCT-3′, HSP21-R:5′-CTCGAGTGCGGCCGC-AAGCTTTTAAGCGATCTGAATCTTCTTT-3′, 分别以BamHⅠ和Hind Ⅲ为上、下游引物的酶切位点。以cDNA为模板进行PCR扩增并纯化PCR产物, 将PCR产物克隆到已用BamHⅠ和HindⅢ酶切处理的原核表达载体pET-32a并转化大肠杆菌DH5α感受态细胞。挑选单菌落, 扩大培养后提取质粒并转入至大肠杆菌BL21感受态细胞中。再次挑选单菌落, 扩大培养后提取质粒进行双酶切鉴定, 阳性质粒命名为pET-32a/TgHSP21。阳性菌落在含50 μg·mL-1氨苄青霉素的LB(Luria-Bertani)液体培养基中培养, 经0.1 mmol·mL-1异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导、离心收集菌体, 反复冻融、超声破碎后, 离心收集上清液。上清液经组氨酸(His)标签蛋白纯化柱纯化、无K+的磷酸缓冲盐溶液(PBS)透析后进行SDS-PAGE(十二烷基硫酸钠-聚丙稀酰胺凝胶电泳)分析。纯化后的重组蛋白rTgHSP21经过滤除菌后分装, 保存于-80 ℃备用。
1.2.3 rTgHSP21抗血清和大鼠弓形虫感染血清的制备rTgHSP21抗血清制备:将600 μL(200 μg)的rTgHSP21与600 μL弗式完全佐剂乳化, 背部皮下多点注射大鼠进行初免。2周后, 取相同质量的重组蛋白质与等体积的弗氏不完全佐剂乳化后经皮下注射进行二免。然后, 每隔1周进行第3~5次免疫, 方法及剂量同二免。五免后1周采血, 分离血清, 于-80 ℃保存备用。
大鼠弓形虫感染血清的制备:将纯化后的弓形虫速殖子用PBS稀释至虫体含量为1×106 mL-1的弓形虫悬液, 取0.5 mL悬液腹腔注射大鼠, 21 d后采血, 分离血清, 于-80 ℃保存备用。
1.2.4 rTgHSP21的Western blot分析取20 μg rTgHSP21进行SDS-PAGE, 然后将蛋白转印已用甲醇激活的聚偏二氟乙烯(PVDF)膜。将膜放入含5%脱脂牛奶的PBST(含Tween-20的PBS)溶液中37 ℃封闭1 h, 再与大鼠弓形虫感染血清(1:100稀释, 一抗)37 ℃共孵育2 h。弃孵育液后, 经PBST漂洗3次后, 以辣根过氧化物酶(HRP)标记的羊抗大鼠IgG(1:5 000稀释)为二抗对所有膜进行37 ℃孵育1 h, PBST漂洗后, 加3, 3-二氨基苯联胺(DAB)显色并拍照。以正常的大鼠血清作为阴性对照。
1.2.5 rTgHSP21与Ana-1细胞结合试验将处于对数期生长的Ana-1细胞稀释至1×105 mL-1, 接种1 mL于24孔板中, 加入rTgHSP21使其终质量浓度为20 μg·mL-1。设立空白对照和空载体蛋白(20 μg·mL-1)对照。混匀后于37 ℃培养1 h后用PBS漂洗, 再用200 μL PBS重悬细胞后滴加到用多聚赖氨酸处理过的防脱载玻片上。4%多聚甲醛固定30 min后用含5%BSA(牛血清白蛋白)的PBS封闭。以1:500稀释后的大鼠抗rTgHSP21血清为一抗, Cy3标记的山羊抗大鼠IgG(1:3 000)为二抗, 孵育, PBS漂洗后用4, 6-二氨基-2-苯基吲哚(DAPI)复染5 min, 封片后在激光共聚焦显微镜下观察并拍照。
1.2.6 rTgHSP21对Ana-1细胞增殖影响的测定将传代培养的Ana-1细胞稀释至5×105 mL-1, 将其加入到96孔细胞培养板中, 每孔100 μL, 再向每孔中分别加入不同质量浓度(5、10、20、40、80 μg·mL-1)的rTgHSP21;另设20 μg·mL-1的pET-32a(空载体)诱导表达对照。在细胞培养箱中培养24 h后, 向每孔加入10 μL CCK-8试剂, 37 ℃继续培养1 h, 用酶标仪测定D450。试验重复3次。
1.2.7 rTgHSP21对Ana-1细胞吞噬影响的测定调整传代培养的Ana-1细胞至浓度为1×106 mL-1, 取1 mL加入到24孔细胞板中。用不同质量浓度(5、10、20、40、80 μg·mL-1)的rTgHSP21处理细胞。同时设20 μg·mL-1的pET-32a空载体诱导表达对照和PBS空白对照。在细胞培养箱中培养24 h, 离心收集细胞, 用预冷的含2% FBS的PBS洗涤2次。取100 μL预冷的PBS重悬细胞, 与等体积的FITC-dextran(1 mg·mL-1)轻轻混匀, 37 ℃避光孵育1 h。2 500 r·min-1离心5 min, 用含2% FBS的预冷PBS洗涤后, 用500 μL PBS重悬细胞, 用流式细胞仪检测Ana-1细胞吞噬活性。试验重复3次。
1.2.8 rTgHSP21对Ana-1细胞凋亡影响的测定调整传代培养的细胞至浓度为1×106 mL-1, 用不同质量浓度(5、10、20、40、80 μg·mL-1)的rTgHSP21、pET-32a空载体(20 μg·mL-1)以及PBS培养Ana-1细胞24 h后, 用凋亡试剂盒中的缓冲液重复洗涤Ana-1细胞2次。用100 μL缓冲液重悬细胞后与10 μL膜联蛋白V-FITC混匀, 室温条件下避光孵育15 min。用缓冲液洗涤2次后, 再用500 μL缓冲液重悬细胞, 加入5 μL碘化丙啶轻轻混匀, 5 min内用流式细胞仪检测细胞凋亡情况。试验重复3次。
1.2.9 rTgHSP21对Ana-1细胞迁移性影响的测定将传代培养的Ana-1细胞稀释至1×105 mL-1, 然后取1 mL加至24孔板中, 分别向每孔中添加终质量浓度为5、10、20、40、80 μg·mL-1的rTgHSP21。同时设置20 μg·mL-1 pET-32a空载体诱导表达对照和PBS空白对照, 在37 ℃培养24 h后计数细胞。取新的24孔培养板加入900 μL含10%FBS和1%双抗的DMEM培养基和趋化因子(2 μg·mL-1)。另设未加趋化因子的空白对照。Transwell细胞小室放置在24孔培养板内, 取上述与蛋白共培养的细胞, 用200 μL细胞培养液重悬, 加至Transwell细胞小室的上室。以未经重组蛋白刺激的细胞加趋化因子为阳性对照组, 以未经蛋白刺激和不加趋化因子的细胞为空白对照组。37 ℃培养24 h后计数迁移至24孔内的细胞数, 计算迁移率。每组设3个重复。
1.2.10 rTgHSP21影响Ana-1细胞分泌NO和细胞因子的测定将Ana-1细胞以DMEM培养基稀释至1×106 mL-1后接种24孔板, 分别向24孔板中加入不同质量浓度(5、10、20、40、80 μg·mL-1)的rTgHSP21, 并设置20 μg·mL-1 pET-32a空载体诱导表达对照和PBS空白对照。在细胞培养箱中培养24 h后, 2 500 r·min-1离心5 min, 收集上清液。按照总NO试剂盒和IL-6、TNF-α、IL-12、IL-1β ELISA试剂盒操作说明测定上清液中NO和细胞因子含量。
1.3 数据分析使用GraphPad Prism 5软件进行方差分析, 采用One-way ANOVA方法比较组间差异显著性。
2 结果与分析 2.1 TgHSP21的克隆表达和重组蛋白rTgHSP21的纯化PCR产物的凝胶电泳结果显示, 在588 bp处出现与预期结果相同的条带(图 1-A)。将构建的pET-32a/TgHSP21表达载体用BamHⅠ和Hind Ⅲ双酶切后, 进行核酸电泳鉴定, 在588 bp和5 900 bp处各有1条清晰的条带, 与插入片段和载体片段大小一致(图 1-B)。测序结果表明, pET-32a/TgHSP21载体插入片段序列正确。将纯化后的重组蛋白进行SDS-PAGE, 得到清晰单一的条带(图 1-C)。

|
图 1 刚地弓形虫HSP21基因的克隆与鉴定和rTgHSP21纯化的电泳鉴定
Fig. 1 Cloning and identification of Toxoplasma gondii HSP21 gene and electrophoresis identification of rTgHSP21 purification
A. TgHSP21开放阅读框的PCR结果; B. pET-32a/TgHSP21双酶切鉴定; C.纯化后rTgHSP21的SDS-PAGE分析。 M1. DNA标准DL 2000;M2. DNA标准DL 5000;M3.蛋白标准品; 1. PCR扩增产物; 2.经BamHⅠ和HindⅢ双酶切的重组质粒; 3.纯化后的rTgHSP21。 A. PCR results of TgHSP21 ORF; B. Identification of recombinant plasmid pET-32a/TgHSP21 digestion by restriction enzyme; C. SDS-PAGE of purified rTgHSP21. M1. DNA marker DL 2000;M2. DNA marker DL 5000;M3. Protein marker; 1. Products of PCR; 2. Recombinant plasmid digested by BamHⅠand Hind Ⅲ enzymes; 3. Purified rTgHSP21 protein. |
DNAstar软件预测分析结果表明, rTgHSP21蛋白的相对分子质量为21.5×103, 标签蛋白相对分子质量为18×103。Western blot分析结果(图 2)显示1条相对分子质量约40×103的条带, 表明rTgHSP21能被大鼠弓形虫感染血清识别, 说明rTgHSP21具有良好的免疫原性。
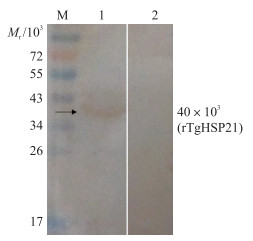
|
图 2 rTgHSP21的Western blot分析 Fig. 2 Western blot analysis of rTgHSP21 M.蛋白标准品; 1.感染刚地弓形虫的大鼠血清; 2.健康大鼠血清。 M. Protein marker; 1. The serum of rat infected with T.gondii was used as primary antibody; 2. The primary antibody was the serum from healthy rat. |
激光共聚焦显微镜检测结果(图 3)显示, rTgHSP21组细胞膜周围有红光, 而空载体对照和PBS对照无红光出现, 所有组的细胞核均发出蓝色荧光, 说明rTgHSP21能够与Ana-1细胞表面结合。
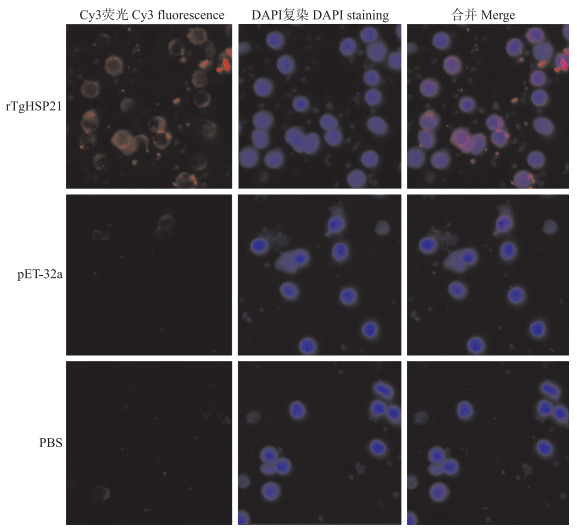
|
图 3 rTgHSP21与Ana-1细胞结合的免疫荧光鉴定(×100) Fig. 3 Immunofluorescence identification of binding of rTgHSP21 and Ana-1 cells(×100) rTgHSP21∶rTgHSP21组The group treated with rTgHSP21; pET-32a∶pET-32a空载体组The group treated with pET-32a; PBS∶PBS对照组The group treated with PBS。下同The same as below. |
从图 4-A可见:与空载体对照和PBS对照相比, 低质量浓度(5和10 μg·mL-1)rTgHSP21能够极显著促进Ana-1细胞的增殖(P<0.001), 而其他质量浓度的rTgHSP21对Ana-1细胞增殖没有明显影响(P>0.05)。
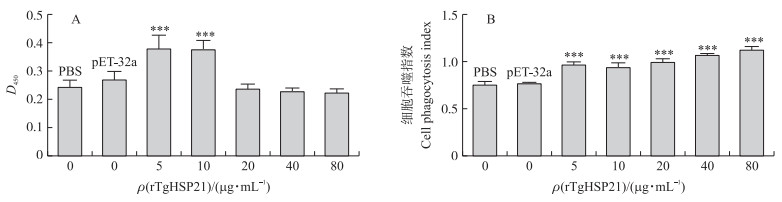
|
图 4 rTgHSP21对Ana-1细胞增殖(A)和细胞吞噬功能(B)的影响 Fig. 4 Effects of rTgHSP21 on proliferation(A)and phagocytosis(B)of Ana-1 cells 与pET-32a组相比Compared with pET-32a group, ***P<0.001.下同The same as follows. |
与PBS和空载体对照相比, 各质量浓度的rTgHSP21均能显著促进Ana-1细胞的吞噬活性(P<0.001)(图 4-B)。
2.5 rTgHSP21对Ana-1细胞凋亡的影响如图 5所示:与PBS对照和空载体对照相比, 10 μg·mL-1的rTgHSP21能极显著促进Ana-1细胞的早期凋亡(P<0.001), 而其他浓度的rTgHSP21对Ana-1细胞的早期凋亡没有明显影响(P>0.05)。10 μg·mL-1的rTgHSP21极显著促进Ana-1细胞的早期和晚期凋亡(P<0.001), 而20、40和80 μg·mL-1的rTgHSP21仅极显著促进Ana-1细胞的晚期凋亡(P<0.001)。
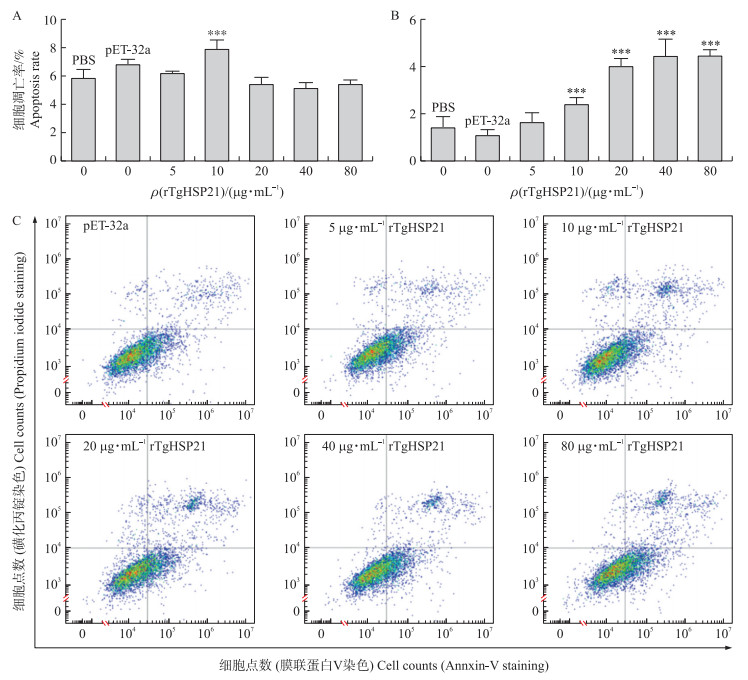
|
图 5 rTgHSP21对Ana-1细胞凋亡的影响 Fig. 5 Effects of rTgHSP21 on the apoptosis of Ana-1 cells A.早期凋亡; B.晚期凋亡; C.Ana-1细胞的FITC-PI双染流式分析。 A. Early stage apoptosis; B. Late stage apoptosis; C. Ana-1 cells were stained with FITC-PI by flow cytometry. |
从图 6可见:Ana-1细胞在PBS对照组中迁移率极低, 而在加空载体的pET-32a对照组中迁移率达到35%左右。rTgHSP21与Ana-1细胞共同孵育后, Ana-1细胞的迁移(率)受到极显著抑制(P<0.001), 且具有浓度依赖性。
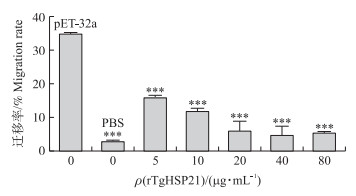
|
图 6 rTgHSP21对Ana-1细胞迁移的影响 Fig. 6 Effects of rTgHSP21 on Ana-1 cells migration |
如图 7所示:将rTgHSP21与Ana-1细胞共同孵育后, rTgHSP21仅在极高质量浓度(80 μg·mL-1)时显著促进Ana-1细胞分泌NO(P<0.001), 而在其他浓度下, 对Ana-1细胞分泌NO没有显著影响(P>0.05)。
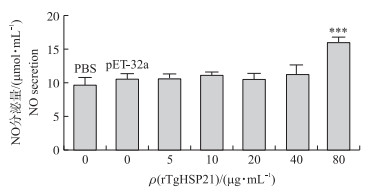
|
图 7 rTgHSP21对Ana-1细胞分泌NO的影响 Fig. 7 Effects of rTgHSP21 on the nitric oxide(NO) secretion of Ana-1 cells |
如图 8所示:与PBS对照组和空载体对照组相比, 受rTgHSP21刺激后, Ana-1细胞的IL-1β分泌量无明显变化(P>0.05), TNF-α分泌量极显著上升(P<0.001), IL-6分泌量随着rTgHSP21质量浓度的增加而增加(P<0.001)。当rTgHSP21质量浓度大于10 μg·mL-1时, IL-12的分泌量极显著降低(P<0.001)。
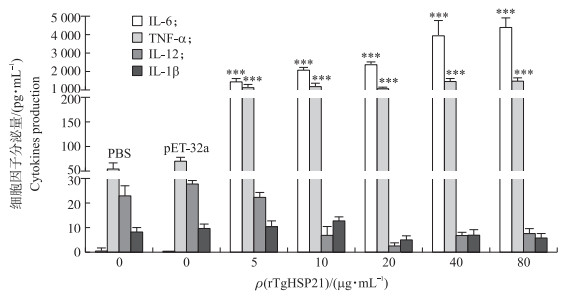
|
图 8 rTgHSP21对Ana-1细胞分泌4种细胞因子的影响 Fig. 8 Effects of rTgHSP21 on four cytokines production of Ana-1 cells |
巨噬细胞是免疫应答反应中的一种重要免疫细胞, 参与大部分先天性和获得性免疫反应[8], 并有效参与病原体的清除过程, 在炎症和宿主防御中起着核心作用[9]。不同的病原体感染宿主, 巨噬细胞能够通过吞噬作用并分泌不同的细胞因子和Fcγ受体、Toll样受体及NO等发挥免疫功能[10]。因此, 探究机体巨噬细胞的免疫机制对弓形虫等寄生虫的防治研究具有重要意义。本试验结果显示:rTgHSP21能够与Ana-1细胞结合, 并且以适当浓度刺激细胞后, Ana-1细胞的增殖、吞噬、凋亡、趋化性和细胞因子的分泌等均发生明显改变, 由此可见, rTgHSP21能够在体外调节Ana-1细胞的免疫功能。
巨噬细胞的吞噬作用是机体抵抗病原体感染的重要宿主反应[11], 它不仅能够对侵入的病原体进行识别和吞噬, 而且能够和机体其他的免疫过程共同作用以抵抗病原体的侵袭[12]。本试验结果显示, 与rTgHSP21互相作用后, Ana-1细胞的吞噬能力显著提升。有报道称, 弓形虫从速殖子到缓殖子阶段的转化与HSP90有关, 在缓殖子分化条件下, 虫体HSP90蛋白水平上升[13]。HSP21和HSP90同属于热休克蛋白家族, 可能具有同样的功能。在本试验中, 5和10 μg·mL-1rTgHSP21显著促进Ana-1细胞的增殖, 这时弓形虫可能正处于速殖子分化阶段, 需要更多的Ana-1细胞来对其进行清除, 于是Ana-1细胞的增殖明显加快。当rTgHSP21浓度较高时, 可加快弓形虫从速殖子向缓殖子的转化, 不需要更多的Ana-1细胞对其进行清除, 因此巨噬细胞增殖情况和未经rTgHSP21刺激时相差无几。但rTgHSP21促进弓形虫从速殖子到缓殖子阶段转化的机制还需要进一步研究。
在寄生虫感染过程中, 细胞凋亡是宿主对寄生虫的先天性和适应性反应的重要响应机制。此外, 细胞凋亡还具有调节宿主免疫力和组织稳态的基本功能[14]。Nishikawa等[15]研究表明, 寄生虫感染后, 被感染细胞会释放NO和其他可溶性细胞因子, 进而导致其相邻细胞的凋亡, 这有助于机体对病原体的防御。细胞凋亡可以通过外源性(死亡受体)和内在性(线粒体或应激诱导)2种主要途径引发[16]。本试验中, rTgHSP21仅在10 μg·mL-1时促进Ana-1细胞的早期凋亡, 猜测Ana-1细胞的早期凋亡可能需要定量的rTgHSP21进行诱导。rTgHSP21在质量浓度高于10 μg·mL-1时均能诱导Ana-1细胞的晚期凋亡, 这有利于宿主防御寄生虫。此结果表明, rTgHSP21能影响巨噬细胞的凋亡, 但还需要进一步研究作用机制。
迁移是免疫细胞参与机体免疫反应过程的重要步骤, 它通过促进效应细胞募集到感染部位进而启动宿主细胞的免疫应答[17], 否则巨噬细胞作为免疫调节细胞的功能将无法启动[18]。添加趋化因子能够诱导Ana-1细胞的迁移。本试验结果显示, rTgHSP21显著抑制Ana-1细胞的迁移, 不利于巨噬细胞靠近弓形虫体, 进而抑制了机体的免疫应答。因此, 从趋化性角度分析, rTgHSP21能够影响巨噬细胞的迁移。
NO参与宿主的非特异性防御, 在免疫调节中发挥重要作用[19]。机体的NO由内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS)和神经元一氧化氮合酶(nNOS)这3种酶诱导表达, 且NO生成的增加可以抑制寄生虫的增殖[20]。本试验结果显示, rTgHSP21在浓度达到80 μg·mL-1时才显著促进NO的分泌, 而机体内分泌的rTgHSP21量可能达不到本试验的浓度, 因此, rTgHSP21对NO分泌的影响还需进一步研究分析。
除了分泌NO外, 巨噬细胞还分泌多种细胞因子, 如IL-6、IL-12、IL-1β、TNF-α等。IL-6在免疫应答和炎症调节中起着重要作用, 是T细胞早期活化阶段不可缺少的细胞因子[21]。IL-1β是炎性细胞因子, 是炎症的主要调控者[22]。IL-12影响T细胞的发育, 诱导T细胞产生IFNγ并促进Th1分化[23]。IFNγ在机体抗弓形虫感染中起重要作用[24]。TNF-α可以协同IFNγ发挥抗弓形虫作用[25]。本研究中, rTgHSP21显著促进Ana-1细胞分泌IL-6, 这会促进T细胞的活化并利于机体对弓形虫的清除。巨噬细胞TNF-α表达增加可以促进巨噬细胞的抗弓形虫反应, 而IL-12的分泌下降会导致IFNγ分泌减少, 不利于宿主对弓形虫的清除。
| [1] |
Blader I J, Saeij J P. Communication between Toxoplasma gondii and its host:impact on parasite growth, development, immune evasion, and virulence[J]. Apmis, 2009, 117(5/6): 458-476. |
| [2] |
Alday P H, Doggett J S. Drugs in development for toxoplasmosis:advances, challenges, and current status[J]. Drug Design, Development and Therapy, 2017, 11: 273-293. DOI:10.2147/DDDT.S60973 |
| [3] |
Robert-Gangneux F, Dardé M L. Epidemiology of and diagnostic strategies for toxoplasmosis[J]. Clinical Microbiology Reviews, 2012, 25(3): 264-296. |
| [4] |
Gusev N B, Bogatcheva N V, Marston S B. Structure and properties of small heat shock proteins(sHsp)and their interaction with cytoskeleton proteins[J]. Biochemistry(Moscow), 2002, 67(5): 511-519. |
| [5] |
Narberhaus F. A-crystallin-type heat shock proteins:socializing minichaperones in the context of a multichaperone network[J]. Microbiology and Molecular Biology Reviews, 2002, 66(1): 64-93. DOI:10.1128/MMBR.66.1.64-93.2002 |
| [6] |
de Miguel N, Echeverria P C, Angel S O. Differential subcellular localization of members of the Toxoplasma gondii small heat shock protein family[J]. Eukaryotic Cell, 2005, 4(12): 1990-1997. DOI:10.1128/EC.4.12.1990-1997.2005 |
| [7] |
Zhang Y W, Kim K, Ma Y F, et al. Disruption of the Toxoplasma gondii bradyzoite-specific gene BAG1 decreases in vivo cyst formation[J]. Molecular Microbiology, 1999, 31(2): 691-701. DOI:10.1046/j.1365-2958.1999.01210.x |
| [8] |
Chazaud B. Macrophages:supportive cells for tissue repair and regeneration[J]. Immunobiology, 2014, 219(3): 172-178. DOI:10.1016/j.imbio.2013.09.001 |
| [9] |
Gordon S, Martinez F O. Alternative activation of macrophages:mechanism and functions[J]. Immunity, 2010, 32(5): 593-604. DOI:10.1016/j.immuni.2010.05.007 |
| [10] |
Wynn T A, Chawla A, Pollard J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455. DOI:10.1038/nature12034 |
| [11] |
Weiss G, Schaible U E. Macrophage defense mechanisms against intracellular bacteria[J]. Immunological Reviews, 2015, 264(1): 182-203. DOI:10.1111/imr.12266 |
| [12] |
Rückerl D, Allen J E. Macrophage proliferation, provenance, and plasticity in macroparasite infection[J]. Immunological Reviews, 2014, 262(1): 113-133. DOI:10.1111/imr.12221 |
| [13] |
Echeverria P C, Matrajt M, Harb O S, et al. Toxoplasma gondii Hsp90 is a potential drug target whose expression and subcellular localization are developmentally regulated[J]. Journal of Molecular Biology, 2005, 350(4): 723-734. DOI:10.1016/j.jmb.2005.05.031 |
| [14] |
Schaumburg F, Hippe D, Vutova P, et al. Pro- and anti-apoptotic activities of protozoan parasites[J]. Parasitology, 2006, 132(S1): S69-S85. DOI:10.1017/S0031182006000874 |
| [15] |
Nishikawa Y, Kawase O, Vielemeyer O, et al. Toxoplasma gondii infection induces apoptosis in noninfected macrophages:role of nitric oxide and other soluble factors[J]. Parasite Immunology, 2007, 29(7): 375-385. DOI:10.1111/j.1365-3024.2007.00956.x |
| [16] |
Bruchhaus I, Roeder T, Rennenberg A, et al. Protozoan parasites:programmed cell death as a mechanism of parasitism[J]. Trends in Parasitology, 2007, 23(8): 376-383. DOI:10.1016/j.pt.2007.06.004 |
| [17] |
Gadahi J A, Yongqian B, Ehsan M, et al. Haemonchus contortus excretory and secretory proteins(HcESPs)suppress functions of goat PBMCs in vitro[J]. Oncotarget, 2016, 7(24): 35670-35679. DOI:10.18632/oncotarget.9589 |
| [18] |
Doherty D E, Haslett C, Tonnesen M G, et al. Human monocyte adherence:a primary effect of chemotactic factors on the monocyte to stimulate adherence to human endothelium[J]. Journal of Immunology, 1987, 138(6): 1762-1771. |
| [19] |
James S L. Role of nitric oxide in parasitic infections[J]. Microbiological Reviews, 1995, 59(4): 533-547. DOI:10.1128/MR.59.4.533-547.1995 |
| [20] |
Dincel G C, Atmaca H T. Nitric oxide production increases during Toxoplasma gondii encephalitis in mice[J]. Experimental Parasitology, 2015, 156: 104-112. DOI:10.1016/j.exppara.2015.06.009 |
| [21] |
Weigmann B, Lehr H A, Yancopoulos G, et al. The transcription factor NFATc2 controls IL-6-dependent T cell activation in experimental colitis[J]. The Journal of Experimental Medicine, 2008, 205(9): 2099-2110. DOI:10.1084/jem.20072484 |
| [22] |
Dinarello C A. A clinical perspective of IL-1β as the gatekeeper of inflammation[J]. European Journal of Immunology, 2011, 41(5): 1203-1217. DOI:10.1002/eji.201141550 |
| [23] |
Vignali D A A, Kuchroo V K. IL-12 family cytokines:immunological playmakers[J]. Nature Immunology, 2012, 13(8): 722-728. DOI:10.1038/ni.2366 |
| [24] |
Suzuki Y, Orellana M, Schreiber R, et al. Interferon-gamma:the major mediator of resistance against Toxoplasma gondii[J]. Science, 1988, 240(4851): 516-518. DOI:10.1126/science.3128869 |
| [25] |
方艳秋, 许淑芬, 谭岩. TNFα、IL-6、IL-4、IL-2对IFNγ抗弓形虫感染作用的影响[J]. 免疫学杂志, 2000, 16(3): 196-199. Fang Y Q, Xu S F, Tan Y. Effects of TNFα, IL-6, IL-4 and IL-2 on IFNγ-induced toxoplasmastatic activity[J]. Immunological Journal, 2000, 16(3): 196-199 (in Chinese with English abstract). |




