文章信息
- 柳丽娜, 刘晔, 李媛媛, 陈发棣, 陈素梅, 房伟民, 管志勇
- LIU Lina, LIU Ye, LI Yuanyuan, CHEN Fadi, CHEN Sumei, FANG Weimin, GUAN Zhiyong
- 38个茶用菊品种苗期对黑斑病的抗性鉴定
- Resistance identification to black spot disease of 38 cultivars of chrysanthemum for tea at seedling stage
- 南京农业大学学报, 2021, 44(1): 68-77
- Journal of Nanjing Agricultural University, 2021, 44(1): 68-77.
- http://dx.doi.org/10.7685/jnau.202004012
-
文章历史
- 收稿日期: 2020-04-07
菊花(Chrysanthemum morifolium Ramat.)起源于中国, 栽培历史长达2 500多年, 品种多达3 000以上[1], 是我国种植最广泛的一种传统名花, 除了观赏栽培外, 茶用菊和药用菊的产业规模更大。久饮菊花茶, 能够利血气, 使身体轻盈, 能耐老而延寿[2]。在茶用菊产业化栽培中, 各类真菌病害是各产区的普遍性问题。由链格孢属(Alternaria sp.)真菌引起的茶用菊黑斑病严重制约其规模化生产, 且在高温高湿环境条件下破坏性更强。被感染的菊花在发病初期叶片上会零星分散着面积较小、呈褐色的坏死斑点; 发展后病斑逐渐扩大, 形成圆形、椭圆形和不规则形的黑褐色病斑; 在高温、高湿条件下, 病斑上会着生稀疏的灰白色霉层, 通常数个病斑连片汇合, 叶肉组织完全坏死, 进而导致花形扭曲、花朵衰败甚至整株枯萎和死亡, 严重影响茶用菊的食品安全与商业价值[3]。喷施农药进行防治, 农药残留会对人的身体健康造成威胁, 也会造成病原抗药性问题, 还会污染生态环境并阻碍绿色与环境友好型农业的可持续性发展[4]。
采用抗病品种进行生产是防治植物病害最经济的方法, 而抗病性鉴定和抗病种质资源的筛选是抗病育种工作的基础, 也是抗性生理和遗传研究的前提。目前已有多种蔬菜、果树针对链格孢属真菌引起的叶斑病的抗病性鉴定报道[5-6]。许高娟[7]对33种菊花近缘种属植物苗期黑斑病抗性进行了鉴定。目前, 还未见针对批量茶用菊种质资源抗病性鉴定方面的报道。抗病茶用菊种质资源的发掘对推动茶用菊抗病品种选育具有重要意义, 不同茶用菊品种的抗性鉴定是获得典型抗病材料的基础。在苗期进行人工接种鉴定是筛选茶用菊抗病品种经济有效的方法, 且具有操作简单、结果可靠、周期短等优点, 为抗性品种筛选的常用方法[8]。
植物的防御抵抗机制主要包括物理结构抗性和化学物质抗性, 其中, 物理结构抗性是植物利用自身的结构屏障, 例如表皮毛、气孔、角质层和细胞壁等阻挡病原物入侵及扩散[9]。对于植物而言, 表皮毛是植物与病原菌最初接触的地方, 也是植物识别外来威胁并进行防御的起点[10]。气孔是病原菌入侵最直接的通道, 其密度、大小、开闭程度等也会影响病原菌能否成功入侵[11]。本研究基于38个茶用菊品种的抗性鉴定结果对不同抗、感茶用菊品种叶片的表皮毛与气孔密度进行分析, 探讨其对黑斑病的防御机制, 为茶用菊抗黑斑病机制解析提供一定的理论依据。
1 材料与方法 1.1 试验材料病原菌分离自茶用菊品种‘福白菊’, 采自湖北省麻城市福田河镇纯阳山‘福白菊’生产基地。供试的38个茶用菊品种来自南京农业大学中国菊花种质资源保存中心, 详见表 1。
| 编号Code | 品种Cultivar |
| 1 | 杭白菊Hangbaiju |
| 2 | 福白菊Fubaiju |
| 3 | 射阳红心菊Sheyanghongxinju |
| 4 | 射阳大白菊Sheyangdabaiju |
| 5 | 滁菊Chuju |
| 6 | 七月白Qiyuebai |
| 7 | 九月菊Jiuyueju |
| 8 | 黄香梨Huangxiangli |
| 9 | 白小香菊Baixiaoxiangju |
| 10 | 黄小香菊Huangxiaoxiangju |
| 11 | 小黄菊Xiaohuangju |
| 12 | 河北香菊Hebeixiangju |
| 13 | 桐乡小黄菊Tongxiangxiaohuangju |
| 14 | 金丝黄菊Jinsihuangju |
| 15 | 皇菊Huangju |
| 16 | 大洋菊Dayangju |
| 17 | 金菊1号Jinju 1 |
| 18 | 金菊3号Jinju 3 |
| 19 | 亳菊Boju |
| 20 | 迟黄Chihuang |
| 21 | 晚贡菊Wangongju |
| 22 | 黄山贡菊Huangshangongju |
| 23 | 白金菊Baijinju |
| 24 | 川百菊Chuanbaiju |
| 25 | 满天星Mantianxing |
| 26 | 黄山黄菊Huangshanhuangju |
| 27 | 苏菊6号Suju 6 |
| 28 | 苏菊7号Suju 7 |
| 29 | 苏菊8号Suju 8 |
| 30 | 苏菊9号Suju 9 |
| 31 | 苏菊10号Suju 10 |
| 32 | 苏菊11号Suju 11 |
| 33 | 苏菊12号Suju 12 |
| 34 | 苏菊13号Suju 13 |
| 35 | 苏菊14号Suju 14 |
| 36 | 苏菊15号Suju 15 |
| 37 | 休宁贡菊Xiuninggongju |
| 38 | 休宁药菊Xiuningyaoju |
采用组织块分离法分离病原菌。取‘福白菊’病叶, 经自来水冲洗干净, 再用无菌蒸馏水冲洗5 min。此后的操作均在超净工作台中进行。将病叶置于盛有70%(体积分数)乙醇的容器中消毒30 s, 再置于15%的H2O2中消毒15 min, 重复消毒3次, 最后用无菌蒸馏水冲洗干净, 灭菌滤纸吸干叶片表面水分[12]。用组培刀将病斑部位分解成面积约为0.25 cm2的组织块。将叶片组织块接种在马铃薯葡萄糖琼脂(PDA)培养基上, 25 ℃条件下暗培养3 d, 当培养的组织块周围长出肉眼可见的菌落时, 用灭菌打孔器从单个菌落边缘取出菌饼转接到新的PDA培养基上; 当菌落长出黄褐色霉层时, 说明已经产生孢子, 可在超净工作台内挑取少量孢子, 制作切片, 在光学显微镜下观察并挑取单孢纯化培养。采用冷冻保存法, 用灭菌打孔器沿纯化菌落边缘切取直径约为5 mm的菌块3块, 置于装有800 μL马铃薯葡萄糖水(PDB)液体培养基和800 μL 30%甘油的2 mL灭菌离心管中, -80 ℃冰箱中存储备用。
1.2.2 菌株形态与分子生物学鉴定形态鉴定:将在PDA培养基上活化分离到的菌株置于25 ℃培养箱中黑暗培养7 d, 观察菌落形状、颜色等外观特征, 再用无菌水冲洗菌落表面富集分生孢子, 制作切片, 并在显微镜下观察分生孢子的形态特征。根据张天宇[13]和Lawrence等[14]的方法对链格孢菌的特征进行鉴定。分子生物学鉴定:采用真菌DNA提取试剂盒(OMEGA生物科技公司)提取所得菌株DNA, 利用PCR技术对病原菌核糖体内转录间隔区18S rDNA-ITS序列进行扩增。扩增采用的引物序列为:ITS1-F:5′-CTTGGT-CATTTAGAGGAAGTAA-3′, ITS4:5′-TCCTCCGCTTATTGATATGC-3′[15], 由上海捷瑞生物工程有限公司合成。PCR反应程序:94 ℃ 5 min; 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s, 35个循环; 72 ℃ 5 min。通过20 g·L-1琼脂糖凝胶电泳检测PCR产物目的片段长度是否正确, 最后将PCR产物送通用生物有限公司进行测序。测序结果在NCBI官网进行BLAST序列比对, 并采用MEGA 5.10软件构建系统进化树[16]。
1.2.3 致病力检测采用离体菌块贴接法。采集健康新鲜的‘滁菊’叶片, 先用自来水冲洗掉表面的灰尘, 再浸入70%的乙醇中消毒30 s, 待乙醇挥发后在叶柄上包1层无菌脱脂棉以保证100%的相对湿度, 然后置入铺有1层无菌脱脂棉和2层湿润滤纸的培养皿中。用直径5 mm的灭菌打孔器在PDA平板上生长7 d的菌落边缘打孔, 将制备好的菌饼接种在叶面固定位置, 同时将等量的无菌PDA培养基圆饼贴放在健康叶片相同部位作为对照。将培养皿密封并放入25 ℃培养箱中进行黑暗培养48 h, 然后置于光照/黑暗时间为16 h/8 h的条件下培养。分别于接种后3、6、9、12 d观察叶片的发病情况, 采用十字交叉法[17]统计不同接种时期叶片病斑直径。
1.3 茶用菊黑斑病苗期抗性鉴定 1.3.1 植物材料培养将生长状态一致的38个茶用菊品种的扦插生根苗栽植到草炭和珍珠岩质量比为3:1的混合基质中, 缓苗后正常水肥管理, 保证基质不缺水, 每周施用稀释液体平衡肥。在光照/黑暗时间为16 h/8 h的光周期下生长, 昼/夜温度分别设置为25 ℃/22 ℃, 相对湿度保持在68%~75%。培养10 d后, 每个品种选取健壮且长势一致的盆栽幼苗30株, 将幼苗随机分成2组, 每组15株, 1组用于接种, 1组用作对照。
1.3.2 菌丝悬浮液制备与接种取培养7 d的交链格孢菌株, 用灭菌打孔器沿PDA培养基菌落边缘打取直径约5 mm左右的菌饼10~15块, 放入装有40~60 mL PDB液体培养基的100 mL三角瓶, 在25 ℃摇床上200 r·min-1培养24 h。取3个培养好的菌球(尽量保证菌球大小一致)于2 mL离心管中, 加入灭菌小钢珠后上磨样机研磨。将研磨好的菌丝匀浆加入装有200 mL PDB液体培养基的三角瓶, 在25 ℃摇床上200 r·min-1培养48 h。吸取2 mL摇匀的菌丝悬浮液于直径6 cm的一次性无菌培养皿中, 用灭菌毛笔挑出菌丝涂抹于供试菊花第2或第3片真叶背面。接种后给叶片套上自封袋, 注意叶片背部不要与袋子接触。对照组用PDB液体培养基涂抹并套袋。将菊花置于培养箱中培养, 培养条件设置为:温度25 ℃, 湿度80%, 黑暗条件培养48 h。
1.3.3 病情调查与统计在接种后48 h进行病情调查与统计。参照许高娟[7]的分级标准加以改进。将病情分为4级。0级:叶片健康, 无病害; 1级:病斑面积占叶片面积比例小于25%;2级:病斑面积占叶片面积比例为25%~50%;3级:病斑面积占叶片面积比例大于50%, 按照该标准调查发病情况。统计每级病株数, 计算每个品种发病率与病情指数(DSI), 其计算公式如下。

|
根据病情指数划分抗病评价等级。免疫(I):DSI=0;抗病(R):0<DSI≤25.00;中感(MS):25.00<DSI < 50.00;感病(S):DSI≥50.00。
1.4 扫描电镜观察表皮毛与气孔取抗病和感病品种(抗病品种:‘苏菊6号’‘苏菊8号’‘滁菊’; 感病品种:‘苏菊7号’‘七月白’‘大洋菊’)植株顶端以下第2或第3片完全展开的新鲜叶片, 在叶脉主脉两侧距离相同部位剪取面积约0.5 cm2的小叶块, 下表皮朝上。用2.5%戊二醛溶液进行抽真空固定, 固定后立即转移至4 ℃冰箱保存。将样品送至武汉赛维尔生物科技有限公司进行扫描电子显微镜(SU8100, HITACHI)观察、拍照。每个小叶块观察4~6个视野, 每个品种观察3个小叶块。
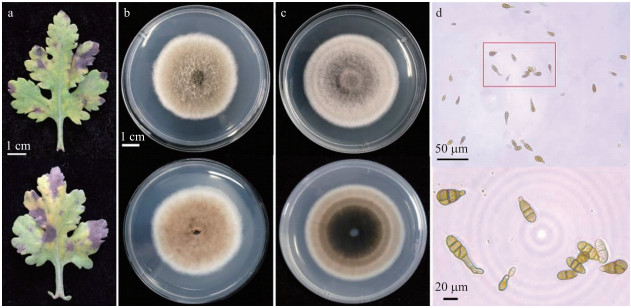
2 结果与分析 2.1 茶用菊黑斑病菌的分离与鉴定从‘福白菊’病叶(图 1-a)上分离纯化得到2个黑斑病致病菌株, 编号为F16与F20。2个菌株在PDA培养基上的菌落均为圆形, 分别呈黄褐色及黄棕色, 表面生长着厚厚的茸毛状气生菌丝。菌株F16菌落边缘没有F20平滑, 且F16正、背面颜色较均一, 仅菌落边缘颜色较浅(图 1-b); F20正面颜色较F16偏灰, 背面颜色从外向内由浅变深, 且呈现轮纹状(图 1-c)。2个菌株分生孢子均为褐色或者浅褐色, 大多呈倒棍棒状或倒梨形, 少数呈卵形或者近似椭圆形, 大小为:(24.5~42.5)μm×(9.5~13.5)μm; 喙或假喙呈短圆柱状, 长2.9~9.8 μm; 具有2~6个横的隔膜, 偶尔可见1~4个纵(或斜)的隔膜, 分隔处有缢缩(图 1-d)。根据F16和F20菌落形态与分生孢子特征并参照前人的研究结果[13-14], 可初步判定其为交链格孢菌[Alternaria alternata(Fr.)Keissl]。
|
图 1 茶用菊黑斑病病叶与致病菌株 Fig. 1 Disease leaves and pathogens of Alternaria alternata in chrysanthemum for tea a.‘福白菊’黑斑病病叶; b.菌株F16形态(上:正面; 下:背面); c.菌株F20形态(上:正面; 下:背面); d. 20倍(上)与40倍(下)显微镜下分生孢子形态。 a. Black spot disease leaves of 'Fubaiju'; b. Morphology of strain F16(above:front; below:back); c. Morphology of strain F20(above:front; below:back); d. Conidiophores morphology under 20 times(above)and 40 times(below)microscope. |
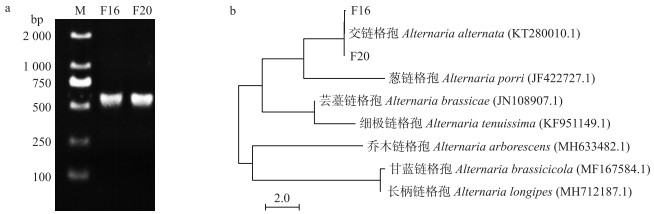
为了进一步确定F16与F20在链格孢属中的分类地位, 提取2个菌株的DNA, 应用真菌18S rDNA-ITS序列对其进行分子水平鉴定, 测序结果提交至NCBI(http://www.ncbi.nlm.nih.gov)官网进行BLAST比对。结果显示F16和F20与NCBI数据库中记载的交链格孢菌[Alternaria alternata(登录号:KT280010.1)]相似度达99%以上, 且在系统发育树上聚为一支(图 2)。结合形态特征, 确定F16与F20均为交链格孢菌。
|
图 2 茶用菊黑斑病病原菌分子鉴定 Fig. 2 Molecular identification of the pathogen of black spot disease in chrysanthemum for tea a. 18S rDNA-ITS目的基因PCR检测; b.基于18S rDNA-ITS目的基因序列以邻接法构建系统发育树。 a. 18S rDNA-ITS target gene PCR test results; b. Phylogenetic tree constructed based on 18S rDNA-ITS target gene sequences by Neighbor-joining method. |
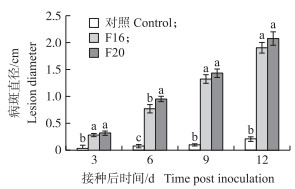
分别用F16和F20的菌饼接种‘滁菊’离体叶片3 d时均出现明显的发病症状, 随着接种时间推移病斑面积逐渐扩展, 颜色为黑褐色, 并在外围出现浅黄色的晕圈(图 3)。病斑直径统计结果(图 4)显示, 随接种时间延长病斑直径增加, 表明菌株F16和F20均有较强致病力, 除了接种后6 d, 其他接种时间F16与F20的病斑直径均无显著性差异。根据柯赫氏法则从发病的‘滁菊’叶片上再次分离、纯化病原菌F16与F20, 其菌落形态、分生孢子形态与首次分离出的病原菌一致, 说明原接种菌株确为致病菌。

|
图 3 茶用菊叶片接种后不同时间的发病症状 Fig. 3 Symptoms at different time post inoculation on vitro leaves of chrysanthemum for tea |
|
图 4 ‘滁菊’叶片病斑直径 Fig. 4 The lesion diameter of 'Chuju'leaves 不同字母表示同一接种时间不同菌株处理下差异显著(P < 0.05)。 Different letters indicate significant difference at 0.05 level at the same inoculation time under different strains treatment. |
通过叶背涂抹菌丝接种法对38个茶用菊品种进行了2次苗期黑斑病抗性鉴定试验。根据病情指数可将38个品种划分成抗病(R)、中感(MS)和感病(S)3个类别(表 2, 图 5)。其中, 有11个品种(占28.95%)表现为抗病, 病情指数从小到大排名前5位的是‘苏菊6号’‘苏菊10号’‘河北香菊’‘苏菊15号’和‘满天星’; 22个品种(占57.89%)表现为中感, 代表品种为‘苏菊9号’‘杭白菊’‘射阳红心菊’; 5个感病品种(占13.16%)为‘黄山贡菊’‘苏菊13号’‘大洋菊’‘川百菊’和‘休宁药菊’, 其病情指数分别为53.33、56.67、56.67、60.65和75.56。
| 编号 Code |
第1次试验The first experiment | 第2次试验The second experiment | 平均病情指数 Average disease index |
抗病类型 Resistance type |
|||
| 发病率/% Incidence | 病情指数Disease index | 发病率/% Incidence | 病情指数Disease index | ||||
| 27 | 33.33 | 11.11 | 26.67 | 8.89 | 10.00 | R | |
| 31 | 60.00 | 13.33 | 40.00 | 15.56 | 14.45 | R | |
| 12 | 46.67 | 15.56 | 66.67 | 13.33 | 14.45 | R | |
| 36 | 46.67 | 13.33 | 53.33 | 17.78 | 15.56 | R | |
| 25 | 40.00 | 15.56 | 60.00 | 15.56 | 15.56 | R | |
| 7 | 46.67 | 15.56 | 66.67 | 22.22 | 18.89 | R | |
| 5 | 66.67 | 22.22 | 80.00 | 17.78 | 20.00 | R | |
| 19 | 73.33 | 17.78 | 53.33 | 22.22 | 20.00 | R | |
| 29 | 66.67 | 24.44 | 46.67 | 20.00 | 22.22 | R | |
| 10 | 46.67 | 20.00 | 53.33 | 24.44 | 22.22 | R | |
| 23 | 60.00 | 20.00 | 66.67 | 26.67 | 23.34 | R | |
| 30 | 93.33 | 24.44 | 73.33 | 28.89 | 26.67 | MS | |
| 33 | 73.33 | 26.67 | 80.00 | 28.89 | 27.78 | MS | |
| 17 | 60.00 | 26.67 | 80.00 | 28.89 | 27.78 | MS | |
| 32 | 73.33 | 26.67 | 73.33 | 28.89 | 27.78 | MS | |
| 14 | 73.33 | 26.67 | 66.67 | 35.56 | 31.12 | MS | |
| 11 | 53.33 | 28.89 | 53.33 | 33.33 | 31.11 | MS | |
| 37 | 86.67 | 33.33 | 80.00 | 33.33 | 33.33 | MS | |
| 1 | 73.33 | 35.56 | 66.67 | 28.89 | 32.23 | MS | |
| 35 | 80.00 | 37.78 | 73.33 | 28.89 | 33.34 | MS | |
| 13 | 66.67 | 31.11 | 73.33 | 37.78 | 34.45 | MS | |
| 15 | 93.33 | 37.78 | 80.00 | 31.11 | 34.45 | MS | |
| 8 | 86.67 | 40.00 | 100.00 | 37.78 | 38.89 | MS | |
| 2 | 86.67 | 44.44 | 66.67 | 35.56 | 40.00 | MS | |
| 26 | 93.33 | 48.89 | 80.00 | 33.33 | 41.11 | MS | |
| 20 | 60.00 | 46.67 | 66.67 | 35.56 | 41.12 | MS | |
| 9 | 100.00 | 44.44 | 80.00 | 44.44 | 44.44 | MS | |
| 6 | 100.00 | 40.00 | 80.00 | 48.89 | 44.45 | MS | |
| 4 | 86.67 | 42.22 | 93.33 | 51.11 | 46.67 | MS | |
| 21 | 100.00 | 51.11 | 80.00 | 42.22 | 46.67 | MS | |
| 3 | 86.67 | 55.56 | 80.00 | 37.78 | 46.67 | MS | |
| 28 | 100.00 | 51.11 | 93.33 | 44.44 | 47.78 | MS | |
| 18 | 73.33 | 57.78 | 73.33 | 40.00 | 48.89 | MS | |
| 22 | 53.33 | 42.22 | 66.67 | 64.44 | 53.33 | S | |
| 34 | 86.67 | 57.78 | 93.33 | 55.56 | 56.67 | S | |
| 16 | 100.00 | 62.22 | 86.67 | 51.11 | 56.67 | S | |
| 24 | 80.00 | 56.86 | 100.00 | 64.44 | 60.65 | S | |
| 38 | 100.00 | 77.78 | 100.00 | 73.33 | 75.56 | S | |
| 注:R:抗病Resistant; MS:中感Moderately susceptible; S:感病Susceptible.下同。The same as follows. | |||||||

|
图 5 接种48 h后不同抗性品种的发病症状(标尺=1.0 cm) Fig. 5 Disease symptoms of different resistance cultivars after inoculation for 48 h(bar=1.0 cm) |
用SPSS 19.0软件对2次抗性鉴定的病情指数(DSI)进行相关性分析, 结果显示2次试验的DSI相关系数为0.860, 极显著相关。
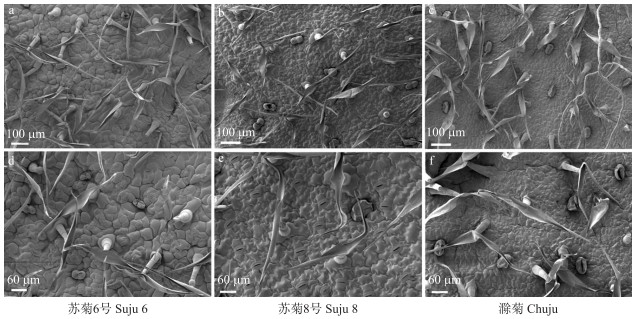
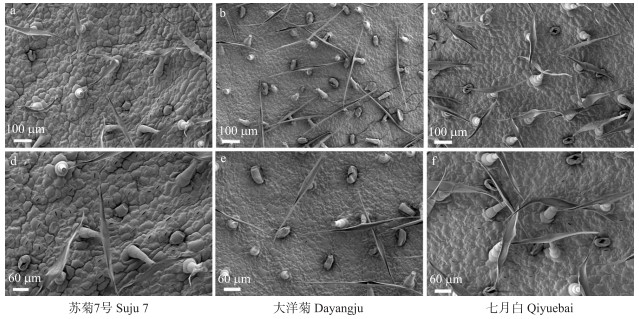
2.4 抗、感品种表皮毛与气孔特征差异 2.4.1 叶片表皮毛差异基于抗性鉴定结果, 选取3个抗病品种‘苏菊6号’‘苏菊8号’‘滁菊’及3个感病品种‘苏菊7号’‘大洋菊’‘七月白’, 进行扫描电镜观察。观察与统计结果显示, 抗病品种和感病品种的叶片下表皮表皮毛形态没有明显差异, 但密度存在显著差异(表 3、图 6、图 7), 且在3个抗病品种中, 表皮毛密度与病情指数呈负相关, 即表皮毛密度越大, 病情指数越小。感病品种中除了‘大洋菊’, ‘苏菊7号’与‘七月白’的表皮毛密度与病情指数也呈负相关。在6个品种中, 抗病品种‘苏菊6号’的表皮毛密度最大, 为32.75 mm-2; 感病品种‘苏菊7号’表皮毛密度最小, 为12.96 mm-2。
| 品种Cultivar | 病情指数Disease index | 表皮毛密度/mm-2 Epidermal trichome density | 气孔密度/mm-2 Stomata density |
| 苏菊6号Suju 6 | 10.00 | 32.75±4.59a | 93.02±9.86d |
| 苏菊8号Suju 8 | 22.22 | 26.34±2.29b | 96.35±8.66d |
| 滁菊Chuju | 20.00 | 31.08±5.38a | 130.68±4.54bc |
| 苏菊7号Suju 7 | 47.78 | 12.96±1.89d | 132.89±8.66b |
| 大洋菊Dayangju | 56.67 | 23.24±1.61b | 238.73±7.53a |
| 七月白Qiyuebai | 44.45 | 18.39±1.56c | 121.97±9.54c |
| 注:不同字母表示不同品种间差异显著(P < 0.05)。 Note:Different letters indicate significant differences at 0.05 level between different cultivars. |
|||
|
图 6 3个抗病品种叶片下表皮表皮毛的整体与局部 Fig. 6 The overall and partial of leaf lower epidermal trichomes of 3 resistant cultivars |
|
图 7 3个感病品种叶片下表皮表皮毛整体与局部 Fig. 7 The overall and partial of leaf lower epidermal trichomes of 3 susceptible cultivars |
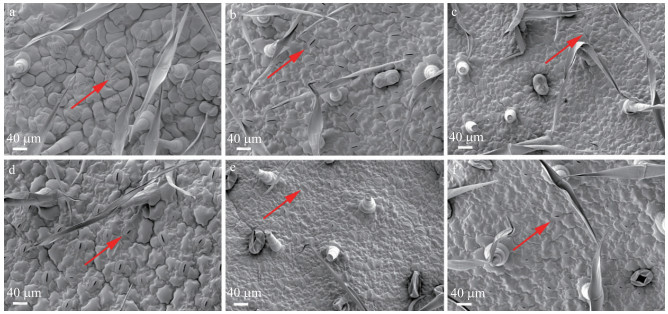
在6个试验品种中, 气孔形态基本一致, 气孔密度最小的是抗病品种‘苏菊6号’, 密度为93.02 mm-2, 而气孔密度最大的是感病品种‘大洋菊’, 密度为238.73 mm-2; ‘苏菊6号’病情指数最小, ‘大洋菊’病情指数最大(表 3、图 8)。但抗病品种‘滁菊’的气孔密度与感病品种‘苏菊7号’和‘七月白’之间没有显著性差异, 表明气孔密度可能与‘滁菊’的抗病性相关性不大。结合叶片表皮毛的分析可知, 抗病品种较感病品种具有更为密集的表皮毛和更为稀疏的气孔。表明叶片表皮毛密度及气孔密度可能与茶用菊品种对黑斑病的抗性有一定的相关性。
|
图 8 6个茶用菊品种气孔整体形态 Fig. 8 Stomata overall morphology of 6 chrysanthemum for tea cultivars a—c.抗病品种:‘苏菊6号’‘苏菊8号’‘滁菊’; d—f.感病品种:‘苏菊7号’‘大洋菊’‘七月白’。 a-c. Disease resistant cultivars:'Suju 6''Suju 8''Chuju'; d-f:Disease susceptible cultivars:'Suju 7''Dayangju''Qiyuebai'. |
形态学鉴定是真菌分类鉴定中应用最早且直观的方法。在半知菌群体中, 链格孢菌属级特征明显, 形态学分类主要依据分生孢子的形状、大小、表面纹饰、着生方式、喙的特征, 并辅助以菌丝、菌落、次生代谢产物等特征[18]。链格孢属真菌的培养特性(孢子及菌落特征)易受环境条件(光、温度和湿度等)和培养条件(培养基质等)的影响而发生变异, 影响种级鉴定的准确性。目前已经在鸭梨[19]、茶树[20]、莴笋[21]及高粱[22]等物种上通过rDNA-ITS序列进行了链格孢叶斑病的病原鉴定。Loganathan等[23]从番茄早疫病病株上分离纯化了17种链格孢属真菌, 通过形态观察结合rDNA-ITS序列鉴定, 确定有12个菌株与A.alternata(JX993756)同源, 5个菌株与A.solani(JF796068)同源。金程凡[24]对分离自油菜的黑斑病菌FY73QF-QI进行了rDNA-ITS序列鉴定, 系统进化分析显示其与Alternaria brassicae(JN108907.1)聚为同一支。本研究基于病原菌rDNA-ITS段片长度适中(高等真菌小于1 000 bp)、具保守性且在属种水平上具有特异性的特点, 鉴定‘福白菊’黑斑病病原菌为交链格孢菌(A.alternata), 这是首次发现交链格孢菌能够引起菊花黑斑病, 与许高娟[7]分离鉴定的地被菊黑斑病病原菌极细链格孢菌(A.tenuissima)不同。
3.2 茶用菊对黑斑病的抗性鉴定目前已报道的植物黑斑病抗性鉴定方法有:菌块贴接法、菌丝液涂抹法、孢子悬浮液喷雾法。陈出新[25]在梨品种资源黑斑病抗性鉴定和抗病种质资源筛选时, 将病菌饼接种于刺破的离体叶片和果皮上, 最终从叶片与果皮2个角度筛选出不同比例的抗、感品种。刘东等[26]采用孢子悬浮液喷雾接种法, 对50份黄瓜种质资源进行了苗期黑斑病抗性鉴定, 筛选出3份高抗材料。本研究采用人工涂抹菌丝接种法进行抗性鉴定, 相比于孢子悬浮液喷雾接种法, 缩小了接种范围, 固定了接种菌丝量, 套袋控制了发病条件并且对特定叶位叶片接种, 避免喷雾不均匀、孢子萌发条件不好控制、易受外界环境影响、统计工作量大等缺点。
3.3 叶片表皮毛及气孔与抗性相关作为植物最外层的天然屏障, 表皮毛对植物起着重要的保护作用。本研究结果表明:抗病茶用菊品种表皮毛密度普遍大于感病品种, 推测浓密的表皮毛是菌丝接触浸染部位的物理阻隔, 使其无法产生附着结构, 从而延缓菌丝入侵, 这与翟艳霞等[27]和李淼等[28]的研究结果一致。但也有研究指出, 拟南芥表皮毛有利于真菌孢子和菌丝的吸附, 在一定程度上增加了感病性[29]。还有研究表明, 大豆灰斑病抗、感品种叶片的茸毛密度并没有差异[30]。综上所述, 表皮毛与植物抗病性相关, 但在不同物种中存在差异, 可能与物种自身结构特征、病原菌种类及主要入侵方式有关。
气孔也是病原菌入侵植物获取营养的重要通道。本研究结果显示:茶用菊典型抗病品种叶片下表皮气孔密度显著小于感病品种, 提供给菌丝入侵的机会相应减少。李海英等[30]的研究表明, 大豆对灰斑病的抗病品种叶片正面及背面的气孔密度明显少于感病品种, 本研究结果与之相一致。也有研究指出, 枇杷[31]与葡萄[32]叶下表皮气孔密度和大小均与其对叶斑病的抗性无显著相关性。翟艳霞等[27]和李淼等[28]的研究结果认为, 抗、感品种的叶片气孔大小无明显差异, 但抗病品种气孔密度明显大于感病品种。上述结果说明气孔密度与植物抗病性相关, 但具体相关性因具体物种而异, 可能与该物种自身的结构特征有关, 也可能与病原菌的入侵方式有关。
| [1] |
陈俊愉. 中国菊花过去和今后对世界的贡献[J]. 中国园林, 2005, 21(9): 73-75. Chen J Y. Contributions of Chinese Chrysanthemum to the world in the past and future[J]. Journal of Chinese Landscape Architecture, 2005, 21(9): 73-75 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-6664.2005.09.018 |
| [2] |
马荣粒, 黄丛林, 张秀海, 等. 茶用菊花研究进展[J]. 北方园艺, 2009(8): 151-154. Ma R L, Huang C L, Zhang X H, et al. Advancement on the study of tea Chrysanthemum[J]. Northern Horticulture, 2009(8): 151-154 (in Chinese with English abstract). |
| [3] |
Deng Y M, Chen S M, Chang Q S, et al. The Chrysanthemum×Artemisia vulgaris intergeneric hybrid has better rooting ability and higher resistance to Alternaria leaf spot than its Chrysanthemum parent[J]. Scientia Horticulturae, 2012, 134: 185-190. DOI:10.1016/j.scienta.2011.11.012 |
| [4] |
Jiang M Y, Zhang W, Zhang T T, et al. Assessing transfer of pesticide residues from Chrysanthemum flowers into tea solution and associated health risks[J]. Ecotoxicology and Environmental Safety, 2020, 187: 109859. DOI:10.1016/j.ecoenv.2019.109859 |
| [5] |
贺占雪, 马建鹏, 杨斌, 等. 云南主栽核桃品种对Alternaria alternata叶枯病的抗病性评价[J]. 植物保护, 2019, 45(4): 195-200, 235. He Z X, Ma J P, Yang B, et al. Evaluation of the resistance of main walnut varieties in Yunnan Province to Alternaria alternata[J]. Plant Protection, 2019, 45(4): 195-200, 235 (in Chinese with English abstract). |
| [6] |
姚协丰, 李苹芳, 朱凌丽, 等. 甜瓜链格孢叶斑病的2种抗性接种鉴定方法比较[J]. 浙江农业科学, 2018, 59(1): 34-36, 76. Yao X F, Li P F, Zhu L L, et al. Comparison of two resistance identification methods for melon Alternaria alternata leaf spot disease[J]. Journal of Zhejiang Agricultural Sciences, 2018, 59(1): 34-36, 76 (in Chinese). DOI:10.3969/j.issn.0258-4069.2018.01.006 |
| [7] |
许高娟.部分菊花近缘种属植物黑斑病苗期抗性及hrfA基因转化菊花的研究[D].南京: 南京农业大学, 2009. Xu G J. Studies on seedling's of related species of Chrysanthemum to Alternaria leaf spot and genetic transformation of chrysanthemum with hrfA gene[D]. Nanjing: Nanjing Agricultural University, 2009(in Chinese with English abstract). |
| [8] |
张小丽, 单晓政, 顾宏辉, 等. 甘蓝类蔬菜品种(系)苗期根肿病抗性鉴定[J]. 植物保护, 2020, 46(5): 193-199. Zhang X L, Shan X Z, Gu H H, et al. Resistance identification of Brassica oleracea cultivars(lines)to clubroot at seedling stage[J]. Plant Protection, 2020, 46(5): 193-199 (in Chinese with English abstract). |
| [9] |
余蓬勃, 任妍, 侯玮秀, 等. 小麦苗期抗纹枯病鉴定方法的改良及抗病品种筛选[J]. 植物病理学报, 2019, 49(5): 715-720. Yu P B, Ren Y, Hou W X, et al. An improved method for the resistance evaluation of wheat sharp eyespot at seedling stage and screening of resistance varieties[J]. Acta Phytopathologica Sinica, 2019, 49(5): 715-720 (in Chinese with English abstract). |
| [10] |
陈雪峰, 景晨娟, 赵习平, 等. 植物叶片组织结构在抗逆研究中的应用进展[J]. 河北农业科学, 2018, 22(3): 50-53. Chen X F, Jing C J, Zhao X P, et al. Advances in application of plant leaf tissue structure in the research of stress tolerance[J]. Journal of Hebei Agricultural Sciences, 2018, 22(3): 50-53 (in Chinese with English abstract). |
| [11] |
李聪.猕猴桃枝叶组织结构及内含物与溃疡病的相关性研究[D].杨凌: 西北农林科技大学, 2016. Li C. Correlation of the relationship between resistance of branch leaves structure and inclusion and kiwifruit canker[D]. Yangling: Northwest A&F University, 2016(in Chinese with English abstract). |
| [12] |
李亚, 吕佳芮, 朱玲, 等. 福建省柑橘褐斑病菌的分离、鉴定和系统进化分析[J]. 植物保护学报, 2019, 46(6): 1243-1251. Li Y, Lü J R, Zhu L, et al. Isolation, identification and phylogenetic analysis of Citrus brown spot pathogens in Fujian Province[J]. Journal of Plant Protection, 2019, 46(6): 1243-1251 (in Chinese with English abstract). |
| [13] |
张天宇. 中国真菌志(第十六卷):链格孢属[M]. 北京: 科学出版社, 2003. Zhang T Y. Chinese Fungi(Volume Sixteen):Alternaria[M]. Beijing: Science Press, 2003 (in Chinese). |
| [14] |
Lawrence D P, Rotondo F, Gannibal P B. Biodiversity and taxonomy of the pleomorphic genus Alternaria[J]. Mycological Progress, 2016, 15(1): 3. DOI:10.1007/s11557-015-1144-x |
| [15] |
陈慧杰, 赵爽, 张凯凯, 等. 菊花枯萎病病原菌的分离和鉴定及其粗毒素对切花菊'神马'幼苗生长的影响[J]. 南京农业大学学报, 2018, 41(4): 662-669. Chen H J, Zhao S, Zhang K K, et al. Isolation and identification of Fusarium oxysporum from chrysanthemum and the effects of crude toxin on growth of cut-chrysanthemum 'Jimba' seedlings[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 662-669 (in Chinese with English abstract). DOI:10.7685/jnau.201708009 |
| [16] |
汤小美, 林天元, 周珊珊, 等. 梨树根腐病病原菌的分离与鉴定及有效防控药剂筛选[J]. 南京农业大学学报, 2017, 40(1): 76-83. Tang X M, Lin T Y, Zhou S S, et al. Pathogen identification of root rot in pear plant and fungicide screening for its efficient control[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 76-83 (in Chinese with English abstract). DOI:10.7685/jnau.201607002 |
| [17] |
孙俊. 榛子叶斑病病原菌生物学特性[J]. 江苏农业科学, 2017, 45(7): 101-103. Sun J. Biological characteristics of the pathogen of hazelnut leaf spot[J]. Jiangsu Agricultural Sciences, 2017, 45(7): 101-103 (in Chinese). |
| [18] |
Andersen B, Sørensen J L, Nielsen K F, et al. A polyphasic approach to the taxonomy of the Alternaria infectoria species-group[J]. Fungal Genetics and Biology, 2009, 46(9): 642-656. DOI:10.1016/j.fgb.2009.05.005 |
| [19] |
严进, 施宗伟, 宋福, 等. 河北和山东鸭梨果实上链格孢菌鉴定[J]. 植物保护学报, 2009, 36(1): 37-43. Yan J, Shi Z W, Song F, et al. Identification of Alternaria isolates from Ya-pear fruits in Hebei and Shandong provinces[J]. Acta Phytophylacica Sinica, 2009, 36(1): 37-43 (in Chinese with English abstract). DOI:10.3321/j.issn:0577-7518.2009.01.008 |
| [20] |
周园园, 吴治然, 贡长怡, 等. 茶树链格孢叶斑病的病原鉴定[J]. 植物保护, 2019, 45(6): 145-148, 155. Zhou Y Y, Wu Z R, Gong C Y, et al. Identification of Alternaria alternata causing leaf spot disease of Camellia sinensis[J]. Plant Protection, 2019, 45(6): 145-148, 155 (in Chinese with English abstract). |
| [21] |
郭润婷, 石延霞, 赵倩, 等. 莴笋链格孢叶斑病病原鉴定[J]. 植物病理学报, 2018, 48(3): 418-422. Guo R T, Shi Y X, Zhao Q, et al. Identification of the pathogens causing leaf spot on lettuce[J]. Acta Phytopathologica Sinica, 2018, 48(3): 418-422 (in Chinese with English abstract). |
| [22] |
赵艳琴, 于华荣, 石凯, 等. 高粱链格孢叶斑病病原鉴定[J]. 植物病理学报, 2017, 47(2): 282-285. Zhao Y Q, Yu H R, Shi K, et al. Identification of the pathogen causing leaf spot on Sorghum[J]. Acta Phytopathologica Sinica, 2017, 47(2): 282-285 (in Chinese with English abstract). |
| [23] |
Loganathan M, Venkataravanappa V, Saha S, et al. Morphological, pathogenic and molecular characterizations of Alternaria species causing early blight of tomato in northern India[J]. Proceedings of the National Academy of Sciences India Section B:Biological Sciences, 2016, 86(2): 325-330. DOI:10.1007/s40011-014-0446-0 |
| [24] |
金程凡.油菜上链格孢菌的分离、鉴定、致病力比较及药剂筛选[D].长沙: 湖南农业大学, 2014. Jin C F. Studies on isolation, identification, virulence comparison and fungicide screening of pathogenic alternaria on rapeseed[D]. Changsha: Hunan Agricultural University, 2014(in Chinese with English abstract). |
| [25] |
陈出新.梨品种资源的抗病性鉴定与抗病资源筛选[D].南京: 南京农业大学, 2016. Chen C X. Identification of germplasm resources of pear cultivars and screening of resistant resources[D]. Nanjing: Nanjing Agricultural University, 2016(in Chinese with English abstract). |
| [26] |
刘东, 辛明, 周秀艳, 等. 主要黄瓜种质资源抗病性评价[J]. 东北农业大学学报, 2017, 48(3): 10-16. Liu D, Xin M, Zhou X Y, et al. Resistance evaluation of main cucumber germplasms[J]. Journal of Northeast Agricultural University, 2017, 48(3): 10-16 (in Chinese with English abstract). |
| [27] |
翟艳霞, 胡俊, 黄俊霞, 等. 哈密瓜叶片结构与细菌性果斑病抗性的研究[J]. 内蒙古农业大学学报(自然科学版), 2006, 27(1): 47-50. Zhai Y X, Hu J, Huang J X, et al. Studies on the structural resistance to Acidovorax avenae subsp. citrulli in hamimelon leaves[J]. Journal of Inner Mongolia Agricultural University(Natural Science Edition), 2006, 27(1): 47-50 (in Chinese with English abstract). |
| [28] |
李淼, 檀根甲, 李瑶, 等. 猕猴桃品种叶片组织结构与抗溃疡病的关系[J]. 安徽农业科学, 2002, 30(5): 740-742. Li M, Tan G J, Li Y, et al. Study on the leaf tissue structure of kiwifruit cultivars in relation to bacterial canker disease resistance[J]. Journal of Anhui Agricultural Sciences, 2002, 30(5): 740-742 (in Chinese with English abstract). DOI:10.3969/j.issn.0517-6611.2002.05.049 |
| [29] |
Calo L, García I, Gotor C, et al. Leaf hairs influence phytopathogenic fungus infection and confer an increased resistance when expressing a Trichoderma alpha-1, 3-glucanase[J]. Journal of Experimental Botany, 2006, 57(14): 3911-3920. DOI:10.1093/jxb/erl155 |
| [30] |
李海英, 倪红涛, 杨庆凯. 大豆叶片结构与灰斑病抗性的研究.Ⅰ.大豆叶片气孔密度、茸毛密度与灰斑病抗性的关系[J]. 中国油料作物学报, 2001, 23(3): 52-53, 56. Li H Y, Ni H T, Yang Q K. Study on stomatal and hair density in soybean leaves of resistant and susceptible cultivars of Cercospora sojina Hara[J]. Chinese Journal of Oil Crop Sciences, 2001, 23(3): 52-53, 56 (in Chinese with English abstract). |
| [31] |
张小艳, 许奇志, 郑姗, 等. 枇杷种质资源对叶斑病的抗性及其与叶片气孔的相关性[J]. 福建农业学报, 2015, 30(9): 891-895. Zhang X Y, Xu Q Z, Zheng S, et al. Resistance to leaf spot disease and its correlation with stomata on loquat plants[J]. Fujian Journal of Agricultural Sciences, 2015, 30(9): 891-895 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0384.2015.09.012 |
| [32] |
杜蕙, 蒋晶晶, 王春明, 等. 葡萄叶片表皮气孔与霜霉病的抗性研究[J]. 甘肃农业科技, 2018(12): 58-61. Du H, Jiang J J, Wang C M, et al. Relationship between stoma of grape leaves and resistance to Plasmopara viticola[J]. Gansu Agricultural Science and Technology, 2018(12): 58-61 (in Chinese with English abstract). |




