文章信息
- 高润红, 郭桂梅, 何婷, 杜志钊, 任金宝, 刘成洪, 陆瑞菊
- GAO Runhong, GUO Guimei, HE Ting, DU Zhizhao, REN Jinbao, LIU Chenghong, LU Ruiju
- 大麦旗叶距对小孢子发育时期、愈伤组织诱导以及绿苗再生的影响
- Effects of the flag leaf space on microspore developmental stage, callus induction and green plant regeneration in barley
- 南京农业大学学报, 2021, 44(1): 36-41
- Journal of Nanjing Agricultural University, 2021, 44(1): 36-41.
- http://dx.doi.org/10.7685/jnau.202002022
-
文章历史
- 收稿日期: 2020-02-20
2. 上海市农业科技服务中心, 上海 200335;
3. 苏州农业职业技术学院, 江苏 苏州 215008
2. Shanghai Municipal Agricultural Science and Technology Service Centre, Shanghai 200335, China;
3. Suzhou Polytechnic Institute of Agriculture, Suzhou 215008, China
加倍单倍体(doubled haploid, DH)技术是实现纯合最快的方法, 已应用在植物育种等研究中[1]。小孢子培养和花药培养是常用的获取单倍体的方法。相对于花药培养, 小孢子培养更有优势, 去除花药壁的影响, 直接对小孢子进行操作, 短时间内可以处理更大的群体, 从而增加绿苗产量, 节省大量资源[2]。在大麦中, 通过小孢子培养来产生DH群体是最有效的方法[3]。影响小孢子培养效果的因素很多, 包括基因型、供体植株的生长条件、小孢子的发育时期、培养前预处理和培养基成分等[4-6]。其中小孢子适宜的发育时期是单核中晚期, 这一时期的小孢子经过逆境处理后去分化, 获得细胞全能性, 然后在适当的培养条件下分裂发育成胚性愈伤组织, 最后形成植株[7]。小孢子的发育阶段可以通过细胞学观察来确定, 这对于大批量的试验而言费时费力[8]。因此寻找合适的形态学指标来评判小孢子的发育时期非常必要。
旗叶距是指旗叶与倒二叶的叶耳间距离, 可以作为大麦和小麦减数分裂、幼穗大小的一个形态学指标[9-10]。有研究表明, 在大麦中不同旗叶距对每穗分离的小孢子产量有非常显著的影响, 最佳的收获时期能够将胚性小孢子的产量提高2~4倍[3]。在燕麦中, 旗叶距对花药愈伤产量和绿苗再生具有显著的影响[11]。
本实验室已经建立了大麦小孢子培养技术体系, 在田间取材过程中发现旗叶距的大小跨度很大, 同一批材料的小孢子培养效果存在较大的差异。因此我们对同一天取材的穗子根据旗叶距的长度进行分组, 研究不同旗叶距对大麦小孢子愈伤组织诱导和绿苗再生的影响, 为大麦小孢子培养提供更为精细的形态学指标。
1 材料与方法 1.1 供试材料供试材料为大麦(Hordeum vulgare L.)品种'花30', 2017—2018年种植于上海市农业科学院青浦试验基地, 正常水肥管理。2018年3月24日选取旗叶距0.5~7.0 cm的幼穗, 测量旗叶距并按长度分为6组, 分别是0.5~2.0 cm、2.1~3.0 cm、3.1~4.0 cm、4.1~5.0 cm、5.1~6.0 cm和6.1~7.0 cm。剪去叶片, 包裹保鲜袋放入4 ℃冰箱中低温预处理17 d, 每组取15个左右的幼穗。
1.2 小孢子DAPI染色取不同旗叶距幼穗的中部3枚花药放入卡诺氏固定液(无水乙醇和冰乙酸的体积比为3 : 1)固定10 min, 取出清洗干净置于载玻片上, 加20 μL ddH2O, 用镊子将花药夹破使小孢子游离出来, 取10 μL小孢子悬浮液并加入0.1 mg · mL-1 4′, 6-二脒基-2-苯基吲哚(DAPI)染色液10 μL, 混合均匀, 常温黑暗放置10 min, 荧光显微镜下观察。于低温处理前、后的每个分段分别观察5个视野, 并统计每个视野下单核小孢子所占的比例。
1.3 小孢子培养、愈伤组织诱导以及绿苗分化参照郭桂梅等[12]方法将低温预处理后不同旗叶距的幼穗进行消毒灭菌; 小孢子游离参照Lu等[13]方法。收集的小孢子置于提取液中, 25 ℃、黑暗预处理2 d后, 用210 g ·L-1麦芽糖纯化, 纯化后的小孢子用诱导培养基洗涤1次, 密度调节至1.0×105 mL-1, 取1 mL小孢子悬浮液接种于培养皿(30 mm×15 mm)中, 用Parafilm封口。每组5个重复, 25 ℃、黑暗培养18 d后, 吸干诱导培养基, 称取愈伤组织质量, 然后将愈伤组织转到分化培养基, 25 ℃、12 h光照/12 h黑暗培养, 待再生苗长至3 cm左右统计绿苗数, 并将绿苗移入壮苗生根培养基。小孢子提取液、诱导培养基、分化培养基、壮苗生根培养基成分参照文献[14]。提取液和诱导培养基经0.22 μm孔径滤膜过滤灭菌, 分化和壮苗生根培养基经0.11 MPa、121 ℃高温高压灭菌15 min。
1.4 小孢子再生植株倍性鉴定将已生根的再生植株从壮苗培养基中取出, 洗净基部培养基后, 用海绵条包裹, 放入Hoagland营养液中培养3周, 取第1片完全展开叶中部2~3 cm和新生根尖1.5 cm, 分别进行气孔保卫细胞长度测定和根尖染色体制片。气孔保卫细胞长度测定参考何婷等[15]方法; 根尖染色体制片参考Chen等[16]方法。
1.5 指标测定及数据统计分析愈伤组织产量:每皿小孢子培养18 d时产生的愈伤组织量(mg); 再生能力:每100 mg愈伤组织分化出的绿苗数。
所有试验数据采用Microsoft Excel 2007和DPS 7.05进行整理、统计分析及差异显著性比较。
2 结果与分析 2.1 不同旗叶距小孢子发育时期的显微观察利用DAPI染色对不同旗叶距小孢子发育时期进行鉴定。显微观察(图 1)显示:在取材当天(定义为0 d)6个旗叶距游离的小孢子均处于单核期; 随着旗叶距的增大, 小孢子的核呈现出从致密到松散的变化趋势。经过4 ℃低温处理17 d后(图 2), 不同旗叶距小孢子的时期发生了明显的变化, 从单核期发展到单核与二核混合期。在0.5~2.0 cm旗叶距中, 单核占据相对较大的比例, 而且单核和二核在DAPI染色下均有比较明显的荧光; 随着旗叶距的增加, 特别是旗叶距为6.1~7.0 cm时, 游离小孢子基本以二核形态存在, 而且2个核DAPI染色荧光较弱, 核质呈现松散状态。
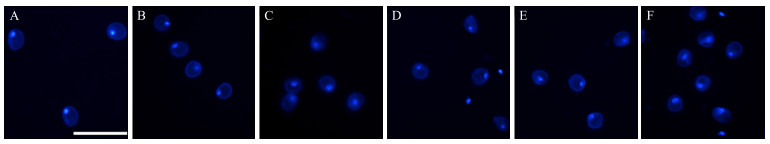
|
图 1 取材0 d时不同旗叶距小孢子发育时期的细胞学观察 Fig. 1 Cytological observation of microspore development at different space of flag leaf on the day of sampling A. 0.5~2.0 cm; B. 2.1~3.0 cm; C. 3.1~4.0 cm; D. 4.1~5.0 cm; E. 5.1~6.0 cm; F. 6.1~7.0 cm. Bar=100 μm. |
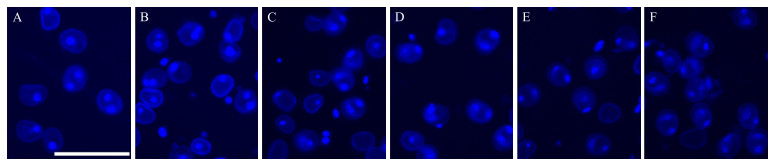
|
图 2 低温处理17 d后不同旗叶距小孢子发育时期的细胞学观察 Fig. 2 Cytological observation of microspore development at different space of flag leaf after 17 days of low temperature treatment A. 0.5~2.0 cm; B. 2.1~3.0 cm; C. 3.1~4.0 cm; D. 4.1~5.0 cm; E. 5.1~6.0 cm; F. 6.1~7.0 cm. Bar=100 μm. |
对低温处理17 d后不同旗叶距游离的小孢子中单核小孢子所占的比例进行统计分析(图 3)。结果表明, 随着旗叶距的增加, 单核小孢子的数目持续降低。旗叶距为0.5~2.0 cm时单核小孢子比例达到71%, 显著高于其他旗叶距的单核小孢子比例; 而旗叶距为6.1~7.0 cm时单核小孢子比例仅为5%。
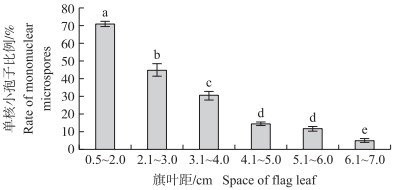
|
图 3 低温处理17 d后不同旗叶距单核小孢子比例 Fig. 3 The rate of mononuclear microspores at different space of flag leaf after 17 days of low temperature treatment 不同小写字母代表在0.05水平差异显著。下同。 Different lowercase letters indicate significant difference at the 0.05 level.The same below. |
不同旗叶距的小孢子均能产生愈伤组织, 愈伤组织产量随着旗叶距的增大稍有增加(图 4), 不同旗叶距的小孢子产生的愈伤组织产量没有显著差异。对不同旗叶距的单核小孢子比例与其对应的愈伤组织产量的相关性进行分析, 二者相关系数为-0.89, 呈极显著负相关。
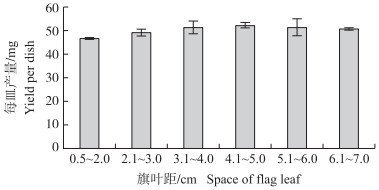
|
图 4 不同旗叶距对小孢子愈伤组织产量的影响 Fig. 4 Effects of the different space of flag leaf on callus yield of microspores |
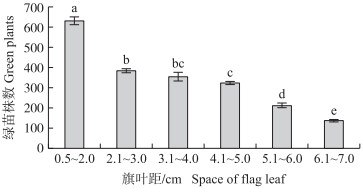
不同旗叶距的小孢子愈伤组织绿苗再生能力差异显著, 随旗叶距增大绿苗再生能力显著降低。旗叶距为0.5~2.0 cm的小孢子愈伤组织再生能力显著高于其他旗叶距的小孢子愈伤组织再生能力, 每100 mg愈伤组织能分化出600多株绿苗, 是旗叶距为2.1~3.0 cm的1.6倍、6.1~7.0 cm的4.7倍(图 5)。对不同旗叶距的单核小孢子比例与其对应的再生能力相关性进行分析, 二者相关系数为0.96, 呈极显著正相关。
|
图 5 不同旗叶距对小孢子愈伤组织(100 mg)再生能力(绿苗数)的影响 Fig. 5 Effects of the different space of flag leaf on regeneration capacity(green plants) of microspore callus(100 mg) |
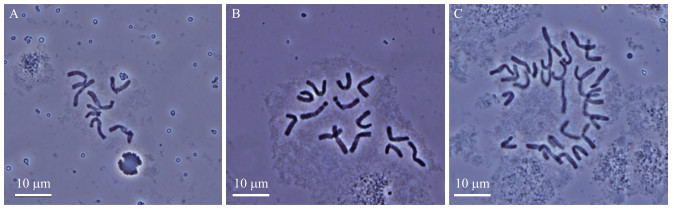
利用气孔保卫细胞长度的2个临界值(37和62 μm), 将旗叶距为0.5~2.0 cm、2.1~4.0 cm和4.1~7.0 cm的小孢子再生植株分为单倍体、二倍体和四倍体。为了减少误差, 利用根尖染色体制片技术对所有分类为单倍体和四倍体的植株以及在这2个临界值附近的再生植株进行验证。最终一共挑取707株再生植株, 其中单倍体的比例为22.77%, 二倍体的比例为71.57%, 四倍体的比例为5.66%。旗叶距为0.5~2.0 cm的小孢子再生植株单倍体所占比例较大, 旗叶距为2.1~4.0 cm和4.1~7.0 cm的小孢子再生植株的四倍体比例相对较大(表 1)。图 6为小孢子再生植株单倍体、二倍体和四倍体根尖细胞染色体。
| 旗叶距/cmSpace of flag leaf | 单倍体Haploid | 二倍体Diploid | 四倍体Tetraploid |
| 0.5~2.0 | 27.96%(52) | 68.82%(128) | 3.22%(6) |
| 2.1~4.0 | 19.30%(66) | 73.98%(253) | 6.72%(23) |
| 4.1~7.0 | 24.02%(43) | 69.83%(125) | 6.15%(11) |
| 注:括号中数字代表不同倍性的单株数。 Note:Numbers in brackets represent the number of regenerated plants with different ploidy. | |||
|
图 6 小孢子再生植株中单倍体(n=x=7, A)、二倍体(2n=2x=14, B)和四倍体(2n=4x=28, C)的根尖细胞染色体 Fig. 6 The chromosome in the root tip cells of haploid(n=x=7, A), diploid(2n=2x=14, B) and tetraploid(2n=4x=28, C)in regenerated plants from microspores |
小孢子发育阶段是影响小孢子胚胎发生的重要因素之一[17-18]。能够对诱导处理作出反应的小孢子处于一个狭窄的发育窗口, 即使在同一枚花药内也只有一定比例的小孢子会将其正常的配子体途径转变为孢子体发育途径[19]。对很多物种而言, 小孢子单核晚期或者双核早期是最适宜的小孢子培养时期[19-20]。本研究中在取材当天不同旗叶距的小孢子虽然都处在单核期, 但是核的状态由致密到分散; 经过低温处理后, 小孢子出现了单核和二核混合的时期, 单核的比例随着旗叶距的增大逐渐降低, 而且单核的比例与绿苗再生能力有密切关系, 因此培养前准确鉴定小孢子发育时期对大麦小孢子培养至关重要。
由于旗叶距的直观性, 利用旗叶距的大小来确定小孢子发育时期在不同作物的小孢子培养中得到广泛应用。在水稻中, 旗叶和倒2叶叶节之间距离为7~11 cm通常被认为是小孢子培养的最佳时期[21]; 胡锐[22]认为籼稻叶枕距4~6 cm时花药已经处于单核靠边期, 最适宜进行诱导培养; 大麦中分离小孢子数量最多的旗叶距为1.7~5.1 cm[3]。燕麦中旗叶基部至倒2叶基部的距离小于4 cm的圆锥花序能在所有供试品种中形成胚状体[11]。本研究中大麦'花30'旗叶距为0.5~7.0 cm均能够产生愈伤组织, 而且不同旗叶距的愈伤组织产量没有显著差异, 但是绿苗再生能力在不同旗叶距之间差异显著。旗叶距为0.5~2.0 cm的小孢子愈伤组织产量虽然最少, 但其再生能力却显著超过其他旗叶距的小孢子, 这可能是由于0.5~2.0 cm旗叶距的幼穗中小孢子发育阶段比较适合小孢子培养, 产生的胚性愈伤组织较多, 从而绿苗产量也较高。随着旗叶距的增大, 经过低温预处理后的小孢子发育时期发生变化, 虽然产生较多的愈伤组织, 但是形成胚性愈伤相对较少, 导致绿苗产量下降。不同旗叶距的小孢子再生植株不同倍性的比例分布相近, 二倍体占70%左右, 单倍体和四倍体为30%左右, 旗叶距为0.5~2.0 cm的小孢子再生植株单倍体所占比例较大, 旗叶距为2.1~4.0 cm和4.1~7.0 cm的小孢子再生植株的四倍体比例相对较大, 这种倍性变化是小孢子发育不同时期引起的还是后代验证群体数目太少引起的, 还需要进一步验证。
在田间取材过程中, 旗叶距是一个比较明显的形态学指标, 小孢子发育时期与旗叶距的大小有明显的相关性。气候和田间种植条件等其他因素对小孢子发育阶段也会有很大的影响。不同材料发育时期不同, 需要根据材料特征, 以旗叶距为基本标准, 并结合小孢子显微观察, 来明确最合适的小孢子培养时期, 从而降低试验误差。
| [1] |
Wang H M, Enns J L, Nelson K L, et al. Improving the efficiency of wheat microspore culture methodology:evaluation of pretreatments, gradients, and epigenetic chemicals[J]. Plant Cell, Tissue and Organ Culture, 2019, 139(3): 589-599. DOI:10.1007/s11240-019-01704-5 |
| [2] |
Ferrie A M R, Caswell K L. Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production[J]. Plant Cell, Tissue and Organ Culture, 2011, 104(3): 301-309. DOI:10.1007/s11240-010-9800-y |
| [3] |
Esteves P, Belzile F. Improving the efficiency of isolated microspore culture in six-row spring barley:I-optimization of key physical factors[J]. Plant Cell Reports, 2014, 33(6): 993-1001. DOI:10.1007/s00299-014-1583-x |
| [4] |
Li H C, Devaux P. Isolated microspore culture overperforms anther culture for green plant regeneration in barley(Hordeum vulgare L.)[J]. Acta Physiologiae Plantarum, 2005, 27(4): 611-619. DOI:10.1007/s11738-005-0065-8 |
| [5] |
Omirbekova N Z, Boguspayev K K, Zhussupova A I, et al. An improved wheat microspore culture technique for the production of doubled haploid plants[J]. Journal of Biotechnology, 2014, 185: S114. |
| [6] |
吕树作, 李雪红, 王洁琼, 等. 小麦小孢子胚胎发生机制及培养技术研究进展[J]. 河南农业科学, 2016, 45(9): 8-14. Lü S Z, Li X H, Wang J Q, et al. Research progress on microspore embryogenesis mechanism and culture techniques in wheat[J]. Journal of Henan Agricultural Sciences, 2016, 45(9): 8-14 (in Chinese with English abstract). |
| [7] |
Sánchez-Díaz R A, Castillo A M, Vallés M P. Microspore embryogenesis in wheat:new marker genes for early, middle and late stages of embryo development[J]. Plant Reproduction, 2013, 26(3): 287-296. DOI:10.1007/s00497-013-0225-8 |
| [8] |
庞强强, 李德明, 周曼, 等. 菜心小孢子发育时期与花器官形态的相关性[J]. 热带作物学报, 2019, 40(1): 60-66. Pang Q Q, Li D M, Zhou M, et al. Correlation of microspore development period and flower morphological characteristics of Chinese flowering cabbage[J]. Chinese Journal of Tropical Crops, 2019, 40(1): 60-66 (in Chinese with English abstract). |
| [9] |
齐志广, 杨献光, 赵宝存, 等. 小麦旗叶距与花粉减数分裂动态相关性分析[J]. 麦类作物学报, 2004, 24(1): 27-30. Qi Z G, Yang X G, Zhao B C, et al. Correlation analysis between the space of flag leaf and the dynamic changes of meiosis in pollen cells of wheat[J]. Journal of Triticeae Crops, 2004, 24(1): 27-30 (in Chinese with English abstract). |
| [10] |
薛香, 李春霞, 王巧玲, 等. 大麦花粉减数分裂与植株主要形态特征关系的研究[J]. 河南职业技术师范学院学报, 2004, 32(4): 14-16. Xue X, Li C X, Wang Q L, et al. Study on the correlation between the space of flag leaf and main morphological traits of meiosis in pollen cells of barley[J]. Journal of Henan Vocation-Technical Teachers College, 2004, 32(4): 14-16 (in Chinese with English abstract). |
| [11] |
Warchoł M, Czyczyło-Mysza I, Marcińska I, et al. Factors inducing regeneration response in oat(Avena sativa L.)anther culture[J]. In Vitro Cellular & Developmental Biology-Plant, 2019, 55(5): 595-604. |
| [12] |
郭桂梅, 何婷, 高润红, 等. 预处理和培养温度对陆稻游离小孢子愈伤组织诱导及分化的影响[J]. 植物生理学报, 2014, 50(12): 1759-1763. Guo G M, He T, Gao R H, et al. Effects of pretreatments and culture temperature on callus induction and differentiation in upland rice microspore culture[J]. Plant Physiology Journal, 2014, 50(12): 1759-1763 (in Chinese with English abstract). |
| [13] |
Lu R J, Wang Y F, Sun Y F, et al. Improvement of isolated microspore culture of barley(Hordeum vulgare L.):the effect of floret co-culture[J]. Plant Cell, Tissue and Organ Culture, 2008, 93(1): 21-27. DOI:10.1007/s11240-008-9338-4 |
| [14] |
郭桂梅, 何婷, 刘成洪, 等. 大麦单株小孢子植株再生及胁迫培养研究[J]. 植物生理学报, 2015, 51(12): 2201-2206. Guo G M, He T, Liu C H, et al. Regeneration from single plant via microspore culture and culture response to salt stress[J]. Plant Physiology Journal, 2015, 51(12): 2201-2206 (in Chinese with English abstract). |
| [15] |
何婷, 郭桂梅, 陈志伟, 等. 大麦小孢子再生植株气孔保卫细胞长度与倍性的相关性[J]. 麦类作物学报, 2014, 34(2): 175-180. He T, Guo G M, Chen Z W, et al. Relationship between the stomatal guard cell length and ploidy level in barley microspore regenerated plantlets[J]. Journal of Triticeae Crops, 2014, 34(2): 175-180 (in Chinese with English abstract). |
| [16] |
Chen P D, Qi L L, Zhou B, et al. Development and molecular cytogenetic analysis of wheat-Haynaldia villosa 6VS/6AL translocation lines specifying resistance to powdery mildew[J]. Theoretical and Applied Genetics, 1995, 91(6/7): 1125-1128. |
| [17] |
de Cesaro T, Baggio M I, Zanetti S A, et al. Haplodiploid androgenetic breeding in oat:genotypic variation in anther size and microspore development stage[J]. Scientia Agricola, 2009, 66(1): 118-122. |
| [18] |
Bhatia R, Dey S S, Sood S, et al. Optimizing protocol for efficient microspore embryogenesis and doubled haploid development in different maturity groups of cauliflower(B.oleracea var. botrytis L.)in India[J]. Euphytica, 2016, 212(3): 439-454. |
| [19] |
Sood S, Dwivedi S. Doubled haploid platform:an accelerated breeding approach for crop improvement[M]//Plant Biology and Biotechnology. New Delhi:Springer India, 2015:89-111.
|
| [20] |
陈薇, 陈思, 庞基良. 植物花粉培养研究进展[J]. 氨基酸和生物资源, 2016, 38(1): 6-12. Chen W, Chen S, Pang J L. Research progress on plant pollen culture[J]. Amino Acids & Biotic Resources, 2016, 38(1): 6-12 (in Chinese with English abstract). |
| [21] |
Mayakaduwa D M R G, Silva T D. A cytological indicator allows rapid assessment of microspore maturity, leading to improved in vitro anther response in Indica rice(Oryza sativa L.)[J]. In Vitro Cellular & Developmental Biology-Plant, 2017, 53(6): 591-597. |
| [22] |
胡锐.籼稻花药培养影响因素的研究[D].武汉: 湖北大学, 2015: 24. Hu R. Research on the effects in the process of anther cultivation of indica rice[D]. Wuhan: Hubei University, 2015: 24(in Chinese with English abstract). |




