文章信息
- 蔡梦颖, 张平, 宋炜涵, 余江峰, 郝栖贤, 王平, 刘世家, 王益华, 江玲, 万建民
- CAI Mengying, ZHANG Ping, SONG Weihan, YU Jiangfeng, HAO Qixian, WANG Ping, LIU Shijia, WANG Yihua, JIANG Ling, WAN Jianmin
- 通过CRISPR/Cas9技术靶向编辑SSSⅡb基因改良稻米品质
- Targeted editing of SSSⅡb gene through CRISPR/Cas9 technology to improve rice quality
- 南京农业大学学报, 2021, 44(1): 18-26
- Journal of Nanjing Agricultural University, 2021, 44(1): 18-26.
- http://dx.doi.org/10.7685/jnau.202003009
-
文章历史
- 收稿日期: 2020-03-04
2. 中国农业科学院作物科学研究所, 北京 100081
2. Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
随着经济增长和消费水平的提高, 人们对优质稻米的需求越来越多[1]。稻米品质指标主要包括外观品质、食味品质、营养成分和加工特性等。这些品质性状直接决定稻米的商品价值与营养价值以及消费者的消费行为[2]。对稻米食味品质的评价大多基于淀粉的理化特性[3], 如直链淀粉含量(amylose content, AC)、胶稠度(gel consistency, GC)、糊化温度(gelatinization temperature, GT)与米饭的黏性、柔软性、弹性等关系密切, 是间接评价稻米蒸煮食味品质的重要参数[4]。其中, 直链淀粉含量与稻米蒸煮食味品质呈显著负相关, 而胶稠度与蒸煮食味品质呈显著正相关。另外, 稻米淀粉黏滞性谱(RVA谱)可以快速鉴定稻米蒸煮食味品质指标, 其特征值热浆黏度、冷胶黏度、消减值、峰值时间、起浆温度与食味品质相关性状(如柔软性、弹性、冷饭质地等)呈极显著负相关, 而特征值崩解值与其呈极显著正相关[5]。随着研究的深入, 发现直链淀粉除包括真正的直链淀粉外, 还包括支链淀粉中的中长链淀粉, 因此, 支链淀粉是造成直链淀粉含量相同或相近的水稻品种间食味品质差异的重要原因[6]。越来越多的学者开始关注支链淀粉的结构以及支链的组成、长度、聚合度与稻米理化特性和食味品质间的关系。
淀粉是稻米胚乳中主要的储存成分, 包括直链淀粉和支链淀粉, 其组成和结构对稻米的食味品质起决定性影响[7]。直链淀粉含量作为稻米品质的重要评价指标, 对稻米品质的影响最大。已有研究表明, 由水稻蜡质基因(Waxy, Wx)编码的颗粒淀粉合酶(granule bound starch synthaseⅠ, GBSSⅠ)负责直链淀粉的合成, 主要包括Wxa和Wxb这2种类型, 其中携带Wxa的籼稻直链淀粉含量一般较高, Wxb主要分布在粳稻品种中, 携带Wxb的品种直链淀粉含量为中等至较低水平[8]。可溶性淀粉合酶(soluble starch synthase, SSS)也是催化淀粉合成的一个关键酶, 主要负责支链淀粉的合成。水稻中已发现8个SSS[9], 分别是SSSⅠ、SSSⅡa、SSSⅡb、SSSⅡc、SSSⅢa、SSSⅢb、SSSⅣa和SSSⅣb, 编码这些酶的基因都可能参与淀粉品质形成过程。Tian等[3]研究发现, Wx和SSS Ⅱ a通过影响3个品质性状(直链淀粉含量、胶稠度和糊化温度)来决定稻米的蒸煮食味品质, 另外还有12个淀粉合成相关基因参与调控。表明Wx基因效应显著, 而其他淀粉合成相关基因也发挥着不可或缺的调控作用。
Jiang等[10]研究发现3种编码SSS Ⅱ 基因, 分别为SSS Ⅱ a、SSS Ⅱ b和SSS Ⅱ c。SSS Ⅱ a主要在胚乳表达, SSS Ⅱ b主要在叶片表达, SSS Ⅱ c在胚乳、叶片和根中均有表达[11]。Hirose等[12]研究表明SSS Ⅱ b基因负责合成中等长度链的支链淀粉。淀粉的结构决定其功能特性, 淀粉的晶体层主要由支链淀粉高度分支的双螺旋结构组成, 较大比例的中等或长支链分支淀粉会稳定晶体层的热糊化特性, 使稻米糊化温度升高, 而短支链分支淀粉的比例与淀粉糊化温度负相关, 优质稻米品种往往具有较低的糊化温度。SSS Ⅱ b基因主要负责合成支链淀粉的中等长度链[13], 因此, 敲除该基因能够减少中等链长淀粉的比例, 产生较多的短链分支淀粉, 从而使稻米具有较低的糊化温度和较优的品质特性。
'宁粳4号'属粳型常规水稻, 直链淀粉含量在16%~17%, 为进一步降低该品种直链淀粉含量, 增加适口性, Sun等[14]利用近几年发展起来的基因组编辑技术如CRISPR/Cas9, 以'宁粳4号'为受体, 以淀粉合酶基因SSS Ⅱ b(Os02g0744700)为目标基因, 创制了一批淀粉合酶基因SSS Ⅱ b敲除的转基因家系。本研究经过分子鉴定, 选出已敲除目标基因、不含Cas9载体构建的SSS2-Q家系, 其直链淀粉含量较'宁粳4号'下降, 并对该家系进行生理生化特征及农艺性状的考察, 评价其利用价值。
1 材料与方法 1.1 试验材料SSS Ⅱ b基因位于第2染色体, 大小为4 919 bp。本研究在该基因的前、中、后设置3个靶点, 分别构建基于CRISPR/Cas9的敲除载体, 以'宁粳4号'为受体, 进行转化。
'宁粳4号'基因编辑后的T0代转基因苗, 种子量少, 进一步繁种得T1代。经测序发现T1代植株发生碱基变化的位点部分为杂合型, 继续繁种得T2代。挑选T2代纯合敲除的植株加代种植, 获得T3代稳定的、纯合敲除的转基因家系。根据编辑靶点位置的不同, 分别命名为SSS2-Q、SSS2-Z、SSS2-H(图 1)。
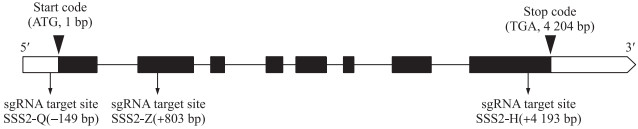
|
图 1 SSS Ⅱ b基因的靶点位置 Fig. 1 The location of SSS Ⅱ b gene target sites |
将T3代SSS2-Q、SSS2-Z、SSS2-H转基因家系和'宁粳4号'种植于南京农业大学土桥水稻试验站。行距为20 cm, 株距为13.3 cm, 每穴1苗, 每行10株, 3个转基因家系各6行, 常规大田管理。抽穗前, 分单株取'宁粳4号'和转基因家系叶片用于DNA的提取。水稻开花时, 对当天开花的'宁粳4号'和转基因家系进行点颖标记, 在开花12 d后取各个家系的胚乳, 用于RNA提取。水稻成熟后, 根据分子鉴定结果随机选取'宁粳4号'和各个转基因家系20株阳性单株, 调查株高、分蘖数、一次枝梗数、穗长、每穗粒数、结实率等。收取'宁粳4号'和各个转基因家系阳性单株, 烘干至恒重, 用万深SC-G自动考种仪测量粒长、粒宽、千粒重, 3次重复。用于后续品质指标测定。
1.3 分子标记鉴定 1.3.1 DNA提取采用CTAB法提取DNA, 步骤如下:剪叶片放入2.0 mL EP管中, 球磨仪粉碎后, 加入600 μL CTAB提取液, 65 ℃水浴30 min。加入600 μL氯仿、异戊醇混合液(体积比为24 : 1), 12 000 r · min-1离心5 min, 吸400 μL上清液于另一新的1.5 mL EP管, 加入240 μL异丙醇溶液, 冷冻30 min。4 ℃ 12 000 r · min-1离心3 min, 弃上清液, 加入400 μL 70%(体积分数)乙醇溶液洗涤后弃乙醇, 晾干。加入200 μL ddH2O溶解, 即得DNA母液。
1.3.2 PCR反应PCR扩增反应体系:DNA模板2.0 μL, 10 μmol · L-1正、反向引物各1.0 μL, 10× Buffer(Mg2+ plus)2.0 μL, 2.5 mmol · L-1 dNTP1.0 μL, rTaq DNA聚合酶(TaKaRa)0.1 μL, 加ddH2O补至10 μL。反应程序为:95 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 36个循环; 72 ℃ 10 min; 4 ℃ 10 min。将得到的PCR产物于4 ℃保存, PCR扩增引物见表 1。
| 家系 Line |
正向引物序列 Forward premier sequence(5′→3′) |
反向引物序列 Reverse premier sequence(5′→3′) |
| SSS2-Q | CCGTTTGCCTTCCCTCCAA | GTGGTGAGGATGGCGTCGC |
| SSS2-Z | GGATTCAGTTTCATCACCC | GTGGTGGCTTCTGAATGTT |
| SSS2-H | CGGAACTACAAGGAGAGC | ATTGTCCTGGTAAATGGT |
| 含有Cas9单株Plant contained Cas9 | GCAGTCAGGGACCATAGCACAAGA | AAGCACCGACTCGGTGCCACTTT |
用450 mmol · L-1 Tris-H3BO3和10 mmol · L-1 EDTA调节溶液pH值为8.0;配制50× TAE缓冲液母液, 将母液稀释为1× TAE的缓冲液作为电泳液, 用其配制10 g · L-1琼脂糖凝胶, 加1滴溴化乙锭, 待冷却凝固后点样(加Loading Buffer的PCR扩增产物)。在电压150 V、电流80 mA条件下电泳15 min后取出, 在凝胶成像仪下观察, 切目标条带, 送南京擎科生物科技有限公司测序, 鉴定敲除效应。
1.4 品质指标的测定 1.4.1 直链淀粉含量测定在已调查农艺性状的各个转基因家系20个单株中随机挑选10个单株和'宁粳4号'的种子, 去壳得糙米, 将糙米研磨成精米, 再磨碎成过147 μm筛孔的精米粉, 对其精米粉进行直链淀粉含量测定。参照《水稻、玉米、谷子籽粒直链淀粉测定法:GB 7648—1987》进行测定:称取精米粉0.100 0 g, 置于100 mL容量瓶, 加入95%乙醇1 mL和1 mol · L-1 NaOH溶液9 mL, 沸水浴10 min, 冷却, 定容。取5 mL定容后的溶液至新的容量瓶中, 加入1 mol · L-1乙酸1 mL和1.5 mL碘液, 定容, 静置20 min。使用分光光度计在620 nm波长下测定样品的吸光度值, 计算出待测样品的直链淀粉含量。每个样品重复3次, 取平均值。
1.4.2 支链淀粉链长分布检测在已完成直链淀粉含量测定的'宁粳4号'与转基因家系的10个单株中, 选取直链淀粉含量下降显著单株的精米粉进行支链淀粉链长的测定。称取5 mg精米粉于2.0 mL EP管中, 采用Han等[15]的方法进行处理。加入20 μL ddH2O对样品稀释、过滤, 37 ℃保温数分钟, 离心, 水洗2次。样品经冻干机干燥成干粉状, 加入3 mol · L-1尿素80 μL, 用于毛细管电泳。在ABI3730XL高通量DNA测序仪上进行电泳分析, 电泳完毕, 导出数据。
1.4.3 胶稠度测定在已完成直链淀粉含量测定的'宁粳4号'与转基因家系的10个单株中, 选取直链淀粉含量变化的单株精米粉进行胶稠度测定。称取精米粉100 mg放入玻璃试管, 加入95%乙醇麝香草酚蓝液200 μL和0.2 mol · L-1的KOH溶液2 mL; 沸水中加热8 min, 取出试管置于室温10 min, 冰水浴20 min; 再把试管水平放在铺有方格坐标纸的水平台上, 静置1 h。记录米胶流淌长度, 以mm为单位表示。
1.4.4 米粉黏度的测定用于米粉黏度测定的单株同1.4.3节, 称取精米粉3.0 g于铝杯中, 加入25.0 mL ddH2O搅拌。采用瑞典波通公司的快速黏度分析仪(RVA)测定米粉的黏度特性, 仪器在水循环下使用, 具体测定参照隋炯明等[5]的方法。
1.5 RNA提取及RT-qPCR使用RNApure Plant Kit(Tiangen)提取'宁粳4号'和转基因家系总RNA。将开花12 d后的胚乳于冰上研磨, 具体步骤参见试剂盒。向模板RNA(1 μg)中加入1 μL Oligo dT Primer、1 μL dNTP Mixture, 用RNA Free ddH2O补充至10 μL。65 ℃保温5 min后, 冰上迅速冷却。在上述10 μL反应液中加入4 μL 5×PrimeScriptⅡ Buffer、0.5 μL RNase Inhibitor、0.5 μL PrimeScriptⅡ RTase, 用RNA Free ddH2O补充至20 μL。经42 ℃ 1 h, 72 ℃ 15 min, 4 ℃ 10 min合成cDNA。荧光定量PCR反应体系:8 μL cDNA模板(稀释10倍使用)、1.6 μL引物、10.4 μL SYBR Green荧光染料。以水稻Ubq基因作为内参进行扩增, 设3个重复。RT-qPCR反应在ABI PRISM 7500HT仪器上进行, 采用2-ΔΔCT法对数据进行分析。
2 结果与分析 2.1 CRISPR/Cas9转基因家系的分子鉴定对SSS Ⅱ b基因进行多靶点编辑, 得到3个独立来源的转基因家系SSS2-Q、SSS2-Z和SSS2-H(图 2)。SSS2-Q家系在靶点处产生4种类型的突变:缺少3个碱基(-3TAA)、缺少2个碱基(-2TA)、缺少11个碱基、插入1个碱基(+C)。SSS2-Z家系在靶点处产生2种类型的突变:插入1个碱基(+T)、缺少1个碱基(-T)。SSS2-H家系在靶点处产生2种类型的突变:插入1个碱基(+T)、缺少1个碱基(-T)。选择基因型、表型稳定且株型未发生显著变化的转基因家系, 用于后续研究。
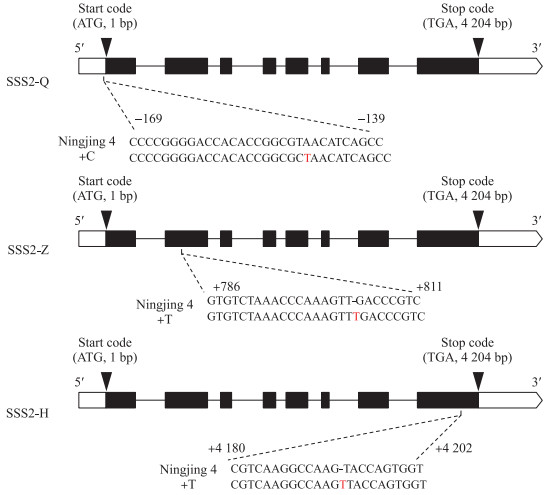
|
图 2 靶向编辑SSS Ⅱ b基因位点示意图 Fig. 2 Schematic diagram of the targeted site in the SSS Ⅱ b gene 箭头表示起始密码子和终止密码子, 括号中的数字表示到起始密码子(ATG)的距离。黑盒子表示编码序列, 白盒子表示未翻译区域。 Arrows indicate the start codon and stop codon. The numbers in brackets indicate the distance to the start codon(ATG). Black box denotes coding sequence, and white box is the untranslated region. |
这些家系在SSS Ⅱ b基因序列上分别发生以下变化:SSS2-Q家系的编辑位点发生在5′非翻译区, 该靶点处发生1个碱基(+C)的插入, 不影响翻译和氨基酸序列, 但影响SSS Ⅱ b基因的表达; SSS2-Z家系在靶点处发生1个碱基(+T)的插入, 导致SSS Ⅱ b氨基酸序列提前终止; SSS2-H家系在靶点处发生1个碱基(+T)的插入, 使末尾几个氨基酸序列发生替换。
为挑选出转基因家系中含目标片段但不含Cas9载体构建的单株, 对每个家系各世代的单株进行分子检测, 结果见表 2。从每个世代中选择阳性单株, 然后再从阳性单株中挑选不含Cas9载体构建的单株。
| 转基因家系 Transgenic lines |
世代 Generation |
总株数 Total number of plants |
阳性植株数 Positive number of plants |
不含Cas9载体构建株数 Number of transgenic vector plants |
| SSS2-Q | T1 | 41 | 27 | 4 |
| T2 | 42 | 37 | 11 | |
| T3 | 53 | 41 | 28 | |
| SSS2-Z | T1 | 34 | 18 | 3 |
| T2 | 43 | 35 | 8 | |
| T3 | 46 | 37 | 12 | |
| SSS2-H | T1 | 36 | 27 | 5 |
| T2 | 31 | 28 | 5 | |
| T3 | 51 | 42 | 14 |
如图 3所示:SSS2-Q-1—SSS2-Q-10、SSS2-Z-1—SSS2-Z-10、SSS2-H-1—SSS2-H-10分别为SSS2-Q、SSS2-Z、SSS2-H家系T3代10个独立转基因单株, 选用这些单株进行分子鉴定。SSS2-Q家系10个单株含有目标片段但不含有Cas9载体构建, SSS2-Z-6、SSS2-Z-10和SSS2-H-4、SSS2-H-9、SSS2-H-10含有目标片段且含有Cas9载体构建。
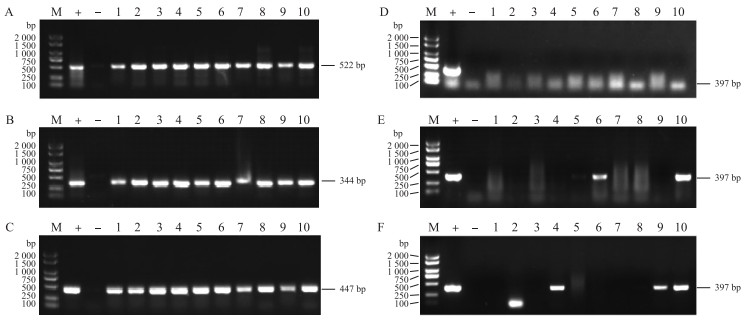
|
图 3 SSS2-Q、SSS2-Z和SSS2-H家系T3代转基因单株的基因型鉴定 Fig. 3 Genotype identification of T3 transgenic plants of SSS2-Q, SSS2-Z and SSS2-H lines A、B、C. SSS2-Q、SSS2-Z和SSS2-H家系目标片段鉴定; D、E、F. SSS2-Q、SSS2-Z和SSS2-H家系Cas9鉴定。M.分子质量标准; +.阳性对照; -.阴性对照; 1~10分别为SSS2-Q、SSS2-Z、SSS2-H家系T3代10个独立转基因单株。下同。 A, B, C. Identification of target fragments in SSS2-Q, SSS2-Z and SSS2-H lines; D, E, F. Identification of Cas9 in SSS2-Q, SSS2-Z and SSS2-H lines. M. Molecular weight marker; +. Positive control; -. Negative control; 1-10 represent 10 independent T3 transgenic plants of SSS2-Q, SSS2-Z and SSS2-H lines, respectively. The same as follows. |
对'宁粳4号'和T3代各个家系10个独立转基因单株进行直链淀粉含量测定。结果(表 3)显示:SSS2-Q家系较'宁粳4号'直链淀粉含量显著下降, SSS2-Z家系直链淀粉含量与'宁粳4号'没有显著差异, SSS2-H家系与'宁粳4号'相比直链淀粉含量升高。对SSS Ⅱ b基因设计多靶点敲除, 仅SSS2-Q家系符合低直链淀粉水稻品种选育的目标。
| 品种/家系 Variety/lines |
直链淀粉含量/% Amylose conten |
| 宁粳4号Ningjing 4 | 17.876±0.048 |
| SSS2-Q-1 | 16.879±0.418* |
| SSS2-Q-2 | 17.239±0.173** |
| SSS2-Q-3 | 16.795±0.127** |
| SSS2-Q-4 | 16.435±0.083** |
| SSS2-Q-5 | 17.239±0.173** |
| SSS2-Q-6 | 17.183±0.166** |
| SSS2-Q-7 | 15.909±0.292** |
| SSS2-Q-8 | 16.629±0.292** |
| SSS2-Q-9 | 15.853±0.288** |
| SSS2-Q-10 | 17.599±0.249 |
| 宁粳4号Ningjing 4 | 17.114±0.569 |
| SSS2-Z-1 | 18.319±0.481 |
| SSS2-Z-2 | 16.128±0.711 |
| SSS2-Z-3 | 17.661±0.207 |
| SSS2-Z-4 | 18.319±0.207* |
| SSS2-Z-5 | 17.826±1.823 |
| SSS2-Z-6 | 17.771±0.164 |
| SSS2-Z-7 | 18.045±0.342 |
| SSS2-Z-8 | 18.456±0.095* |
| SSS2-Z-9 | 17.963±0.342 |
| SSS2-Z-10 | 16.566±0.288 |
| 宁粳4号Ningjing 4 | 17.167±0.228 |
| SSS2-H-1 | 18.484±0.241** |
| SSS2-H-2 | 19.458±0.241** |
| SSS2-H-3 | 20.565±0.241** |
| SSS2-H-4 | 18.958±0.329** |
| SSS2-H-5 | 18.273±0.690 |
| SSS2-H-6 | 18.984±0.299** |
| SSS2-H-7 | 18.800±0.717* |
| SSS2-H-8 | 18.826±0.199** |
| SSS2-H-9 | 19.695±0.121** |
| SSS2-H-10 | 20.512±0.158** |
| Note:*P<0.05, * *P<0.01. The same as follows. | |
与'宁粳4号'相比, SSS2-Q家系(SSS2-Q-3)支链淀粉链长聚合度(degree of polymerization, DP)分布在10<DP<18处的中等链长减少, 而6<DP<10处的短链和18<DP<25的长链增加(图 4)。
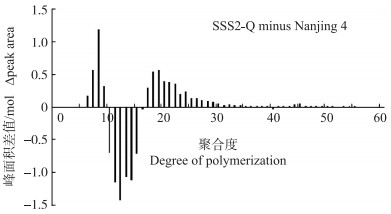
|
图 4 '宁粳4号'与SSS2-Q家系淀粉支链长分布的差异 Fig. 4 Difference in amylopectin chain length distributions between'Ningjing 4'and SSS2-Q lines |
'宁粳4号'胶稠度平均为86 mm。SSS2-Q家系(SSS2-Q-3和SSS2-Q-5)胶稠度与'宁粳4号'相比显著升高; 而SSS2-Z家系(SSS2-Z-4和SSS2-Z-8)胶稠度与'宁粳4号'没有差异; SSS2-H家系(SSS2-H-3和SSS2-H-6)胶稠度与'宁粳4号'相比有所下降(图 5)。由于胶稠度与蒸煮食味品质呈显著正相关关系, 表明SSS2-Q家系食味品质优于'宁粳4号'和其他2个家系。
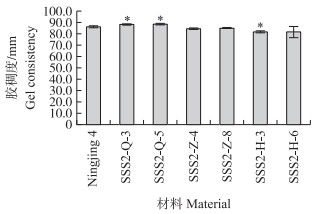
|
图 5 '宁粳4号'与3个转基因家系的胶稠度 Fig. 5 Gel consistency of 'Ningjing 4'and three different knockout transgenic lines |
从表 4可见:SSS2-Q家系(SSS2-Q-3)的淀粉热浆黏度、冷浆黏度、峰值时间、起浆温度均低于'宁粳4号', 崩解值高于'宁粳4号'。SSS2-Z家系(SSS2-Z-4)、SSS2-H家系(SSS2-H-3)的热浆黏度、冷浆黏度低于'宁粳4号'但高于SSS2-Q家系, 崩解值高于'宁粳4号'但低于SSS2-Q家系。SSS2-Q家系的淀粉黏滞性特征值均较好。
| 品种/家系 Variety/lines |
峰值黏度 PKV |
热浆黏度 HPV |
崩解值 BDV |
冷浆黏度 CPV |
消减值 SBV |
峰值时间/min PET |
起浆温度/℃ PAT |
| 宁粳4号Ningjing 4 | 4 402 | 2 125 | 2 017 | 3 354 | -1 335 | 5.8 | 76.65 |
| SSS2-Q-3 | 4 142 | 1 888 | 2 514 | 3 067 | -788 | 5.5 | 76.00 |
| SSS2-Z-4 | 3 751 | 1 913 | 2 138 | 3 142 | -909 | 5.6 | 75.15 |
| SSS2-H-3 | 3 558 | 1 919 | 2 039 | 3 291 | -967 | 5.5 | 75.95 |
| Note: PKV:Peak viscosity; HPV:Hot paste viscosity; BDV:Breakdown; CPV:Cool paste viscosity; SBV:Setback; PET:Peak time; PAT:Pasting temperature. | |||||||
从图 6可见:SSS2-Q家系(SSS2-Q-3)中SSS Ⅱ b基因表达水平极显著低于'宁粳4号', SSS2-Q家系(SSS2-Q-3)其他淀粉合成相关基因的表达水平也发生变化, 如:SSS Ⅲ a、SBE Ⅱ a(淀粉分支酶Ⅱa Starch branching enzyme Ⅱa)基因表达量升高, SSS Ⅰ 、SSS Ⅱ a和SBE Ⅱ b基因表达水平下降, 而颗粒结合淀粉合成酶(granule-bound starch synthase, GBSS)表达没有变化。SSS2-Q家系SSS Ⅱ b基因在5′非翻译区发生碱基变化, 该区域可能存在控制基因表达的调控序列, 基因编辑之后导致SSS Ⅱ b基因的表达水平发生变化, 同时引起其他淀粉合成相关基因的表达紊乱和补偿, 进而影响淀粉合成途径和理化性质。
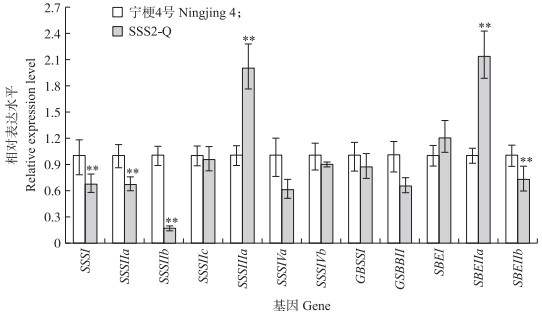
|
图 6 '宁粳4号'与SSS2-Q家系胚乳中淀粉合成相关基因的相对表达水平 Fig. 6 Relative expression level of starch synthesis related genes in'Ningjing 4'and SSS2-Q transgenic lines |
'宁粳4号'与SSS2-Q家系(SSS2-Q-5)成熟期植株表型如图 7所示。考种发现, SSS2-Q家系每穗粒数与'宁粳4号'没有差异, 每穗实粒数显著下降, 结实率降低, 出现一些空壳、瘪粒, 可能是由于转基因影响育性相关的性状。另外SSS2-Q家系稻粒变长, 其他农艺性状没有显著变化(表 5)。

|
图 7 '宁粳4号'与SSS2-Q家系植株表型 Fig. 7 The plant phenotype of 'Ningjing 4' and SSS2-Q transgenic lines A和B分别代表'宁粳4号'与SSS2-Q家系成熟期植株表型, 标尺为18 cm。 A and B represent the plants of 'Ningjing 4'and SSS2-Q transgenic lines after maturation, respectively. Bar=18 cm. |
| 农艺性状Agronomic trait | 宁粳4号Ningjing 4 | SSS2-Q |
| 株高/cmPlant height | 79.65±2.01 | 79.45±3.33 |
| 有效分蘖数Productive tiller | 10.60±2.50 | 9.90±1.37 |
| 穗长/cmPanicle length | 17.13±1.07 | 16.72±0.55 |
| 一次枝梗数Primary branch | 13.33±1.53 | 13.27±1.04 |
| 每穗粒数Grains per panicle | 156.67±3.06 | 153.60±12.56 |
| 每穗实粒数Filled grain per panicle | 131.33±13.01 | 82.53±11.67** |
| 结实率/% Seed-setting rate | 83.81±7.92 | 53.95±6.37** |
| 千粒重/g1 000-grain weight | 26.55±0.21 | 26.10±0.53 |
| 粒长/mmGrain length | 7.06±0.07 | 7.22±0.07** |
| 粒宽/mmGrain width | 3.25±0.01 | 3.29±0.04 |
稻米的主要组分是淀粉, 包括直链淀粉和支链淀粉, 2种类型淀粉的比例、组成及其精细结构差异是影响稻米食味品质的主要决定因素[13]。直链淀粉含量作为稻米品质的重要评价指标, 由GBSSⅠ控制直链淀粉合成, 对稻米品质的影响较大, 另外还存在其他淀粉合酶基因共同调控水稻品质特性。SSS各类同工型在支链淀粉合成中发挥不同作用, 并具有特定的功能[16]。Jeon等[9]报道, SSSⅠ主要负责支链淀粉短链合成, 其籼型等位基因编码的酶活性更强, 能提高稻米淀粉的黏滞性。SSSⅣ的2种同工型(SSSⅣa和SSSⅣb)在拟南芥中过表达后能够提高叶片瞬时淀粉的含量, 其可能在水稻中具有增加淀粉含量的潜能[17]。Zhu等[18]通过同时下调SBE Ⅰ 和SBE Ⅱ b的表达而获得直链淀粉含量接近50%、抗性淀粉含量达到13%左右的转基因水稻材料。Li等[13]利用RNA干扰技术抑制SSS Ⅱ b基因的表达培育出软米品种。上述研究表明, 通过合理的基因选择, 进行不同等位组合可以达到改良品质的目的, 培育出优质的稻米种质资源。
直链淀粉含量与稻米食味品质负相关, 直链淀粉含量高的米煮饭时膨胀性较大, 米饭松散, 冷后发硬, 适口性较差; 而直链淀粉含量较低的米煮饭时膨胀性较小, 米饭蓬松柔软, 深受人们青睐。'宁粳4号'的直链淀粉含量在16%左右, 在此基础上适度降低含量, 能够综合软米的柔软性和粳稻的弹性, 使其适口度增加, 更被人们所接受。本研究利用CRISPR/Cas9基因编辑技术, 以水稻品种'宁粳4号'为受体, 对SSS Ⅱ b基因进行多靶点敲除, 即在该基因的前、中、后位置设计敲除位点, 通过基因型和表型鉴定, 获得了目标基因受到编辑、不含Cas9载体构建的SSS2-Q家系。与前人采用RNA干扰技术[13]下调SSS Ⅱ b基因表达的研究相比, SSS2-Q家系在表型得到改善的同时, 也实现了剔除转基因载体构建的目标。该家系基因编辑部位发生在5′非翻译区, 抑制了SSS Ⅱ b基因表达, 但没有影响基因的完整结构, 酶蛋白功能应该是正常的。SSS2-Q家系直链淀粉含量较'宁粳4号'显著降低, 胶稠度、RVA特征值等指标得到优化, 植株外观没有显著变化。同时SSS2-Q家系米粉支链淀粉链长精细结构发生了变化, 中等长度链比例降低, RVA谱测定的淀粉成糊温度即起浆温度降低。研究表明中等长度链减少之后对稻米外观没有影响, 但能够降低稻米的糊化温度, 进而具有较好的食味表现[2], 说明SSS2-Q家系食味品质特性得到改良。进一步RT-qPCR分析发现, 在SSS2-Q家系中SSS Ⅱ b基因表达下调, 其他淀粉合成相关基因的表达也发生了变化, 如SSS Ⅲ a基因表达升高, 该基因突变后淀粉黏滞性降低[2], 猜测可能是SSS2-Q家系淀粉黏滞性改变的原因; SBE Ⅱ a基因表达升高, 该基因影响支链淀粉短链的形成。SSS Ⅰ 、SSS Ⅱ a和SBE Ⅱ b表达水平下降, SSS Ⅰ 是胚乳中主要的淀粉合酶基因, SSS Ⅱ a基因能够合成支链淀粉中的长链, 影响淀粉的理化性质, SBE Ⅱ b在支链淀粉形成中也起到重要的作用。淀粉的生物合成受20多种酶的调控, 其表达调控极为复杂, 仍需进一步研究。
水稻籽粒灌浆过程中, 可溶性淀粉合酶之间通过形成酶蛋白复合体行使功能, 当某种特定酶的活性改变时, 淀粉合成酶蛋白复合物的组成将有所改变。例如, 粳稻SSSⅡa的活性仅是籼稻中的10%, 粳稻中SSSⅡa与其他淀粉合成酶的相互作用削弱, 但在胚乳发育时期SSSⅡa可通过与SSSⅠ、SBEⅡb或其他淀粉合成酶形成蛋白复合体的形式, 确保淀粉的正常产生[19]。本研究发现, SSS2-Q家系灌浆时期SSS Ⅱ b基因表达受阻, 淀粉积累缓慢, 但后期可以形成正常透明的水稻种子。SSS2-Z家系SSSⅡb氨基酸序列提前终止, 该酶不能行使正常功能, 推测SSSⅡb可与其他淀粉合成酶形成替代复合体的形式, 保证淀粉颗粒形态、分子大小、直链淀粉含量不受影响。SSS2-H家系仅是末尾几个氨基酸发生替换, 就能影响其酶活, 进而影响支链淀粉的合成, 导致直链淀粉含量有所升高。SSS2-Z和SSS2-H家系没有达到品质改良的预期目标, 考虑到本研究选育的SSS2-Q家系, 农艺性状还不够理想, 影响育种利用, 尚需进一步研究和改良。
转基因技术可加速对优异基因的利用, 本研究采用CRISPR/Cas9基因编辑技术靶向编辑淀粉合酶基因SSS Ⅱ b, 调控淀粉生物合成途径, 降低了受体品种'宁粳4号'的直链淀粉含量, 获得符合预期目标的SSS2-Q家系, 实现改良稻米品质的目标, 同时该家系不含有转基因载体的构建, 可作为新种质, 以培育优质稻米新品种。
致谢: 农业部长江中下游粳稻生物学与遗传育种重点实验室、现代作物生产省部共建协同创新中心、南方粳稻研究开发有限公司给予支持, 谨致谢意。
| [1] |
Rao Y C, Li Y Y, Qian Q. Recent progress on molecular breeding of rice in China[J]. Plant Cell Reports, 2014, 33(4): 551-564. DOI:10.1007/s00299-013-1551-x |
| [2] |
张昌泉, 赵冬生, 李钱峰, 等. 稻米品质性状基因的克隆与功能研究进展[J]. 中国农业科学, 2016, 49(22): 4267-4283. Zhang C Q, Zhao D S, Li Q F, et al. Progresses in research on cloning and functional analysis of key genes involving in rice grain quality[J]. Scientia Agricultura Sinica, 2016, 49(22): 4267-4283 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2016.22.002 |
| [3] |
Tian Z X, Qian Q, Liu Q, et al. Allelic diversities in rice starch biosynthesis lead to a diverse array of rice eating and cooking qualities[J]. Proc Natl Acad Sci USA, 2009, 106(51): 21760-21765. DOI:10.1073/pnas.0912396106 |
| [4] |
Chen Y, Bao J. Underlying mechanisms of zymographic diversity in starch synthaseⅠand pullulanase in rice-developing endosperm[J]. J Agric Food Chem, 2016, 64(9): 2030-2037. DOI:10.1021/acs.jafc.5b06030 |
| [5] |
隋炯明, 李欣, 严松, 等. 稻米淀粉RVA谱特征与品质性状相关性研究[J]. 中国农业科学, 2005, 38(4): 657-663. Sui J M, Li X, Yan S, et al. Studies on the rice RVA profile characteristics and its correlation with the quality[J]. Scientia Agricultura Sinica, 2005, 38(4): 657-663 (in Chinese with English abstract). DOI:10.3321/j.issn:0578-1752.2005.04.003 |
| [6] |
Zhu L J, Liu Q Q, Sang Y J, et al. Underlying reasons for waxy rice flours having different pasting properties[J]. Food Chemistry, 2010, 120(1): 94-100. DOI:10.1016/j.foodchem.2009.09.076 |
| [7] |
Zhang J, Zhang H, Botella J, et al. Generation of new glutinous rice by CRISPR/Cas9-targeted mutagenesis of the Waxy gene in elite rice varieties[J]. J Integr Plant Biol, 2018, 60(5): 369-375. DOI:10.1111/jipb.12620 |
| [8] |
Ma X L, Zhang Q Y, Zhu Q L, et al. A robust CRISPR/Cas9 system for convenient, high-efficiency multiplex genome editing in monocot and dicot plants[J]. Molecular Plant, 2015, 8(8): 1274-1284. DOI:10.1016/j.molp.2015.04.007 |
| [9] |
Jeon J S, Ryoo N, Hahn T R, et al. Starch biosynthesis in cereal endosperm[J]. Plant Physiology and Biochemistry, 2010, 48(6): 383-392. DOI:10.1016/j.plaphy.2010.03.006 |
| [10] |
Jiang H W, Dian W M, Liu F Y, et al. Molecular cloning and expression analysis of three genes encoding starch synthase Ⅱ in rice[J]. Planta, 2004, 218(6): 1062-1070. DOI:10.1007/s00425-003-1189-y |
| [11] |
Baba T, Nishihara M, Mizuno K, et al. Identification, cDNA cloning, and gene expression of soluble starch synthase in rice(Oryza sativa L.)immature seeds[J]. Plant Physiology, 1993, 103(2): 565-573. DOI:10.1104/pp.103.2.565 |
| [12] |
Hirose T, Ohdan T, Nakamura Y, et al. Expression profiling of genes related to starch synthesis in rice leaf sheaths during the heading period[J]. Physiologia Plantarum, 2006, 128(3): 425-435. DOI:10.1111/j.1399-3054.2006.00758.x |
| [13] |
Li Q F, Huang L C, Chu R, et al. Down-regulation of SSSⅡ-2 gene expression results in novel low-amylose rice with soft, transparent grains[J]. Journal of Agric Food Chem, 2018, 66(37): 9750-9760. DOI:10.1021/acs.jafc.8b02913 |
| [14] |
Sun Y W, Jiao G A, Liu Z P, et al. Generation of high-amylose rice through CRISPR/Cas9-mediated targeted mutagenesis of starch branching enzymes[J]. Frontiers in Plant Science, 2017, 8: 298. |
| [15] |
Han X H, Wang Y H, Liu X, et al. The failure to express a protein disulphide isomerase-like protein results in a floury endosperm and an endoplasmic reticulum stress response in rice[J]. J Exp Bot, 2012, 63(1): 121-130. DOI:10.1093/jxb/err262 |
| [16] |
朱昌兰, 翟虎渠, 万建民. 稻米食味品质的遗传和分子生物学基础研究[J]. 江西农业大学学报(自然科学), 2002, 24(4): 454-459. Zhu C L, Zhai H Q, Wan J M. Progresses in the studies of genetic and molecular bases of eating-quality in rice[J]. Acta Agriculturae Universitis Jiangxiensis, 2002, 24(4): 454-459 (in Chinese with English abstract). |
| [17] |
Gámez-Arjona F M, Li J, Raynaud S, et al. Enhancing the expression of starch synthase class Ⅳ results in increased levels of both transitory and long-term storage starch[J]. Plant Biotechnology Journal, 2011, 9(9): 1049-1060. DOI:10.1111/j.1467-7652.2011.00626.x |
| [18] |
Zhu L J, Gu M H, Meng X L, et al. High-amylose rice improves indices of animal health in normal and diabetic rats[J]. Plant Biotechnology Journal, 2012, 10(3): 353-362. DOI:10.1111/j.1467-7652.2011.00667.x |
| [19] |
Crofts N, Iizuka Y, Abe N, et al. Rice mutants lacking starch synthaseⅠor branching enzyme Ⅱb activity altered starch biosynthetic protein complexes[J]. Frontiers in Plant Science, 2018, 9: 1817. |




