文章信息
- 胡亚凡, 张汝京, 海丹, 赵梦娜, 陆兆新, 吕凤霞, 赵海珍, 别小妹
- HU Yafan, ZHANG Rujing, HAI Dan, ZHAO Mengna, LU Zhaoxin, LÜ Fengxia, ZHAO Haizhen, BIE Xiaomei
- 抑制肠出血性大肠杆菌感染的鸡源乳杆菌筛选及其抑菌机制
- Screening of chicken-derived Lactobacillus inhibiting enterohemorrhagic Escherichia coli infection and its antibacterial mechanism
- 南京农业大学学报, 2020, 43(6): 1143-1150
- Journal of Nanjing Agricultural University, 2020, 43(6): 1143-1150.
- http://dx.doi.org/10.7685/jnau.202002013
-
文章历史
- 收稿日期: 2020-02-15
肠出血性大肠杆菌(EHEC)是一种人畜共患病原菌, 自1982年分离至今, 已在全球不同程度地爆发流行。EHEC感染时会引起腹泻、出血性结肠炎(HC), 甚至造成溶血性尿毒症综合征(HUS)及血栓血小板减少紫癜(TTP)[1-2]。家畜家禽如鸡、羊等是感染人的主要物种, 同时也是主要的食物致病来源。目前治疗其感染主要依靠抗生素, 滥用抗生素治疗已对人类食品和公共卫生安全产生严重威胁。益生菌制剂因其成本低无害且无残留而引起全世界研究人员的关注。乳杆菌通常被认为是安全菌, 能够防止病原体侵入并在肠道中定殖, 以增强免疫力, 多见于人和动物的肠道中。因此研究者们倾向于从人、猪或鸡肠道中筛选乳杆菌, 这样不仅容易筛选且得到的菌株具有很强的耐受胃肠道能力[3-5]。Johnson-Henry等[6]发现瑞士乳杆菌对大肠杆菌O157:H7在肠上皮细胞的黏附中起到抑制效果; Chen等[7]发现, 鼠李糖乳杆菌(GMNL-74)对多重耐药幽门螺旋杆菌表现出抑制能力。临床研究指出植物乳杆菌、双歧杆菌等可以作为微生物制剂的菌种来源, 抑制致病性大肠杆菌的生长繁殖[8]。
目前研究乳杆菌抑制致病菌黏附多采用体外细胞模拟, 本研究在此基础上对小鼠体内大肠杆菌和乳杆菌比例进行高通量测序分析, 相对普通平板计数更加精确, 并同时增加了炎症因子的检测。乳杆菌的免疫能力是筛选菌株的标准之一, 乳杆菌可通过影响炎症因子(如IL-8、肿瘤坏血因子等)来缓解炎症反应。IL-8是重要的炎症因子且易检出, 目前已有报道乳酸球片菌K15可降低细胞过表达IL-8, 对宿主抵御致病菌有重要作用[9]。本研究从健康鸡肠道中筛选抑制大肠杆菌黏附和IL-8过表达的乳杆菌菌株, 旨在为研发益生菌制剂提供新的菌株, 从而预防肠出血性大肠杆菌的感染。
1 材料与方法 1.1 材料与试剂试验用健康鸡, 购买于江苏省南京市玄武区小卫街市场, 宰杀后取肠道。使用的菌株包括标准菌株鼠李糖乳杆菌ATCC 53103(LGG)以及大肠杆菌CICC 21530、ATCC 35150、ATCC 43889、ATCC 25922、AS1.487, 分离菌株大肠杆菌fmb来自南京农业大学食品科学与技术学院酶工程实验室。异硫氰酸荧光素(FITC)购自上海麦克林生化技术有限公司, 人白细胞介素IL-8试剂盒购自欣博盛生物科技有限公司。
1.2 菌株分离与初筛取肠道样品10 g至100 mL的无菌水中, 稀释, 然后选择合适的浓度在MRS平板上反复划线, 37 ℃厌氧培养48 h。疑似菌株经过革兰氏镜检, 挑取革兰氏阳性菌株活化。活化后的菌株按1%的接种量接种到MRS培养基发酵48 h, 4 ℃、8 000 r·min-1离心10 min, 取上清液备用。指示菌活化6 h, 取1 mL菌液, 在波长600 nm下调节吸光值, 菌量为108 CFU·mL-1。制备双层琼脂培养皿, 待培养基温度适宜, 在100 mL培养基中加入100 μL指示菌, 混匀, 倒入含有指示菌的培养基, 凝固0.5 h。打孔器火焰灭菌, 培养皿打孔。加入筛选菌株发酵上清液100 μL, 常温下放置4 h后, 将培养皿放入37 ℃恒温箱, 8 h后观察抑菌圈情况。
1.3 乳杆菌的鉴定为了进行分类学鉴定, 使用通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′, 1492R:5′-GGTTACCTTGTTACGACTT-3′)通过以下程序扩增16S rDNA基因片段:95 ℃ 3 min; 95 ℃ 30 s, 55 ℃ 90 s, 72 ℃ 150 s, 30个循环; 55 ℃ 10 min, 72 ℃ 7 min。在10 g·L-1琼脂糖中进行凝胶电泳获得PCR产物片段, 然后送至上海生工生物工程有限公司进行序列分析。将DNA序列与NCBI数据库中报告的序列进行比较。
1.4 乳杆菌对人工胃肠液的耐受能力采用Solieri等[10]和Tinrat等[11]的方法并略作改进。乳杆菌37 ℃培养16 h, 用生理盐水(pH7.4)洗去培养基, 重悬; 取1 mL菌液(108 CFU·mL-1)重悬于胃蛋白酶终质量浓度为3 g·L-1的MRS培养基中, 混匀, 迅速放入37 ℃恒温箱中。培养0、1、3 h后菌落平板计数, 并计算存活率。存活率=N/N0×100%, 式中:N代表 1或3 h时的活菌数; N0代表 0 h活菌数。另取1 mL菌液(108 CFU·mL-1)重悬于胰蛋白酶终质量浓度为10 g·L-1的MRS培养基中, 混匀, 迅速放入37 ℃恒温箱中。培养0、1、4 h后菌落平板计数, 计算人工肠液中的乳杆菌活菌数。
1.5 乳杆菌对大肠杆菌ATCC 35150黏附的抑制 1.5.1 大肠杆菌的标记采用Vinderola等[12]的方法标记大肠杆菌并略作修改。将大肠杆菌悬浮在100 μg·mL-1 FITC(溶于碳酸盐缓冲液, pH9.4)中, 在黑暗中于室温孵育1 h。3 000 r·min-1离心10 min, 洗涤4次, 除去未结合的FITC。乳杆菌和FITC-E.coli重悬于DMEM(Dulbecco’s modified eagle medium)培养液中, 并调节至108 CFU·mL-1。
1.5.2 细胞培养在Caco-2细胞中加入DMEM完全培养液(含10%胎牛血清和1%双抗), 置于37 ℃、5%CO2的培养箱中孵育; 待细胞生长良好时(70%融合), 进行传代, 将细胞悬液按体积比1:5加到新的培养基中, 即吸取200 μL加到1 mL新的DMEM完全培养基中。每2 d更换培养液, 4 d传代1次, 传代3次后进行黏附试验。
1.5.3 排斥试验在试验组Caco-2细胞中加入500 μL DMEM培养液和500 μL未标记荧光的乳杆菌, 将培养板置于37 ℃、5%CO2的培养箱中孵育1 h后, 用无菌PBS洗涤3次, 洗去未被黏附的乳杆菌; 然后再加入500 μL DMEM培养液和500 μL荧光标记的大肠杆菌, 将培养板置于37 ℃、5%CO2的培养箱中孵育1 h后, 用无菌PBS洗涤3次, 洗去未被黏附的大肠杆菌。
1.5.4 竞争试验在试验组Caco-2细胞中加入500 μL未标记荧光的乳杆菌和500 μL荧光标记的大肠杆菌混合液, 将培养板置于37 ℃、5%CO2的培养箱中孵育1 h后, 用无菌PBS洗涤3次, 洗去未被黏附的大肠杆菌。
1.5.5 置换试验在试验组Caco-2细胞中加入500 μL培养液和500 μL荧光标记的大肠杆菌, 将培养板置于37 ℃、5%CO2的培养箱中分别孵育1 h后, 用无菌PBS洗涤3次, 洗去未被黏附的大肠杆菌; 然后再加入500 μL培养液和500 μL未标记荧光的乳杆菌, 将培养板置于37 ℃、5%CO2的培养箱中分别孵育1 h后, 用无菌PBS洗涤3次, 洗去未被黏附的乳杆菌。
以上各试验处理均参考Jessie等[13]的方法并略作改进。处理组的每个培养孔中加入0.2 μL胰酶反应5 min, 待细胞完全脱落, 加入0.4 μL完全培养液终止反应。收集液体, 荧光酶标仪测定其荧光强度。
抑制率=(1-A/A0)×100%, 式中:A、A0分别代表无乳杆菌和有乳杆菌存在时的荧光强度。
1.6 乳杆菌对大肠杆菌ATCC 35150诱导IL-8过表达的调节乳杆菌和大肠杆菌活化后重悬在DMEM中, 并调节至108 CFU·mL-1。
1) 判断乳杆菌是否诱导Caco-2细胞产IL-8。试验组孔板中加入1 mL乳杆菌, 阳性对照组孔板中加入1 mL大肠杆菌, 阴性对照组孔板中加入1 mL DMEM培养液。37 ℃、5%CO2的培养箱中孵育3 h, 2 500 r·min-1离心20 min, 取上清液待测。
2) 判断乳杆菌能否抑制大肠杆菌诱导Caco-2细胞产生IL-8。试验组孔板中加入1 mL乳杆菌和大肠杆菌的混合液(体积比1:1), 对照组加入500 μL大肠杆菌, 体系用DMEM培养液补足。37 ℃、5%CO2的培养箱中孵育3 h, 2 500 r·min-1离心20 min, 取上清液待测。
以上试验各处理组均按照人白细胞介素IL-8试剂盒说明书进行测定。
1.7 动物试验SPF级别ICR小鼠, 5周龄, 雌性, 购于南通大学, 体质量为18~20 g。小鼠正常饲喂7 d以适应环境。每天人工灯光照明12 h, 标准小鼠饲料喂养, 自由饮水。随机分为3组, 设计如表 1。
| 组别 Group |
数量 Number |
灌胃时间/d Gavage time | |
| 1~7 | 8~14 | ||
| 空白对照 Control | 7 | PBS | PBS |
| 大肠杆菌 Escherichia coli | 7 | 大肠杆菌 E.coli | PBS |
| Lactobacillus johnsonii NJ13 | 7 | 大肠杆菌 E.coli | L.johnsonii NJ13 |
其中, L.johnsonii NJ13 37 ℃培养16 h, 4 ℃、8 000 r·min-1离心10 min, 收集菌体; PBS悬浮, 调整菌量为108 CFU·mL-1。大肠杆菌ATCC 35150活化1.5 h, 同样处理。灌胃液体积按10 mL·kg-1(菌悬液体积/小鼠质量)确定, 每天定时灌胃1次, 灌胃时间安排见表 1。14 d后无菌收集小鼠粪便, 采用高通量测序方法(基因组DNA抽提、PCR扩增、荧光定量、Illumina PE250文库构建和Illumina PE250测序)探究L.johnsonii NJ13在体内对大肠杆菌的抑制。
1.8 数据分析每个试验重复3次, 结果表示为x±SD。数据统计分析采用SAS 8.1软件, 绘图采用Prism 7.0软件。高通量测序方法得到样本中各微生物的序列数, 采用RDP classifier贝叶斯算法对97%相似水平的操作分类单位(operational taxonomic unit, OTU)代表序列进行分类学分析, 在分类水平统计群落组成, 计算肠杆菌科和乳杆菌属的比例。
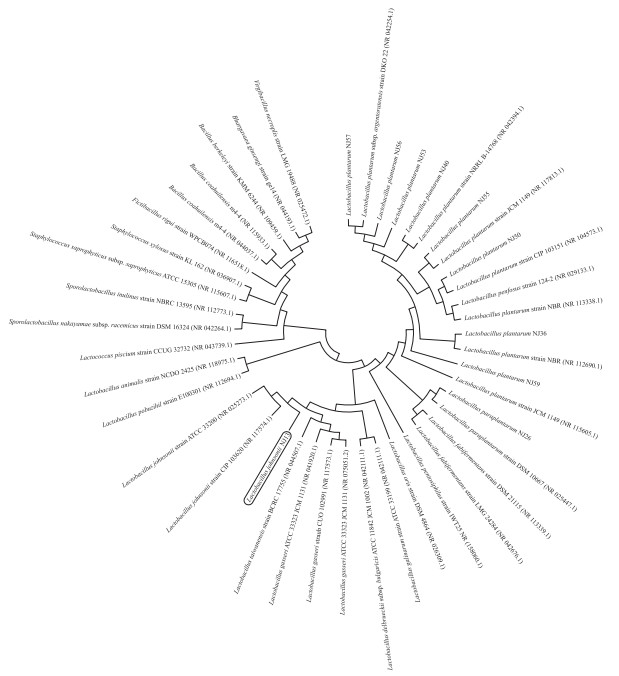
2 结果与分析 2.1 菌株分离与鉴定经平板划线分离和革兰氏镜检, 共有32株疑似菌株。由表 2可见:32株菌的发酵上清液对不同编号的大肠杆菌都具有抑菌效果, 其中编号为13、26、36、40、50、53、55、56、57、59对6株大肠杆菌抑菌圈直径均大于10 mm。这10株菌包括1株约氏乳杆菌、1株副植物乳杆菌、8株植物乳杆菌, 分别为L.johnsonii NJ13、L. paraplantarum NJ26、L. plantarum NJ36、L. plantarum NJ40、L. plantarum NJ50、L. plantarum NJ53、L. plantarum NJ55、L. plantarum NJ56、L. plantarum NJ57、L. plantarum NJ59, 进化树如图 1所示。
| 分离菌株编号 Code of isolated strains |
大肠杆菌 Escherichia coli | |||||
| AS1.487 | fmb | ATCC 35150 | ATCC 43889 | ATCC 25922 | CICC 21530 | |
| 11 | ++ | ++ | ++ | |||
| 12 | ++ | ++ | ++ | + | ++ | |
| 13 | ++ | ++ | ++ | ++ | ++ | ++ |
| 14 | ++ | ++ | ++ | ++ | + | |
| 15 | ++ | ++ | ++ | ++ | ++ | |
| 16 | ++ | ++ | + | |||
| 17 | ++ | ++ | + | |||
| 18 | ++ | ++ | ++ | + | ||
| 19 | ++ | ++ | ++ | + | + | |
| 20 | ++ | ++ | ++ | + | + | |
| 22 | ++ | ++ | + | + | ||
| 25 | ++ | ++ | ++ | + | ||
| 26 | ++ | ++ | ++ | ++ | ++ | ++ |
| 27 | ++ | ++ | + | + | ||
| 31 | ++ | ++ | ++ | + | + | |
| 33 | ++ | ++ | ++ | + | + | |
| 36 | ++ | ++ | ++ | ++ | ++ | ++ |
| 37 | ++ | ++ | ++ | ++ | ||
| 40 | ++ | ++ | ++ | ++ | ++ | ++ |
| 41 | ++ | ++ | ||||
| 42 | ++ | ++ | + | ++ | + | + |
| 43 | ++ | ++ | + | + | + | |
| 44 | ++ | ++ | + | + | ||
| 45 | ++ | ++ | ++ | + | + | + |
| 46 | ++ | ++ | + | + | + | |
| 47 | ++ | ++ | + | |||
| 50 | ++ | ++ | ++ | ++ | ++ | ++ |
| 53 | ++ | ++ | ++ | ++ | ++ | ++ |
| 55 | ++ | ++ | ++ | ++ | ++ | ++ |
| 56 | ++ | ++ | ++ | ++ | ++ | ++ |
| 57 | ++ | ++ | ++ | ++ | ++ | ++ |
| 59 | ++ | ++ | ++ | ++ | ++ | ++ |
|
注:空白代表无抑菌圈; +:4 mm < 抑菌直径(d)≤10 mm; ++:d>10 mm。 Note:Blank represents no inhibition zone; +:4 mm < diameter of the inhibition(d)≤10 mm; ++:d>10 mm. |
||||||
|
图 1 基于16S rDNA序列的系统进化树 Fig. 1 Phylogenetic tree of the ten isolated strains based on 16S rDNA sequence |
由表 3可见:10株乳杆菌在人工模拟胃液环境中培养后, 1 h内活菌数下降102 CFU·mL-1左右, 存活率达76.11%, 并且处理3 h后, L.johnsonii NJ13仍有73.63%的存活率, 说明L.johnsonii NJ13具有很强的耐受胃液能力, 这也为菌株在酸性环境下发挥抑菌作用提供保证。由表 4可见:10株乳杆菌在人工肠液中均能存活, 活菌数保持在108 CFU·mL-1以上。鉴于L.johnsonii NJ13耐受人工胃、肠液效果最佳, 选取其作为潜在益生菌, 并测定其对大肠杆菌的抑制能力。
| 菌株 Strains | 活菌数lg(CFU·mL-1) Viable cells | 存活率/% Survival rates | ||||
| 0 h | 1 h | 3 h | 1 h | 3 h | ||
| L.johnsonii NJ13 | 9.14±0.10 | 6.96±0.06 | 6.69±0.20 | 76.11 | 73.19 | |
| L. paraplantarum NJ26 | 9.14±0.08 | 7.19±0.12 | 5.21±0.08 | 78.66 | 57.02 | |
| L. plantarum NJ36 | 9.39±0.18 | 7.65±0.24 | 5.61±0.18 | 81.45 | 59.68 | |
| L. plantarum NJ40 | 9.24±0.09 | 7.81±0.14 | 5.54±0.14 | 84.52 | 60.00 | |
| L. plantarum NJ50 | 9.23±0.16 | 7.82±0.18 | 6.52±0.21 | 84.73 | 70.63 | |
| L. plantarum NJ53 | 9.23±0.15 | 7.26±0.05 | 5.61±0.27 | 78.65 | 60.74 | |
| L. plantarum NJ55 | 9.24±0.10 | 7.64±0.10 | 6.58±0.16 | 82.66 | 71.24 | |
| L. plantarum NJ56 | 9.44±0.06 | 7.66±0.12 | 6.45±0.34 | 81.12 | 68.29 | |
| L. plantarum NJ57 | 9.19±0.13 | 7.61±0.16 | 6.68±0.16 | 82.76 | 72.65 | |
| L. plantarum NJ59 | 9.43±0.06 | 7.70±0.30 | 6.67±0.16 | 81.64 | 70.74 | |
| 菌株 Strains | 活菌数lg(CFU·mL-1) Viable cells | ||
| 0 h | 1 h | 4 h | |
| L.johnsonii NJ13 | 8.54±0.01 | 8.58±0.00 | 8.64±0.02 |
| L. paraplantarum NJ26 | 8.47±0.02 | 8.47±0.05 | 8.56±0.01 |
| L. plantarum NJ36 | 8.21±0.01 | 8.34±0.03 | 8.47±0.01 |
| L. plantarum NJ40 | 8.41±0.02 | 8.41±0.04 | 8.55±0.02 |
| L. plantarum NJ50 | 8.33±0.01 | 8.34±0.03 | 8.52±0.05 |
| L. plantarum NJ53 | 8.40±0.01 | 8.41±0.00 | 8.68±0.01 |
| L. plantarum NJ55 | 8.36±0.05 | 8.37±0.01 | 8.51±0.02 |
| L. plantarum NJ56 | 8.43±0.01 | 8.44±0.40 | 8.60±0.02 |
| L. plantarum NJ57 | 8.39±0.05 | 8.43±0.02 | 8.58±0.04 |
| L. plantarum NJ59 | 8.40±0.05 | 8.44±0.03 | 8.62±0.02 |
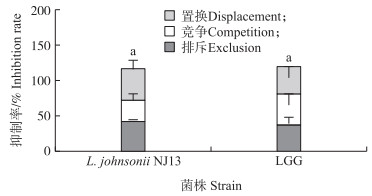
由图 2可见:L.johnsonii NJ13通过排斥、竞争和置换方式对大肠杆菌均具有良好的抑制能力, 抑制率分别为42.52%、27.13%和54.95%, 其中, 置换效果优于排斥和竞争效果。L.johnsonii NJ13综合抑制情况与鼠李糖乳杆菌(LGG)相比无显著差异, 对抑制大肠杆菌的黏附有相似效果。
|
图 2 L.johnsonii NJ13通过排斥、竞争和置换方式对大肠杆菌黏附抑制率的影响 Fig. 2 Effect of L.johnsonii NJ13 on the inhibition rate of E.coli adhesion through exclusion, competition and displacement 1)LGG:鼠李糖乳杆菌L. rhamnosus(ATCC 53103);2)不同字母表示差异显著(P < 0.05)。下同。 Different letters indicate significant differences at 0.05 level. The same as follows. |
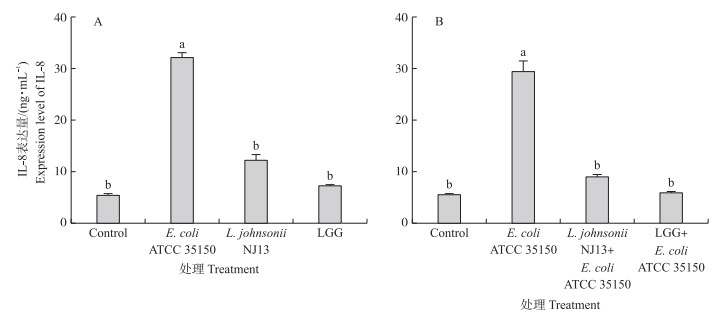
由图 3-A可见:当L.johnsonii NJ13、LGG和E.coli分别处理Caco-2细胞后, 细胞均产生IL-8因子, 说明乳杆菌和大肠杆菌均能使Caco-2细胞产生免疫应答。大肠杆菌处理后IL-8表达量显著高于L.johnsonii NJ13处理组。由图 3-B可见:当L.johnsonii NJ13和LGG分别与E.coli混合处理细胞后, 产生的IL-8细胞因子的量显著低于大肠杆菌单独处理细胞, 说明乳酸可以抑制大肠杆菌对细胞产IL-8的诱导, 其中L.johnsonii NJ13与LGG无显著差异。
|
图 3 不同菌株处理对Caco-2细胞IL-8表达量的影响 Fig. 3 IL-8 production by Caco-2 cells treated with different strains A.乳杆菌和大肠杆菌单独处理对Caco-2细胞IL-8表达量的影响; B.乳杆菌对大肠杆菌诱导Caco-2细胞IL-8过表达的抑制。 A. Effect of Lactobacillus and E.coli alone on the expression level of IL-8 in Caco-2 cells; B. Inhibition of Lactobacillus on E.coli-induced IL-8 overexpression in Caco-2 cells. |
由表 5可见:大肠杆菌组中大肠杆菌占比最高, 达到0.000 442%, 乳杆菌的比例仅占1.298 40%。L.johnsonii NJ13组大肠杆菌科的比例降至0.000 205%, 与大肠杆菌组存在显著差异, 说明L.johnsonii NJ13能够降低大肠杆菌在小鼠肠道内的黏附, 从而起到保护肠道免受大肠杆菌感染的作用。L.johnsonii NJ13组中乳杆菌属的占比达到3.114 40%, 与空白对照组无显著差异, 说明L.johnsonii NJ13能提高肠道有益菌的比例, 调整肠道菌群的结构。
| 组别 Group | 大肠杆菌科/全部菌群 Escherichia/All flora | 乳杆菌属/全部菌群 Lactobacillus/All flora |
| 空白对照 Control | 0.000 184b | 3.506 92a |
| 大肠杆菌 E.coli | 0.000 442a | 1.298 40b |
| L.johnsonii NJ13 | 0.000 205b | 3.114 40a |
|
注:同列数据标有不同字母者表示差异显著(P < 0.05)。 Note:The data in the same column marked with different letters indicate significant differences at 0.05 level. |
||
肠出血性大肠杆菌的致病能力和对胃酸的抵抗力均较强, 对细胞的损伤较大, 感染后宿主容易产生溶血性尿毒综合征等并发症[14]。乳杆菌在代谢过程中会产生有机酸、过氧化氢等抑菌物质, 抑制大肠杆菌的生长[15-16]。发挥抑菌作用的前提是乳杆菌经过胃部到达肠道[17]。本研究中, 10株乳杆菌在胃液中均能存活。Adesulu-Dahunsi等[18]和Angmo等[19]也报道了类似菌株。耐受能力的差别可能与F0F1-ATP酶活性有关[20], 其中, L.johnsonii NJ13耐受能力最佳, 可能与人工胃液中含有葡萄糖有关[21]。肠液的pH值会引起膜电荷的变化并改变其渗透性, 从而影响营养物质的吸收[21], 造成乳杆菌活力下降。本研究中10株乳杆菌都能够在人工肠液中生长, 说明乳杆菌具有较强的耐肠液能力。
乳杆菌可通过不同方式抑制病原菌的黏附, 本研究中L.johnsonii NJ13主要是通过置换方式, 这与Yu等[22]研究结果一致, 但优于排斥和竞争效果的机制还没有定论。感染大肠杆菌后, Caco-2细胞释放促炎症因子, 例如IL-8, 从而引发炎症反应。乳杆菌可通过抑制肠上皮细胞中的炎症因子发挥抗炎作用, 调节肠道炎症细胞信号途径主要包括核因子-κB和促分裂原活化的蛋白激酶[23-24]。正常小鼠肠道菌群中存在着乳杆菌等厌氧菌和大肠杆菌等需氧菌, 二者处于动态平衡中。小鼠灌胃大肠杆菌的7 d内, 肠道内持续增加的大肠杆菌利用肠道内的蛋白质和氨基酸, 致使乳杆菌的数目减少, 条件致病菌大量繁殖, 破坏肠道菌群的平衡, 进而引起一系列疾病如肠炎等[25]。及时补充乳杆菌, 其代谢产物如乳酸、乙酸等可促进肠道中有益菌的生长, 有利于肠道菌群平衡的恢复[26]。L.johnsonii NJ13的补充不仅减少大肠杆菌的数量, 而且还增加乳杆菌的活菌数, 对肠道微生态平衡起到积极的作用。
本研究从鸡肠道中分离出1株约氏乳杆菌, 抑菌能力强, 能够耐受胃、肠道环境, 在人工胃液中的存活率高达73.19%, 在人工肠液中能够生长。同时, 能够抑制大肠乳杆菌对Caco-2细胞的黏附, 缓解大肠杆菌引起的炎症因子IL-8过表达。因此, L.johnsonii NJ13可作为一株潜在益生菌, 应用于益生菌菌种开发, 并可预防肠出血性大肠杆菌的感染。
| [1] |
Karmali M, Petric M, Steele B, et al. Sporadic cases of haemolytic-uraemic syndrome associated with faecal cytotoxin and cytotoxin-producing Escherichia coli in stools[J]. The Lancet, 1983, 321(8325): 619-620. DOI:10.1016/S0140-6736(83)91795-6 |
| [2] |
Konowalchuk J, Speirs J I, Stavric S. Vero response to a cytotoxin of Escherichia coli[J]. Infection and Immunity, 1977, 18(3): 775-779. DOI:10.1128/IAI.18.3.775-779.1977 |
| [3] |
Carafa I, Stocco G, Franceschi P, et al. Evaluation of autochthonous lactic acid bacteria as starter and non-starter cultures for the production of Traditional Mountain cheese[J]. Food Research International, 2019, 115: 209-218. DOI:10.1016/j.foodres.2018.08.069 |
| [4] |
George Kerry R, Patra J K, Gouda S, et al. Benefaction of probiotics for human health:a review[J]. Journal of Food and Drug Analysis, 2018, 26(3): 927-939. DOI:10.1016/j.jfda.2018.01.002 |
| [5] |
Pringsulaka O, Rueangyotchanthana K, Suwannasai N, et al. In vitro screening of lactic acid bacteria for multi-strain probiotics[J]. Livestock Science, 2015, 174: 66-73. DOI:10.1016/j.livsci.2015.01.016 |
| [6] |
Johnson-Henry K C, Hagen K E, Gordonpour M, et al. Surface-layer protein extracts from Lactobacillus helveticus inhibit enterohaemorrhagic Escherichia coli O157:H7 adhesion to epithelial cells[J]. Cellular Microbiology, 2007, 9(2): 356-367. DOI:10.1111/j.1462-5822.2006.00791.x |
| [7] |
Chen Y H, Tsai W H, Wu H Y, et al. Probiotic Lactobacillus spp. act against helicobacter pylori-induced inflammation[J]. Journal of Clinical Medicine, 2019, 8(1): 90. DOI:10.3390/jcm8010090 |
| [8] |
Wang G Q, Zhang Y, Song X, et al. Lactobacillus casei LC2W can inhibit the colonization of Escherichia coli O157:H7in vivo and reduce the severity of colitis[J]. Food & Function, 2019, 10(9): 5843-5852. |
| [9] |
Gutierrez-Merino J, Isla B, Combes T, et al. Beneficial bacteria activate type-Ⅰinterferon production via the intracellular cytosolic sensors STING and MAVS[J]. Gut Microbes, 2020, 11(4): 771-788. DOI:10.1080/19490976.2019.1707015 |
| [10] |
Solieri L, Bianchi A, Mottolese G, et al. Tailoring the probiotic potential of non-starter Lactobacillus strains from ripened Parmigiano Reggiano cheese by in vitro screening and principal component analysis[J]. Food Microbiology, 2014, 38: 240-249. DOI:10.1016/j.fm.2013.10.003 |
| [11] |
Tinrat S, Khuntayaporn P, Thirapanmethee K, et al. In vitro assessment of Enterococcus faecalis MTC 1032 as the potential probiotic in food supplements[J]. Journal of Food Science and Technology, 2018, 55(7): 2384-2394. DOI:10.1007/s13197-018-3155-5 |
| [12] |
Vinderola C G, Medici M, Perdigón G. Relationship between interaction sites in the gut, hydrophobicity, mucosal immunomodulating capacities and cell wall protein profiles in indigenous and exogenous bacteria[J]. Journal of Applied Microbiology, 2004, 96(2): 230-243. DOI:10.1046/j.1365-2672.2004.02158.x |
| [13] |
Jessie Lau L Y, Chye F Y. Antagonistic effects of Lactobacillus plantarum 0612 on the adhesion of selected foodborne enteropathogens in various colonic environments[J]. Food Control, 2018, 91: 237-247. DOI:10.1016/j.foodcont.2018.04.001 |
| [14] |
Nguyen Y, Sperandio V. Enterohemorrhagic E.coli(EHEC)pathogenesis[J]. Frontiers in Cellular and Infection Microbiology, 2012, 2: 90. |
| [15] |
Kumar M, Dhaka P, Vijay D, et al. Antimicrobial effects of Lactobacillus plantarum and Lactobacillus acidophilus against multidrug-resistant enteroaggregative Escherichia coli[J]. International Journal of Antimicrobial Agents, 2016, 48(3): 265-270. DOI:10.1016/j.ijantimicag.2016.05.014 |
| [16] |
Miyazaki Y, Yokota H, Takahashi H, et al. Effect of probiotic bacterial strains of Lactobacillus, Bifidobacterium, and Enterococcus on enteroaggregative Escherichia coli[J]. Journal of Infection and Chemotherapy, 2010, 16(1): 10-18. |
| [17] |
Mortensen N P, Fowlkes J D, Maggart M, et al. Effects of sub-minimum inhibitory concentrations of ciprofloxacin on enteroaggregative Escherichia coli and the role of the surface protein dispersin[J]. International Journal of Antimicrobial Agents, 2011, 38(1): 27-34. DOI:10.1016/j.ijantimicag.2011.03.011 |
| [18] |
Adesulu-Dahunsi A T, Jeyaram K, Sanni A I. Probiotic and technological properties of exopolysaccharide producing lactic acid bacteria isolated from cereal-based Nigerian fermented food products[J]. Food Control, 2018, 92: 225-231. DOI:10.1016/j.foodcont.2018.04.062 |
| [19] |
Angmo K, Kumari A, Bhalla T C, et al. Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J]. LWT-Food Science and Technology, 2016, 66: 428-435. DOI:10.1016/j.lwt.2015.10.057 |
| [20] |
Cotter P D, Hill C. Surviving the acid test:responses of gram-positive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. DOI:10.1128/MMBR.67.3.429-453.2003 |
| [21] |
Corcoran B M, Stanton C, Fitzgerald G F, et al. Survival of probiotic lactobacilli in acidic environments is enhanced in the presence of metabolizable sugars[J]. Applied and Environmental Microbiology, 2005, 71(6): 3060-3067. DOI:10.1128/AEM.71.6.3060-3067.2005 |
| [22] |
Yu Q H, Wang Z S, Yang Q. Ability of Lactobacillus to inhibit enteric pathogenic bacteria adhesion on Caco-2 cells[J]. World Journal of Microbiology and Biotechnology, 2011, 27(4): 881-886. DOI:10.1007/s11274-010-0530-4 |
| [23] |
Liu Y Y, Fatheree N Y, Mangalat N, et al. Lactobacillus reuteri strains reduce incidence and severity of experimental necrotizing enterocolitis via modulation of TLR4 and NF-κB signaling in the intestine[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2012, 302(6): G608-G617. DOI:10.1152/ajpgi.00266.2011 |
| [24] |
Chon H, Choi B, Jeong G, et al. Suppression of proinflammatory cytokine production by specific metabolites of Lactobacillus plantarum 10hk2 via inhibiting NF-κB and p38 MAPK expressions[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2010, 33(6): e41-e49. DOI:10.1016/j.cimid.2009.11.002 |
| [25] |
Lynch S V, Pedersen O. The human intestinal microbiome in health and disease[J]. The New England Journal of Medicine, 2016, 375(24): 2369-2379. DOI:10.1056/NEJMra1600266 |
| [26] |
Wang Y P, Li A Y, Liu J J, et al. L. pseudomesenteroides and L.johnsonii isolated from yaks in Tibet modulate gut microbiota in mice to ameliorate enteroinvasive Escherichia coli-induced diarrhea[J]. Microbial Pathogenesis, 2019, 132: 1-9. DOI:10.1016/j.micpath.2019.04.020 |




