文章信息
- 姜志浩, 李龙龙, 姚瑶, 马海田
- JIANG Zhihao, LI Longlong, YAO Yao, MA Haitian
- 脱氢表雄酮对高脂日粮饲喂大鼠脂肪组织炎症及脂代谢的影响
- Effects of dehydroepiandrosterone on adipose tissue inflammation and lipid metabolism in rats fed a high fat diet
- 南京农业大学学报, 2020, 43(6): 1049-1055
- Journal of Nanjing Agricultural University, 2020, 43(6): 1049-1055.
- http://dx.doi.org/10.7685/jnau.201911003
-
文章历史
- 收稿日期: 2019-11-02
脂肪的过量摄取会诱导肥胖、Ⅱ型糖尿病和非酒精性脂肪肝等代谢紊乱疾病的发生, 威胁人类的健康[1]。研究发现, 肥胖及其相关并发症与免疫系统的长期激活有关:炎症触发因素的持续存在(如过量脂质堆积)会诱导免疫器官中的白细胞不断释放促炎细胞因子, 造成慢性轻度炎症, 诱导胰岛素抵抗和脂代谢紊乱, 最终造成多种代谢性疾病的发生与发展[2-3]。
脂肪组织在体内承担脂肪的存储、合成与分解等功能[4]。此外, 脂肪组织作为机体中重要的免疫器官, 可通过释放脂质介体、炎性细胞因子和多种激素来维持体内脂代谢的平衡[5]。研究表明, 在摄入过多脂肪的情况下, 脂肪细胞会持续产生促炎细胞因子, 导致大量白细胞被募集到脂肪组织, 最终引发炎症, 破坏机体脂代谢稳态[6]。因此, 选择合适的生物活性物质来调节脂代谢并缓解炎症效应, 是治疗或预防肥胖及相关代谢疾病的可行之策。
脱氢表雄酮(dehydroepiandrosterone, DHEA)是机体胆固醇代谢的中间产物, 因其广泛参与机体内一系列重要的生理、病理反应而受到重视[7]。大量文献报道, 补充DHEA可调节机体内脂肪的合成与分解, 降低血清甘油三酯含量, 减少脂肪的沉积[8-10]。另有研究表明, DHEA能通过调节炎症因子的表达来发挥其抗炎效应[11-12]。目前, 关于研究DHEA影响机体代谢相关功能的试验主要集中于动物肝脏或各类型的肝细胞上[13-15], 有关DHEA对高脂日粮诱导大鼠脂肪组织调节效应的报道较少。因此, 本试验通过高脂日粮饲喂大鼠建立肥胖大鼠模型, 探讨DHEA对高脂日粮诱导的肥胖大鼠脂肪组织中脂代谢相关因子和炎症因子表达的影响, 以期为深入研究DHEA调节机体脂代谢紊乱及其炎症反应的生物化学机制提供理论基础。
1 材料与方法 1.1 试验材料脱氢表雄酮购于美国Sigma公司; 苏木素伊红(HE)染色试剂盒和二甲基亚砜购于索莱宝生物科技有限公司; Trizol试剂盒、反转录试剂盒和荧光定量酶购于诺唯赞生物科技有限公司; 引物合成交由上海英骏生物科技有限公司完成。
1.2 试验方法 1.2.1 试验动物及处理2月龄体质量(200±20)g的雄性Sprague-Dawley(SD)大鼠购自南京大学模式动物研究所。大鼠饲养在25 ℃的恒温环境中, 相对湿度50%~60%, 光照/黑暗时间为12 h/12 h; 自由饮食和饮水。正常日粮适应性饲养1周后, 将30只大鼠随机分为3组:正常日粮(ND)组、高脂日粮(HFD)组和高脂日粮+DHEA处理(HFD+DHEA)组。ND组的大鼠饲喂正常日粮(代谢能14.11 kJ·g-1, 日粮包含15.8%脂肪、65.6%碳水化合物和18.6%蛋白质); HFD组和HFD+DHEA组的大鼠饲喂高脂日粮(代谢能21.77 kJ·g-1, 日粮包含60%脂肪、20%碳水化合物和20%蛋白质)。不同处理组分别按体质量以0或50 mg·kg-1的DHEA(溶于1%二甲基亚砜中)灌胃大鼠, 每日1次, 持续10周。
1.2.2 样品采集采样前大鼠饥饿处理12 h, 然后将大鼠乙醚麻醉后断头处死。分别取附睾白色脂肪、腹股沟皮下白色脂肪和肩胛下棕色脂肪。部分组织样品用多聚甲醛固定, 其余组织样本-80 ℃冻存, 用于后续相关指标测定。
1.2.3 脂肪组织的苏木素伊红(HE)染色参照苏木素伊红(HE)染色试剂盒的方法对附睾白色脂肪、腹股沟皮下白色脂肪和肩胛下棕色脂肪进行染色, 每张玻片在显微镜下随机选20个视野拍照, 之后随机选取10张利用ImageJ软件分析脂肪细胞大小。
1.2.4 RT-qPCR法检测细胞脂代谢及炎症相关基因mRNA表达水平总RNA提取:Trizol试剂盒提取附睾白色脂肪、腹股沟皮下白色脂肪总RNA, 分光光度计法测定RNA浓度和纯度(D260/D280=1.8~2.0)。
反转录(RT):采用20 μL体系:2 μL模板RNA, 加入4 μL 5×PrimeScript RT Master Mix, 无RNA酶水补足20 μL, 轻轻混匀后进行反转录(RT)。RT程序:37 ℃ 15 min; 85 ℃ 5 min。
目的基因和内参引物:根据GenBank上大鼠的相关cDNA序列, 用Primer Premier 5.0软件设计目的基因和内参基因β-actin引物序列(表 1)。
| 基因Gene | GenBank登录号GenBank ID | 引物对序列Prime pairs sequences(5′→3′) |
| β-actin | NM_031144 | GATTACTGCCCTGGCTCCTA/TCATCGTACTCCTGCTTGCT |
| ACC | NM_022193.1 | TGAAGGGCTACCTCTAATG/TCACAACCCAAGAACCAC |
| FAS | NM_017332 | AGCCGCCGACCAGTAT/CACAGACACCTTCCCATCA |
| SREBP-1c | AF286470 | GGAGCCATGGATTGCACATT/AGGAAGGCTTCCAGAGAGGA |
| PGC-1α | NM_013196 | TGGAGTCCACGCATGTGAAG/CGCCAGCTTTAGCCGAATAG |
| CPT-1 | NM_009948 | CAACACTACACGCATCCC/GAAAGATTTGTCAAACCACC |
| CPT-2 | NM_012930.1 | TGACCAGTGAGAACCGAGAT/GGCAGAGGCAGAAGACAG |
| TNFα | AJ002278.1 | CCACGCTCTTCTGTCTACTG/GCTACGGGCTTGTCACTC |
| IL-6 | M26744.1 | CTTCTTGGGACTGATGT/GTCTGTTGTGGGTGGT |
| IL-1β | NM_013123.3 | ACCGACCTTGTCTACTGG/CAGATGAACGGATAGCG |
| 注:ACC:乙酰辅酶A羧化酶基因Acetyl-CoA carboxylase gene; FAS:脂肪合成酶基因Fatty acid synthase gene; SREBP-1c:固醇调节元件结合蛋白1c基因Sterol regulatory element binding protein-1c gene; PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子1α基因Peroxisome proliferator-activated receptor-gamma coactivator-1α gene; CPT-1:肉毒碱棕榈酰转移酶1基因Carnitine palmitoyltransferase-1 gene; CPT-2:肉毒碱棕榈酰转移酶2Carnitine palmitoyltransferase-2 gene; TNFα:肿瘤坏死因子α基因Tumor necrosis factor α gene; IL-6:白细胞介素6基因Interleukin-6 gene; IL-1β:白细胞介素1β基因Interleukin 1β gene.下同。The same as follows. | ||
荧光定量PCR(qPCR):采用20 μL定量反应体系:首先加入2 μL cDNA模版, 再加入10 μL SYBR Green Real-time PCR Master Mix, β-actin或目的基因上、下游引物各0.4 μL, 三蒸水补足20 μL。反应条件:95 ℃ 5 min; 95 ℃ 10 s, 60 ℃ 30 s, 40个循环。目的基因相对表达量采用2-ΔΔCT法进行统计。
1.3 数据处理与统计分析利用SPSS 17.0软件对数据进行独立样本t测验或One-way ANOVA方差分析, 统计结果均用平均数±标准误(x±SE)表示。
2 结果与分析 2.1 脱氢表雄酮对不同脂肪组织中脂肪细胞大小的影响由图 1可知:与正常日粮组相比, 高脂日粮组大鼠附睾白色脂肪、腹股沟皮下白色脂肪和肩胛下棕色脂肪组织中的脂肪细胞均极显著增大(P < 0.01)。与高脂日粮组相比, DHEA处理使附睾白色脂肪、腹股沟皮下白色脂肪和肩胛下棕色脂肪组织中脂肪细胞显著变小(P < 0.05)。结果提示, 补充DHEA能减少高脂日粮饲喂大鼠脂肪细胞中脂质的积累。
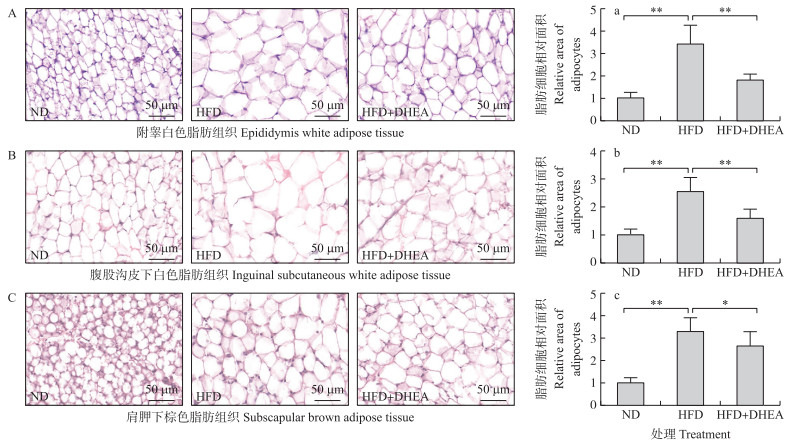
|
图 1 脱氢表雄酮对高脂日粮饲喂大鼠脂肪组织中脂肪细胞大小的影响 Fig. 1 Effect of dehydroepiandrosterone(DHEA)on the sizes of adipocytes in rats fed a high fat diet ND:正常日粮组; HFD:高脂日粮组; HFD+DHEA:高脂日粮+DHEA处理组。*P < 0.05, **P < 0.01。下同。 ND:Normal diet group; HFD:High fat diet group; HFD+DHEA:High fat diet+DHEA group. *P < 0.05, **P < 0.01. The same as follows. |
由图 2可知:与正常日粮组相比, 饲喂高脂日粮可显著上调大鼠附睾以及腹股沟皮下白色脂肪组织中ACC和FAS mRAN表达水平(P < 0.05)。与高脂日粮组相比, DHEA处理极显著降低大鼠附睾白色脂肪组织中FAS和SREBP-1c mRNA表达水平(P < 0.01), 显著降低ACC mRNA表达水平(P < 0.05)。同时, DHEA处理组大鼠腹股沟皮下白色脂肪组织中ACC和FAS mRNA表达水平显著低于高脂日粮组大鼠(P < 0.05)。提示, 补充DHEA可通过抑制高脂日粮饲喂的大鼠不同脂肪组织中的脂肪合成相关因子的表达, 减少脂肪的合成来抑制脂质的堆积。
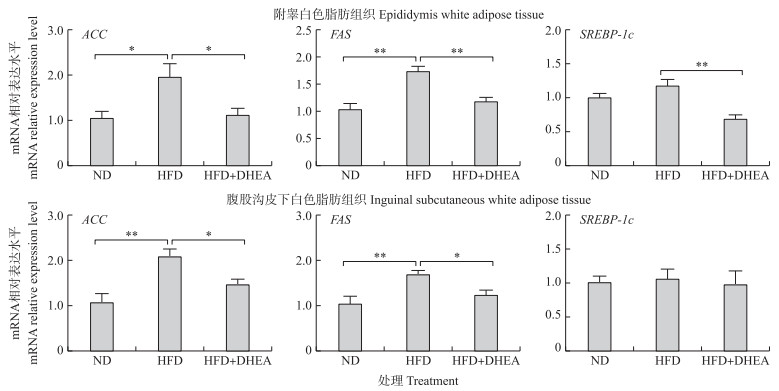
|
图 2 脱氢表雄酮对高脂日粮诱导的大鼠脂肪组织中脂肪合成相关因子mRNA表达水平的影响(n>6) Fig. 2 Effect of DHEA on lipid synthesis-related factors mRNA expression levels in rats fed a high fat diet |
由图 3可知:与正常日粮组相比, 饲喂高脂日粮可显著降低大鼠附睾白色脂肪组织以及腹股沟皮下白色脂肪组织中PGC-1α、CPT-1和CPT-2 mRNA表达水平(P < 0.05)。与高脂日粮组相比, DHEA处理显著提高大鼠附睾白色脂肪组织中PGC-1α、CPT-1和CPT-2 mRNA表达水平(P < 0.05);同时, DHEA处理极显著提高大鼠腹股沟皮下白色脂肪组织中PGC-1α和CPT-2 mRNA表达水平(P < 0.01)。提示, 补充DHEA可通过增加高脂日粮饲喂大鼠不同脂肪组织中的脂肪分解相关基因的表达水平, 加速脂肪组织中脂肪酸的分解来减少高脂日粮饲喂大鼠脂质的堆积。
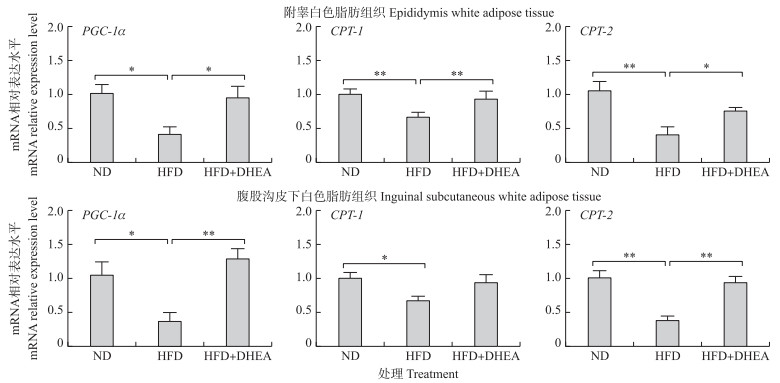
|
图 3 脱氢表雄酮对高脂日粮诱导的大鼠脂肪组织中脂肪分解相关因子mRNA表达水平的影响(n>6) Fig. 3 Effect of DHEA on the lipogenesis-related factors mRNA expression levels in rats fed a high fat diet |
由图 4可知:与正常日粮组相比, 饲喂高脂日粮可极显著上调大鼠附睾白色脂肪组织中促炎细胞因子TNFα和IL-6 mRNA表达水平以及腹股沟皮下白色脂肪组织中IL-6 mRNA表达水平(P < 0.01)。与高脂日粮组相比, DHEA处理可极显著降低大鼠附睾白色脂肪中TNFα mRNA表达水平(P < 0.01), 并显著降低IL-6和IL-1β mRNA表达水平(P < 0.05)。同时, DHEA处理可显著降低高脂饲喂大鼠腹股沟皮下白色脂肪组织中TNFα mRNA表达水平(P < 0.05)。提示:补充DHEA可通过降低高脂日粮饲喂大鼠不同脂肪组织中的促炎细胞因子相关基因的表达水平, 减少脂肪组织中促炎细胞因子的产生来缓解高脂日粮饲喂大鼠的炎症反应。
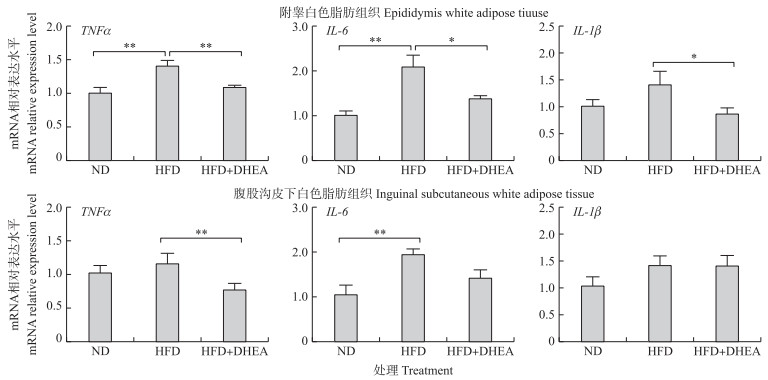
|
图 4 脱氢表雄酮对高脂日粮诱导的大鼠脂肪组织促炎细胞因子mRNA表达水平的影响(n>6) Fig. 4 Effect of DHEA on pro-inflammatory cytokines mRNA expression levels in rats fed a high fat diet |
脂肪组织功能受损是肥胖及代谢紊乱相关疾病的重要诱因之一[16-17]。脂肪组织是机体存储脂肪的主要场所, 其参与脂肪的合成以及脂肪酸的氧化分解, 对维持机体脂代谢的平衡至关重要[4]。脂肪组织主要以甘油三酯的形式储存能量。当脂肪的摄入超过脂肪细胞的储存能力时, 脂质便不能被机体有效利用, 最终导致机体内脂质水平升高[18]。更为重要的是, 脂质在脂肪组织的过量沉积会诱导脂肪细胞产生大量促炎细胞因子, 并募集白细胞到脂肪组织中。随着浸润性白细胞数量的增加, 脂肪组织产生的促炎细胞因子被进一步释放到循环系统中, 最终导致全身性慢性轻度炎症。与此同时, 炎症的发生会进一步加剧体内的代谢紊乱, 诱发心血管疾病和Ⅱ型糖尿病等常见代谢疾病[5, 19]。因此, 筛选并利用活性物质来调节脂代谢及炎症反应, 对于治疗和预防代谢紊乱相关疾病并保障动物及人类健康极其重要。
利用高脂日粮饲喂大鼠来构建肥胖大鼠模型是研究者探索肥胖及相关代谢紊乱疾病发生机制、寻求有效治疗方法的最为重要的方式。本试验采用SD大鼠为试验动物, 饲喂高脂日粮构建肥胖大鼠模型, 以探讨脱氢表雄酮(DHEA)对高脂日粮诱导的脂代谢失衡及炎症反应的调节作用。脂肪细胞大小是评估脂肪组织脂质积累的重要参数[20]。本试验结果表明, 高脂日粮饲喂大鼠不同脂肪组织中的脂肪细胞相较于正常日粮组极显著增大, 且高脂日粮饲喂大鼠不同脂肪组织中的脂肪细胞间隙与正常日粮组相比较模糊。这与先前报道的高脂日粮饲喂大鼠的脂肪组织特征一致[21-22]。综合以上结果提示, 本试验成功建立了高脂日粮诱导的肥胖大鼠模型。DHEA处理组的结果显示, 大鼠附睾白色脂肪、腹股沟皮下白色脂肪和肩胛下棕色脂肪组织中的脂肪细胞显著小于高脂日粮组, 这与DHEA能降低脂肪沉积的报道相印证[23-24]。以上结果提示, DHEA处理可显著抑制高脂日粮饲喂大鼠不同脂肪组织中脂质的堆积。
机体内脂质的积累取决于脂肪合成与分解的动态平衡。在脂肪组织中, 乙酰辅酶A通过乙酰辅酶A羧化酶(ACC)催化生成丙二酸单酰辅酶A, 最后由脂肪酸合成酶(FAS)催化合成脂肪酸[4]。固醇调节元件结合蛋白1c(SREBP-1c)是白色脂肪组织中固醇调节元件结合蛋白的主要存在形式, 其可通过介导脂肪酸合成酶的表达来影响脂肪合成[25]。本研究结果显示, DHEA处理能显著降低高脂日粮饲喂大鼠不同脂肪组织中的脂肪合成相关因子ACC、FAS和SREBP-1c mRNA表达水平, 提示DHEA可通过抑制高脂日粮饲喂大鼠的脂肪合成相关因子的表达来抑制脂质的堆积, 这与本课题组发现的DHEA可抑制棕榈酸诱导的大鼠BRL-3A细胞脂肪合成的结果相一致[26]。肉毒碱棕榈酰转移酶1(CPT-1)和肉毒碱棕榈酰转移酶2(CPT-2)通过转运长链脂肪酸进入线粒体来调控脂肪酸β氧化[27]。过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)可通过影响线粒体功能参与调节机体中的糖、脂代谢, 已有研究表明, PGC-1α基因缺失会导致胰岛素抵抗的发展[28]。本研究结果显示, DHEA处理显著增加高脂日粮饲喂大鼠不同脂肪组织中脂肪分解相关因子PGC-1α、CPT-1和CPT-2 mRNA表达水平, 提示DHEA能促进脂肪细胞中脂肪酸的氧化分解。综上所述, DHEA可通过调节脂肪代谢关键因子的表达来缓解高脂日粮诱导的大鼠脂代谢失衡。
从大量临床研究中发现, 肥胖会诱导脂肪细胞持续产生促炎细胞因子, 引发炎症进而加剧内分泌及代谢紊乱, 加快肥胖及代谢相关疾病的发展[29]。已有研究表明, DHEA可通过调节促炎细胞因子和抗炎细胞因子的动态平衡来影响机体的免疫系统, 从而发挥其抗炎效应[30]。肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素6(IL-6)是机体内由免疫细胞分泌的促炎细胞因子[31]。其中, TNF-α可以诱导白细胞浸润并激活其他促炎细胞因子或炎性介质的级联反应; IL-6介导炎症反应的负反馈调节; IL-1β在调节神经免疫-内分泌系统中起重要作用[32-33]。通常来说, 抑制TNF-α、IL-1β和IL-6的分泌被认为是控制炎性疾病的有效策略[34]。饲喂高脂日粮会诱导大鼠脂肪组织中炎症的发生[35]。从本试验结果发现, DHEA处理显著降低高脂日粮饲喂大鼠脂肪组织中的促炎细胞因子TNFα、IL-6和IL-1β mRNA表达水平, 这与本课题组前期发现的DHEA处理能缓解由大肠杆菌诱导的小鼠腹腔巨噬细胞炎症效应的研究结果相近[36]。值得注意的是, 在本试验中, DHEA处理对腹股沟皮下脂肪组织的IL-1β mRNA表达水平影响不显著, 表明DHEA对不同部位脂肪组织的抑炎效应可能存在差异。综上所述, DHEA可通过抑制脂肪组织中促炎细胞因子的表达, 减少促炎细胞因子的产生来缓解高脂日粮诱导的炎症反应。
综合以上结果, 补充DHEA可通过抑制脂肪合成相关因子ACC、FAS和SREBP-1c基因的表达, 并促进脂肪分解相关因子PGC-1α、CPT-1和CPT-2基因的表达来减少高脂日粮饲喂大鼠脂肪组织中脂质的堆积; 同时, DHEA处理可通过抑制促炎细胞因子TNFα、IL-6和IL-1β基因的表达来减轻高脂日粮诱导的炎症反应; 最终起到缓解由高脂和炎症诱导的机体代谢紊乱效应。该结果为DHEA作为一种膳食补充剂用于防控脂代谢紊乱及其相关疾病的产生提供了重要的试验依据。
| [1] |
Popov V B, Lim J K. Impact of insulin-sensitizing agents on risk for liver cancer and liver-related death in diabetic patients with compensated hepatitis C cirrhosis[J]. The Journal of Clinical Endocrinology & Metabolism, 2011, 96(8): 2398-2400. |
| [2] |
Bastard J P, Maachi M, Lagathu C, et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance[J]. European Cytokine Network, 2006, 17(1): 4-12. |
| [3] |
Vitseva O I, Tanriverdi K, Tchkonia T T, et al. Inducible toll-like receptor and NF-κB regulatory pathway expression in human adipose tissue[J]. Obesity, 2008, 16(5): 932-937. DOI:10.1038/oby.2008.25 |
| [4] |
Mersmann H J, Smith S B. Development of white adipose tissue lipid metabolism[J]. Biology of Growing Animals, 2005, 3: 275-302. DOI:10.1016/S1877-1823(09)70018-9 |
| [5] |
Grant R W, Dixit V D. Adipose tissue as an immunological organ[J]. Obesity, 2015, 23(3): 512-518. |
| [6] |
Weisberg S P, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue[J]. Journal of Clinical Investigation, 2003, 112(12): 1796-1808. DOI:10.1172/JCI200319246 |
| [7] |
Aoki K, Terauchi Y. Effect of dehydroepiandrosterone(DHEA)on diabetes mellitus and obesity[M]//Litwack G. Dehydroepiandrosterone. Amsterdam: Elsevier, 2018: 355-365.
|
| [8] |
Li L L, Ge C Y, Wang D, et al. Dehydroepiandrosterone reduces accumulation of lipid droplets in primary chicken hepatocytes by biotransformation mediated via the cAMP/PKA-ERK1/2 signaling pathway[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2018, 1863(6): 625-638. DOI:10.1016/j.bbalip.2018.03.007 |
| [9] |
Sato K, Iemitsu M. The role of dehydroepiandrosterone(DHEA)in skeletal muscle[M]//Litwack G. Dehydroepiandrosterone. Amsterdam: Elsevier, 2018: 205-221.
|
| [10] |
Jimenez P T, Frolova A I, Chi M M, et al. DHEA-mediated inhibition of the pentose phosphate pathway alters oocyte lipid metabolism in mice[J]. Endocrinology, 2013, 154(12): 4835-4844. DOI:10.1210/en.2012-2140 |
| [11] |
Alves V B F, Basso P J, Nardini V, et al. Dehydroepiandrosterone(DHEA)restrains intestinal inflammation by rendering leukocytes hyporesponsive and balancing colitogenic inflammatory responses[J]. Immunobiology, 2016, 221(9): 934-943. DOI:10.1016/j.imbio.2016.05.013 |
| [12] |
Meijerink J, Poland M, Balvers M G J, et al. Inhibition of COX-2-mediated eicosanoid production plays a major role in the anti-inflammatory effects of the endocannabinoid N-docosahexaenoylethanolamine(DHEA)in macrophages[J]. British Journal of Pharmacology, 2015, 172(1): 24-37. |
| [13] |
Zhao S M, Ma H T, Zou S X, et al. Effects of in ovo administration of DHEA on lipid metabolism and hepatic lipogenetic genes expression in broiler chickens during embryonic development[J]. Lipids, 2007, 42(8): 749-757. DOI:10.1007/s11745-007-3068-y |
| [14] |
Cecconello A L, Trapp M, Hoefel A L, et al. Sex-related differences in the effects of high-fat diets on DHEA-treated rats[J]. Endocrine, 2015, 48(3): 985-994. DOI:10.1007/s12020-014-0396-6 |
| [15] |
殷复建, 刘琳, 丁逍, 等. DHEA调节自然衰老大鼠脂代谢中的研究[J]. 畜牧与兽医, 2012, 44(增刊1): 212-213. Yin F J, Liu L, Ding X, et al. Effects of DHEA on lipid metabolism in natural aging rats[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(Suppl 1): 212-213 (in Chinese). |
| [16] |
Mulder P, Morrison M C, Wielinga P Y, et al. Surgical removal of inflamed epididymal white adipose tissue attenuates the development of non-alcoholic steatohepatitis in obesity[J]. International Journal of Obesity, 2016, 40(4): 675-684. |
| [17] |
Wellen K E, Hotamisligil G S. Obesity-induced inflammatory changes in adipose tissue[J]. Journal of Clinical Investigation, 2003, 112(12): 1785-1788. DOI:10.1172/JCI20514 |
| [18] |
Bełtowski J. Role of leptin in blood pressure regulation and arterial hypertension[J]. Journal of Hypertension, 2006, 24(5): 789-801. DOI:10.1097/01.hjh.0000222743.06584.66 |
| [19] |
Calder P C, Ahluwalia N, Brouns F, et al. Dietary factors and low-grade inflammation in relation to overweight and obesity[J]. British Journal of Nutrition, 2011, 106(S3): S5-S78. DOI:10.1017/S0007114511005460 |
| [20] |
Miyoshi H, Perfield J W Ⅱ, Obin M S, et al. Adipose triglyceride lipase regulates basal lipolysis and lipid droplet size in adipocytes[J]. Journal of Cellular Biochemistry, 2008, 105(6): 1430-1436. DOI:10.1002/jcb.21964 |
| [21] |
Oh M J, Kim H J, Park E Y, et al. The effect of Korean Red Ginseng extract on rosiglitazone-induced improvement of glucose regulation in diet-induced obese mice[J]. Journal of Ginseng Research, 2017, 41(1): 52-59. DOI:10.1016/j.jgr.2015.12.011 |
| [22] |
罗时猛, 李应配, 陆晓桐, 等. 双酚A对高脂饲料小鼠脂肪组织炎症及Th17细胞的影响[J]. 卫生研究, 2017, 46(1): 7-12. Luo S M, Li Y P, Lu X T, et al. Effects of bisphenol A on inflammation and Th17 cells in adipose tissue of high-fat fed mice[J]. Journal of Hygiene Research, 2017, 46(1): 7-12 (in Chinese with English abstract). |
| [23] |
Mahmoud Y I, Mahmoud A A, Abo-Zeid F S, et al. Effect of dehydroepiandrosterone on the liver of perimenopausal rat:multiple doses study[J]. Ultrastructural Pathology, 2018, 42(4): 333-343. DOI:10.1080/01913123.2018.1485806 |
| [24] |
Horii N, Sato K, Mesaki N, et al. DHEA administration activates transcription of muscular lipid metabolic enzymes via PPARα and PPARδ in obese rats[J]. Hormone and Metabolic Research, 2016, 48(3): 207-212. |
| [25] |
Kolehmainen M, Vidal H, Alhava E, et al. Sterol regulatory element binding protein 1c(SREBP-1c)expression in human obesity[J]. Obesity Research, 2001, 9(11): 706-712. DOI:10.1038/oby.2001.95 |
| [26] |
姚瑶, 李龙龙, 姜志浩, 等. 棕榈酸对BRL-3A细胞胰岛素抵抗和脂代谢的影响[J]. 南京农业大学学报, 2019, 42(1): 130-136. Yao Y, Li L L, Jiang Z H, et al. Effect of palmitic acid on insulin resistance and lipid metabolism in BRL-3A cells[J]. Journal of Nanjing Agricultural University, 2019, 42(1): 130-136 (in Chinese with English abstract). DOI:10.7685/jnau.201807042 |
| [27] |
Wilcken B. Disorders carnitine cycle and detection by newborn screening[J]. Annals of the Academy of Medicine Singapore, 2008, 37(Suppl): 71-73. |
| [28] |
Kleiner S, Mepani R J, Laznik D, et al. Development of insulin resistance in mice lacking PGC-1 in adipose tissues[J]. Proc Natl Acad Sci USA, 2012, 109(24): 9635-9640. DOI:10.1073/pnas.1207287109 |
| [29] |
Shoelson S E, Herrero L, Naaz A. Obesity, inflammation, and insulin resistance[J]. Gastroenterology, 2007, 132(6): 2169-2180. DOI:10.1053/j.gastro.2007.03.059 |
| [30] |
Kasperska-Zajac A. Asthma and dehydroepiandrosterone(DHEA):facts and hypotheses[J]. Inflammation, 2010, 33(5): 320-324. DOI:10.1007/s10753-010-9188-1 |
| [31] |
Shin J S, Park Y M, Choi J H, et al. Sulfuretin isolated from heartwood of Rhus verniciflua inhibits LPS-induced inducible nitric oxide synthase, cyclooxygenase-2, and pro-inflammatory cytokines expression via the down-regulation of NF-κB in RAW 264.7 murine macrophage cells[J]. International Immunopharmacology, 2010, 10(8): 943-950. DOI:10.1016/j.intimp.2010.05.007 |
| [32] |
Wu H C, Zhao G, Jiang K F, et al. IFN-[FGS]τ[FGN] alleviates lipopolysaccharide-induced inflammation by suppressing NF-κB and MAPKs pathway activation in mice[J]. Inflammation, 2016, 39(3): 1141-1150. |
| [33] |
Horai R, Asano M, Sudo K, et al. Production of mice deficient in genes for interleukin(IL)-1α, IL-1β, IL-1α/β, and IL-1 receptor antagonist shows that IL-1β is crucial in turpentine-induced fever development and glucocorticoid secretion[J]. Journal of Experimental Medicine, 1998, 187(9): 1463-1475. DOI:10.1084/jem.187.9.1463 |
| [34] |
Chang W T, Huang W C, Liou C J. Evaluation of the anti-inflammatory effects of phloretin and phlorizin in lipopolysaccharide-stimulated mouse macrophages[J]. Food Chemistry, 2012, 134(2): 972-979. DOI:10.1016/j.foodchem.2012.03.002 |
| [35] |
Todoric J, Löffler M, Huber J, et al. Adipose tissue inflammation induced by high-fat diet in obese diabetic mice is prevented by n-3 polyunsaturated fatty acids[J]. Diabetologia, 2006, 49(9): 2109-2119. DOI:10.1007/s00125-006-0300-x |
| [36] |
Zhao J L, Cao J, Yu L, et al. Dehydroepiandrosterone alleviates E.coli O157:H7-induced inflammation by preventing the activation of p38 MAPK and NF-κB pathways in mice peritoneal macrophages[J]. Molecular Immunology, 2019, 114: 114-122. DOI:10.1016/j.molimm.2019.07.013 |




