文章信息
- 余震, 周顺桂
- YU Zhen, ZHOU Shungui
- 超高温好氧发酵技术:堆肥快速腐熟与污染控制机制
- Hyperthermophilic composting of organic solid wastes:accelerated humification and pollution control mechanisms
- 南京农业大学学报, 2020, 43(5): 781-789
- Journal of Nanjing Agricultural University, 2020, 43(5): 781-789.
- http://dx.doi.org/10.7685/jnau.201911030
-
文章历史
- 收稿日期: 2019-11-22
2. 福建农林大学资源与环境学院/福建省土壤环境健康与调控重点实验室, 福建 福州 350002
2. College of Resources and Environment/Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, Fujian Agriculture and Forestry University, Fuzhou 350002, China
有机固体废物既是环境中的主要污染源, 也是巨大的生物质资源库。高温堆肥(又称好氧发酵)是实现有机废物无害化处理与资源化利用的重要生物技术手段, 其实质是利用自然界广泛存在的或经过人工改造的微生物(包括细菌、真菌、放线菌等), 在一定控制条件下使可被生物降解的有机质向稳定的腐殖质转化并生产出可供土地利用的有机肥或调理剂的过程[1-2]。当前, 涉及高温堆肥技术的研究很多, 堆肥工艺和配套装备发展较为完善, 能被应用于城市污泥、畜禽粪便、生活垃圾、餐厨垃圾、农林废物及食品和制药等工业废渣的工程处理[2-6]。然而, 普通高温堆肥工艺固有缺点, 如占地面积大、发酵周期长、堆肥过程二次污染严重、低品位堆肥产品出路受限等始终难以克服, 这也极大限制该工艺进一步的广泛应用[7-9]。
近几年, 超高温堆肥(又称超高温好氧发酵)作为一种新颖的好氧发酵技术, 被成功应用于城市污泥等有机废物处理与资源化利用工程实践中[8]。该工艺基于富含极端嗜热微生物的超高温好氧发酵菌剂, 使堆肥温度在不依赖于外加热源前提下快速提高至80 ℃以上(最高温度可达到100 ℃), 这也是传统高温堆肥所不能达到的温度[8-10]。相比于普通高温堆肥, 超高温堆肥在促进有机物降解、加速堆肥腐熟进程、高效杀灭病虫卵等有害物质以及在堆肥过程二次污染控制等方面具有明显优势[9]。为此, 本文主要基于超高温堆肥相关研究成果, 对该技术发展历程和核心技术特征进行梳理, 重点对超高温堆肥快速腐殖化机制以及温室气体减排、抗生素抗性基因消减、微塑料降解、重金属钝化等堆肥共性污染控制机制进行综述, 以期为该工艺大规模应用于有机废物处理与资源化利用工程实践提供理论支撑。
1 超高温堆肥发展历程及其核心技术特征超高温堆肥是在传统高温堆肥工程实践的基础上发展而来的好氧发酵技术, 其基础理论的研究工作才刚刚起步。2008年, Oshima等[11]率先发现在奶牛场养殖废弃物堆肥过程中堆体最高温度可超过90 ℃; 同年, Kanazawa等[12]提出利用超高温好氧堆肥菌(hyperthermophilic aerobic composting bacteria)发展太空循环农业的构想。2016年, Tashiro等[10]发现超高温堆肥条件(80~90 ℃)会导致城市污泥堆肥产物中形成独特的细菌群落结构, 但是该研究并没有提及超高温堆肥的技术原理和工艺特征, 也未对超高温堆肥过程中独特嗜热微生物群落结构的形成原因及其关键功能进行深入分析。
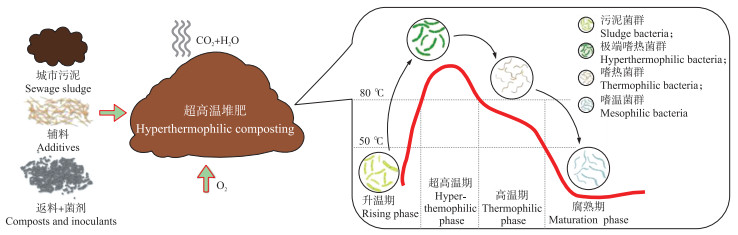
2017年, 我们正式提出“超高温堆肥(或称超高温好氧发酵)”的概念[8], 即在不依赖外部加热条件下, 通过接种含有极端嗜热微生物的堆肥菌剂使堆体温度上升至80 ℃以上并持续5~7 d的好氧发酵过程; 并对超高温堆肥的技术原理、工艺特点及典型工程案例进行详细介绍, 率先在国内开启超高温堆肥理论与应用研究新方向[8]。通过与工程规模的普通高温堆肥过程进行对比研究, 明确超高温堆肥在加速有机物降解、促进堆肥快速腐熟、缩短发酵周期、有效杀灭病虫卵和杂草籽等方面具有明显的技术和经济优势。在此基础上, 提出将超高温堆肥过程中堆体温度≥80 ℃的阶段定义为超高温期(hyperthermophilic phase), 以区别于传统堆肥过程的高温期(thermophilic phase, 50~70 ℃)[9]。图 1呈现的是以城市污泥为主要原料的典型超高温堆肥工艺, 反映整个超高温堆肥过程的温度变化和微生物群落演替规律。
传统堆肥理论认为:为了维持堆肥过程微生物活性, 堆体最高温度不应超过70 ℃, 否则就应当通过翻堆或鼓风曝气实现降温[13-14]。然而, 大量研究表明通过辅助加热或者接种微生物菌剂提高堆肥温度可以克服传统好氧发酵的固有缺点。例如, Xiao等[7]提出了一种利用外源加热方式维持堆肥全过程高温(50 ℃)的工艺, 可显著加速有机物降解和促进堆肥腐熟; Zeng等[15]在农业固体废物堆肥不同阶段接种白腐真菌, 均能有效促进堆体升温, 从而加速堆肥腐殖化进程。超高温堆肥工程实践证明, 极端嗜热菌(65~80 ℃)在堆肥温度超过80 ℃时仍具有较高活性, 并通过群落演替“接棒”堆肥体系中的普通嗜热菌从而完成堆肥化进程[9, 16]。正是由于极端嗜热菌的有效参与, 超高温堆肥工艺才能以高于普通堆肥20~30 ℃稳定运行, 并展现出明显技术优势。由此可见, 堆体温度能够达到80 ℃以上是超高温堆肥的核心技术特征, 也正是由于存在如此显著的温度变化, 其腐殖化和二次污染控制过程才呈现出不同于传统高温堆肥的复杂性。
2 超高温堆肥促进有机废物快速腐殖化机制 2.1 超高温堆肥的独特微生物群落组成堆肥过程中微生物分解有机物释放热量促进堆体温度上升, 温度变化则又促使微生物群落组成发生剧烈演替[4]。在传统堆肥高温阶段, 占优势地位的微生物大多属于厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)等, 而在属水平上, 以Bacillus、Actinomyces等中等嗜热细菌(45~55 ℃)为主[17-18]。与之相比, 超高温堆肥过程中微生物群落组成演替更为剧烈, 特别在超高温阶段, 微生物群落组成趋于单一, α-多样性显著降低[9-10]。Tashiro等[10]采用16S rRNA高通量测序技术调查城市污泥超高温堆肥样品中细菌群落组成, 发现Firmicutes(74%)和Actinobacteria(25%)为绝对优势菌群, 实际上普通高温堆肥中的嗜热微生物菌群也大多归属于这两个门。薛兆骏等[19]针对超高温堆肥嗜热菌剂的微生物群落组成进行测序分析, 也发现Firmicutes和Actinobacteria丰度极高, 分别为70%和28%;而两者在超高温堆肥产物中的丰度分别为44%和56%。在属水平上, 超高温堆肥中占优势地位的细菌主要有Saccharomonospora(28%)、Oceanobacillus(13%)、Thermobifida(13%)、Actinomadura(12%)、Bacillus(11%)和Geobacillus(6%)等。然而, 这些优势细菌大部分并不属于极端嗜热菌, 这可能也是上述研究中超高温阶段持续时间较短的原因。
基于高通量测序技术, 本课题组详细研究了城市污泥超高温堆肥不同发酵阶段微生物群落组成演替规律, 发现在超高温阶段占优势的细菌除了Firmicutes(38%~47%)外, Thermi(36%~53%)细菌丰度最高, 其中的栖热菌属(Thermus)为属水平上的绝对优势种群[9]。目前, 已报道的Thermus细菌最适生长温度超过70 ℃, 并且能够大量产生具有极高热稳定性的水解酶和过氧化氢酶, 催化堆肥中多种有机物降解[20-21]。进一步对超高温堆肥过程中丰度占优势的微生物群落与堆肥理化性质进行典型相关分析(CCA), 发现超高温阶段的温度与Thermus等细菌丰度呈显著正相关, 这就证实Thermus等极端嗜热菌是导致堆体产生超高温和促使堆肥快速腐熟的关键功能微生物[9]。此外, 本课题组还利用富集培养技术从各种极端嗜热环境中分离出大量(极端)嗜热菌, 包括Calditerricola、Anoxybacillus、Planifilum、Geobacillus、Compostibacillus和Bacillus等, 并通过菌株复配、产酶能力测试、发酵条件优化等系列程序开发出多种超高温堆肥复合微生物菌剂[8]。尽管如此, 对于超高温堆肥复杂体系下多种(极端)嗜热菌如何高效促进堆体升温和加速堆肥腐殖化的协同机制仍不清楚, 因此, 需要利用各种不依赖于培养的基因组学、酶学等先进生物学技术开展深入研究。
2.2 超高温好氧发酵促进堆肥快速腐殖化机制腐殖化是指堆肥原料中各种有机物被降解转化为稳定的腐殖质的过程, 大体可分为2个阶段:1)堆肥体系中易降解有机质被微生物分解产生各种腐殖质前体, 如氨基酸、还原糖、多酚、多糖以及其他小分子有机酸等; 2)不同腐殖质前体通过聚合、氧化等一系列生化反应形成腐殖质, 其中木质素-蛋白、多酚途径以及Maillard反应等腐殖质合成途径被研究者广泛接受[22-25]。Wu等[22-23]研究指出腐殖质前体的产生通常发生在堆肥过程的升温和高温阶段, 而腐殖质形成主要发生在降温和腐熟阶段, 而堆体中优势嗜热微生物对腐殖质前体的产生起决定性作用。正是因为腐殖质前体的多样性、腐殖质合成途径的不确定性以及堆肥高温条件下微生物群落的剧烈演替, 堆肥腐殖化机制一直存在争议, 但研究者普遍认可水溶性有机物(DOM)的分子结构和转化规律可以真实反映堆肥腐殖化过程[26-27]。例如, He等[3]采用荧光光谱结合平行因子分析方法(EEM-PARAFAC)表征生活垃圾高温堆肥过程中DOM结构变化规律, 发现腐殖化程度增强与堆肥过程中蛋白类物质逐渐减少、富里酸和腐殖酸类物质明显增多有关。
由于超高温堆肥条件下嗜热微生物酶活性显著增强, 各种有机物被快速降解, DOM转化速率和堆肥腐殖化进程加快。刘晓明等[26]采用荧光光谱(EEM)等方法观察到城市污泥超高温堆肥过程中DOM组分发生显著变化, 蛋白类物质在超高温阶段(0~5 d)几乎完全被降解, 而富里酸和腐殖酸类物质开始逐渐产生, 到23 d时堆肥达到腐熟。Yu等[28]利用傅里叶变换红外光谱结合二维相关光谱分析(FTIR-2DCOS)对比研究超高温堆肥和普通高温堆肥过程中DOM的转化规律, 发现超高温堆肥快速腐殖化过程与腐殖化前体多糖、羧酸以及酚类物质的快速聚合有关。因此, 进一步采用傅里叶变换离子回旋共振质谱(FT-ICR MS)在分子水平上对超高温堆肥快速腐殖化机制进行分析, 结果显示:堆肥原料中低O/C(< 0.3)和高H/C(>1.5)组分在超高温条件下被(极端)嗜热微生物优先降解, 从而产生大量的微生物代谢产物(如木素酚、氨基糖、羧酸等), 这些代谢产物大多作为腐殖质前体被进一步转化为难降解的腐殖质物质[29-30]。由此可见, (极端)嗜热菌驱动有机质快速降解和转化, 导致腐殖质前体大量产生和累积, 这是实现超高温堆肥快速腐殖化的重要前提(图 2)。因此, 在后续研究中进一步明确微生物群落组成与DOM分子结构间的内在关系将有助于深入解析超高温堆肥快速腐殖化机制。
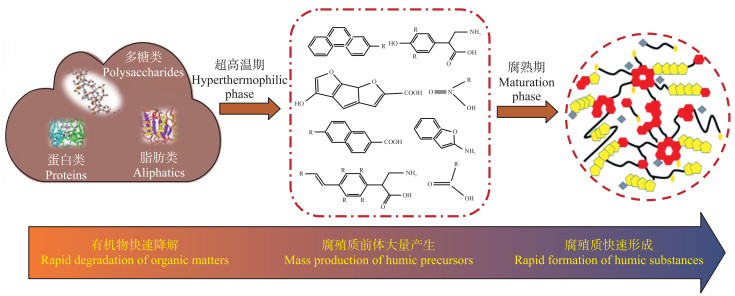
|
图 2 有机废物超高温堆肥快速腐殖化机制 Fig. 2 The accelerated humification mechanism of hyperthermophilic composting of organic wastes |
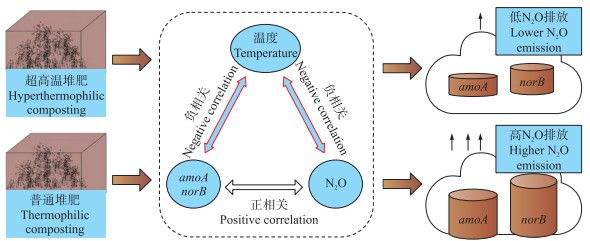
有机废物堆肥过程是全球温室气体排放的重要来源[31]。由于N2O单分子增温潜势为CO2的298倍, 堆肥体系中因N2O排放导致的温室效应已明显超过CO2排放[32]。N2O产生和排放与堆肥氮循环过程密切相关:一方面微生物降解含氮有机物产生铵态氮, 在氨氧化细菌或古菌作用下部分转化为N2O; 另一方面, N2O是反硝化过程中微生物氧化亚氮还原酶催化反应的终产物[33-35]; 因此, 硝化和反硝化过程共同决定N2O产生量。堆肥温度是影响微生物氮循环过程(包括硝化、反硝化和氨化作用)的关键因子, 也显著影响N2O的产生和排放。例如, Xu等[36]报道40 ℃以上的温度就能对氨氧化细菌和反硝化细菌活性产生强烈抑制作用。本课题组以鸡粪和谷壳等为原料开展超高温堆肥试验, 结果表明超高温堆肥相较于普通堆肥可减少N2O排放量达90%以上, 其关键减排机制是由于超高温条件显著抑制氨单加氧酶(amoA)和氧化亚氮还原酶(norB)基因表达, 而amoA和norB分别代表硝化和反硝化过程的关键功能基因(图 3)[33]。基于偏最小二乘路径模型(PL-SPM)分析, 发现2种堆肥工艺中N2O排放机制存在显著差异。温度是超高温堆肥过程中决定N2O排放量的关键因素, 而理化参数和微生物量则共同影响普通堆肥过程中N2O的排放量[33]。
超高温堆肥极端嗜热条件除了对硝化和反硝化作用产生强烈抑制外, 也能明显减少堆肥过程中的氮素损失。例如, Huang等[37]采用基于外源加热的超高温预处理技术对猪粪和秸秆等堆肥原料进行处理(90 ℃水热处理4 h), 堆体温度相比于对照(未经水热处理)显著提高, 微生物群落组成发生改变, 并且脲酶、蛋白酶的活性以及氨化作用速率明显降低, 从而使堆肥过程中氮素损失明显减少。Cui等[38]进一步研究发现超高温堆肥可以促进含氮有机物缩合形成腐殖酸, 减少堆肥过程的氮素损失。总之, 超高温堆肥不仅通过抑制硝化和反硝化反应速率减排N2O, 也能促使更多含氮有机组分转化为腐殖质组分, 提高堆肥产品氮含量。相比于普通高温堆肥, 超高温堆肥工艺在减排N2O、减少氮素损失、提高堆肥品质等方面更具优势。
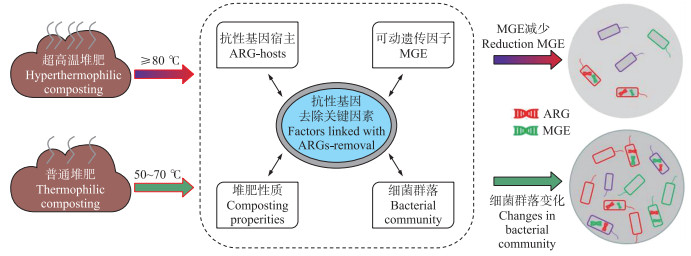
3.2 抗生素抗性基因消减机制抗生素滥用引起的抗生素残留和抗性基因(ARG)污染问题已成为限制堆肥产品土地利用的重要因素[16]。有机废物高温堆肥被证明是去除堆肥产品抗生素残留的有效手段[39-42]。Yu等[39]发现鸡粪中残留的四环素能在堆肥高温条件下有效降解, 提高温度至70 ℃则可以在短时间内彻底去除四环素。然而, 普通高温堆肥对ARG去除效果并不显著。Liu等[40]调查指出药品发酵残渣中13种ARG和8种可动遗传因子(MEG)的丰度在经过高温堆肥后并没有明显降低; Liao等[41]研究食品残渣堆肥过程中ARG和MEG变化规律, 发现两者丰度随堆肥微生物群落组成的变化均明显升高。ARG在堆肥过程中难以被去除的原因通常为:1)由于MEG可以使ARG在不同细菌和潜在宿主之间发生水平基因转移, ARG的丰度和多样性随细菌群落演替发生改变[42]; 2)普通高温堆肥的温度不足以有效杀灭ARG宿主细胞, 如Bacillus, 即便潜在宿主被杀死也可能难以使含ARG的DNA结构完全降解[43]。
各种改进的堆肥工艺常被应用于抗生素抗性基因的去除。Awasthi等[44]通过在畜禽粪便堆肥体系中添加高剂量(10%)石灰实现多种ARG的有效去除, 其去除机制是高剂量石灰可以显著降低ARG潜在宿主细菌相对丰度。我们还发现利用超高温堆肥工艺可以显著减少城市污泥中ARG和MEG丰度, 其去除率相比于普通高温堆肥分别提高89%和49%[16]。由于ARG潜在宿主细菌多属于Firmicutes、Proteobacteria、Actinobacteria和Bacteroidetes, 超高温堆肥的极端嗜热条件能够显著减少这些ARG宿主的丰度和多样性。进一步的PL-SPM分析结果表明, 超高温堆肥过程中MEG减少也是导致ARG高效消减的关键因子[16]。Liao等[45]研究也证实超高温堆肥条件持续6 d, 即可去除生物制药废渣中的泰乐菌素抗生素、ARG和MEG, 去除率分别为95%、76%和99%, 其中, ARG消减的关键机制是其主要载体抗性质粒的丰度被超高温条件所抑制。与先前大多研究结果类似, 高温堆肥过程可以使ARG宿主细菌群落结构发生改变, 但由于MEG的水平基因转移效应, ARG丰度并不能显著降低(图 4)。超高温堆肥则以80 ℃以上极端嗜热条件“重塑”堆肥优势细菌(如Thermus、Planifilum等), 显著降低包括细菌(Bacillus、Bacteroides、Clostridium、Enterococcus)以及古菌(Methanobrevibacter)在内的各种ARG潜在宿主以及抗性质粒的丰度, 同时通过减少MEG从而抑制ARG的水平基因转移效应, 最终实现ARG的高效消减。
微塑料(MP)是全球生态系统中广泛存在的一类新型污染物, 一般是指颗粒尺寸小于5 mm的塑料碎片和颗粒[46-47]。最新研究表明, 一个普通塑料茶包在95 ℃开水冲泡过程中可以释放高达116亿个微塑料颗粒。由于这些颗粒具有尺寸小、内含毒性添加物以及能够吸附污染物等特性, 其造成的生态风险和对人类健康的威胁已经引起社会广泛关注[48]。城市污泥等有机固体废物是环境中微塑料重要的“汇”, 其中每千克干污泥能被检测到的微塑料颗粒达7.4×104[49]。微生物降解是实现土壤、底泥、堆肥等环境中微塑料去除的主要途径, 尤其在高温条件下, 其生物降解速率得到显著提高[50]。Chen等[49]通过对比分析城市污泥高温堆肥和超高温堆肥两种工艺条件下微塑料的降解情况发现, 45 d高温堆肥导致微塑料的降解率小于5%, 而经过相同周期的超高温堆肥后, 微塑料的降解率达44%。
对超高温堆肥促进微塑料颗粒降解机制分析发现, 微塑料分子结构中的—C—C—能够在极端嗜热条件下被快速生物氧化为—C O—和—C—O—等, 从而改善微塑料的可生物降解性和颗粒表面疏水性能, 并能促进形成微塑料颗粒表面降解功能菌生物膜[49]。Yang等[51-52]报道也证实昆虫肠道中微生物可以通过生物氧化作用实现对聚乙烯(PE)和聚苯乙烯(PS)塑料的高效降解。在超高温堆肥体系中, Thermus(54%)、Bacillus(25%)和Geobacillus(20%)等构成了独特的微生物群落结构, 并产生具有较高生物氧化活性的降解酶, 从而使微塑料颗粒在生物氧化后作为微生物碳源被持续矿化。Yu等[28]研究证实超高温堆肥能够加速多种高分子有机物矿化和腐殖化, 而对于微塑料这类难降解高分子有机物, 其能否在超高温极端嗜热条件下通过微生物代谢转化为更为稳定的腐殖质, 则有待更为深入研究。
3.4 重金属钝化机制随着堆肥有机质大量矿化, 相对浓缩效应导致堆肥中重金属含量普遍升高, 从而限制堆肥产品的后续土地利用[53]。实际上, 重金属污染风险取决于重金属总量和有效态组分的分配系数, 而高温堆肥腐殖化过程被证实可以减少有效态重金属分配系数, 显著降低重金属迁移性和生物可利用性, 从而实现重金属钝化[54]。目前, 促进堆肥过程中重金属钝化机制较多, 如腐殖酸络合、生物炭等各种外源添加物吸附、微生物吸附和氧化、提高pH值促进重金属稳定等[55-58]。Zhou等[56]在猪粪堆肥中按一定比例添加生物炭和腐殖酸, 使Cu、Pb和Cd的钝化效率分别达到95%、66%和69%;Chen等[53]在农业废物和河道底泥共堆肥体系中添加Phanerochaete chrysosporium, 60 d内实现对Pb、Cd和Cu 3种重金属的有效钝化, 其关键原因是由于接种微生物强化了堆肥有机物对重金属生物可利用性的影响。
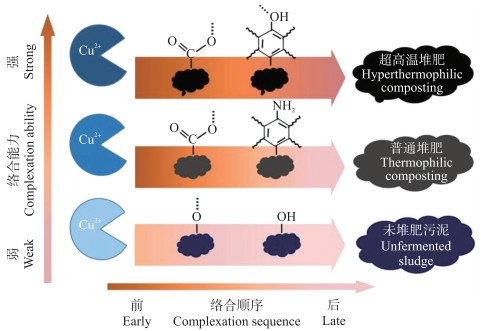
目前, 高温堆肥过程重金属二次污染控制及相关机制的研究较多, 而超高温堆肥过程中关于重金属形态转化的研究尚未见报道。本课题组基于污泥超高温堆肥产品, 采用荧光滴定法研究腐殖酸(HA)对重金属Cu的吸附络合性能及钝化机制, 结果表明由于超高温堆肥产品中HA的碳含量高, 且在腐殖化过程中产生大量富含羧基和酚羟基等结构组分, 能够与Cu(Ⅱ)发生强烈络合作用[59]。进一步采用FTIR-2DCOS对超高温堆肥HA与重金属发生络合反应时官能团的响应顺序进行分析, 发现HA中的羧基是实现对重金属Cu(Ⅱ)高效钝化的主要官能团[26, 59]。Huang等[60]研究农业废物堆肥产品中的DOM组分与Cd(Ⅱ)和Cu(Ⅱ)的络合效应, 也获得类似结果。由此可见, 羧基等官能团的大量产生是导致超高温堆肥产品HA具有更高效重金属钝化能力的原因(图 5), 也是超高温堆肥产品较普通堆肥产品和未经堆肥腐熟的污泥更适合于重金属污染土壤修复的原因。因此, 我们也推测超高温堆肥快速腐殖化过程将导致羧基等不饱和基团含量显著增加, 从而实现Cu和Cd等重金属在堆肥过程中的原位钝化, 这一假设将在我们后续研究中得以验证。
超高温堆肥作为一种新发展的有机废物资源化利用技术, 由于其具有独特嗜热菌群, 在加速堆肥腐殖化和提高堆肥产品质量上, 都呈现出优于传统高温堆肥的技术特征。现阶段已明确的超高温堆肥技术优势包括:1)促进腐殖质前体大量产生, 加快堆肥腐殖化进程; 2)抑制硝化和反硝化反应速率, 减少N2O排放和堆肥氮素损失; 3)显著影响堆肥细菌群落组成和多样性, 消减抗生素残留及ARG和MEG等污染; 4)增强生物氧化酶活性, 加速微塑料等高分子有机污染物的降解; 5)促进富含羧基等不饱和基团的富里酸和腐殖酸组分产生, 提高堆肥产品的土地利用附加值。这些优势也充分表明提高堆肥温度才是克服传统高温堆肥工艺固有缺点最为有效的手段。
尽管如此, 针对超高温堆肥理论的研究才刚刚起步, 尤其在80 ℃以上的极端嗜热条件下, 微生物如何高效驱动有机物矿化、腐殖化以及介导污染物迁移转化将面临诸多挑战:1)由于培养条件和研究方法限制, 超高温堆肥体系中极端嗜热微生物优势菌群和关键功能的研究有待突破; 2)分析(极端)嗜热微生物群落演替规律与DOM分子结构变化间的关系, 是揭示超高温堆肥快速腐殖化“黑箱模型”的重要前提; 3)堆肥不同组分有机碳对温度变化的响应存在显著差异, 研究超高温堆肥过程中各种有机碳的周转规律将有助于深入解析甲烷和CO2产生及腐殖质形成关键机制; 4)温度作为影响超高温堆肥氮素循环最为显著的环境因子, 基于堆肥温度调控发展高效的N2O和NH3减排技术以及氮素损失控制技术应用前景广阔。
| [1] |
Bernal M P, Alburquerque J A, Moral R. Composting of animal manures and chemical criteria for compost maturity assessment:a review[J]. Bioresource Technology, 2009, 100(22): 5444-5453. |
| [2] |
Zeng G M, Yu Z, Chen Y N, et al. Response of compost maturity and microbial community composition to pentachlorophenol(PCP)-contaminated soil during composting[J]. Bioresource Technology, 2011, 102(10): 5905-5911. |
| [3] |
He X S, Xi B D, Wei Z M, et al. Spectroscopic characterization of water extractable organic matter during composting of municipal solid waste[J]. Chemosphere, 2011, 82(4): 541-548. |
| [4] |
Karadag D, Özkaya B, Ölmez E, et al. Profiling of bacterial community in a full-scale aerobic composting plant[J]. International Biodeterioration and Biodegradation, 2013, 77(2): 85-90. |
| [5] |
Hu H, Chao J, Wu Y P, et al. Bacterial and fungal communities and contribution of physicochemical factors during cattle farm waste composting[J]. Microbiology Open, 2017, 6(6): e00518. |
| [6] |
Yang F, Li Y, Han Y H, et al. Performance of mature compost to control gaseous emissions in kitchen waste composting[J]. Science of the Total Environment, 2019, 657: 262-269. |
| [7] |
Xiao Y, Zeng G M, Yang Z H, et al. Continuous thermophilic composting(CTC)for rapid biodegradation and maturation of organic municipal solid waste[J]. Bioresource Technology, 2009, 100(20): 4807-4813. |
| [8] |
廖汉鹏, 陈志, 余震, 等. 有机固体废物超高温好氧发酵技术及其工程应用[J]. 福建农林大学学报, 2017, 46(4): 439-444. Liao H P, Chen Z, Yu Z, et al. Hyperthermophilic compost of organic solid waste and engineering application[J]. Journal of Fujian Agriculture and Forestry University, 2017, 46(4): 439-444 (in Chinese with English abstract). |
| [9] |
Yu Z, Tang J, Liao H P, et al. The distinctive microbial community improves composting efficiency in a full-scale hyperthermophilic composting plant[J]. Bioresource Technology, 2018, 265: 146-154. |
| [10] |
Tashiro Y, Tabata H, Itahara A, et al. Unique hyper-thermal composting process in Kagoshima City forms distinct bacterial community structures[J]. Journal of Bioscience and Bioengineering, 2016, 122(5): 606-612. |
| [11] |
Oshima T, Moriya T. A preliminary analysis of microbial and biochemical properties of high-temperature compost[J]. Annals of the New York Academy of Sciences, 2008, 1125(1): 338-344. |
| [12] |
Kanazawa S, Ishikawa Y, Tomita-Yokotani K, et al. Space agriculture for habitation on Mars with hyper-thermophilic aerobic composting bacteria[J]. Advances in Space Research, 2008, 41(5): 696-700. |
| [13] |
Liang C, Das K C, McClendon R W. The influence of temperature and moisture contents regimes on the aerobic microbial activity of a biosolids composting blend[J]. Bioresource Technology, 2003, 86(2): 131-137. |
| [14] |
Antizar-Ladislao B, Beck A J, Spanova K, et al. The influence of different temperature programmes on the bioremediation of polycyclic aromatic hydrocarbons(PAHs)in a coal-tar contaminated soil by in-vessel composting[J]. Journal of Hazardous Materials, 2007, 144: 340-347. |
| [15] |
Zeng G M, Huang H L, Huang D L, et al. Effect of inoculating white-rot fungus during different phases on the compost maturity of agricultural wastes[J]. Process Biochemistry, 2009, 44(4): 396-400. |
| [16] |
Liao H P, Lu X M, Rensing C, et al. Hyperthermophilic composting accelerates the removal of antibiotic resistance genes and mobile genetic elements in sewage sludge[J]. Environmental Science and Technology, 2018, 52(1): 266-276. |
| [17] |
Yamada T, Suzuki A, Ueda H, et al. Successions of bacterial community in composting cow dung wastes with or without hyperthermophilic pre-treatment[J]. Applied Microbiology and Biotechnology, 2008, 81(4): 771-781. |
| [18] |
Wei H W, Wang L H, Hassan M, et al. Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J]. Bioresource Technology, 2018, 256: 333-341. |
| [19] |
薛兆骏, 周国亚, 俞肖峰, 等. 超高温自发热好氧堆肥工艺处理剩余污泥[J]. 中国环境科学, 2017, 37(9): 3399-3406. Xue Z J, Zhou G Y, Yu X F, et al. Ultra high temperature aerobic composting processin treating municipal sludge[J]. China Environmental Science, 2017, 37(9): 3399-3406 (in Chinese with English abstract). |
| [20] |
Niehaus F, Bertoldo C, Kähler M, et al. Extremophiles as a source of novel enzymes for industrial application[J]. Applied Microbiology and Biotechnology, 1999, 51(6): 711-729. |
| [21] |
Pantazaki A, Pritsa O, Kyriakidis A. Biotechnologically relevant enzymes from Thermus thermophilus[J]. Applied Microbiology and Biotechnology, 2002, 58(1): 1-12. |
| [22] |
Wu J Q, Zhao Y, Zhao W, et al. Effect of precursors combined with bacteria communities on the formation of humic substances during different materials composting[J]. Bioresource Technology, 2017, 226: 191-199. |
| [23] |
Wu J Q, Zhao Y, Qi H S, et al. Identifying the key factors that affect the formation of humic substance during different materials composting[J]. Bioresource Technology, 2017, 244: 1193-1196. |
| [24] |
Zhang Z C, Zhao Y, Wang R X, et al. Effect of the addition of exogenous precursors on humic substance formation during composting[J]. Waste Management, 2018, 79: 462-471. |
| [25] |
Gao X T, Tan W B, Zhao Y, et al. Diversity in the mechanisms of humin formation during composting with different materials[J]. Environmental Science and Technology, 2019, 53(7): 3653-3662. |
| [26] |
刘晓明, 余震, 周普雄, 等. 污泥超高温堆肥过程中DOM结构的光谱分析[J]. 环境科学, 2018, 39(8): 3807-3815. Liu X M, Yu Z, Zhou P X, et al. Spectral analysis of DOM structure in slugde hyperthermophilic composting[J]. Environmental Science, 2018, 39(8): 3807-3815 (in Chinese with English abstract). |
| [27] |
Cao Y, Wang J D, Huang H Y, et al. Spectroscopic evidence for hyperthermophilic pretreatment intensifying humification during pig manure and rice straw composting[J]. Bioresource Technology, 2019, 294: 122131. |
| [28] |
Yu Z, Liu X M, Zhao M H, et al. Hyperthermophilic composting accelerates the humification process of sewage sludge:molecular characterization of dissolved organic matter using EEM-PARAFAC and two-dimensional correlation spectroscopy[J]. Bioresource Technology, 2019, 274: 198-206. |
| [29] |
Yu Z, Liu X M, Chen C Y, et al. Molecular insights into the transformation of dissolved organic matter during hyperthermophilic composting using ESI FT-ICR MS[J]. Bioresource Technology, 2019, 292: 122007. |
| [30] |
Yu Z, Liu X M, Chen C Y, et al. Analytical dataset on the molecular compositional changes of dissolved organic matter during hyperthermophilic composting[J]. Data in Brief, 2019, 27: 104588. |
| [31] |
Lou X F, Nair J. The impact of landfilling and composting on greenhouse gas emissions:a review[J]. Bioresource Technology, 2009, 100(16): 3792-3798. |
| [32] |
Luo Y M, Li G X, Luo W H, et al. Effect of phosphogypsum and dicyandiamide as additives on NH3, N2O and CH4 emissions during composting[J]. Journal of Environmental Sciences, 2013, 25(7): 1338-1345. |
| [33] |
Cui P, Chen Z, Zhao Q, et al. Hyperthermophilic composting significantly decreases N2O emissions by regulating N2O-related functional genes[J]. Bioresource Technology, 2019, 272: 433-441. |
| [34] |
Fan H Y, Liao J, Abass O K, et al. Effects of compost characteristics on nutrient retention and simultaneous pollutant immobilization and degradation during co-composting process[J]. Bioresource Technology, 2019, 275: 61-69. |
| [35] |
Ren L H, Cai C Q, Zhang J C, et al. Key environmental factors to variation of ammonia-oxidizing archaea community and potential ammonia oxidation rate during agricultural waste composting[J]. Bioresource Technology, 2018, 270: 278-285. |
| [36] |
Xu X Y, Liu X R, Li Y, et al. High temperatures inhibited the growth of soil bacteria and archaea but not that of fungi and altered nitrous oxide production mechanisms from different nitrogen sources in an acidic soil[J]. Soil Biology and Biochemistry, 2017, 107: 168-179. |
| [37] |
Huang Y, Li D Y, Wang L, et al. Decreased enzyme activities, ammonification rate and ammonifiers contribute to higher nitrogen retention in hyperthermophilic pretreatment composting[J]. Bioresource Technology, 2019, 272: 521-528. |
| [38] |
Cui P, Liao H P, Bai Y D, et al. Hyperthermophilic composting reduces nitrogen loss via inhibiting ammonifiers and enhancing nitrogenous humic substance formation[J]. Science of the Total Environment, 2019, 692: 98-106. |
| [39] |
Yu Y S, Chen L J, Yu F, et al. High temperatures can effectively degrade residual tetracyclines in chicken manure through composting[J]. Journal of Hazardous Materials, 2019, 380: 120862. |
| [40] |
Liu Y W, Feng Y, Cheng D M, et al. Dynamics of bacterial composition and the fate of antibiotic resistance genes and mobile genetic elements during the co-composting with gentamicin fermentation residue and lovastatin fermentation residue[J]. Bioresource Technology, 2018, 261: 249-256. |
| [41] |
Liao H P, Friman V P, Geisen S, et al. Horizontal gene transfer and shifts in linked bacterial community composition are associated with maintenance of antibiotic resistance genes during food waste composting[J]. Science of the Total Environment, 2019, 660: 841-850. |
| [42] |
Youngquist C P, Mitchell S M, Cogger C G. Fate of antibiotics and antibiotic resistance during digestion and composting:a review[J]. Journal of Environment Quality, 2016, 45(2): 537-545. |
| [43] |
Diehl D L, LaPara T M. Effect of temperature on the fate of genes encoding tetracycline resistance and the integrase of class 1 integrons within anaerobic and aerobic digesters treating municipal wastewater solids[J]. Environmental Science and Technology, 2010, 44(23): 9128-9133. |
| [44] |
Awasthi M K, Chen H Y, Awasthi S K, et al. Application of metagenomic analysis for detection of the reduction in the antibiotic resistance genes(ARGs)by the addition of clay during poultry manure composting[J]. Chemosphere, 2019, 220: 137-145. |
| [45] |
Liao H P, Zhao Q, Cui P, et al. Efficient reduction of antibiotic residues and associated resistance genes in tylosin antibiotic fermentation waste using hyperthermophilic composting[J]. Environment International, 2019, 133: 105203. |
| [46] |
Judy J D, Williams M, Gregg A, et al. Microplastics in municipal mixed-waste organic outputs induce minimal short to long-term toxicity in key terrestrial biota[J]. Environmental Pollution, 2019, 252: 522-531. |
| [47] |
Li X, Chen L, Mei Q, et al. Microplastics in sewage sludge from the wastewater treatment plants in China[J]. Water Research, 2018, 142: 75-85. |
| [48] |
Hernandez L M, Xu E G, Larsson H C E, et al. Plastic teabags release billions of microparticles and nanoparticles into tea[J]. Environmental Science and Technology, 2019, 53(21): 12300-12310. |
| [49] |
Chen Z, Zhao W Q, Xing R Z, et al. Enhanced in situ biodegradation of microplastics in sewage sludge using hyperthermophilic composting technology[J]. Journal of Hazardous Materials, 2020, 384: 121271. |
| [50] |
Leejarkpai T, Suwanmanee U, Rudeekit Y, et al. Biodegradable kinetics of plastics under controlled composting conditions[J]. Waste Management, 2011, 31(6): 1153-1161. |
| [51] |
Yang J, Yang Y, Wu W M, et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J]. Environmental Science and Technology, 2014, 48(23): 13776-13784. |
| [52] |
Yang Y, Yang J, Wu W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms:part 2. Role of gut microorganisms[J]. Environmental Science and Technology, 2015, 49(20): 12087-12093. |
| [53] |
Chen Y R, Chen Y N, Li Y P, et al. Changes of heavy metal fractions during co-composting of agricultural waste and river sediment with inoculation of Phanerochaete chrysosporium[J]. Journal of Hazardous Materials, 2019, 378: 120757. |
| [54] |
Shan G C, Xu J Q, Jiang Z W, et al. The transformation of different dissolved organic matter subfractions and distribution of heavy metals during food waste and sugarcane leaves co-composting[J]. Waste Management, 2019, 87: 636-644. |
| [55] |
Chen Y N, Liu Y, Li Y P, et al. Influence of biochar on heavy metals and microbial community during composting of river sediment with agricultural wastes[J]. Bioresource Technology, 2017, 243: 347-355. |
| [56] |
Zhou H B, Meng H B, Zhao L X, et al. Effect of biochar and humic acid on the copper, lead, and cadmium passivation during composting[J]. Bioresource Technology, 2018, 258: 279-286. |
| [57] |
Li R, Meng H B, Zhao L X, et al. Study of the morphological changes of copper and zinc during pig manure composting with addition of biochar and a microbial agent[J]. Bioresource Technology, 2019, 291: 121752. |
| [58] |
Chen X M, Zhao Y, Zeng C C, et al. Assessment contributions of physicochemical properties and bacterial community to mitigate the bioavailability of heavy metals during composting based on structural equation models[J]. Bioresource Technology, 2019, 289: 121657. |
| [59] |
Tang J, Zhuang L, Yu Z, et al. Insight into complexation of Cu(Ⅱ)to hyperthermophilic compost-derived humic acids by EEM-PARAFAC combined with heterospectral two dimensional correlation analyses[J]. Science of the Total Environment, 2019, 656: 29-38. |
| [60] |
Huang M, Li Z W, Huang B, et al. Investigating binding characteristics of cadmium and copper to DOM derived from compost and rice straw using EEM-PARAFAC combined with two-dimensional FTIR correlation analyses[J]. Journal of Hazardous Materials, 2018, 344: 539-548. |