文章信息
- 陈亚然, 操然, 张瑶瑶, Voglmeir JOSEF, 刘丽
- CHEN Yaran, CAO Ran, ZHANG Yaoyao, Voglmeir JOSEF, LIU Li
- β4GalT1基因点突变为GalNAcT对小鼠生理功能的影响
- Effect of point mutation of β4GalT1 gene to GalNAcT on physiological function of mice
- 南京农业大学学报, 2020, 43(4): 762-769
- Journal of Nanjing Agricultural University, 2020, 43(4): 762-769.
- http://dx.doi.org/10.7685/jnau.201909027
-
文章历史
- 收稿日期: 2019-09-17
糖基化反应是生物体内非常重要的转化反应之一, 是碳水化合物(即糖基供体)与另一分子(糖基受体如蛋白质等)的羟基或其他官能团相连形成糖缀合物的反应。这些糖缀合物中的碳水化合物部分在机体内参与了广泛的生命活动过程, 如细胞与细胞相互作用[1-3]、细胞黏附[4-6]、宿主和病原体相互作用[7-9]、先天和后天免疫[4, 10]、中性粒细胞募集到组织损伤部位等[4], 具有重要的生物学作用。生物体内的糖基化过程主要由糖基转移酶催化完成。
β-1, 4-半乳糖基转移酶(β4GalT)是近年来研究最多的糖基转移酶类之一, 它是一种由β4GalT1基因编码的酶[11], 负责细胞糖缀合物(糖蛋白、糖脂和蛋白聚糖)碳水化合物部分中半乳糖基化结构的合成[12]。研究发现, β4GalT对细胞生长和分化, 特别是皮肤和小肠细胞, 以及早期的动物死亡率均有显著影响[13-15]。通过氨基酸多序列对比和系统发育学预测分析将β4GalT家族分为4个亚族, 分别为β4GalTⅠ和β4GalTⅡ、β4GalTⅢ和β4GalTⅣ、β4GalTⅤ和β4GalTⅥ, 以及β4GalTⅦ[1]。β4GalT家族的各成员定位于染色体的不同位置, 目前对于β4GalT1的功能研究最多。
β4GalT1是机体中分布最广泛的糖基化转移酶之一。β4GalT1是一种反式高尔基体常驻酶, 在锰离子存在下, 它可以将UDP-半乳糖中的半乳糖转移到存在于受体聚糖分子非还原末端存在的N-乙酰氨基葡萄糖分子中, 合成具有以β-1, 4-糖苷键连接的二糖部分LacNAc(UDP-半乳糖+N-乙酰氨基葡萄糖→UDP+N-乙酰氨基乳糖), 这在糖蛋白的碳水化合物组分的合成中非常重要[16]。研究表明, β4GalT1参与精卵结合[17]和胚胎着床过程[18-19], 促进细胞轴突生长[20]和神经节神经轴突的产生和延伸[21], 在促进损伤神经的修复中也可能发挥着重要作用[22], 并与免疫及炎症反应密切相关[23]。
在动物乳腺中, 当有α-乳清蛋白存在时, β4GalT1可以和α-乳清蛋白一起形成乳糖合酶, 其催化反应的受体底物特异性发生了变化, 从原来的乙酰氨基葡萄糖变成葡萄糖, 因此用于催化乳中乳糖的合成。α-乳清蛋白是一种无催化活性蛋白, 只存在于乳腺中, 可与储存在乳腺中的β4GalT1结合生成乳糖合酶, 催化乳糖的生成, 其催化反应如下:UDP-半乳糖+葡萄糖→UDP+乳糖, 整个过程涉及到酶活性位点区域的构象变化[24]。
有关β4GalT1功能的研究很多, 但大都是通过将β4GalT1基因在小鼠体内敲除而进行的。Asano等[13]研究β4GalT1基因敲除对小鼠生理功能的影响, 发现敲除β4GalT1基因小鼠可以正常出生和繁殖, 但是生长迟缓, 以及表现出断奶前的半数致死性等, 由此可知, 完全敲除β4GalT1基因对生物体的正常功能有严重影响。然而, 将β4GalT1替换成底物为其他已知单糖的转移酶会对机体产生何种影响尚未见报道, 即β4GalT1在体内的可替代性如何尚属未知。因此本研究考虑将β4GalT1突变成GalNAcT, 合成乙酰氨基半乳糖基化糖单元结构, 这样既没有简单敲除β4GalT1, 同时也不会在小鼠体内引入不存在的糖单元结构, 以此考察β4GalT1基因点突变对小鼠生理功能的影响; 并与β4GalT1基因敲除对小鼠生理功能的影响对比探究其异同, 研究β4GalT1在小鼠体内的功能; 同时研究β4GalT1基因点突变对小鼠肝中N-链寡糖结构的影响, 旨在探索β4GalT1基因点突变对小鼠肝脏参与解毒、吞噬、代谢、排泄以及免疫等多种复杂的生物学过程的影响。
1 材料与方法 1.1 材料和试剂β4GalT1基因点突变小鼠由上海南方模式生物科技股份有限公司提供; 动物组织/细胞基因组DNA提取试剂盒和琼脂购自北京索莱宝生物科技有限公司; rTaq酶购自TaKaRa公司; 琼脂糖凝胶DNA回收试剂盒购自Lembio公司。其他常规试剂为国产分析纯试剂。
1.2 β4GalT1基因点突变小鼠的设计利用CRISPR/Cas9技术, 获得β4GalT1基因第286位氨基酸酪氨酸Tyr变为亮氨酸Leu, 即碱基TAT置换为CTG点突变的纯合子小鼠。该过程由上海南方模式生物科技股份有限公司完成。
1.3 动物饲养动物试验方案经过南京农业大学动物实验中心伦理委员会批准。15只小鼠, 其中6只纯合子(HO), 9只杂合子(HE), 由上海南方模式生物科技股份有限公司提供。之后饲养在光照/黑暗时间为12 h/12 h、温度(21.0±1)℃、湿度(60±10)%均恒定的SPF级实验动物中心。自由交配、采食和饮水, 试验期内, 观察并记录其日常状态及行为、交配情况、子代数量, 测定体质量及器官质量等。
1.4 β4GalT1基因点突变小鼠基因型鉴定 1.4.1 样品采集及鼠尾基因组DNA的提取小鼠的基因型鉴定在小鼠出生7~14 d时进行。由β4GalT1基因点突变的杂合子雌鼠与杂合子雄鼠交配后, 得到子代小鼠。剪取大约1 cm的待检测子代小鼠的尾巴放于事先灭菌的匀浆器中, 充分研磨, 然后按照动物组织/细胞基因组DNA提取试剂盒(Solarbio)说明书提取小鼠尾巴基因组DNA。
1.4.2 β4GalT1基因点突变小鼠基因型的鉴定将提取的小鼠尾巴基因组DNA进行PCR扩增反应。引物为mouse-genomic-F(AGGCAGGCAGATCTCAAGTCAGC)和mouse-genomic-R(AAAGCCCACATAGGAA-GCCAAAGT), 碱基数分别为23和24, 由南京金斯瑞生物科技有限公司合成。反应体系(25 μL):rTaq 12.5 μL, mouse-genomic-F 0.5 μL, mouse-genomic-R 0.5 μL, Genomic DNA 1.5 μL, ddH2O 10 μL。扩增程序:94 ℃ 10 min; 94 ℃ 40 s, 63 ℃ 40 s, 72 ℃ 1 min, 共34个循坏; 72 ℃ 10 min。用10 g·L-1琼脂糖凝胶电泳检测扩增产物的大小, 并用Lembio琼脂糖凝胶DNA回收试剂盒回收和纯化目的基因, 然后将目的基因送南京金斯瑞生物科技有限公司测序。
1.5 β4GalT1基因点突变小鼠的繁殖、行为学分析及器官质量测定 1.5.1 β4GalT1基因点突变小鼠的繁殖分别选取β4GalT1基因点突变的纯合子雌、雄小鼠, 杂合子雌、雄小鼠, 野生型雌、雄小鼠, 杂合子雌小鼠与纯合子雄小鼠为亲本进行交配, 自由采食和饮水。记录小鼠的繁育情况, 基因型鉴定同1.4节。
1.5.2 β4GalT1基因点突变小鼠的形态和行为观察β4GalT1基因点突变的纯合子和野生型小鼠的日常行为并记录。
悬尾试验:用双面胶将小鼠尾部1 cm处悬于架子上, 使其头部正对镜头, 用摄像系统记录小鼠6 min内后4 min的行为变化, 包括首次出现不动状态的时间和不动状态持续的时间(不动状态是指小鼠放弃主动挣扎, 处于完全不动的时间)。
1.5.3 β4GalT1基因点突变小鼠的器官质量取纯合子小鼠和野生型小鼠各3只, 用乙醚麻醉, 摘眼球取血, 待小鼠死后, 解剖小鼠取其各个器官, 称质量并记录。
1.5.4 统计分析试验数据采用SAS 9.2软件统计, 采用单因素方差分析(One-way ANOVA)和Duncan’s多重比较进行差异显著性分析, 结果以平均数±标准差表示。
1.6 β4GalT1基因点突变对小鼠肝脏中糖基化的影响 1.6.1 小鼠肝脏样品的处理经基因型鉴定后的纯合子小鼠和和野生型小鼠, 饲养2~3个月后, 用乙醚麻醉, 摘眼球取血; 解剖取其肝脏, 装于灭菌的1.5 mL EP管中, -80 ℃保存备用。
1.6.2 小鼠肝脏中N-链寡糖的制备1) 肝脏的前处理:将纯合子小鼠和野生型小鼠的肝脏从-80 ℃冰箱中取出, 室温融化后, 置于研钵中, 加液氮冷冻并研磨, 待磨碎后称量50 mg备用。
2) N-链寡糖的酶解释放:将称量好的样品经氯仿-甲醇(体积比为2:1)去脂处理后, 加入50 μL 2.45 mol·L-1的三氯乙酸沉淀蛋白, 再用去离子水洗至中性。将处理好的样品用提前纯化好的N-糖苷酶F进行消化处理。反应步骤如下:加50 μL的6 mol·L-1尿素溶解样品, 待溶解后再依次加入28 μL超纯水、23 μL 500 mmol·L-1磷酸缓冲液(pH7.5)、12.5 μL变性剂(70 mmol·L-1十二烷基硫酸钠水溶液、3% β-巯基乙醇), 将其充分混匀后置于金属浴中, 95 ℃加热10 min使蛋白变性, 然后将样品置于冰上, 待其冷却至室温后, 加入19 μL 10%的Triton-100溶液混匀, 与100 μL N-糖苷酶F在37 ℃条件下孵育过夜。
3) N-链寡糖的纯化:用SupelcleanTM ENVI-CarbTM预装柱对反应后的样品进行纯化。首先进行碳柱的活化, 依次用3 mL 80%乙腈(含0.1%三氟乙酸)、3 mL蒸馏水、3 mL 80%乙腈(含0.1%三氟乙酸)、3 mL蒸馏水冲洗碳柱; 将反应后的溶液在12 100 g 4 ℃离心10 min, 用移液器取上清液转移至碳柱中, 待其完全流出后, 再用3.0 mL蒸馏水冲洗柱子, 最后分别收集20%乙腈和40%乙腈(均含0.1%三氟乙酸)洗脱部分(各1.5 mL), 将收集好的样品置于真空离心浓缩干燥机中旋干。
1.6.3 小鼠肝脏N-链寡糖的高效液相色谱(UPLC)检测将旋干后的样品经2-氨基苯甲酰胺(2-AB)溶液标记。2-AB溶液配制:35 mmol·L-1 2-AB, 0.1 mol·L-1氰基硼氢化钠, 溶剂为二甲基亚砜和冰醋酸(体积比为7:3)。取10 μL 2-AB溶液于旋干后的样品中混匀, 65 ℃金属浴中反应4 h。向标记处理后的小鼠肝脏N-链寡糖加入20 μL纯净水, 用涡旋振荡仪混匀, 12 100 g离心2 min, 取上清液15 μL与35 μL的乙腈混匀, 12 100 g离心3 min后取上清液40 μL于进样瓶中, 进样量为30 μL。检测所用色谱柱为BEH Glycan column(1.7 μm, 2.1 mm× 150 mm, Waters); 流动相A为50 mmol·L-1甲酸铵溶液(pH4.5), 流动相B为色谱纯级乙腈; 激发波长为330 nm, 检测波长为420 nm; 柱温设为60 ℃。
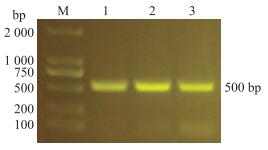
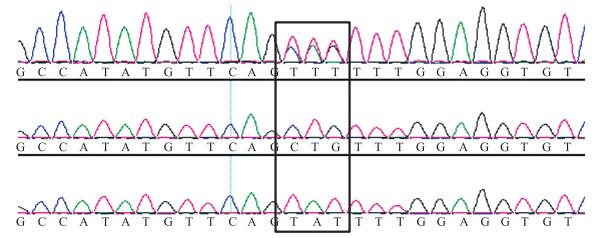
2 结果与分析 2.1 小鼠基因型的鉴定 2.1.1 PCR鉴定小鼠基因型由图 1可知:鼠尾DNA经扩增后序列大小约为500 bp, 与目的基因片段大小一致。由图 2可知:基因序列中突变点处为单峰且基因序列为CTG, 其对应的小鼠为纯合的β4GalT1基因点突变小鼠; 突变点处为单峰且基因序列为TAT, 对应的小鼠为野生型小鼠; 突变点处为双峰, 对应的小鼠为杂合子小鼠。由图 3可知:成年的纯合子、杂合子和野生型小鼠外观上没有明显差别。
|
图 1 鼠尾DNA经扩增后序列大小验证 Fig. 1 Sequence size verification of mice tail DNA after amplification M. DNA标准品; 1-3.分别为纯合子、杂合子和野生型鼠尾DNA经扩增后序列结果。 M. DNA marker; 1-3. The result of homozygous, heterozygous and wild type mice tail DNA after amplification. |
|
图 2 子代小鼠的DNA序列的突变点 Fig. 2 Mutation point of DNA sequence in filial generation mice |

|
图 3 3种基因型小鼠外观比较 Fig. 3 Comparison of appearance of three genotypes in mice HO:纯合子小鼠Homozygous mice; HE:杂合子小鼠Heterozygous mice; WT:野生型小鼠Wild type mice.下同。The same as follows. |
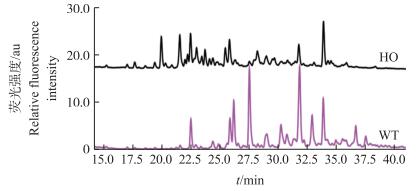
β4GalT1基因点突变纯合子和野生型小鼠肝脏中的N-链寡糖的UPLC峰谱图结果如图 4所示。通过比较2种不同基因型小鼠肝脏中的N-链寡糖, 发现纯合子小鼠N-链寡糖的洗脱时间在15~40 min时的峰型图较野生型小鼠有较大差异, 如保留时间为23和26 min时, 两者峰型差异较大, 原因是纯合子小鼠体内不含β4GalT1, 不能将半乳糖转移到N-乙酰氨基葡萄糖上, 而野生型小鼠体内含有β4GalT1, 可以将半乳糖转移到N-乙酰氨基葡萄糖上。含有半乳糖的N-链寡糖可以进一步进行唾液酸化修饰, 生成含半乳糖和唾液酸的结构, 所以纯合子小鼠肝脏中N-链寡糖峰型图中的峰较野生型小鼠的峰整体前移, 说明β4GalT1基因点突变对小鼠肝脏中N-链寡糖的结构产生显著影响, 也进一步证明纯合子小鼠成功突变。
|
图 4 不同基因型小鼠肝脏中N-链寡糖UPLC峰谱图的比较 Fig. 4 Comparison of UPLC peaks of N-glycans in liver of different genotypes mice |
对β4GalT1基因点突变的纯合子小鼠和野生型小鼠在断奶前的存活率进行记录, 结果表明:纯合子小鼠出生总数为20只, 存活数为18只, 存活率为90%;而野生型小鼠出生总数为95只, 全部存活, 存活率为100%。由表 1可见:纯合子小鼠平均体质量增加速度低于野生型小鼠, 纯合子小鼠组和野生型小鼠组体质量在相同周龄时无显著差异(P > 0.05), 在不同周龄时也无显著差异(P > 0.05)。
| 基因型Genotype | 出生后时间/周Time after birth/week | ||||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| HO | 10.9±0.52a | 16.54±1.7a | 18.25±1.96a | 19.56±2.05a | 19.18±3.34a | 21.71±2.25a | 22.63±1.87a |
| WT | 11.46±3.84a | 17.05±3.42a | 19.26±3.05a | 20.65±2.93a | 21.78±2.09a | 22.61±2.8a | 24.04±2.73a |
| 注:相同字母表示差异不显著(P > 0.05)。下同。 Note:The same letters mean no significant difference at 0.05 level. The same as follows. |
|||||||
如表 2所示:纯合子小鼠主要器官质量与野生型小鼠相比均无显著差异(P > 0.05)。因此, β4GalT1基因点突变对小鼠各主要器官的质量无显著影响, 即对小鼠的生长发育没有显著影响。
| 基因型 Genotype |
心脏 Heart |
肝脏 Liver |
脾 Spleen |
肺 Lung |
肾脏 Kidney |
胃 Stomach |
小肠 Small intestine |
盲肠 Cecum |
结肠 Colon |
| HO | 0.160±0.022a | 1.224±0.114a | 0.158±0.034a | 0.255±0.016a | 0.381±0.062a | 0.269±0.045a | 1.157±0.127a | 0.396±0.028a | 0.331±0.181a |
| WT | 0.180±0.035a | 1.362±0.295a | 0.180±0.066a | 0.255±0.024a | 0.369±0.200a | 0.330±0.061a | 1.337±0.048a | 0.473±0.071a | 0.269±0.081a |
日常观察纯合子和野生型小鼠的行为, 发现纯合子小鼠行动迟缓, 对外界刺激不敏感; 而野生型小鼠更活泼, 表现为更易在笼盒顶部的铁架上攀爬。当抓握小鼠时, 野生型小鼠挣扎得更厉害。纯合子小鼠悬尾平均静止时间为(104±19)s, 占总悬挂时间的35.4%~51.3%, 野生型小鼠平均静止时间为(50±7)s, 占总悬挂时间的17.9%~23.8%。纯合子小鼠的平均静止时间显著长于野生型小鼠(P < 0.01)。表明纯合子小鼠处在抑郁状态的时间更长, 即β4GalT1基因点突变对小鼠神经发育过程有显著影响。
2.2.3 β4GalT1基因点突变对雌小鼠繁殖能力的影响选择β4GalT1基因点突变小鼠的杂合子雌小鼠与杂合子雄小鼠作为亲本交配, 子代数目及基因型分布情况如表 3所示。通过鼠尾基因组提取, PCR扩增和基因测序可知, 在所得子代小鼠中, 纯合子小鼠(β4GalT1-/-)15只, 占比为13.8%;杂合子小鼠(β4GalT1+/-)62只, 占比为56.9%;野生型小鼠(β4GalT1+/+)32只, 占比为29.3%。纯合子、杂合子、野生型小鼠的比例约为1:4:2, 子代纯合子小鼠所占比例明显少于孟德尔遗传定律所应占比例, 杂合子和野生型小鼠所占比例约为2:1, 符合孟德尔遗传定律。因此, 在杂合子自交繁殖中, 子代纯合子小鼠的出生率明显低于正常值。
| 基因型Genotype | 子代数目Number of progeny | 理论占比/%Theoretical proportion | 实际占比/%Actual proportion |
| HO | 15 | 25.0 | 13.8 |
| HE | 62 | 50.0 | 56.9 |
| WT | 32 | 25.0 | 29.3 |
不同基因型小鼠进行亲本自交时繁殖情况如表 4所示。受测纯合子雌小鼠20只, 受孕4只, 受孕率为20%, 分娩雌小鼠2只, 分娩率为10%, 且分娩的2只纯合子雌小鼠和子代小鼠均死亡, 子代小鼠存活率为0%。野生型小鼠作为亲本自交, 得到15胎, 共128只小鼠, 平均每胎9只。杂合子(HE)自交繁殖得到19胎, 共109只, 平均每胎6只。受测杂合子和野生型雌小鼠分别为15只和19只, 受孕率、分娩率和子代小鼠存活率都为100%。上述结果表明, 纯合子雌小鼠很难受孕, 即使受孕也很难生出小鼠或者生出不完整的小鼠即死胎, 此时纯合子小鼠往往难产而死。而杂合子和野生型小鼠均能正常受孕和分娩。表明β4GalT1基因点突变影响了雌小鼠的繁殖能力。
| 自交亲本 Self-crossing parent |
受测雌小鼠数 Measured number of female mice |
受孕数 Number of pregnant mice |
受孕率/% Rate of pregnant mice |
分娩雌小鼠数 Number of delivery maternal mice |
分娩率/% Maternal mice rate of delivery |
子代小鼠存活数 Survival number of offspring mice |
子代小鼠存活率/% Survival rate of offspring mice |
| HO | 20 | 4 | 20 | 2 | 10 | 0 | 0 |
| HE | 19 | 19 | 100 | 19 | 100 | 109 | 100 |
| WT | 15 | 15 | 100 | 15 | 100 | 128 | 100 |
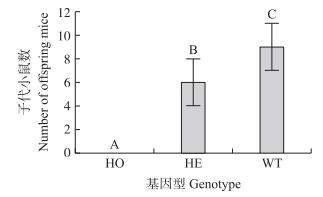
如图 5所示:纯合子、杂合子和野生型小鼠自交后得到的平均每胎子代数量分别为0、(6±2)和(9±2)只。野生型自交所得到的平均每胎子代小鼠数量极显著多于杂合子自交及纯合子自交所得到的子代小鼠数量(P < 0.01)。说明β4GalT1基因点突变对雌小鼠的生殖有影响。
|
图 5 不同基因型小鼠自交子代小鼠数比较 Fig. 5 Comparison of progeny number of self-crossing combinations of different genotype mice 不同大写字母表示差异极显著(P < 0.01)。 Different capital letters indicate significant difference at 0.01 level. |
糖基化修饰是生物体中一类重要的转化反应, 可以把糖基从糖基供体转移到糖基受体, 从而形成各种聚糖、糖蛋白和糖脂等过程的反应[25-26], 与机体的生长发育等各项活动都密切相关。β4GalT是一种重要的糖基转移酶, 广泛分布在人体内各个组织中, β4GalT1是糖基转移酶家族β4GalT中的一员。Asano等[13]研究β4GalT1基因敲除对小鼠生理功能的影响发现, 敲除小鼠可以正常出生和被繁殖, 但是生长迟缓, 以及表现为断奶前的半数致死性等。本试验通过研究β4GalT1基因点突变(β-1, 4-半乳糖基转移酶1转变为β-1, 4-N-乙酰氨基半乳糖转移酶)小鼠模型(由基因编辑技术CRISPR/Cas9构建), 探究β4GalT1点突变后小鼠在生长发育、行为能力及繁殖过程等方面的变化。
通过对β4GalT1基因点突变纯合子小鼠和野生型小鼠肝中的N-链寡糖的UPLC峰谱图分析可知, 两者的峰谱图有很大差异。β4GalT1基因点突变以后, 由于缺少β4GalT1, 导致纯合子小鼠体内N-链寡糖中半乳糖合成减少, 进而影响N-链寡糖的唾液酸化。因此, 纯合子小鼠肝中N-链寡糖的UPLC峰谱图中的峰型前移, 证明β4GalT1基因点突变为β4GalNAcT1以后, 改变了小鼠肝中N-链寡糖的结构。这种突变导致小鼠其他器官和组织中的蛋白质N-糖基化也发生了变化, 基于蛋白质N-糖基化的重要生物学功能, 纯合子小鼠体内蛋白质N-糖基化的改变必然也改变小鼠的生理机能。
通过对β4GalT1基因点突变纯合子小鼠的生长发育情况记录并分析, 发现纯合子小鼠在断奶前的存活率为90%, 而野生型小鼠在断奶前的存活率为100%, 表明β4GalT1基因点突变降低了小鼠的存活率。β4GalT1基因敲除导致小鼠断奶前半数致死[3], 而本研究中β4GalT1基因点突变纯合子小鼠断奶前存活率显著高于β4GalT1基因敲除小鼠, 由此说明β4GalT1基因点突变比敲除对小鼠存活率影响更小。比较纯合子和野生型小鼠体质量, 发现它们在生长发育期间体质量无显著差别(P > 0.05)。对比纯合子和野生型小鼠各器官质量, 发现心脏、肝脏、肠等器官的质量在2种小鼠中没有显著差异, 说明β4GalT1突变为β4GalNAcT对小鼠的生长发育过程没有显著影响。
Shen等[22]发现β4GalT1可能参与了受损的外周神经早期损伤阶段的再生, PC12细胞中的β4GalT1过度表达显著增强了轴突的形成和延伸[20, 27]。这些研究表明, β4GalT1与小鼠神经系统发育有关。本研究通过对纯合子、野生型小鼠日常状态的观察记录及小鼠悬尾试验分析, 发现纯合子小鼠较野生型小鼠而言, 表现为反应迟滞, 对外界刺激反应不敏感等症状。悬尾试验显示纯合子小鼠挣扎较轻, 纯合子小鼠的静止时间显著长于野生型小鼠(P < 0.01), 说明纯合子小鼠处于抑郁状态的时间更长, 证明β4GalT1基因通过表达β4GalT1从而参与小鼠体内的神经系统发育。而突变体β4GalNAcT并不能补偿β4GalT1在神经系统发育过程中所起的重要作用。
已有研究报道, β4GalT1与小鼠受精过程密切相关。Rodeheffer等[17]研究结果表明精子通过β-1, 4-半乳糖基转移酶Ⅰ(精子表面的凝集素样受体)识别并与透明带糖蛋白ZP3内的特定寡糖配体结合, 从而影响小鼠的精卵识别。β4GalT1的细胞质结构域可以直接或间接结合被ZP3激活的异源三聚体G蛋白, 最终使得精子与卵子结合成为受精卵, 发育成胚胎, 从而影响小鼠的胚胎发育。纯合子与纯合子交配时, 雌小鼠受孕困难, 说明β4GalT1与小鼠的精卵识别密切相关, 另外, 雌小鼠卵子的透明糖蛋白ZP3内的特定寡糖配体结构也可能发生变化, 并进一步影响精卵的识别与结合。因此, β4GalNAcT突变体虽然也能使雌小鼠受孕, 但与β4GalT1相比, 精卵识别与结合的能力大大降低。纯合子与纯合子交配时, 雌小鼠受孕以后很难生出子代小鼠, 甚至纯合子雌小鼠难产死亡, 说明β4GalT1对雌小鼠的繁殖能力也有着至关重要的作用, 突变后无法维持雌小鼠的正常怀孕和生产, 其机制还需进一步研究。此外, 杂合子小鼠的自交繁殖结果表明, 纯合子、杂合子、野生型小鼠的基因型比例约为1:4:2, 子代纯合子小鼠所占比例明显少于孟德尔遗传定律所应占比例(1:2:1)。纯合子、杂合子、野生型小鼠的自交繁殖结果表明, 纯合子小鼠自交平均每胎子代数显著少于杂合子和野生型小鼠(P < 0.01)。以上结果表明β4GalT1基因点突变在多个方面都降低了纯合子小鼠的出生率和繁殖能力, 这说明β4GalT1可以通过影响小鼠的精子识别和胚胎的发育, 从而影响小鼠的整体繁殖能力。因为本试验中未能获得纯合子雌小鼠的母乳(母鼠与子鼠均死亡), 因此也无法获得不含乳糖的乳, 也因此, 通过将β4GalT1基因改造成β4GalNAcT1而生产不含有乳糖的乳的设想未成功。
肝脏作为人体最大的腺体, 参与胆汁的分泌、解毒、吞噬、代谢、排泄以及免疫等多种复杂的生物学过程[25]。β4GalT1突变后导致小鼠N-链寡糖的结构产生了变化, 从而引起生理功能(如:生长发育、行为能力及繁殖能力等)的改变, 而N-链寡糖结构的改变与小鼠生理功能变化的具体联系有待进一步验证。
| [1] |
Crocker P R, Feizi T. Carbohydrate recognition systems:functional triads in cell:cell interactions[J]. Current Opinion in Structural Biology, 1996, 6(5): 679-691. DOI:10.1016/S0959-440X(96)80036-4 |
| [2] |
Poirier F, Kimber S. Cell surface carbohydrates and lectins in early development[J]. Molecular Human Reproduction, 1997, 3(10): 907-918. DOI:10.1093/molehr/3.10.907 |
| [3] |
Collins B E, Paulson J C. Cell surface biology mediated by low affinity multivalent protein-glycan interactions[J]. Current Opinion in Chemical Biology, 2004, 8(6): 617-625. DOI:10.1016/j.cbpa.2004.10.004 |
| [4] |
Lowe J B. Glycan-dependent leukocyte adhesion and recruitment in inflammation[J]. Current Opinion in Cell Biology, 2003, 15(5): 531-538. DOI:10.1016/j.ceb.2003.08.002 |
| [5] |
Talbot P, Shur B D, Myles D G. Cell adhesion and fertilization:steps in oocyte transport, sperm-zona pellucida interactions, and sperm-egg fusion[J]. Biology of Reproduction, 2003, 68(1): 1-9. |
| [6] |
Akama T O, Nakagawa H, Sugihara K, et al. Germ cell survival through carbohydrate-mediated interaction with Sertoli cells[J]. Science, 2002, 295(5552): 124-127. DOI:10.1126/science.1065570 |
| [7] |
Sharon N. Carbohydrate:lectin interactions in infectious disease[M]. Boston, MA: Springer, 1996: 1-8.
|
| [8] |
Sacks D, Kamhawi S. Molecular aspects of parasite-vector and vector-host interactions in leishmaniasis[J]. Annual Review of Microbiology, 2001, 55(1): 453-483. DOI:10.1146/annurev.micro.55.1.453 |
| [9] |
Sharon N, Ofek I. Fighting infectious diseases with inhibitors of microbial adhesion to host tissues[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(S3): 267-272. |
| [10] |
Rudd P M, Wormald M R, Dwek R A. Glycosylation and the immune system[J]. Science, 2001, 291(5512): 2370-2376. DOI:10.1126/science.291.5512.2370 |
| [11] |
Lo N W, Shaper J H, Pevsner J, et al. The expanding beta 4-galactosyltransferase gene family:messages from the databanks[J]. Glycobiology, 1998, 8(5): 517-526. DOI:10.1093/glycob/8.5.517 |
| [12] |
Roseman S. Reflections on glycobiology[J]. The Journal of Biological Chemistry, 2001, 276(45): 41527-41542. DOI:10.1074/jbc.R100053200 |
| [13] |
Asano M, Furukawa K, Kido M, et al. Growth retardation and early death of beta-1, 4-galactosyltransferase knockout mice with augmented proliferation and abnormal differentiation of epithelial cells[J]. The EMBO Journal, 1997, 16(8): 1850-1857. DOI:10.1093/emboj/16.8.1850 |
| [14] |
Kido M, Asano M, Iwakura Y, et al. Presence of polysialic acid and HNK-1 carbohydrate on brain glycoproteins from beta-1, 4-galactosyltransferase-knockout mice[J]. Biochemical and Biophysical Research Communications, 1998, 245(3): 860-864. DOI:10.1006/bbrc.1998.8537 |
| [15] |
Lu Q, Hasty P, Shur B D. Targeted mutation in β1, 4-galactosyltransferase leads to pituitary insufficiency and neonatal lethality[J]. Developmental Biology, 1997, 181(2): 257-267. DOI:10.1006/dbio.1996.8444 |
| [16] |
Ramakrishnan B, Qasba P K. UDP-Gal: BetaGlcNAc beta 1, 4-galactosyltransferase, polypeptide 1(B4GALT1)[M]//Taniguchi N, Honke K, Fukuda M, et al. Handbook of Glycosyltransferases and Related Genes. Tokyo: Springer, 2014: 51-62.
|
| [17] |
Rodeheffer C, Shur B D. Characterization of a novel ZP3-independent sperm-binding ligand that facilitates sperm adhesion to the egg coat[J]. Development, 2004, 131(3): 503-512. |
| [18] |
Chen L, Xie Y, Fan J, et al. HCG induces β1, 4-GalT I expression and promotes embryo implantation[J]. Int J Clin Exp Pathol, 2015, 8(5): 4673-4683. |
| [19] |
Gu J, Fan J, Xu Y, et al. Regulatory function of β1, 4-galactosyltransferase I expression on Lewis-Y glycan and embryo implantation[J]. Gene, 2015, 562: 220-225. DOI:10.1016/j.gene.2015.02.072 |
| [20] |
Huang Q, Shur B D, Begovac P C. Overexpressing cell surface beta 1, 4-galactosyltransferase in PC12 cells increases neurite outgrowth on laminin[J]. Journal of Cell Science, 1995, 108: 839-847. |
| [21] |
Shen A, Yan J, Ding F, et al. Overexpression of β-1, 4-galactosyltransferase I in rat Schwann cells promotes the growth of co-cultured dorsal root Ganglia[J]. Neuroscience Letters, 2003, 342: 159-162. DOI:10.1016/S0304-3940(03)00271-4 |
| [22] |
Shen A, Zhu D, Ding F, et al. Increased gene expression of β-1, 4-galactosyltransferase I in rat injured sciatic nerve[J]. Journal of Molecular Neuroscience, 2003, 21: 103-110. DOI:10.1385/JMN:21:2:103 |
| [23] |
Asano M, Nakae S, Kotani N, et al. Impaired selectin-ligand biosynthesis and reduced inflammatory responses in β-1, 4-galactosyltransferase-I-deficient mice[J]. Blood, 2003, 102: 1678-1685. DOI:10.1182/blood-2003-03-0836 |
| [24] |
Ivanov Y D, Bukharina N S, Pleshakova T O, et al. Atomic force microscopy visualization and measurement of the activity and physicochemical properties of single monomeric and oligomeric enzymes[J]. Biophysics, 2011, 56(5): 892-896. DOI:10.1134/S000635091105006X |
| [25] |
李婷. 肝脏功能的检测方法分类及研究现状[J]. 肝脏, 2019, 24(8): 952-955. Li T. Classification and research status of detection methods for liver function[J]. Chinese Hepatology, 2019, 24(8): 952-955 (in Chinese). DOI:10.3969/j.issn.1008-1704.2019.08.039 |
| [26] |
李淑芬, 李希. β1, 4半乳糖基转移酶的生物学功能研究进展[J]. 生命的化学, 2016, 36(5): 589-595. Li S F, Li X. Recent advance in the function of β1, 4 galactosyltransferase[J]. Chemistry of Life, 2016, 36(5): 589-595 (in Chinese with English abstract). |
| [27] |
Begovac P C, Hall D E, Shur B D. Laminin fragment E8 mediates PC12 cell neurite outgrowth by binding to cell surface beta 1, 4 galactosyltransferase[J]. The Journal of Cell Biology, 1991, 113(3): 637-644. DOI:10.1083/jcb.113.3.637 |




