文章信息
- 周艺琳, 王正磊, 许媛媛, 韩先干, Vanhnaseng PHOUTHAPANE, 苗晋锋
- ZHOU Yilin, WANG Zhenglei, XU Yuanyuan, HAN Xiangan, Vanhnaseng PHOUTHAPANE, MIAO Jinfeng
- 白藜芦醇对乳房链球菌感染引起乳腺细胞氧化应激的影响及机制
- The effects and mechanism of resveratrol on oxidative stress of mammary cells induced by Streptococcus uberis infection
- 南京农业大学学报, 2020, 43(4): 698-704
- Journal of Nanjing Agricultural University, 2020, 43(4): 698-704.
- http://dx.doi.org/10.7685/jnau.201909042
-
文章历史
- 收稿日期: 2019-09-25
2. 中国农业科学院上海兽医研究所, 上海 200241;
3. 老挝科技部生态与生物技术研究所, 万象 01000
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China;
3. Biotechnology and Ecology Institute, Ministry of Science and Technology of Laos, Vientiane 01000, Laos
白藜芦醇(resveratrol, Res)又称芪三酚, 是一种天然存在的多酚类化合物, 广泛存在于多种植物和商业产品中, 如葡萄、花生、虎杖及红酒等。它通常被认为是一种植物抗毒素, 可应对紫外辐射、化学毒素、真菌与细菌感染等在内的多种有害刺激。研究表明, 白藜芦醇具有多种生理功能, 包括抗氧化、抗菌、保护心脏和抗肿瘤作用等[1]。
氧化应激(oxidative stress, OS)的实质是机体产生的生物活性物质超过了自身的抵抗能力, 导致机体氧化与抗氧化系统动态失衡。当机体受到损伤、病原微生物感染等应激时, 会产生大量活性氧(reactive oxygen species, ROS)、活性氮(reactive nitrogen species, RNS)等自由基, 这些物质在杀灭病原的同时会损伤细胞和组织。机体在进化过程中不断完善自身的抗氧化防御系统, 抵抗氧化应激的发生, 其中核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)是机体内1个关键的核转录因子, 在机体抵抗氧化应激过程中发挥关键作用。当机体发生氧化应激时, Nrf2活化入核并诱导其靶基因表达, 如血红素加氧酶1(heme oxygenase-1, HO-1)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、NAD(P)H:醌氧化还原酶1、谷胱甘肽S-转移酶(glutathione S-transferase, GST)等的基因表达, 清除自由基, 缓解氧化应激[2]。
本课题组前期研究表明, 乳房链球菌(Streptococcus uberis)、大肠杆菌及金黄色葡萄球菌感染均可显著提高乳腺上皮细胞中ROS、丙二醛(malondialdehyde, MDA)、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)及上清中N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase, NAGase)、乳酸脱氢酶(lactate dehydrogenase, LDH)的含量或活性, 降低总抗氧化能力(total antioxidant capacity, T-AOC), 引起氧化损伤[3-4]。白藜芦醇作为一种有效的抗氧化剂, 能否缓解S.uberis感染引起的氧化损伤, 这种作用是否与Nrf2通路有关, 为此, 本试验以小鼠乳腺上皮细胞与乳房链球菌为材料, 对抗氧化水平及Nrf2通路中关键指标进行检测, 以期阐明白藜芦醇缓解乳房链球菌感染引起氧化应激的机制。
1 材料与方法 1.1 试验材料小鼠乳腺上皮细胞(EpH4-Ev)与乳房链球菌(S.uberis 0140J)均购自美国模式培养物集存库(ATCC); DMEM培养液、磷酸缓冲盐溶液(phosphate buffer saline, PBS)、胎牛血清均购自Gibco公司; 白藜芦醇购于生工生物工程(上海)股份有限公司; ROS荧光探针、BCA试剂盒、RIPA缓冲液、蛋白上样缓冲液购于南京碧云天生物公司; GAPDH抗体购于南京巴傲得生物科技有限公司; Nrf2抗体及二抗购于CST公司; LDH、T-AOC、SOD、MDA检测试剂盒和PMSF购于北京索莱宝科技有限公司; NAGase、NO、iNOS检测试剂盒购于南京建成生物工程研究所; 相关引物于擎科生物科技有限公司合成; PrimeScript RT Master Mix、TB GreenTM Premix Ex Taq酶购自TaKaRa公司; 全波长酶标仪购于Thermo Fisher公司; C6个人型流式细胞仪购于BD公司; Tanon-3900成像系统购于上海天能科技有限公司; 倒置显微镜购于Nikon公司。
1.2 试验方法 1.2.1 细菌培养将S.uberis按1:100(体积比)的比例接种于灭菌的Todd-Hewitt Broth(THB)培养基中, 在37 ℃, 180 r·min-1的恒温培养箱中培养至对数生长期(D600=0.45~0.55)。
1.2.2 细胞培养及处理小鼠乳腺上皮细胞系EpH4-Ev培养在细胞专用培养瓶中, 用含10%(体积分数)胎牛血清的DMEM培养液在37 ℃、5% CO2的条件下培养, 备用。将EpH4-Ev细胞传代至6孔板中培养, 待其生长至80%融合时, 更换为无血清DMEM培养基, 饥饿处理4 h, 试验组加入15 μmol·L-1白藜芦醇培养4 h, 然后按复合感染数(MOI)为10接入乳房链球菌, 轻轻混匀, 共孵育3 h; 对照组适时加入等量PBS, 收集处理后的细胞样品液, 进行如下测定。
1.2.3 RT-PCR检测取处理后细胞, 弃上清液, 用PBS洗3次, 根据说明书提取细胞内的总RNA, 将其反转录成cDNA, 之后进行荧光定量PCR, 检测HO-1、NQO1、CAT、GST基因mRNA的表达。相关引物序列见表 1。
| 目的基因Target gene | 引物对序列Primer pairs sequences(5′→3′) | 产物大小/bp Product size |
| β-actin | TCTGGCACCACACCTTCTA/AGGCATACAGGGACAGCAC | 180 |
| HO-1 | CACTCTGGAGATGACACCTGAG/GTGTTCCTCTGTCAGCATCACC | 115 |
| NQO1 | GCCGAACACAAGAAGCTGGAAG/GGCAAATCCTGCTACGAGCACT | 100 |
| CAT | CCGTCCCTGCTGTCTCA/ATTGGGTTCCCGCCTC | 156 |
| GST | GCCCACTGGAGTAACAAG/GGAAGAGGGTGAGGAGAT | 184 |
| 注:β-actin:β-肌动蛋白基因beta-actin gene; HO-1:血红素加氧酶1基因Heme oxygenase-1 gene; NQO1:NAD(P)H:醌氧化还原酶1基因NAD(P)H:quinone oxidoreductase 1 gene; CAT:过氧化氢酶基因Catalase gene; GST:谷胱甘肽S-转移酶基因Glutathione S-transferase gene. | ||
取处理后细胞, 弃上清液, PBS洗3次, 加入适量裂解液, 用刮刀刮取细胞, 收集至1.5 mL离心管中, 4 ℃、12 000 r·min-1离心10 min。取上清液采用BCA法检测并调节蛋白浓度, 然后加入相应体积的上样缓冲液, 混匀后100 ℃水浴中煮10 min, 置于冰上冷却, -80 ℃冰箱保存。
将预染蛋白标准品和样品上样至SDS-PAGE胶孔里, 80 V电泳至浓缩胶与分离胶分界线, 然后调节电压至120 V, 电泳至凝胶下部, 停止电泳; 100 V湿转印90 min, 50 g·L-1牛血清白蛋白室温封闭2 h后加入一抗4 ℃过夜孵育; TBST清洗, 加入1:10 000稀释的二抗室温孵育2 h, 弃二抗, TBST清洗。放入发光成像系统, 加发光液拍照并用Image J软件统计分析。
1.2.5 流式细胞术检测取处理后细胞, 弃上清液, PBS洗3次后, 加入终浓度为10 μmol·L-1的DCFH-DA(2′, 7′-二氯荧光黄双乙酸盐), 37 ℃恒温培养箱中孵育20 min, 弃上清液后PBS洗3次, 加入胰酶消化, 收集于流式管中进行流式细胞术检测。
1.2.6 显微镜下观察取处理后细胞, 弃上清液, PBS洗3次, 加1 mL PBS于6孔板中, 在显微镜下观察并拍照。
1.2.7 生化指标测定细胞完成处理后, 收集上清液于2 mL离心管中, 4 ℃、12 000 r·min-1离心10 min后, 收集上清液于另一干净2 mL离心管中, 按说明书分别检测LDH、NAGase活性及NO含量。取贴壁的细胞用PBS洗3次后, 按说明书加入相应的提取液, 刮取细胞至1.5 mL离心管, 超声波破碎细胞后, 离心取上清液, 按说明书分别检测iNOS和SOD活性及T-AOC水平、MDA含量。
1.3 数据处理与分析采用SPSS 18.0软件进行单因子方差(One-way ANOVA)分析和差异显著性检验。采用Graph Pad Prism 5.0软件对数据绘图。数据结果均表示为平均值±标准误(x±SE)。
2 结果与分析 2.1 白藜芦醇预处理对乳房链球菌感染乳腺上皮细胞内ROS水平、NO含量及iNOS活性的影响结果如图 1所示:与未处理对照组相比, 单加白藜芦醇均显著降低乳腺细胞中ROS水平、NO含量及iNOS活性, 而S.uberis感染与之相反。与S.uberis感染组相比, 白藜芦醇预处理显著降低ROS水平、NO含量及iNOS活性。说明乳房链球菌感染引起细胞产生氧化应激, 白藜芦醇对其有干预作用。
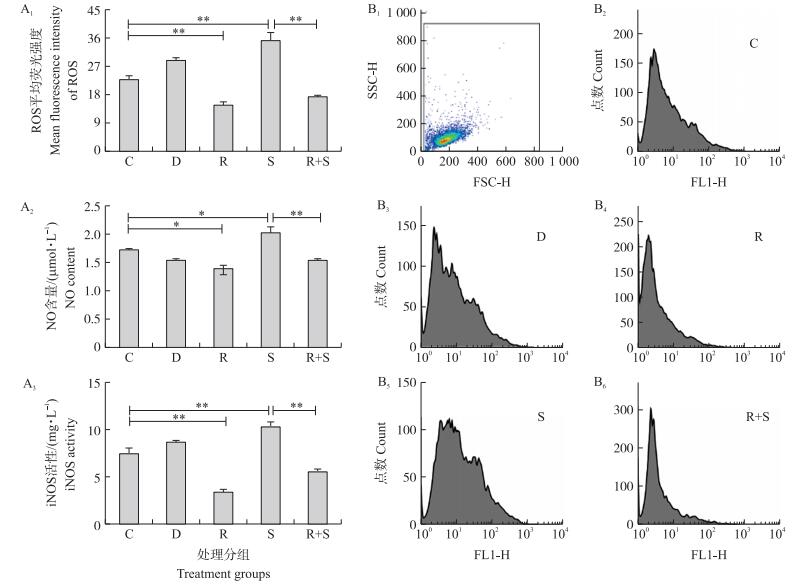
|
图 1 白藜芦醇及乳房链球菌感染对EpH4-Ev细胞中活性氧(ROS)水平(荧光强度)、NO含量和iNOS活性的影响
Fig. 1 Effects of resveratrol and Streptococcus uberis infection on ROS level(fluorescence intensity), NO content and iNOS activity in EpH4-Ev cells
A1—A3.ROS水平、NO含量和iNOS活性统计; B1.对目标细胞群设门; B2—B6分别代表C、D、R、S、R+S处理组细胞。 处理分组:C:未处理对照:D:二甲基亚砜(DMSO)对照; R:15 μmol·L-1白藜芦醇预处理4 h; S:乳房链球菌感染3 h; R+S:先用15 μmol·L-1白藜芦醇处理4 h再用乳房链球菌感染3 h。SSC-H:侧向散射高度; FSC-H:前向散射高度; FL1-H:A-V染色细胞高度。*P < 0.05, ** P < 0.01。下同。 A1-A3.The statistical results of ROS level, NO content and iNOS activity; B1.Gating of the cells population; B2-B6.C, D, R, S and R+S mean treatment groups in cells. Treatment groups:C.Untreated; D.Treated with DMSO; R.Treated with 15 μmol·L-1 resveratrol for 4 h; S.Infected by S.uberis for 3 h; R+S.Treated with 15 μmol·L-1 resveratrol for 4 h before infecting by S.uberis for 3 h. SSC-H:Side scatter height; FSC-H:Forward scatter height; FL1-H:Annexin-V staining cell height. *P < 0.05, **P < 0.01. The same as follows. |
如图 2所示:与未处理对照组相比, 单加白藜芦醇显著降低NAGase活性, MDA含量有下降的趋势, 显著提高SOD活性和T-AOC水平; 而S.uberis感染组LDH、NAGase、SOD活性及MDA含量显著增加, T-AOC水平显著下降。与感染组相比, 白藜芦醇预处理显著降低LDH、NAGase活性和MDA含量, 提高SOD活性与T-AOC水平。上述结果进一步说明S.uberis感染使机体抗氧化能力降低, 引起氧化损伤, 而白藜芦醇预处理可以提高机体的抗氧化能力, 缓解由S.uberis感染引起的氧化损伤。
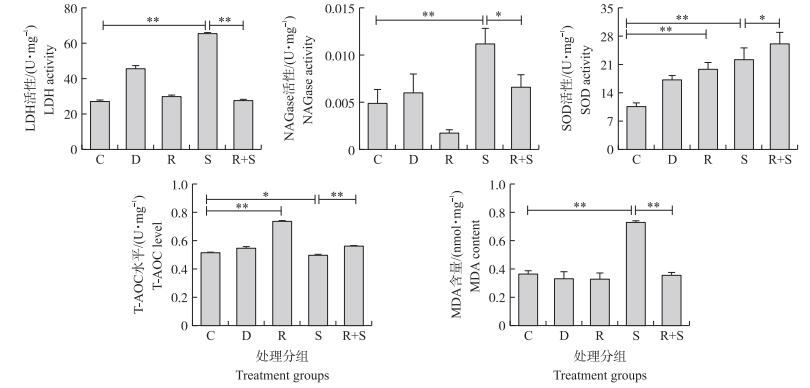
|
图 2 白藜芦醇及乳房链球菌感染对EpH4-Ev细胞LDH、NAGase、SOD活性和T-AOC水平及MDA含量的影响 Fig. 2 Effects of resveratrol and S.uberis infection on the activities of LDH, NAGase, SOD, T-AOC level and MDA content in EpH4-Ev cells |
如图 3所示:正常情况下, EpH4-Ev乳腺上皮细胞均边界清晰, 呈典型的多边形特征(图 3-A、B、C)。S.uberis感染使细胞出现变圆、皱缩等形态变化(图 3-D), 白藜芦醇预处理可以显著改善这些变化(图 3-E)。表明白藜芦醇可以缓解乳房链球菌感染造成的细胞损伤。
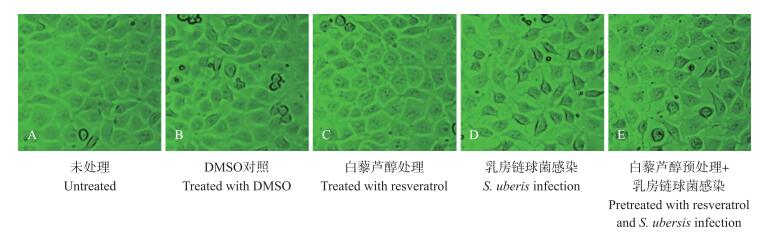
|
图 3 显微镜下观察EpH4-Ev乳腺上皮细胞的形态(×400) Fig. 3 The morphology of EpH4-Ev mammary epithelial cells observed under microscope(×400) |
如图 4所示:与正常组相比, 单加白藜芦醇或S.uberis感染均可以显著提高乳腺上皮细胞中Nrf2蛋白水平。当S.uberis感染时, 白藜芦醇预处理提高了Nrf2蛋白的表达。说明S.uberis感染对Nrf2蛋白有一定的激活作用, 而白藜芦醇预处理可以使之进一步激活。
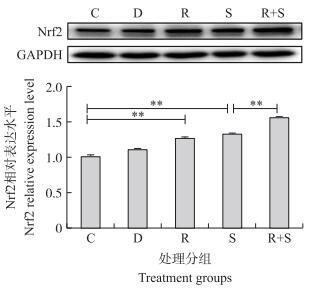
|
图 4 白藜芦醇及乳房链球菌感染对EpH4-Ev细胞Nrf2蛋白表达水平的影响 Fig. 4 Effects of resveratrol and S.uberis infection on the protein expression level of Nrf2 in EpH4-Ev cells |
如图 5所示:与对照相比, 白藜芦醇单独处理或S.uberis感染均可显著提高Nrf2靶基因HO-1、NQO1、CAT和GST的mRNA水平。当S.uberis感染时, 白藜芦醇预处理提高Nrf2靶基因的mRNA水平。说明S.uberis感染可以在一定程度上刺激Nrf2下游靶基因的表达, 而白藜芦醇预处理可以进一步激活机体的抗氧化防御系统。
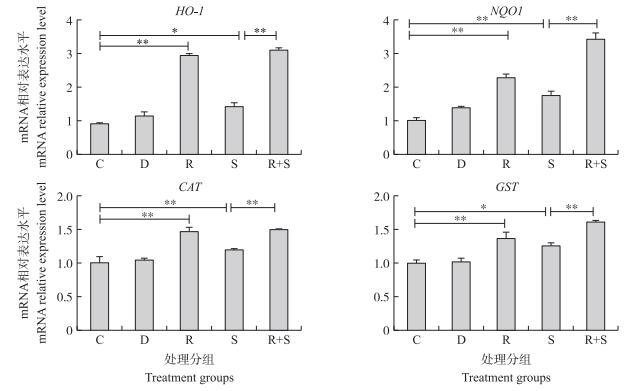
|
图 5 白藜芦醇预处理对乳房链球菌感染EpH4-Ev细胞HO-1、NQO1、CAT、GST mRNA相对表达水平的影响 Fig. 5 Effects of resveratrol pretreatment on the mRNA relative expression levels of HO-1、NQO1、CAT、GST genes infected with S.uberis in EpH4-Ev cells |
S.uberis是一种重要的环境性致病菌, 感染机制比较复杂, 可黏附、内化到乳腺上皮细胞内, 造成胞内感染[5]。本课题组Li等[4]和王正磊等[6]已证明S.uberis感染会显著提高小鼠乳腺上皮细胞内TNF-α、IL-1β、IL-6水平, 提高NAGase和LDH活性, 造成炎症损伤, 而利用抗氧化物质可以有效干预S.uberis感染造成的炎症反应并且缓解细胞损伤。近年来, 白藜芦醇由于具有强大的抗氧化能力而引起学者的关注。研究发现, 在类风湿性关节炎成纤维样滑膜细胞中, 白藜芦醇可以缓解过氧化氢诱导的氧化应激和凋亡[7]; 白藜芦醇可以保护奶牛乳腺上皮细胞抵御过氧化氢诱导的氧化损伤[8]; 在链脲佐菌素诱导的大鼠肝脏缺血再灌注损伤模型中, 白藜芦醇对其引起的炎症反应和氧化应激具有保护作用[9]。在本研究中, 我们将S.uberis与EpH4-Ev细胞共培养后, 检测培养上清液中LDH和NAGase活性, 发现白藜芦醇预处理可以显著降低两者的活性, 缓解S.uberis感染造成小鼠乳腺上皮细胞的损伤。正常情况下LDH和NAGase均位于细胞内, 当细胞受到损伤或崩裂时, 它们会释放至胞外, 因此常作为衡量细胞损伤严重程度的重要指标[10-11]。
ROS、RNS等多种活性物质的大量产生会造成细胞损伤, 同时它们也是衡量机体氧化应激严重程度的重要指标[12]。其中RNS的合成需要以NO作为前体小分子, NO主要由iNOS催化形成。本研究结果显示, S.uberis感染显著提高ROS水平、NO含量及iNOS活性, 而白藜芦醇预处理显著降低这些变化, 说明白藜芦醇可以显著缓解S.uberis感染诱发的氧化应激, 推测白藜芦醇可能通过发挥抗氧化作用缓解炎症。细胞由于自身代谢也会产生少量自由基, 白藜芦醇作为一种多酚化合物可将其清除, 因此在正常情况下白藜芦醇同样具有一定的抗氧化作用。推测白藜芦醇抗氧化性能与其3、4、5位3个羟基的酚环、共轭双键的存在以及结构分子中电子离域有关[14]。
一些生化指标常用于衡量机体的抗氧化状况, 其中T-AOC是机体抗氧化防御系统的综合评价指标, 能衡量机体对自由基清除能力, MDA是脂质过氧化产物, 代表细胞中脂质过氧化水平[15-16]。本研究结果发现, S.uberis感染后, 细胞内T-AOC水平显著降低, MDA含量显著升高, 而白藜芦醇可以显著改善这些变化。这可能是S.uberis感染导致细胞产生大量的ROS、RNS, 使T-AOC水平降低, 引发脂质过氧化, 造成MDA含量升高。此外机体内还存在一些抗氧化酶, 如SOD是一种清除自由基的金属酶, 它能够催化超氧阴离子自由基歧化生成氧和过氧化氢, 被称为人体天然的垃圾清道夫[17-18]。本试验结果显示S.uberis感染后, 细胞内SOD升高, 白藜芦醇进一步使之升高。而SOD是Keap1-Nrf2通路下游主要的抗氧化蛋白[18-19], 推测白藜芦醇发挥抗氧化作用与此通路相关。
Keap1-Nrf2通路在机体抗氧化过程中发挥重要作用。Nrf2是一种核转录因子, 氧化应激发生时与其偶联的抑制因子Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)会发生变构, Nrf2与之分离并活化入核, 启动SOD、HO-1、CAT等一系列抗氧化酶的表达。本研究结果显示, S.uberis感染显著提高Nrf2蛋白水平并促进调控区SOD的表达, 以及HO-1、NQO1等基因转录, 说明S.uberis感染可以在一定程度上活化Nrf2通路, 机体以此主动抵御部分感染。然而机体对自由基的清除能力有限, 当超过承受范围即引起氧化应激。用白藜芦醇处理能进一步激活Nrf2及其介导的抗氧化系统, 提高机体对自由基的清除能力, 从而缓解S.uberis感染引起的氧化损伤。本研究结果与相关报道相似, 例如, 海藻糖通过调节Keap1-Nrf2途径缓解百草枯诱导的小鼠肝癌细胞的氧化应激[20]; 脱氢表雄酮通过激活Nrf2/ARE信号通路减轻铁性癫痫的氧化应激和凋亡[21]。Zhou等[22]研究发现, 在奶牛乳腺上皮细胞中, 白藜芦醇可以通过活化Nrf2通路缓解黄曲霉毒素b1诱导的氧化应激和细胞凋亡。本研究使用的是细胞模型, 接下来需要体内试验进一步验证。
综上所述, S.uberis感染会引起机体氧化应激的发生, 白藜芦醇预处理可缓解S.uberis感染引起的氧化损伤。其原因有二, 一是白藜芦醇直接清除自由基, 二是白藜芦醇激活Nrf2及其介导的抗氧化系统缓解氧化损伤。本研究为白藜芦醇作为营养元素缓解氧化应激提供了一定的理论支持。
| [1] |
Liu Y J, Chen X Z, Li J. Resveratrol protects against oxidized low-density lipoprotein-induced human umbilical vein endothelial cell apoptosis via inhibition of mitochondrial-derived oxidative stress[J]. Molecular Medicine Reports, 2017, 15(5): 2457-2464. DOI:10.3892/mmr.2017.6304 |
| [2] |
Stępkowski T M, Kruszewski M K. Molecular cross-talk between the NRF2/KEAP1 signaling pathway, autophagy, and apoptosis[J]. Free Radical Biology and Medicine, 2011, 50(9): 1186-1195. DOI:10.1016/j.freeradbiomed.2011.01.033 |
| [3] |
Zheng L H, Xu Y Y, Lu J Y, et al. Variant innate immune responses of mammary epithelial cells to challenge by Staphylococcus aureus, Escherichia coli and the regulating effect of taurine on these bioprocesses[J]. Free Radical Biology and Medicine, 2016, 96: 166-180. DOI:10.1016/j.freeradbiomed.2016.04.022 |
| [4] |
Li B, Xi P, Wang Z, et al. PI3K/Akt/mTOR signaling pathway participates in Streptococcus uberis-induced inflammation in mammary epithelial cells in concert with the classical TLRs/NF-κB pathway[J]. Veterinary Microbiology, 2018, 227: 103-111. DOI:10.1016/j.vetmic.2018.10.031 |
| [5] |
代斌.牛磺酸缓解乳房链球菌感染损伤的机制研究[D].南京: 南京农业大学, 2015. Dai B. The mechanism of taurine attenuated inflamatory injury induced by Streptococcus uberis[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1017045405.htm |
| [6] |
王正磊, 周艺琳, 周美意, 等. 牛磺酸对乳房链球菌感染引起的氧化应激影响及其机制[J]. 南京农业大学学报, 2019, 42(3): 491-498. Wang Z L, Zhou Y L, Zhou M Y, et al. The effects of taurine on oxidative stress induced by Streptococcus uberis infection and its mechanism[J]. Journal of Nanjing Agricultural University, 2019, 42(3): 491-498 (in Chinese with English abstract). DOI:10.7685/jnau.201812007 |
| [7] |
Zhang Y, Wang G Y, Wang T R, et al. Nrf2-Keap1 pathway-mediated effects of resveratrol on oxidative stress and apoptosis in hydrogen peroxide-treated rheumatoid arthritis fibroblast-like synoviocytes[J]. Annals of the New York Academy of Sciences, 2019, 1457(1): 166-178. DOI:10.1111/nyas.14196 |
| [8] |
金晓露.白藜芦醇抵御奶牛乳腺上皮细胞氧化应激的作用机制研究[D].杭州: 浙江大学, 2016. Jin X L. Mechanisms underlying the cytoprotective effects of resveratrol against oxidative stress in bovine mammary epithelial cells[D]. Hangzhou: Zhejiang University, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10335-1016267435.htm |
| [9] |
Aktaş H S, Ozel Y, Ahmad S, et al. Protective effects of resveratrol on hepatic ischemia reperfusion injury in streptozotocin-induced diabetic rats[J]. Molecular and Cellular Biochemistry, 2019, 460(1/2): 217-224. |
| [10] |
Drent M, Cobben N A M, Henderson R F, et al. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation[J]. European Respiratory Journal, 1996, 9(8): 1736-1742. DOI:10.1183/09031936.96.09081736 |
| [11] |
Pyörälä S, Pyörälä E. Accuracy of methods using somatic cell count and N-acetyl-β-D-glucosaminidase activity in milk to assess the bacteriological cure of bovine clinical mastitis[J]. Journal of Dairy Science, 1997, 80(11): 2820-2825. DOI:10.3168/jds.S0022-0302(97)76246-5 |
| [12] |
Nair N, Gongora E. Oxidative stress and cardiovascular aging:interaction between NRF-2 and ADMA[J]. Current Cardiology Reviews, 2017, 13(3): 183-188. |
| [13] |
Li C, Xu X F, Tao Z H, et al. Resveratrol dimers, nutritional components in grape wine, are selective ROS scavengers and weak Nrf2 activators[J]. Food Chemistry, 2015, 173: 218-223. DOI:10.1016/j.foodchem.2014.09.165 |
| [14] |
Stivala L A, Savio M, Carafoli F, et al. Specific structural determinants are responsible for the antioxidant activity and the cell cycle effects of resveratrol[J]. Journal of Biological Chemistry, 2001, 276(25): 22586-22594. DOI:10.1074/jbc.M101846200 |
| [15] |
Harasym J, Oledzki R. Effect of fruit and vegetable antioxidants on total antioxidant capacity of blood plasma[J]. Nutrition, 2014, 30(5): 511-517. DOI:10.1016/j.nut.2013.08.019 |
| [16] |
Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde(MDA)and relatives in biological samples:analytical and biological challenges[J]. Analytical Biochemistry, 2017, 524: 13-30. DOI:10.1016/j.ab.2016.10.021 |
| [17] |
徐靖. 超氧化物歧化酶及其应用的研究进展[J]. 食品工业科技, 2013, 34(12): 387-391. Xu J. Research progress in superoxide dismutase and its application[J]. Science and Technology of Food Industry, 2013, 34(12): 387-391 (in Chinese with English abstract). |
| [18] |
胡流芳, 王迎, 任汝静, 等. Keap1-Nrf2/ARE信号通路的抗氧化应激作用及其调控机制[J]. 国际药学研究杂志, 2016, 43(1): 146-152. Hu L F, Wang Y, Ren R J, et al. Anti-oxidative stress actions and regulation mechanisms of Keap1-Nrf2/ARE signal pathway[J]. Journal of International Pharmaceutical Research, 2016, 43(1): 146-152 (in Chinese with English abstract). |
| [19] |
阮智杨, 陈新, 孙雯, 等. 奶牛乳房炎病原菌的分离鉴定及药物敏感试验[J]. 畜牧与兽医, 2018, 50(6): 105-109. Ruan Z Y, Chen X, Sun W, et al. Isolation and identification of cow mastitis pathogenic bacteria and disk diffusion test[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(6): 105-109 (in Chinese with English abstract). |
| [20] |
Mizunoe Y, Kobayashi M, Sudo Y, et al. Trehalose protects against oxidative stress by regulating the Keap1-Nrf2 and autophagy pathways[J]. Redox Biology, 2018, 15: 115-124. DOI:10.1016/j.redox.2017.09.007 |
| [21] |
Prakash C, Mishra M, Kumar P, et al. Dehydroepiandrosterone alleviates oxidative stress and apoptosis in iron-induced epilepsy via activation of Nrf2/ARE signal pathway[J]. Brain Research Bulletin, 2019, 153: 181-190. DOI:10.1016/j.brainresbull.2019.08.019 |
| [22] |
Zhou Y F, Jin Y C, Yu H, et al. Resveratrol inhibits aflatoxin B1-induced oxidative stress and apoptosis in bovine mammary epithelial cells and is involved the Nrf2 signaling pathway[J]. Toxicon, 2019, 164: 10-15. DOI:10.1016/j.toxicon.2019.03.022 |




