文章信息
- 谢婉滢, 邹希
- XIE Wanying, ZOU Xi
- 浮萍叶面细菌群落对砷的氧化及该过程受抗生素的影响
- Arsenite oxidation by phyllosphere bacterial community of duckweed and the effect of antibiotics on this process
- 南京农业大学学报, 2020, 43(4): 667-673
- Journal of Nanjing Agricultural University, 2020, 43(4): 667-673.
- http://dx.doi.org/10.7685/jnau.201906059
-
文章历史
- 收稿日期: 2019-06-28
稻田环境中砷(As)的生物地球化学循环与人类健康密切相关。As在环境中的形态决定其毒性及生物有效性[1]。作为As代谢的主要过程, 环境中As的氧化还原显著影响植物对As的吸收和累积[1-2]。稻田环境中, 水稻根际微生物介导As的氧化和还原[2]。淹水条件下, 土壤中的As主要被微生物还原为三价砷(AsⅢ)。AsⅢ被矿物吸附的能力弱, 且移动性强, 通过水稻硅吸收通道被吸收, 导致水稻相对于旱作植物更容易累积As[3]。五价砷(AsⅤ)容易被矿物表面的铁锰化合物吸附, 水稻根际微生物将AsⅢ氧化为AsⅤ能够降低水稻对As的吸收[23。因此, 增加水稻环境中AsⅢ的氧化是降低水稻As累积的潜在途径[4]。从水稻环境中分离AsⅢ氧化细菌, 可以作为水稻环境As污染的潜在修复手段[5]。
浮萍是水稻环境中常见的浮水植物, 其叶面好氧与厌氧结合的微环境中生存着丰富多样的细菌群落[6]。浮萍叶面的As代谢细菌由AsⅢ氧化菌主导[7]。然而, 从浮萍或者其他水生植物叶面分离AsⅢ氧化细菌的研究报道较少。同时, 由于抗生素在医疗和养殖业中的广泛使用, 环境中的抗生素污染日趋严重, 这其中也包括水稻田环境[8-9]。在抗生素污染的条件下, 浮萍叶面细菌群落及可培养菌株对AsⅢ的氧化是否会有变化, 这种变化对浮萍吸收和累积As影响如何还未见报道。因此, 本研究主要测定浮萍叶面细菌群落对AsⅢ的氧化能力和对浮萍吸收累积As的作用, 以及抗生素对该AsⅢ氧化过程、浮萍吸收累积As的能力和可培养AsⅢ氧化菌株的影响, 探讨As和抗生素复合污染条件下As生物地球化学循环的变化。
1 材料与方法 1.1 试验材料与处理浮萍(Wolffia australiana)由苏黎世联邦理工学院的Prof. Dr. Elias Landolt提供。有菌浮萍在温室中培养于水稻土(采集于湖南常德)中, 液面保持5~10 cm。根据浮萍的生长情况, 不定期向土壤中施加240 mg·kg-1 CO(NH2)2和240 mg·kg-1 K2HPO3·3H2O。无菌浮萍的获取和维持方法为:纯净水洗净在温室中培养的浮萍, 于10 g·L-1 NaClO中浸泡3 min, 用无菌水彻底冲洗; 将单个叶片转移至含10 g·L-1蔗糖的固体Hoagland培养基中。待浮萍成活后, 选取培养基上不含细菌菌落的浮萍用于传代培养。传代培养基为含10 g·L-1蔗糖的Hoagland溶液。传代浮萍于光照培养箱中培养, 每月更换培养基。为检查浮萍的无菌条件, 定期采集培养液涂布于LB培养基观察是否有菌落生长。舍弃有菌落的传代培养或者将传代浮萍再按照以上的方法进行除菌, 直到获得不含细菌的浮萍。
Hoagland营养液(pH6):10 mmol·L-1 KNO3, 1 mmol·L-1 KH2PO4, 2 mmol·L-1 MgSO4, 2 mmol·L-1 Ca(NO3)2, 48.5 μmol·L-1 H3BO3, 20 μmol·L-1 FeSO4-EDTA, 10 μmol·L-1 MnCl2, 0.7 μmol·L-1 ZnSO4, 0.35 μmol·L-1 CuSO4, 0.1 μmol·L-1 Na2MoO4。细菌筛选培养基(pH7):0.25 g·L-1 NH4Cl, 0.5 g·L-1 KCl, 0.1 g·L-1 CaCl2, 0.4 g·L-1 MgCl2·6H2O, 0.5 g·L-1 NaCl, 0.6 g·L-1 NaH2PO4。培养基高温灭菌冷却至50 ℃左右加入10 mL·L-1矿质元素母液和10 mL·L-1维生素母液[10]。
试验处理设置为:无菌浮萍、有菌浮萍、有菌浮萍+抗生素(50 mg·L-1氯霉素)处理及不加浮萍的培养液对照。每个处理4个重复。
1.2 试验方法与测定 1.2.1 浮萍叶面菌群对As的转化能力测定于100 mL锥形瓶中加入50 mL培养液, 用无菌塑料封膜封住瓶口, 于121 ℃灭菌30 min。分别向灭菌后的培养液中加入2.5 g无菌浮萍、有菌浮萍和有菌浮萍+抗生素, 以不加浮萍的培养液为空白对照。将锥形瓶于光照培养箱中培养24 h后加入0.1 mL 50 mg·L-1无菌AsⅢ溶液(0.22 μm无菌过滤), 使培养液中AsⅢ的最终质量浓度为110 μg·L-1。加入AsⅢ后, 于0、10、24、72和168 h分别取1 mL溶液, 用于测定As的形态和总量。于168 h收集溶液, 一部分用于测定As的形态和总量, 一部分用于筛选浮萍叶面可培养细菌。光照培养条件为:相对湿度60%, 光照强度50 μmol·m-2·s-1, 昼/夜时间14 h/10 h, 昼/夜温度30 ℃/25 ℃。
1.2.2 浮萍培养液和叶面可培养细菌的筛选和鉴定将浮萍叶面细菌用0.02%(体积分数)Tween-20洗脱[6], 将洗脱液和浮萍培养液按10倍梯度稀释, 涂布于培养基上, 于光照培养箱中培养3~7 d, 挑选形态不同的菌落, 于固体培养基划线纯化。纯化后的菌落通过菌落PCR用于细菌鉴定。PCR引物为27F和1492R。PCR体系:12.5 μL Dream Taq Green PCR Master Mix(2×)(Thermo Scientific), 前、后引物各1 μL, 无菌水10.5 μL, 无菌牙签蘸取适量菌落。PCR条件:95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 35个循环; 72 ℃ 10 min。PCR产物测序由上海美吉生物医药有限公司完成。
1.2.3 浮萍培养液和叶面可培养细菌对As的转化能力测定将从浮萍培养液和叶面筛选到的菌株在含100 μg·L-1 AsⅢ的液体培养基中培养至D600值为0.8, 转接50 μL菌液于含100 μg·L-1 AsⅢ的5 mL液体培养基中, 于30 ℃、200 r·min-1避光培养50 h。以不加菌液的含AsⅢ培养液为空白对照(CK), 测定培养液中的As形态和浓度。
1.2.4 As形态的测定浮萍中As形态测定:称取0.5 g新鲜浮萍于50 mL特氟龙的微波消煮管中, 加入10 mL 1%(体积分数)硝酸(优级纯, Merck, 德国), 静置过夜后, 微波消煮仪中消煮。消煮程序为:55 ℃ 10 min, 75 ℃ 10 min, 95 ℃ 30 min, 每个阶段温度上升时间为5 min。消解液冷却、过滤(0.22 μm滤头)后用高效液相色谱-电感耦合等离子体-质谱联用(HPLC-ICP-MS, PerkinElmer NexIon 300x)测定As形态。样品中As形态通过与混标中As标准形态的出峰时间对比获得。As标准形态包括:三价砷(AsⅢ)、五价二甲基砷(DMAⅤ)、五价单甲基砷(MMAⅤ)和五价砷(AsⅤ)。4种As形态的浓度采用峰面积外标法计算, 以已知浓度DMAⅤ的峰面积为标准。空白试剂和标准物质(大米, GBW10010, 国家标准物质研究中心)各3个重复。大米中As的回收率为(95.8±2.0)%。溶液样品过滤(0.22 μm滤头)后, 采用上述相同的方法测定溶液中As的形态和浓度。
1.2.5 As总浓度的测定浮萍中As总浓度测定:称取0.2 g新鲜浮萍于50 mL特氟龙的微波消煮管中, 加入2.0 mL 65%硝酸, 静置过夜, 加入1 mL 30% H2O2。微波消煮程序同1.2.4节。消解液冷却后用超纯水稀释到50 mL, 过0.45 μm过滤器。采用电感耦合等离子体质谱测定滤液中As总浓度。试剂空白和标准物质(灌木枝叶, GBW07603, 国家标准物质研究中心)各3个重复。标准物质总As回收率为(97.5±4.6)%。溶液样品中各种As形态浓度的总和作为As总浓度。
1.3 数据统计与分析试验数据采用Sigmaplot 12和Adobe Illustrator CS5软件绘图和处理。用Excel 2010计算平均值和标准差(SE, n=4)。用SPSS 18.0中One-way ANOVA或者t测验对数据进行显著性差异分析(P < 0.05)。
2 结果与分析 2.1 不同处理溶液中AsⅢ的转化从图 1可知:浮萍培养液中只检测到AsⅢ和AsⅤ, 有机As形态未检出。在加浮萍的3种处理中, AsⅢ质量浓度随时间不断降低, 降低的速率从大到小的处理依次为有菌浮萍、有菌浮萍+抗生素、无菌浮萍处理。有菌浮萍处理中AsⅢ质量浓度在10 h时降低为初始浓度的2.6%, 之后一直保持低浓度(小于0.5 μg·L-1)。溶液中AsⅤ质量浓度随时间不断增加, 增加速率从大到小的处理依次为有菌浮萍、有菌浮萍+抗生素、无菌浮萍处理。对照处理中AsⅢ和AsⅤ的质量浓度变化较小, 但也有小部分AsⅢ被氧化为AsⅤ, AsⅤ质量浓度在168 h时为7.2 μg·L-1。无菌浮萍处理溶液中AsⅤ质量浓度在10 h时仅为3.3 μg·L-1, 略低于空白对照(5.0 μg·L-1); 但168 h后溶液中AsⅤ质量浓度达22 μg·L-1, 显著高于空白对照。有菌浮萍处理中, 10 h时溶液中AsⅤ质量浓度急剧增加到96 μg·L-1(占As总质量浓度的比例为97.1%), 168 h后, 溶液中AsⅤ质量浓度降低到75 μg·L-1(占As总质量浓度的比例为99.5%)。添加抗生素的有菌浮萍处理中, AsⅤ质量浓度的增加速率相比有菌浮萍处理急剧降低, 72和168 h时溶液中AsⅤ质量浓度分别为49和54 μg·L-1(分别占As总质量浓度的70.2%和72.9%)。有菌浮萍和添加抗生素的有菌浮萍处理中, AsⅤ质量浓度超过AsⅢ质量浓度的取样时间分别为10和72 h, 而在整个培养过程中, 无菌浮萍体系中AsⅢ的质量浓度始终高于AsⅤ质量浓度。
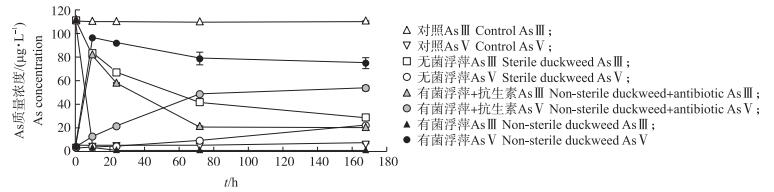
|
图 1 不同处理溶液中砷(As)的形态转化 Fig. 1 Arsenic(As)speciation in the solution of different treatments |
添加浮萍的溶液中As总质量浓度随处理时间延长不断降低, 72 h时, 溶液中As总质量浓度达到平衡(图 2)。无菌浮萍溶液中As总质量浓度的降低速度最快, 在72 h时已降低至初始值的50%。有菌浮萍处理溶液中As总质量浓度降低速度比无菌浮萍慢, 而添加抗生素可在一定程度上提高As总质量浓度的降低速度。根据As在培养体系中的质量守恒, 无菌浮萍和有菌浮萍+抗生素处理溶液中减少的As主要被浮萍吸收, 分别为2.83和2.04 μg(表 1)。此外, 与空白对照(0.48 μg)类似, 无菌浮萍和有菌浮萍+抗生素处理溶液中还有一小部分As被溶液中的沉淀吸附, 分别为0.55和0.39 μg(表 1)。无菌浮萍以及添加抗生素的有菌浮萍中As的总含量和总量显著高于有菌浮萍(P < 0.05), 总含量分别为后者的3.4和2.9倍(图 3, 表 1)。根据有菌浮萍初始体系与168 h体系间As差量(1.65 μg)可判断, 有菌浮萍处理中, 除了浮萍吸收和沉淀吸附的As以外, 还有部分As可能被体系中的微生物吸收或者吸附(表 1)。无菌浮萍和有菌浮萍+抗生素处理的浮萍中As形态主要为AsⅢ(分别占As总含量的96.8%和94.0%), 而AsⅤ所占比例小(分别只占As总含量的3.2%和6.0%)(图 4)。有菌浮萍中AsⅤ的比例显著增加(P < 0.05), 占As总含量的49.7%(图 4)。

|
图 2 不同处理溶液中As总质量浓度随时间的变化 Fig. 2 Change of total As concentration in the solutionof different treatments |

|
图 3 不同处理浮萍中As总含量 Fig. 3 Total content of As in the duckweeds ofdifferent treatments 不同小写字母表示处理间在0.05水平差异显著。下同。 Different lower letters indicate significant differences between treatments at 0.05 level. The same as follows. |
| 处理 Treatment |
As总量/μg As mass | 初始体系与168 h体系间As差量/μg Content difference between 0 h and 168 h |
|||
| 初始溶液 Solution at 0 h |
168 h浮萍 Duckweed at 168 h |
168 h溶液 Solution at 168 h |
168 h浮萍和溶液 Duckweed and solution at 168 h |
||
| 对照Control | 5.74±0.04 | — | 5.26±0.02 | 5.26±0.02 | 0.48±0.04b |
| 无菌浮萍Sterile duckweed | 5.65±0.04 | 2.83±0.11a | 2.28±0.04 | 5.10±0.07 | 0.55±0.10b |
| 有菌浮萍+抗生素Non-sterile duckweed+antibiotic | 5.75±0.01 | 2.04±0.08b | 3.32±0.06 | 5.36±0.03 | 0.39±0.04b |
| 有菌浮萍Non-sterile duckweed | 5.79±0.01 | 0.76±0.07c | 3.38±0.20 | 4.14±0.26 | 1.65±0.27a |
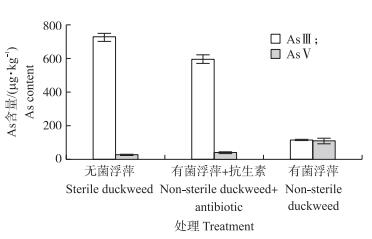
|
图 4 不同处理浮萍中As的形态和含量 Fig. 4 Speciation and content of As in theduckweeds of different treatments |
空白对照和无菌浮萍体系中没有分离到可培养细菌。有菌浮萍和添加抗生素的有菌浮萍培养体系中总共分离到38株细菌。从图 5可知:培养50 h后, 空白对照中的AsⅢ有小部分被氧化为AsⅤ。相对于空白对照, 有25株可培养细菌表现出对AsⅤ的还原能力, 只有7株菌株表现出微弱的AsⅢ氧化能力。D2、D3、D6、D8、D10、D12和D13都从有菌浮萍叶面上分离得到, 对AsⅢ具有氧化能力。然而, 这些细菌对AsⅢ氧化能力较弱, 菌株培养液中AsⅤ的浓度都没有超过空白对照的2倍。有菌浮萍的培养液中, 以及添加抗生素的浮萍培养处理(包括叶面和溶液)中分离到的细菌都没有表现出对AsⅢ的氧化能力。
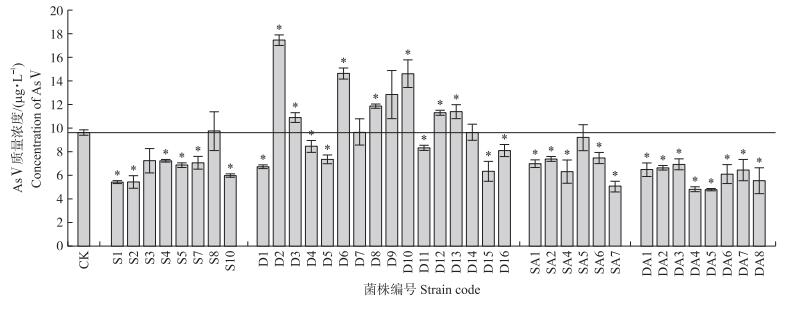
|
图 5 浮萍培养体系中菌株对As的转化 Fig. 5 Transformation of As by culturable bacteria from the duckweed incubation systems CK:不加菌液空白对照; S:有菌浮萍培养液中分离到的细菌; D:有菌浮萍叶面分离到的细菌; SA:抗生素+有菌浮萍培养液中分离到的细菌; DA:抗生素+有菌浮萍叶面分离到的细菌。*代表处理与CK在0.05水平差异显著。 CK:Control; S:Bacteria from the incubation solution of non-sterile duckweed; D:Bacteria from the phyllosphere of non-sterile duckweed; SA:Bacteria from the incubation solution of non-sterile duckweed with antibiotics; DA:Bacteria from the phyllosphere of non-sterile duckweed with antibiotics. * indicates significant difference with control at 0.05 level. |
其中D2、D8、D12和D13属于α-变形菌, 其16S rRNA基因与Asticcacaulis sp.(GU199450.1)、Sphingomonas sp.(AM900786.1)、Novosphingobium sp.(MH392629.1)和Porphyrobacter sp.(AB033326.1)的同源性分别为99.8%、97.7%、98.8%和99.3%;D3和D10属于β-变形菌, 其16S rRNA基因与Kinneretia sp.(KU360713.1)和Hydrogenophaga sp.(MK751587.1)的同源性分别为99.0%和99.2%;D6属于γ-变形菌, 其16S rRNA基因与Pseudomonas sp.(MG674651.1)的同源性为99.7%。
3 讨论水生植物叶面生存着具有较高多样性的细菌群落, 这些细菌群落在生物地球化学循环中有着不可忽略的作用[6]。本研究结果表明, 浮萍叶面细菌群落导致有菌浮萍体系中AsⅢ的氧化, 这主要体现在3个方面:1)有菌浮萍处理相对于无菌浮萍处理对AsⅢ的快速氧化; 2)抗生素对该氧化过程的显著抑制; 3)AsⅢ氧化菌株全部分离于有菌浮萍叶面。在空白对照中, AsⅢ转化为AsⅤ的速率非常慢, 为AsⅢ的化学氧化[12]。当加入无菌浮萍后, 体系对AsⅢ氧化速率增强。高等植物对As的转化主要表现为还原, 因此无菌浮萍体系对AsⅢ的氧化可能主要由于浮萍的代谢(例如光合作用释放氧气)在一定程度上促进AsⅢ的化学氧化。含有浮萍的3个处理中, 被氧化的AsⅤ不断在溶液中累积。这主要是由于植物主要通过磷吸收蛋白吸收AsⅤ[13], 而培养液中高浓度的磷(1.0 mmol·L-1)抑制浮萍对AsⅤ的吸收。在大田环境中, 由于磷肥的广泛使用, 水生植物吸收AsⅤ受到高浓度磷的抑制, 这就使表层水体中的AsⅢ不断被浮水植物叶面细菌群落氧化为AsⅤ, 并以AsⅤ的形态进行累积。同时, 由于AsⅤ相对于AsⅢ更容易被矿物质吸附, 叶面细菌群落驱动的AsⅢ氧化有利于降低水环境中As的生物有效性[1]。
由于不同培养体系中As形态动态变化的差异, 浮萍对As的总累积量和形态在不同处理间也表现出显著差异。无菌浮萍培养体系中AsⅢ为主要形态, 植物对AsⅢ的吸收主要受Si通道蛋白控制[13]。超纯水配制的培养液中Si浓度低, 对浮萍吸收AsⅢ的抑制作用小, 因而无菌浮萍对AsⅢ的总吸收速率快, 对As的累积浓度高。有菌浮萍体系中, 叶面细菌快速将AsⅢ氧化为AsⅤ, 受溶液中高浓度磷的抑制, AsⅤ进入浮萍的速率慢, 导致As在浮萍中的累积浓度低。本研究中, 有菌浮萍体系中微生物群落累积了非常高比例的As。这些结果表明叶面细菌群落的存在对浮萍累积As具有非常好的阻控作用。同时, 由于叶面细菌的快速氧化, 有菌浮萍培养溶液中AsⅢ长时间处于低浓度状态。这增加浮萍与溶液中AsⅢ的浓度梯度, 导致有菌浮萍中的AsⅢ更容易外排。有菌浮萍相对于无菌浮萍含有更低比例的AsⅢ, 说明水生植物叶面细菌群落对水生植物中As的形态有显著的影响。
添加抗生素抑制浮萍叶面细菌对AsⅢ的氧化, 增加溶液中AsⅢ的比例, 并减少浮萍叶面微生物对As的累积, 这导致浮萍对AsⅢ的吸收增加, 从而使浮萍中AsⅢ的比例和As累积总量也增加。本研究中采用的氯霉素能够抑制细菌蛋白合成[14], 因此有效抑制浮萍叶面细菌群落对AsⅢ的氧化。氯霉素的添加也能够抑制沉积物中微生物群落对AsⅢ的氧化, 但对AsⅤ的还原影响不显著[10]。这说明环境中AsⅢ的氧化更容易受抗生素污染的影响。近年来, 由于抗生素在人类医疗和动物养殖中的大量使用, 水体受抗生素污染的现象普遍[15-16]。抗生素在水体中的污染除了可能增加环境中的抗生素抗性基因外[16], 在污染程度严重的情况下可能也存在增加水生植物对As的总累积量和改变水生植物中As形态比例的风险。这对水生生态系统中As的生物地球化学循环产生不可忽视的影响, 值得进一步研究。
可培养的AsⅢ氧化细菌主要位于浮萍叶面, 但这些细菌在单独培养条件下对AsⅢ的氧化能力并不强。Zhang等[5]从被As污染的水稻土中分离到1株AsⅢ氧化菌株SY(Paracoccus sp.), 其能够在24 h内将1 mmol·L-1 AsⅢ完全氧化为AsⅤ。从浮萍叶面可培养细菌对AsⅢ较弱的氧化能力以及浮萍叶面细菌群落对AsⅢ的快速氧化推测, 浮萍叶面可能存在不可培养的对AsⅢ氧化能力更强的细菌, 同时浮萍叶面细菌群落对AsⅢ的氧化能力也可能由多种细菌协作完成。与浮萍培养试验的结果类似, 氯霉素可显著减少具备As氧化能力的可培养的叶面细菌, 这也证明AsⅢ氧化细菌对氯霉素的敏感性。从浮萍叶面分离到的AsⅢ氧化细菌均属于变形菌。通过对以往的研究调查发现, 从不同生境中分离获得纯培养的大部分AsⅢ氧化细菌也属于变形菌[5, 12]。Xie等[6]研究结果表明, 浮萍叶面细菌群落中变形菌的比例达97%以上。结合本研究中浮萍叶面细菌群落对AsⅢ的快速氧化能力, 稻田环境中浮萍或者其他浮水植物的叶面可能是获取AsⅢ氧化菌株的理想生境, 值得进一步探索。
| [1] |
薛喜枚, 朱永官. 土壤中砷的生物转化及砷与抗生素抗性的关联[J]. 土壤学报, 2019, 56(4): 763-772. Xue X M, Zhu Y G. Arsenic biotransformation in soils and its relationship with antibiotic resistance[J]. Acta Pedologica Sinica, 2019, 56(4): 763-772 (in Chinese with English abstract). |
| [2] |
Jia Y, Huang H, Chen Z, et al. Arsenic uptake by rice is influenced by microbe-mediated arsenic redox changes in the rhizosphere[J]. Environmental Science & Technology, 2014, 48(2): 1001-1007. |
| [3] |
Zhao F J, McGrath S P, Meharg A A. Arsenic as a food chain contaminant:mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61(1): 535-559. DOI:10.1146/annurev-arplant-042809-112152 |
| [4] |
Zhang J, Zhao S, Xu Y, et al. Nitrate stimulates anaerobic microbial arsenite oxidation in paddy soils[J]. Environmental Science & Technology, 2017, 51(8): 4377-4386. |
| [5] |
Zhang J, Zhou W, Liu B, et al. Anaerobic arsenite oxidation by an autotrophic arsenite-oxidizing bacterium from an arsenic-contaminated paddy soil[J]. Environmental Science & Technology, 2015, 49(10): 5956-5964. |
| [6] |
Xie W Y, Su J Q, Zhu Y G. Phyllosphere bacterial community of floating macrophytes in paddy soil environments as revealed by Illumina high-throughput sequencing[J]. Applied and Environmental Microbiology, 2015, 81(2): 522-532. |
| [7] |
Xie W Y, Su J Q, Zhu Y G. Arsenite oxidation by the phyllosphere bacterial community associated with Wolffia australiana[J]. Environmental Science & Technology, 2014, 48(16): 9668-9674. |
| [8] |
Silva V, Igrejas G, Poeta P. Antibiotics pollution in the paddy soil environment[M]//Soil Biology. Cham: Springer International Publishing, 2018: 85-97.
|
| [9] |
Sun J, Zeng Q, Tsang D C W, et al. Antibiotics in the agricultural soils from the Yangtze River Delta, China[J]. Chemosphere, 2017, 189: 301-308. DOI:10.1016/j.chemosphere.2017.09.040 |
| [10] |
Zhou G W, Yang X R, Su J Q, et al. Bacillus ferrooxidans sp. nov., an iron(Ⅱ)-oxidizing bacterium isolated from paddy soil[J]. Journal of Microbiology, 2018, 56(7): 472-477. DOI:10.1007/s12275-018-7543-3 |
| [11] |
Yamamura S, Watanabe K, Suda W, et al. Effect of antibiotics on redox transformations of arsenic and diversity of arsenite-oxidizing bacteria in sediment microbial communities[J]. Environmental Science & Technology, 2014, 48(1): 350-357. |
| [12] |
Zhu Y G, Yoshinaga M, Zhao F J, et al. Earth abides arsenic biotransformations[J]. Annual Review of Earth and Planetary Sciences, 2014, 42(1): 443-467. DOI:10.1146/annurev-earth-060313-054942 |
| [13] |
Zhao F J, Ma J F, Meharg A A, et al. Arsenic uptake and metabolism in plants[J]. New Phytologist, 2009, 181(4): 777-794. DOI:10.1111/j.1469-8137.2008.02716.x |
| [14] |
Schwarz S, Kehrenberg C, Doublet B, et al. Molecular basis of bacterial resistance to chloramphenicol and florfenicol[J]. FEMS Microbiology Reviews, 2004, 28(5): 519-542. DOI:10.1016/j.femsre.2004.04.001 |
| [15] |
Xie W Y, Shen Q, Zhao F J. Antibiotics and antibiotic-resistance from animal manures to soil:a review[J]. European Journal of Soil Science, 2018, 69: 181-195. DOI:10.1111/ejss.12494 |
| [16] |
Qiao M, Ying G G, Singer A C, et al. Review of antibiotic resistance in China and its environment[J]. Environment International, 2018, 110: 160-172. DOI:10.1016/j.envint.2017.10.016 |




