文章信息
- 贾雯茹, 赵紫迎, 左小霞, 金鹏, 金文渊, 郑永华
- JIA Wenru, ZHAO Ziying, ZUO Xiaoxia, JIN Peng, JIN Wenyuan, ZHENG Yonghua
- 高湿贮藏减轻黄瓜果实冷害的效果研究
- Effects of high relative humidity storage on alleviating chilling injury of cucumber fruit
- 南京农业大学学报, 2020, 43(3): 529-536
- Journal of Nanjing Agricultural University, 2020, 43(3): 529-536.
- http://dx.doi.org/10.7685/jnau.201907062
-
文章历史
- 收稿日期: 2019-07-29
2. 苏州大福外贸食品有限公司, 江苏 苏州 215000
2. Suzhou Dafu Foreign Trade Food Co., Ltd., Suzhou 215000, China
黄瓜(Cucumis sativus L.)果实富含膳食纤维和矿物质等营养物质, 肉质清脆可口, 既可直接生食也可用作烹饪食材, 是一种深受大众喜爱的蔬菜。但黄瓜果实水分含量高, 生理代谢旺盛, 且外皮较薄, 采后在常温贮藏过程中易发生衰老黄化和失水萎焉, 从而引起感官的品质下降。低温可有效降低黄瓜果实的代谢活性和失水萎焉, 但黄瓜果实在温度低于7~10 ℃贮藏时会发生冷害, 出现表皮凹陷和霉变腐烂等冷害症状, 严重降低黄瓜的外观及食用品质[1], 从而限制了低温在黄瓜采后贮藏保鲜和流通中的应用。因此, 如何减轻果实冷害的发生, 是黄瓜采后冷链流通过程中急需解决的问题。
湿度是影响果蔬贮藏的重要环境因素, 对果蔬采后生理和品质可产生广泛的影响[2-3]。Reichel等[4]研究发现, 贮藏环境较高的相对湿度(relative humidity, RH)能更好保持荔枝果皮色泽, 延缓褐变; 朱丹实等[5]研究发现, 与RH 50%条件相比, 在RH 90%条件下贮藏的葡萄果实水分含量较高, 果实的质地较硬。由于新鲜果蔬的含水量高(一般在85%~95%), 采后在低湿环境中贮藏时易发生蒸腾失水而造成果蔬的失重和失鲜, 当失水量大于5%时, 就会表现出明显的萎蔫皱缩, 从而降低商品性。因此, 保持高湿的贮藏环境是新鲜果蔬保鲜的关键, 一般果蔬贮藏环境的RH要控制在85%~95%[6]。然而, 普通冷库的RH常达不到果蔬保鲜的要求, 采用传统的塑料薄膜包装虽有增湿效果但会产生白色污染等问题, 而超声波加湿、高压喷雾加湿由于水雾颗粒较大, 在低温环境中极易造成结露凝水, 湿度控制的精度低, 同时容易滋长病菌在果蔬上的生长而增加腐烂的发生[7-8]。以色列HygroTech公司发明的干雾控湿系统通过雾化器向贮藏库中喷发极其微细(2~10 μm)的水粒子, 能快速分散融入到空气中实现湿热交换, 可提供95%~98%精确均匀的高RH而不会出现结露凝水。采用这种干雾控湿冷库贮藏可有效抑制番木瓜、番石榴、广东菜心和奶白菜等果蔬的失水萎焉, 保持其新鲜度, 贮藏期可延长1倍以上[9], 因此在果蔬采后保鲜中具有较好的应用前景。有关干雾控湿高湿贮藏对冷敏果蔬保鲜的效果尚未见报道。本文以典型的冷敏性水果黄瓜为试材, 研究干雾控湿高湿冷库和普通冷库贮藏对黄瓜果实冷藏期间冷害指数、主要品质指标和抗氧化系统变化的影响, 以探索高湿贮藏对减轻黄瓜果实冷害的作用, 并从活性氧代谢的角度阐明其作用机制, 为高湿贮藏在黄瓜果实冷链物流保鲜中的应用提供依据。
1 材料与方法 1.1 材料与试剂供试的水果黄瓜品种‘托尼102’购自南京众彩农产品物流市场。挑选瓜条饱满、顺直、粗细均匀、无机械伤、带1 cm果柄的黄瓜果实备用。
氮蓝四唑、核黄素、L-蛋氨酸、邻菲啰啉购自上海瑞永生物科技有限公司; 抗坏血酸、硫代巴比妥酸、乙二胺四乙酸购自南京杰汶达试剂器材有限公司; 乙二胺四乙酸二钠、对氨基苯磺酸、α-萘胺、四氯化钛、愈创木酚、水杨酸购自国药集团化学试剂有限公司; 三氯乙酸、盐酸羟胺购自上海凌峰化学试剂有限公司; 1, 1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl, DPPH)购自美国Sigma公司; 其他试剂均为国产分析纯。
1.2 仪器与设备Hygrote湿度控制系统(配有电脑控制终端、湿度调节感应系统和干雾喷雾器)购于以色列HygroTech公司; RS-YS-W-A型GSP无线温湿度测点、RSWS-ETH-6型以太网温湿度记录仪购于山东仁科测控技术有限公司; DDS-11A电导仪购于上海第二分析仪器厂; UV-6000型分光光度计购于上海元析仪器有限公司; HH-6型数显恒温水浴锅购于国华电器有限公司; HZ-9211KB型恒温振荡器购于太仓市科教器材厂。
1.3 处理方法将挑选好的黄瓜果实随机分为2组(每组300个果实, 每个重复100个果实, 分3次重复处理), 分装于底层铺有透气性泡沫垫的塑料转运筐(长、宽、高为720、515、390 mm)中, 每组12筐, 每筐25个果实, 分别置于干雾控湿冷库(温度4 ℃, RH 95%~98%)和普通冷库(温度4 ℃, RH 70%~75%)中贮藏15 d, 每隔3 d取样用于果实冷害指数和其他指标的测定。
1.4 测定指标及方法 1.4.1 冷害指数和失重率的测定冷害指数测定采用Liu等[10]的方法并稍作修改。将黄瓜果实先置于(20±1)℃货架贮藏2 d, 然后将黄瓜果实按冷害程度分为0~4级:0级, 无冷害症状; 1级, 冷害面积为0%~ 25%;2级, 冷害面积为25%~50%;3级, 冷害面积为50%~75%;4级, 冷害面积大于75%。

|
失重率:将3筐黄瓜果实存放在冷库固定位置, 贮藏前和贮藏期间每隔3 d称量1次, 用于测定失重的果实, 记录初始质量为m0, 贮藏期间每次称量质量为m1。失重率=(m0-m1)/m0×100%。
1.4.2 电导率和丙二醛含量的测定电导率测定参照Song等[11]的方法并稍作修改。取10个黄瓜果实, 用6 mm打孔器取每个果实中间部位的果皮小圆片1片, 共10片, 放入25 mL具塞刻度试管中, 加入20 mL蒸馏水, 振荡并测定电导度C0, 静置30 min后测电导度C1, 然后将试管煮沸15 min冷却后测电导度C2。电导率=(C1-C0)/(C2-C0)×100%。
丙二醛(MDA)含量测定参照Dong等[12]的方法。分别测定反应液在600、532、450 nm波长处的吸光值, 结果以nmol · g-1表示(以鲜质量计, 下同)。
1.4.3 叶绿素和抗坏血酸含量测定叶绿素含量测定参照曹建康等[13]的方法。利用分光光度法测定果皮提取液在663和645 nm波长处的吸光值, 结果以mg · g-1表示。
抗坏血酸(AsA)含量测定参照Arakawa等[14]的方法。采用邻菲啰啉法测定反应液在534 nm波长处的吸光值, 结果以mg · 100 g-1表示。
1.4.4 抗氧化酶活性的测定超氧化物歧化酶(SOD)活性测定参照Han等[15]的方法并稍作修改。取2 g黄瓜果肉, 加入5 mL 100 mmol · L-1磷酸钠缓冲液(pH7.8), 冰浴研磨成匀浆后转入10 mL离心管中, 于4 ℃、12 000 g条件下离心20 min, 所得上清液即为备用酶液。反应体系包括:50 mmol · L-1磷酸钠缓冲液1.77 mL, 130 mmol · L-1 L-蛋氨酸0.3 mL, 750 μmol · L-1氮蓝四唑0.3 mL, 100 μmol · L-1乙二胺四乙酸二钠0.3 mL, 20 μmol · L-1核黄素0.3 mL, 酶液30 μL。混匀后置于4 000 lx日光灯下反应15 min后取出置于暗处终止反应, 测定560 nm波长处的吸光值。以每分钟反应体系对NBT光化还原的抑制为50%时所需的酶量为1个活性单位(U), 结果以U · mg-1表示。
过氧化氢酶(CAT)活性测定参照Jia等[16]的方法并作部分修改。取2 g黄瓜果肉, 将SOD酶液制备方法中的磷酸钠缓冲液pH值调为7.0, 其余步骤一致。反应体系包括:50 mmol · L-1磷酸钠缓冲液2.6 mL, 0.75%(体积分数)H2O2 0.2 mL, 酶液0.2 mL。以每分钟反应体系在240 nm波长处吸光值减少0.01所需的酶量为1个CAT单位(U), 结果以U · mg-1表示。
抗坏血酸过氧化物酶(APX)活性测定参照Nakano等[17]的方法。酶液制备方式与CAT相同。反应体系为:50 mmol · L-1磷酸钠缓冲液2.65 mL, 9 mmol · L-1抗坏血酸0.1 mL, 酶液0.15 mL, 3%(体积分数)H2O2 0.1 mL。以每分钟反应体系在290 nm波长处吸光值减少0.01所需的酶量为1个APX单位(U), 结果以U · mg-1表示。
过氧化物酶(POD)活性测定参照Liu等[18]的方法并稍作修改。反应体系为:25 mmol · L-1愈创木酚3 mL, 酶液0.5 mL, 0.85%(体积分数)H2O2 0.2 mL。以每分钟反应体系在470 nm波长处吸光值减少0.01所需的酶量为1个POD单位(U), 结果以U · mg-1表示。
蛋白含量测定采用Bradford[19]的方法, 以牛血清白蛋白为标准。
1.4.5 超氧阴离子(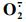
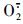
H2O2含量测定参照Patterson等[21]的方法并稍作修改。用冷丙酮作为提取液, 将1 mL酶液与200 g · L-1四氯化钛-盐酸溶液混合反应1 h后加浓氨水沉淀, 然后用冷丙酮反复洗脱2~3次后离心, 留淡黄色沉淀, 加3 mL硫酸溶解沉淀并测定410 nm波长处的吸光值, 结果以μmol · g-1表示。
1.4.6 DPPH自由基清除力与羟自由基清除力的测定DPPH自由基清除力测定采用Oliveira等[22]的方法。测定反应液在525 nm波长处的吸光值, 结果以清除百分率来表示。
羟自由基清除力测定采用Wang等[23]的方法。测定反应液在510 nm波长处的吸光值, 结果以清除百分率表示。
1.5 数据分析上述指标均取3个平行样, 进行3次重复测定。采用Excel 2016和SAS V8.1软件进行数据处理分析, 用Origin 8.6软件绘图, 采用Duncan ’ s多重比较方法进行数据的差异显著性分析(P<0.05)。
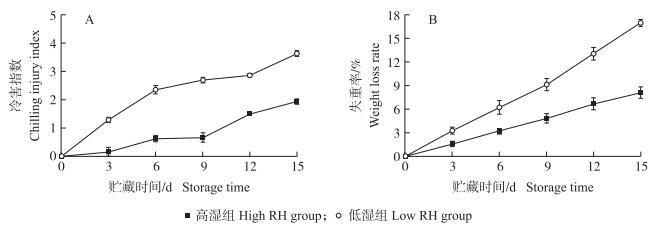
2 结果与分析 2.1 高湿贮藏对黄瓜果实冷害指数和失重率的影响如图 1-A所示:低湿组黄瓜果实贮藏3 d即出现果皮凹陷和霉变腐烂等冷害症状, 冷害指数达到1.3, 且在冷藏期间果实冷害指数快速增长; 而高湿组果实在贮藏3 d时没有出现明显的冷害症状, 并在整个冷藏期间果实冷害指数增加缓慢。贮藏15 d时, 低湿组黄瓜果实的冷害指数为高湿组的1.88倍(P<0.05), 说明高湿贮藏可显著抑制黄瓜果实冷害的发生。与果实冷害指数的变化相似, 低湿组黄瓜果实的失重率在冷藏期间迅速上升, 贮藏15 d时失重率达到16.98%;而高湿组果实的失重率在冷藏期间缓慢上升, 贮藏15 d的失重率仅为8.14%, 显著低于高湿组果实(图 1-B), 说明高湿贮藏可有效抑制黄瓜果实采后水分的损失, 从而保持果实的新鲜度。
|
图 1 高湿贮藏对黄瓜果实冷害指数(A)和失重率(B)的影响 Fig. 1 Effects of high relative humidity(RH)storage on chilling injury index(A) and weight loss rate(B)of cucumber fruits |
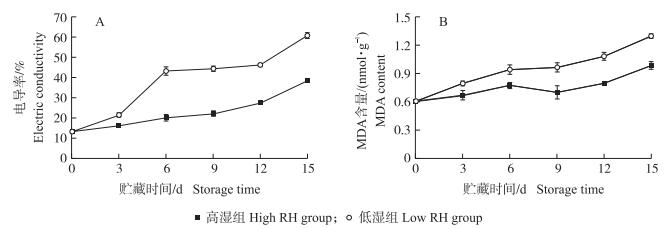
由图 2-A可知:在整个冷藏期间, 高湿组黄瓜果实的电导率始终保持平缓上升状态; 而低湿组黄瓜的电导率在贮藏期上升幅度较大, 在贮藏15 d时, 低湿组黄瓜电导率为高湿组的1.59倍, 显著高于高湿组。由图 2-B可知:2组黄瓜果实的MDA含量在贮藏期间均呈上升趋势, 高湿贮藏显著抑制了黄瓜MDA含量的积累, 自贮藏6 d开始, 2组黄瓜果实的MDA含量差异逐渐变大, 至贮藏末期, 低湿组的含量比高湿组增加30%。这些结果表明, 高湿贮藏可有效抑制黄瓜果实细胞膜脂的过氧化作用, 维持细胞膜结构的完整性, 从而减轻果实冷害的发生。
|
图 2 高湿贮藏对黄瓜果实电导率(A)和MDA含量(B)的影响 Fig. 2 Effects of high relative humidity storage on electric conductivity(A) and MDA content(B)of cucumber fruits |
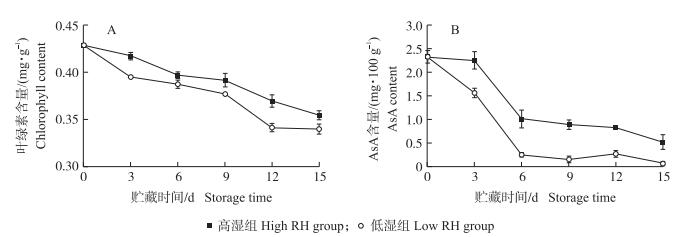
如图 3-A所示:黄瓜果实的叶绿素含量在整个冷藏期间不断下降, 但高湿组的下降幅度显著低于低湿组。贮藏3和12 d时, 高湿组黄瓜果实的叶绿素含量分别为低湿组的1.05倍和1.09倍, 说明高湿贮藏有效延缓叶绿素的分解, 较好保持了黄瓜果实的绿色色泽。如图 3-B所示:低湿组黄瓜果实的AsA含量在贮藏前6 d迅速下降至很低水平, 随后保持平稳变化; 高湿贮藏可抑制AsA含量的下降, 在整个贮藏期间高湿组果实的抗坏血酸含量都显著高于低湿组。表明高湿贮藏可较好保持黄瓜果实的感官和营养品质。
|
图 3 高湿贮藏对黄瓜果实叶绿素(A)和AsA含量(B)的影响 Fig. 3 Effects of high relative humidity storage on chlorophyll(A) and AsA(B)contents of cucumber fruits |
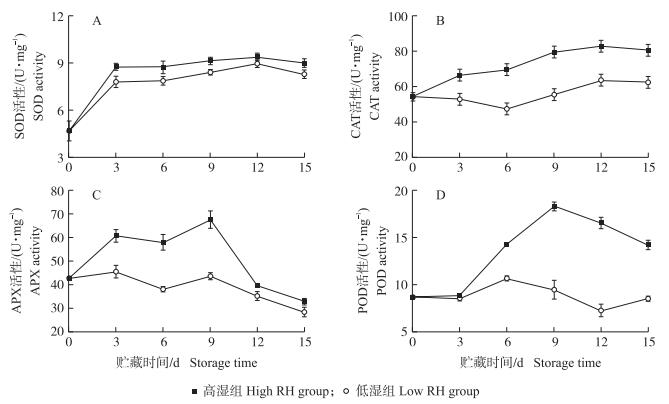
如图 4-A、B所示:在整个冷藏期间, 黄瓜果实的SOD和CAT活性均呈平稳上升趋势。在贮藏前9 d, 高湿组黄瓜的SOD活性显著高于低湿组, 而高湿组果实的CAT活性在整个冷藏期间都显著高于低湿组。如图 4-C所示:高湿组黄瓜果实的APX活性先升后降, 在贮藏9 d时达到最大值67.67 U · mg-1, 随后呈下降趋势; 而低湿组黄瓜的APX活性在整个冷藏期间变化幅度较小且始终显著低于高湿组。由图 4-D可知:高湿组黄瓜的POD活性在冷藏期呈先上升后下降趋势, 于9 d时达到峰值18.33 U · mg-1; 而低湿组黄瓜POD活性总体呈平稳下降状态; 除贮藏3 d外, 高湿组黄瓜的POD活性都显著高于低湿组。表明高湿贮藏可维持黄瓜果实较高的抗氧化酶活性。
|
图 4 高湿贮藏对黄瓜果实SOD(A)、CAT(B)、APX(C)和POD(D)活性的影响 Fig. 4 Effects of high relative humidity storage on SOD(A), CAT(B), APX(C) and POD(D)activities of cucumber fruits |
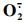
由图 5-A可知:2组黄瓜果实中的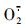
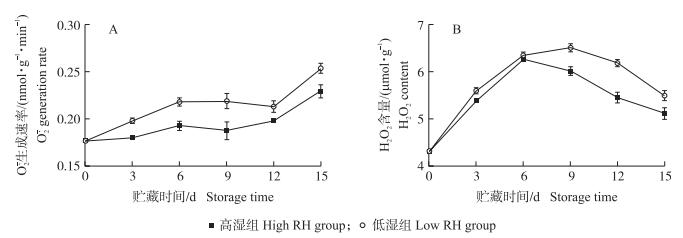
|
图 5 高湿贮藏对黄瓜果实  |
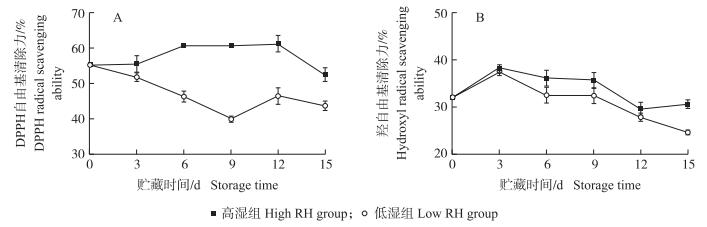
如图 6-A所示:高湿组黄瓜果实的DPPH自由基清除力基本保持平稳状态, 于贮藏12 d时达到最高值61.48%, 随后呈下降趋势; 而低湿组黄瓜果实的DPPH自由基清除力则呈先下降后上升趋势, 并且在整个冷藏期始终显著低于高湿组。由图 6-B可知:2组黄瓜果实的羟自由基清除力均呈先升后降的变化趋势, 贮藏3 d后, 高湿组黄瓜果实的羟自由基清除力均显著高于低湿组。表明高湿贮藏可保持黄瓜果实较高的自由基清除力。
|
图 6 高湿贮藏对黄瓜果实1, 1-苯基-2-三硝基苯肼(DPPH)自由基(A)和羟自由基(B)清除力的影响 Fig. 6 Effects of high relative humidity storage on 1, 1-diphenyl-2-picrylhydrazyl(DPPH)radical(A) and hydroxyl radical(B)scavenging ability of cucumber fruits |
温度和湿度是影响新鲜果蔬贮藏的主要环境因子, 与果蔬采后生理和病理变化密切相关, 控制低温高湿的贮藏环境是果蔬保鲜的关键[6], 然而, 许多热带、亚热带果蔬在温度低于10~12 ℃贮藏时会发生冷害而失去商品性, 从而限制冷链技术在这些果蔬保鲜中的应用。因此, 如何控制冷害的发生是冷敏果蔬采后低温流通中迫切需要解决的技术问题[24]。本试验结果表明, 采用干雾控湿高湿冷库贮藏能够显著抑制黄瓜果实采后失水和冷害的发生, 同时延缓叶绿素和抗坏血酸含量的下降, 从而较好保持果实品质。由于干雾控湿技术不仅可以解决目前普通冷库湿度偏低导致果蔬失水萎焉、增湿处理易凝露积水而增加腐烂发生等问题[9], 同时与塑料薄膜包装[8]等保湿保鲜手段和水杨酸及茉莉酸甲酯[24]等化学处理冷害控制技术相比, 具有绿色、环保等优点, 因而在黄瓜等冷敏果蔬采后保鲜中具有较好的应用前景。
氧化胁迫是一种常见的次生胁迫, 植物体遭受冷害时也会导致氧化胁迫。果蔬在遭受低温胁迫后, 活性氧(ROS)产生和清除的平衡体系遭到破坏, 积累过多的ROS会袭击生物大分子和膜系统, 膜脂肪酸发生过氧化反应, 破坏生物膜结构和功能, 最终诱发冷害症状的出现[25]。SOD、CAT、APX和POD是清除ROS的主要抗氧化酶[26]。SOD负责将
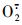
综上所述, 干雾控湿高湿贮藏能够显著抑制黄瓜果实冷害指数和失重率的升高, 减少水分、叶绿素和抗坏血酸等营养物质的损失, 从而较好维持黄瓜果实在低温冷藏期间的品质。同时, 高湿贮藏还可显著提高SOD、CAT、APX和POD等抗氧化酶的活性以及DPPH自由基和羟自由基的清除力, 从而维持ROS代谢平衡, 减少ROS对细胞膜的损害, 减轻果实冷害的发生, 因而在黄瓜保鲜中具有较好的应用前景。
| [1] |
Yang H, Wu F, Cheng J. Reduced chilling injury in cucumber by nitric oxide and the antioxidant response[J]. Food Chemistry, 2011, 127(3): 1237-1242. DOI:10.1016/j.foodchem.2011.02.011 |
| [2] |
薛彦斌, 久保康隆, 稻叶昭次, 等. 采后湿度环境与果蔬生理生化反应[J]. 北方园艺, 2000(1): 25-26. Xue Y B, Yasutaka K, Akitsugu I, et al. Postharvest humidity environment and physiological and biochemical reaction of fruits and vegetables[J]. Northern Horticulture, 2000(1): 25-26 (in Chinese). DOI:10.3969/j.issn.1001-0009.2000.01.022 |
| [3] |
王阳, 王志华, 王文辉, 等. 不同温湿度对樱桃果实采后衰老及抗氧化酶活性的影响[J]. 保鲜与加工, 2018, 18(4): 1-6, 11. Wang Y, Wang Z H, Wang W H, et al. Effects of different temperatures and humidities on postharvest senescence and activity of antioxidant enzymes of cherry fruit[J]. Storage and Process, 2018, 18(4): 1-6, 11 (in Chinese with English abstract). |
| [4] |
Reichel M, Wellhöfer J, Triani R, et al. Postharvest control of litchi(Litchi chinensis Sonn.)pericarp browning by cold storage at high relative humidity after enzyme-inhibiting treatments[J]. Postharvest Biology and Technology, 2017, 125(3): 77-90. |
| [5] |
朱丹实, 张巧曼, 曹雪慧, 等. 湿度条件对巨峰葡萄贮藏过程中水分及质构变化的影响[J]. 食品科学, 2014, 35(22): 340-345. Zhu D S, Zhang Q M, Cao X H, et al. Effect of relative humidity on the changes in water and texture of Kyoho grape during storage[J]. Food Science, 2014, 35(22): 340-345 (in Chinese with English abstract). DOI:10.7506/spkx1002-6630-201422066 |
| [6] |
Paull R E. Effect of temperature and relative humidity on fresh commodity quality[J]. Postharvest Biology and Technology, 1999, 15(3): 263-277. DOI:10.1016/S0925-5214(98)00090-8 |
| [7] |
Brown T, Corry J E L, James S J. Humidification of chilled fruit and vegetables on retail display using an ultrasonic fogging system with water/air ozonation[J]. International Journal of Refrigeration, 2004, 27(8): 862-868. DOI:10.1016/j.ijrefrig.2004.04.009 |
| [8] |
方思贞, 吕恩利, 陆华忠, 等. 果蔬贮藏加湿技术研究现状与发展趋势[J]. 广东农业科学, 2014, 41(18): 70-73, 78. Fang S Z, Lü E L, Lu H Z, et al. Research status and development trends of humidifying technology on storage of fruits and vegetables[J]. Guangdong Agricultural Sciences, 2014, 41(18): 70-73, 78 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-874X.2014.18.018 |
| [9] |
孟祥春, 黄泽鹏, 毕方铖, 等. 干雾湿度控制系统的组建及果蔬贮藏保鲜应用试验[J]. 农业工程学报, 2016, 32(11): 271-276. Meng X C, Huang Z P, Bi F C, et al. Dry-fog controlled humidity system and its application in fruit & vegetable storage[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(11): 271-276 (in Chinese with English abstract). DOI:10.11975/j.issn.1002-6819.2016.11.038 |
| [10] |
Liu Y F, Yang X X, Zhu S J, et al. Postharvest application of MeJA and NO reduced chilling injury in cucumber(Cucumis sativus)through inhibition of H2O2 accumulation[J]. Postharvest Biology and Technology, 2016, 119(9): 77-83. |
| [11] |
Song L L, Ding W, Zhao M G, et al. Nitric oxide protects against oxidative stress under heat stress in the calluses from two ecotypes of reed[J]. Plant Science, 2006, 171(2): 449-458. |
| [12] |
Dong J F, Yu Q, Lu L, et al. Effect of yeast saccharide treatment on nitric oxide accumulation and chilling injury in cucumber fruit during cold storage[J]. Postharvest Biology and Technology, 2012, 68(6): 1-7. |
| [13] |
曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2011: 57-59. Cao J K, Jiang W B, Zhao Y M. Experimental Guidance on Postharvest Physiology and Biochemistry of Fruits and Vegetables[M]. Beijing: China Light Industry Press, 2011: 57-59 (in Chinese). |
| [14] |
Arakawa N, Tsutsumi K, Sanceda N G, et al. A rapid and sensitive method for the determination of ascorbic acid using 4, 7-diphenyl-1, 10-phenanthroline[J]. Journal of the Agricultural Chemical Society of Japan, 1981, 45(5): 1289-1290. |
| [15] |
Han C, Li J, Jin P, et al. The effect of temperature on phenolic content in wounded carrots[J]. Food Chemistry, 2017, 215(2): 116-123. |
| [16] |
Jia B, Zheng Q, Zuo J H, et al. Application of postharvest putrescine treatment to maintain the quality and increase the activity of antioxidative enzyme of cucumber[J]. Scientia Horticulturae, 2018, 239(13): 210-215. |
| [17] |
Nakano Y, Asada K. Hydrogen peroxide scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology, 1981, 22(5): 867-880. |
| [18] |
Liu J, Tian S, Meng X, et al. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit[J]. Postharvest Biology and Technology, 2007, 44(3): 300-306. DOI:10.1016/j.postharvbio.2006.12.019 |
| [19] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. |
| [20] |
Cao S F, Zheng Y H, Wang K T, et al. Methyl jasmonate reduces chilling injury and enhances antioxidant enzyme activity in postharvest loquat fruit[J]. Food Chemistry, 2009, 115(4): 1458-1463. |
| [21] |
Patterson B D, Macrae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(Ⅳ)[J]. Analytical Biochemistry, 1984, 139(2): 487-492. |
| [22] |
Oliveira I, Sousa A, Ferreira I C F R, et al. Total phenols, antioxidant potential and antimicrobial activity of walnut(Juglans regia L.)green husks[J]. Food and Chemical Toxicology[J]. Food and Chemical Toxicology, 2008, 46(7): 2326-2331. DOI:10.1016/j.fct.2008.03.017 |
| [23] |
Wang K T, Jin P, Cao S H, et al. Methyl jasmonate reduces decay and enhances antioxidant capacity in Chinese bayberries[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5809-5815. DOI:10.1021/jf900914a |
| [24] |
金鹏, 王静, 朱虹, 等. 果蔬采后冷害控制技术及机制研究进展[J]. 南京农业大学学报, 2012, 35(5): 167-174. Jin P, Wang J, Zhu H, et al. Progress on techniques and mechanisms in alleviating chilling injury of postharvest fruits and vegetables[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 167-174 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2012.05.018 |
| [25] |
Imahori Y, Bai J, Baldwin E. Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J]. Scientia Horticulturae, 2016, 198(1): 398-406. |
| [26] |
Li H, Fan Y W, Zhi H, et al. Influence of fruit stalk on reactive oxygen species metabolism and quality maintenance of peach fruit under chilling injury condition[J]. Postharvest Biology and Technology, 2019, 148(2): 141-150. |
| [27] |
Sala J M. Involvement of oxidative stress in chilling injury in cold-stored mandarin fruits[J]. Postharvest Biology and Technology, 1998, 13(3): 255-261. DOI:10.1016/S0925-5214(98)00011-8 |
| [28] |
Yao W S, Xu T T, Farooq S U, et al. Glycine betaine treatment alleviates chilling injury in zucchini fruit(Cucurbita pepo L.)by modulating antioxidant enzymes and membrane fatty acid metabolism[J]. Postharvest Biology and Technology, 2018, 144(10): 20-28. |
| [29] |
Babalar M, Pirzad F, Sarcheshmeh M A A, et al. Arginine treatment attenuates chilling injury of pomegranate fruit during cold storage by enhancing antioxidant system activity[J]. Postharvest Biology and Technology, 2018, 137(3): 31-37. |
| [30] |
Ali S, Nawaz A, Ejaz S, et al. Effects of hydrogen sulfide on postharvest physiology of fruits and vegetables:an overview[J]. Scientia Horticulturae, 2019, 243(1): 290-299. |
| [31] |
Jin P, Zhu H, Wang L, et al. Oxalic acid alleviates chilling injury in peach fruit by regulating energy metabolism and fatty acid contents[J]. Food Chemistry, 2014, 161(19): 87-93. |
| [32] |
Liu H, Jiang W B, Cao J K, et al. A combination of 1-methylcyclopropene treatment and intermittent warming alleviates chilling injury and affects phenolics and antioxidant activity of peach fruit during storage[J]. Scientia Horticulturae, 2018, 229(3): 175-181. |




