文章信息
- 李宗凯, 陆扬, 刘家俊, 王晋, 苏勇
- LI Zongkai, LU Yang, LIU Jiajun, WANG Jin, SU Yong
- 益生菌对生长育肥猪生长性能、肉品质和结肠菌群的影响
- Effects of probiotics on the growth performance, meat quality and colonic microflora of growing and finishing pigs
- 南京农业大学学报, 2020, 43(3): 523-528
- Journal of Nanjing Agricultural University, 2020, 43(3): 523-528.
- http://dx.doi.org/10.7685/jnau.201906052
-
文章历史
- 收稿日期: 2019-06-25
2. 上海市农业科学院畜牧兽医研究所, 上海 201106
2. Institute of Animal Husbandry and Veterinary Medicine, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China
益生菌制剂是一类用有益菌制成的微生物制剂, 主要包括两大类益生菌, 一类是芽胞杆菌类(如地衣芽胞杆菌和枯草芽胞杆菌), 另一类是乳酸杆菌类(如双歧杆菌、乳酸乳杆菌和嗜酸乳杆菌)。益生菌制剂通过调节畜禽肠道菌群平衡, 抑制有害菌数目, 从而增强畜禽机体免疫力, 促进动物健康和提高生产性能。益生菌制剂作为饲用抗生素的潜在替代品, 在猪方面的应用研究已有报道[1]。目前, 这些研究主要集中在断奶仔猪的应用方面, 而益生菌在生长育肥猪(30 kg至出栏阶段)上的应用研究较少。益生菌制剂不仅对畜禽的生产性能有促进作用, 还可以改善猪肉品质[2]。但是, 在调控猪肉品质方面, 不同的研究报道结果存在差异, 这可能与不同研究所用菌株种类以及益生菌在饲料中的活菌数有关。目前, 关于益生菌在饲料中的存活情况未见报道。
因此, 本文拟研究益生菌制剂对生长育肥猪生长性能、肉品质及肠道菌群组成的影响, 并且分析饲料中益生菌存活率情况, 探讨益生菌制剂在生长育肥猪方面应用的前景, 旨在为优质安全猪肉的生产提供科学依据。
1 材料与方法 1.1 试验动物及分组本试验选取32 kg左右的杜×长×大三元生长猪48头, 随机分成2组, 每组6个重复(栏), 每个重复4头猪, 公、母各半。对照组饲喂基础日粮(表 1), 日粮配方参照NRC(2012)标准。益生菌组在基础日粮中添加质量分数为0.05%的益生菌制剂。益生菌制剂由得荣生物科技股份有限公司提供, 主要成分为复合乳酸杆菌和枯草芽胞杆菌, 所含活菌数均高于1×1010 CFU · g-1。试验期间, 猪自由采食和饮水, 按照猪场的常规饲养方法进行管理。
| 原料组成 Ingredient composition |
生长期3) Growth period |
育肥期3) Finishing period |
营养成分 Nutritional compositions |
生长期 Growth period |
育肥期 Finishing period | |
| 玉米 Corn | 70.0 | 80.0 | 消化能 Digestive energy2) | 14.60 | 14.20 | |
| 豆粕 Soybean meal | 18.0 | 16.83 | 粗蛋白质 Crude protein | 16.00 | 14.00 | |
| 麦麸 Wheat bran | 6.50 | 0.00 | 赖氨酸 Lysine | 1.23 | 0.73 | |
| 大豆油 Soybean oil | 1.90 | 0.30 | 蛋氨酸/胱氨酸 Methionine/cystine | 0.70 | 0.42 | |
| 赖氨酸 Lysine | 0.69 | 0.22 | 苏氨酸 Threonine | 0.79 | 0.47 | |
| 蛋氨酸 Methionine | 0.24 | 0.00 | 色氨酸 Tryptophan | 0.22 | 0.13 | |
| 苏氨酸 Threonine | 0.30 | 0.05 | 必需氨基酸/非必需氨基酸 | 0.42 | 0.27 | |
| 色氨酸 Tryptophan | 0.07 | 0.00 | Essential amino acid/nonessential amino acid | |||
| 磷酸氢钙 Calcium hydrogen phosphate | 0.45 | 0.65 | ||||
| 石粉 Stone powder | 0.50 | 0.50 | ||||
| 食盐 Salt | 0.30 | 0.30 | ||||
| 多种维生素和矿物质 Multivitamins and minerals1) | 0.23 | 0.23 | ||||
| 氯化胆碱 Choline chloride(50%) | 0.12 | 0.12 | ||||
| 沸石粉 Zeolite powder | 0.60 | 0.70 | ||||
| 抗氧化剂和防霉剂 | 0.10 | 0.10 | ||||
| Antioxidant and antifungal agent | ||||||
| 合计 Total | 100.0 | 100.0 | ||||
| 注: 1)每千克饲料提供多种维生素和矿物质含量如下The multivitamins and minerals supply per kg diet as follows:VA 11 000 IU, VD3 1 000 IU, VE 16 IU, VK1 1 mg, VB1 0.6 mg, VB2 0.6 mg, VB5 6 mg, VB3 10 mg, VB12 0.03 mg, VB9 0.8 mg, VB6 1.5 mg, Fe 165 mg, Zn 165 mg, Cu 16.5 mg, Mn 30 mg, Co 0.15 mg, I 0.25 mg, Se 0.25 mg. 2)消化能单位是MJ · kg-1. The unit of digestive energy is MJ · kg-1. 3)生长期85~105日龄, 育肥期105~162日龄Growth period 85-105 days of age, finishing period 105-162 days of age. | ||||||
分别在存储的0、15、30和45 d, 采集益生菌组全价饲料, 用于益生菌活菌计数。试验猪体质量达115 kg左右, 每个重复随机屠宰1头公猪, 进行胴体品质和肉品质测定。收集结肠食糜, -28 ℃保存, 用于菌群分析。
1.2.2 饲料中益生菌存活率用平板计数法对饲料中的芽胞杆菌和乳酸杆菌进行活菌计数:用无菌生理盐水将饲料样品稀释到一定倍数后, 分别均匀涂布芽胞杆菌培养基和MRS培养基, 37 ℃倒置培养24 h后, 分别计算每克样品中芽胞杆菌和乳酸杆菌活菌数[3-4]。
1.2.3 生长性能试验过程中记录生长期、育肥前期和育肥后期2组猪的采食量及猪体质量, 计算平均日增重、平均日采食量和饲料转化效率(平均日采食量/平均日增重)。
1.2.4 胴体性状和肉品质按照农业行业标准《瘦肉型猪胴体性状测定技术规范:NY/T 825—2004》及《猪肌肉品质测定技术规范:NY/T 821—2004》进行胴体品质和肉品质的测定。测定宰前质量、胴体质量及心脏、肝脏、脾脏、胰腺、肾脏和各肠段质量, 计算屠宰率和器官指数; 在肩部最厚处、胸腰结合处、荐部、第6~7肋处的背標厚度; 屠宰后取第10肋处背最长肌测定其pH值、肉色、大理石花纹、剪切力、滴水损失、含水量及肌肉脂肪含量。
1.3 菌群分析 1.3.1 DNA提取将结肠食糜称样, 参考Dai等[5]的方法, 首先用珠磨法将细菌细胞壁破碎, 再加入酚-氯仿-异戊醇提取食糜中的DNA。提取后的DNA用Nano-Drop 2100核酸蛋白检测仪测定DNA浓度以及D260/D280, 以保证提取质量, 存放于-20 ℃以便后续检测。
1.3.2 PCR扩增参考Sun等[6]的方法, 选取细菌通用引物515F和907R用于扩增细菌16S rRNA基因的V4—V5区域。PCR扩增使用20 μL体系:5×FastPfu缓冲液4.0 μL, 2.5 mmol · L-1 dNTPs 2.0 μL, DNA模板1.0 μL, 5 μmol · L-1上、下游引物各0.8 μL, FastPfu聚合酶0.4 μL, ddH2O 11.0 μL。PCR扩增产物经20 g · L-1琼脂糖凝胶电泳检测, AxyPrep DNA凝胶回收试剂盒(Axygen, USA)回收、纯化和Tris-HCl洗脱后, 在Illumina Mi-seq平台进行高通量测序分析。
1.3.3 生物信息学分析将Mi-seq测序得到的原始fastq文件使用QIIME 1.17进行质量过滤和筛选:删除小于250 bp序列, 过滤含barcode的序列, 去除错配超过2个或者含有模糊字符的序列, 筛选掉有6个以上单独碱基重复的序列。使用UPARSE 7.1(http://drive5.com/uparse/)将过滤后的序列进行OTU(operational taxonomic units可操作分类单元)聚类分析, 序列相似度达97%即为一类, 再使用UCHIME鉴定和去除嵌合序列。通过Silva11916S rRNA数据库比对序列。参照Schloss等[7]的方法, 利用MOTHUR程序1.32(http://www.mothur.org)计算菌群的丰富度指数(ACE和Chao)和多样性指数(Shannon和Simpson)。
1.4 数据的统计与分析采用Excel 2010软件对收集的试验数据进行整理, 采用SPSS 17.0软件的独立样品的t测验进行差异显著性分析。数据以平均值±标准差(x±SD)表示。
2 结果与分析 2.1 饲料中益生菌活性分析饲料中活菌数量随存储时间的变化如图 1所示:存储当天猪颗粒饲料中芽胞杆菌和乳酸杆菌活菌数量均超过106 CFU · g-1; 随存储时间的延长, 芽胞杆菌数量变化不明显, 而乳酸杆菌数量略有降低; 存储45 d时, 饲料中的芽胞杆菌和乳酸杆菌活菌数不低于106和105 CFU · g-1。
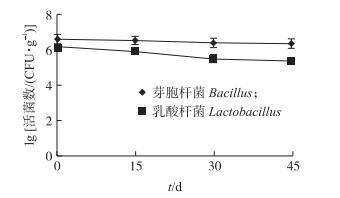
|
图 1 饲料中益生菌活菌数量随存储时间的变化 Fig. 1 Number of living probiotic bacteria in the feed at different time |
由表 2可见:与对照组相比, 生长期益生菌组猪平均日增重极显著升高(P<0.01), 料重比显著下降(P<0.05), 但采食量差异不显著(P>0.05)。在育肥前期和后期以及整个生长育肥期, 益生菌组和对照组猪的日增重、采食量和料重比差异均不显著(P>0.05)。
| 生长阶段 Growth stage | 指标 Index | 对照组 Control group | 益生菌组 Probiotic group |
| 生长期 | 初始体质量/kg Initial weight | 32.21±0.90 | 32.38±1.12 |
| Growth period | 终末体质量/kg Final weight | 51.50±1.79 | 54.31±0.84* |
| 平均日增重/kg Average daily gain | 0.77±0.05 | 0.86±0.01** | |
| 平均采食量/kg Average daily feed intake | 1.69±0.07 | 1.74±0.05 | |
| 料重比 Feed to gain ratio | 2.19±0.09 | 2.04±0.10* | |
| 育肥前期 | 终末体质量/kg Final weight | 72.70±3.70 | 76.31±1.40 |
| Pre-fattening period | 平均日增重/kg Average daily gain | 0.77±0.08 | 0.81±0.03 |
| 平均采食量/kg Average daily feed intake | 2.04±0.14 | 2.20±0.01 | |
| 料重比 Feed to gain ratio | 2.78±0.17 | 2.80±0.09 | |
| 育肥后期 | 终末体质量/kg Final weight | 102.00±5.31 | 106.80±1.85 |
| Late period of fattening | 平均日增重/kg Average daily gain | 0.96±0.07 | 0.98±0.03 |
| 平均采食量/kg Average daily feed intake | 2.85±0.15 | 2.96±0.04 | |
| 料重比 Feed to gain ratio | 2.97±0.12 | 3.02±0.10 | |
| 生长育肥全期 | 平均日增重/kg Average daily gain | 0.83±0.06 | 0.88±0.01 |
| Whole period of growth | 平均采食量/kg Average daily feed intake | 2.12±0.11 | 2.23±0.02 |
| and fattening | 料重比 Feed to gain ratio | 2.56±0.07 | 2.53±0.02 |
| Note:* P<0.05, * * P0.01. The same as follows. | |||
由表 3可见:与对照组相比, 益生菌处理极显著提高肝脏质量(P<0.01), 有提高胴体长度(胴体斜长、直长)和降低眼肌面积的趋势(0.05<P<0.1), 对其他测定指标无显著影响(P>0.05)。
| 项目 Items |
对照组 Control group |
益生菌组 Probiotic group |
| 宰前活体质量/kg Live weight before slaughter |
114.00±2.00 | 116.20±4.27 |
| 胴体质量/kg Carcass weight |
83.66±1.43 | 84.90±3.83 |
| 屠宰率/% Slaughter rate |
73.40±1.83 | 73.06±1.51 |
| 胴体斜长/cm Oblique carcass length |
100.20±3.11 | 104.75±3.10 |
| 胴体直长/cm Straight carcass length |
86.80±2.39 | 89.75±2.06 |
| 肝脏质量/kg Liver weight |
1.67±0.09 | 1.85±0.04** |
| 胃质量/kg Stomach weight |
0.51±0.05 | 0.62±0.14 |
| 小肠质量/kg Small intestine weight |
1.67±0.42 | 1.94±0.38 |
| 大肠质量/kg Large intestine weight |
2.09±0.38 | 2.36±0.52 |
| 脾脏质量/kg Spleen weight |
0.14±0.02 | 0.14±0.02 |
| 背膘厚度/cm Thickness of backfat |
2.18±0.55 | 2.40±0.26 |
| 眼肌面积/cm2 Eye muscle area |
61.41±5.63 | 54.72±5.02 |
由表 4可见:与对照组相比, 益生菌组的肉色L*值显著降低(P<0.05), 剪切力极显著升高(P<0.01), 但a*值、b*值和肉色评分差异不显著(P>0.05), 2组间猪肉含水量、大理石纹评分、滴水损失、肌内脂肪、pH45min和pH24h也无显著差异。
| 项目 Items |
对照组 Control group |
益生菌组 Probiotic group |
| pH45min | 6.34±0.26 | 6.36±0.13 |
| pH24h | 6.03±0.06 | 6.07±0.03 |
| 大理石纹评分Marbling score | 1.50±0.55 | 1.33±0.52 |
| 肉色评分Meat color score | 3.00±0.63 | 3.20±0.87 |
| 肉色L*值Meat color L*-value | 45.13±1.47 | 43.00±1.55* |
| 肉色a*值Meat color a*-value | 6.35±1.37 | 6.55±1.46 |
| 肉色b*值Meat color b*-value | 13.53±2.22 | 13.28±0.79 |
| 剪切力/kg Shear force | 4.93±0.83 | 7.63±0.78** |
| 滴水损失/% Drip loss | 3.52±0.60 | 2.91±0.95 |
| 含水量/% Water content | 73.86±2.82 | 72.44±0.29 |
| 肌内脂肪/% Intramuscular fat | 2.09±0.90 | 2.34±0.49 |
与对照组相比, 益生菌组猪结肠菌群的丰富度指数Chao值显著升高(P<0.05), ACE(基于覆盖率估计的丰度)值也有升高趋势(P>0.05), 而多样性指数Shannon和Simpson值无显著差异; 2组样品的测序覆盖率均超过99.7%, 表明测序量符合要求, 且2组间无显著差异(表 5)。
| 指数Index | 对照组Control group | 益生菌组Probiotic group |
| ACE | 681.600±52.9 | 744.800±34.300 |
| Chao | 681.100±42.9 | 751.800±37.700* |
| Shannon | 4.538±0.289 | 4.619±0.243 |
| Simpson | 0.031±0.011 | 0.027±0.008 |
| Coverage | 0.997±0.000 | 0.997±0.001 |
| 注: ACE:基于覆盖率估计的丰度Abundance-based coverage estimator. | ||
菌群组成分析结果(表 6)表明:与对照组相比, 益生菌处理在门水平上对菌群结构无影响, 在属水平上, 猪结肠中Ruminococcaceae UCG-005、Halomonas、Erysipelotrichaceae UCG-001、Marvinbryantia和Butyrivi-brio相对丰度显著升高(P<0.05), 而Bacteroidales S24-7 group和Oscillospira显著降低(P<0.05)。
| 属 Genus |
对照组 Control group |
益生菌组 Probiotic grop |
| 拟杆菌Bacteroidales S24-7 group | 16.18±3.49 | 9.83±1.82* |
| 瘤胃球菌Ruminococcaceae UCG-005 | 6.34±2.18 | 11.75±3.29* |
| 颤螺菌Oscillospira | 0.60±0.20 | 0.21±0.07* |
| 盐单胞菌Halomonas | 0.21±0.03 | 0.34±0.05* |
| 韦荣球菌Erysipelotrichaceae UCG-001 | 0.08±0.05 | 0.34±0.18* |
| 毛螺菌Marvinbryantia | 0.03±0.02 | 0.09±0.03* |
| 丁酸弧菌Butyrivibrio | 0.01±0.02 | 0.09±0.07* |
| 非培养瘤胃菌Uncultured Ruminococcaceae | 0.06±0.03 | 0.15±0.07* |
本研究结果表明, 日粮中添加益生菌可显著提高育肥猪生长期的日增重, 并降低料重比。这一结果与Upadhaya等[8]和Meng等[9]在生长育肥期猪日粮中添加益生菌制剂能够提高其生长性能的结果基本一致。然而, 也有研究表明, 日粮添加复合益生菌制剂对生长育肥猪的生长性能无影响[10], 说明益生菌制剂在生产实践中的应用效果不一致, 这可能与猪品种、基础日粮组成、益生菌制剂剂量水平、动物生长阶段以及环境因素的相互作用等因素有关[10]。
已有的研究结果显示, 益生菌制剂对断奶仔猪和生长前期猪具有一定的促生长效果, 但对生长中、后期(60 kg至出栏)猪的作用效果较差。本试验中, 颗粒饲料中芽胞杆菌能够维持较长时间的活性, 其促生长作用可能是该菌能够消耗肠道中的游离氧, 造成厌氧环境, 并调节菌群平衡, 促进乳酸杆菌等有益菌生长, 抑制病原菌生长[11-12]。益生菌对生长中后期猪的促生长作用较差, 其原因可能是由于随着猪年龄的不断增长, 其消化和免疫系统逐步完善, 肠道菌群逐步定殖形成稳定的状态, 对外界环境变化的适应能力也增强。因此益生菌制剂在日龄较小猪上的应用效果明显优于日龄较大的猪。
3.2 益生菌制剂对生长育肥猪胴体性状和肉品质的影响张天阳等[13]研究发现, 饲喂菌落数为1011的乳酸菌液可显著增加生长育肥猪的胴体斜长和胴体质量, 且不同剂量的乳酸菌液也可显著增加眼肌面积。本试验结果表明, 益生菌制剂提高猪的胴体斜长。这可能是因为有益菌群能够产生多种生物活性成分, 将脂肪组织的脂肪酶激活从而促进脂肪分解和能量释放, 减少糖类氧化和转化, 增加体内蛋白质合成, 从而改善胴体品质。
肉色、风味、嫩度、多汁性和系水力是影响肉品质的关键因素[14]。猪肉品质的下降大多是由于屠宰后肌肉中大量脂质过氧化物发生氧化反应, 破坏细胞膜, 从而造成嫩度下降、肉色变淡和系水力下降等[15]。本试验发现, 益生菌组的育肥猪肉色亮度值显著降低, 并且猪肉剪切力显著升高, 这表明该益生菌一定程度上降低了猪肉品质[16]。本研究说明饲粮中添加益生菌对改善生长育肥猪的胴体和肉品质没有显著作用, 这可能与不同研究所用的益生菌菌株有关。
3.3 益生菌制剂对生长育肥猪肠道菌群的影响正常情况下, 动物肠道内的微生物菌群与宿主之间处于动态平衡状态, 不同菌群之间也保持一定的比例关系, 菌群的平衡与稳定对机体的正常生理功能具有重要影响。本试验利用高通量测序分析猪结肠菌群结构, 发现益生菌处理可提高猪结肠菌群的丰富度指标Chao值。说明益生菌处理组肠道菌群中的菌群丰度更高, 这可能是益生菌通过在肠道内定殖, 起到调节肠道菌群的作用, 使肠道菌群维持在一个丰度较高的平衡水平, 更有利于育肥猪的健康与生长。在属水平上, 对照组和处理组均是未分类的疣微菌科和普氏菌属占较大优势, 益生菌组猪结肠Ruminococcaceae UCG-005、Halomonas、Erysipelotrichaceae UCG-001、Marvinbryantia和Butyrivibrio属相对丰度显著升高, Ruminococcaceae和Butyrivibrio中很多菌均能发酵不易消化的多糖和胶质产生短链脂肪酸, 肠道中的短链脂肪酸可以调节宿主的能量, 使宿主免于炎症反应[17-18], 抑制脂肪组织发育[19]。然而, 益生菌如何通过改变菌群影响宿主表型的机制还需要进一步研究。
| [1] |
呼红梅, 林松, 武英, 等. 饲粮添加益生菌对猪生长性能和肉品质的影响[J]. 养猪, 2017(2): 50-53. Hu H M, Lin S, Wu Y, et al. Effects of probiotics supplementation on growth performance and meat quality of pigs[J]. Swine Production, 2017(2): 50-53 (in Chinese). DOI:10.3969/j.issn.1002-1957.2017.02.021 |
| [2] |
刘金阳, 王在贵, 张宏福, 等. 益生菌与饲粮组合效应对苏淮猪生长性能、胃肠道pH和肉品质的影响[J]. 畜牧兽医学报, 2014, 45(10): 1648-1655. Liu J Y, Wang Z G, Zhang H F, et al. Effects of diets supplemented with probiotic on growth performance, gastrointestinal pH and meat quality of Suhuai pigs[J]. Chinese Journal of Animal and Veterinary Sciences, 2014, 45(10): 1648-1655 (in Chinese with English abstract). DOI:10.11843/j.issn.0366-6964.2014.10.010 |
| [3] |
陈影, 卢宗梅, 俞建良, 等. 微生物发酵饲料中益生菌的计数方法[J]. 当代化工, 2018, 47(5): 991-994. Chen Y, Lu Z M, Yu J L, et al. Counting method of probiotics in microbial fermentation feed[J]. Contemporary Chemical Industry, 2018, 47(5): 991-994 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-0460.2018.05.030 |
| [4] |
王银环, 钱凌, 董芳华, 等. 流式细胞术和平板计数法用于地衣芽孢杆菌活菌制剂检测的比较研究[J]. 中国现代应用药学, 2018, 35(3): 352-356. Wang Y H, Qian L, Dong F H, et al. Comparative research on the detection of viable organism preparation of bacillus licheniformis between flow cytometry and plate counting method[J]. Chinese Journal of Modern Applied Pharmacy, 2018, 35(3): 352-356 (in Chinese with English abstract). |
| [5] |
Dai Z L, Zhang J, Wu G, et al. Utilization of amino acids by bacteria from the pig small intestine[J]. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [6] |
Sun Y, Zhou L P, Fang L D, et al. Responses in colonic microbial community and gene expression of pigs to a long-term high resistant starch diet[J]. Frontiers in Microbiology, 2015, 6(25): 877-887. |
| [7] |
Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [8] |
Upadhaya S D, Kim S C, Valientes R A, et al. The effect of bacillus-based feed additive on growth performance, nutrient digestibility, fecal gas emission, and pen cleanup characteristics of growing-finishing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(7): 999-1005. DOI:10.5713/ajas.15.0066 |
| [9] |
Meng Q W, Yan L, Ao X, et al. Influence of probiotics in different energy and nutrient density diets on growth performance, nutrient digestibility, meat quality, and blood characteristics in growing-finishing pigs[J]. Journal of Animal Science, 2010, 88(10): 3320-3326. DOI:10.2527/jas.2009-2308 |
| [10] |
张紫微, 卜棚, 陈月丽, 等. 复合益生菌制剂在杜陆二元杂育肥猪中的应用效果[J]. 饲料研究, 2017(16): 1-6. Zhang Z W, Bu P, Chen Y L, et al. Application effect of compound probiotics in Dulu binary miscellaneous fattening pigs[J]. Feed Research, 2017(16): 1-6 (in Chinese). |
| [11] |
Khan S H, Atif M, Mukhtar N, et al. Effects of supplementation of multi-enzyme and multi-species probiotic on production performance, egg quality, cholesterol level and immune system in laying hens[J]. Journal of Applied Animal Research, 2011, 39(4): 386-398. DOI:10.1080/09712119.2011.621538 |
| [12] |
陈海军, 蔡东森, 袁咏刚, 等. 饲料中添加复合益生菌对山猪生长育肥及胴体性能的影响[J]. 猪业科学, 2018, 35(6): 127-129. Chen H J, Cai D S, Yuan Y G, et al. Effect of adding probiotics in feed on growth and fattening and carcass performance of mountain pigs[J]. Swine Industry Science, 2018, 35(6): 127-129 (in Chinese). DOI:10.3969/j.issn.1673-5358.2018.06.048 |
| [13] |
张天阳, 楚青惠, 曾勇庆, 等. 饲喂不同剂量乳酸菌液对生长育肥猪生长性能及胴体性状的影响[J]. 养猪, 2013(5): 41-44. Zhang T Y, Chu Q H, Zeng Y Q, et al. Effects of different doses of lactic acid bacteria solution on growth performance and carcass traits of growing and finishing pigs[J]. Swine Production, 2013(5): 41-44 (in Chinese). DOI:10.3969/j.issn.1002-1957.2013.05.015 |
| [14] |
尹靖东, 李德发. 猪肉质形成的分子机制与营养调控[J]. 动物营养学报, 2014, 26(10): 2979-2985. Yin J D, Li D F. Molecular mechanism underlying meat quality formation and its nutritional regulation in pigs[J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 2979-2985 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2014.10.009 |
| [15] |
晁娅梅, 陈代文, 余冰, 等. 茶多酚对育肥猪生长性能、抗氧化能力、胴体品质和肉品质的影响[J]. 动物营养学报, 2016, 28(12): 3996-4005. Chao Y M, Chen D W, Yu B, et al. Effects of tea polyphenol on growth performance, antioxidant capacity, carcass performance and meat quality of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2016, 28(12): 3996-4005 (in Chinese with English abstract). |
| [16] |
胡新旭, 周映华, 卞巧, 等. 无抗发酵饲料对生长育肥猪生产性能、血液生化指标和肉品质的影响[J]. 华中农业大学学报, 2015, 34(1): 72-77. Hu X X, Zhou Y H, Bian Q, et al. Effects of complex probiotics fermented feed without antibiotic on growth performance, plasma biochemical parameters, immune function and meat quality in growing-finishing pig[J]. Journal of Huazhong Agricultural University, 2015, 34(1): 72-77 (in Chinese with English abstract). |
| [17] |
Dennis K L, Wang Y W, Blatner N R, et al. Adenomatous polyps are driven by microbe-instigated focal inflammation and are controlled by IL-10-producing T cells[J]. Cancer Research, 2013, 73(19): 5905-5913. DOI:10.1158/0008-5472.CAN-13-1511 |
| [18] |
陈明亮, 蒋勇军, 丁雪燕, 等. 益生菌对猪大肠杆菌病防治作用的研究进展[J]. 畜牧与兽医, 2019, 51(4): 131-135. Chen M L, Jiang Y J, Ding X Y, et al. Progress in research on probiotics in prevention and treatment of porcine colibacillosis[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(4): 131-135 (in Chinese with English abstract). |
| [19] |
杨东明, 赵鑫婧, 赵德明, 等. 短链脂肪酸在宿主能量代谢方面的调节作用[J]. 中国微生态学杂志, 2019, 31(9): 1100-1104. Yang D M, Zhao X J, Zhao D M, et al. The regulation of short chain fatty on host energy metabolism[J]. Chinese Journal of Microecology, 2019, 31(9): 1100-1104 (in Chinese with English abstract). |




