文章信息
- 颜桂花, 邢恒涛, 刘强, 孙文恺, 刘洋, 庄苏
- YAN Guihua, XING Hengtao, LIU Qiang, SUN Wenkai, LIU Yang, ZHUANG Su
- 可溶性玉米纤维对仔猪盲肠微生物多样性的影响
- Effects of soluble corn fiber on microbial diversity in cecum of piglets
- 南京农业大学学报, 2020, 43(3): 505-513
- Journal of Nanjing Agricultural University, 2020, 43(3): 505-513.
- http://dx.doi.org/10.7685/jnau.201906060
-
文章历史
- 收稿日期: 2019-06-28
可溶性玉米纤维又名Fibersol-2(Fib2), 是一种抗性麦芽糊精, 由玉米淀粉在酸性条件下经过热和酶处理产生的一种低分子可溶性非消化性葡聚糖[1]。Fib2作为膳食纤维中的一种可溶性纤维, 具有低黏度和低卡路里等特性, 已广泛应用于人类食品中。在畜牧生产中, 动物肠道中的微生物参与养分消化、吸收、代谢以及机体免疫, 影响动物生长和健康, 而微生物组成结构易受日粮成分的影响。Miyazato等[2]发现小鼠连续采食抗性麦芽糊精后会改变其盲肠微生物组成。仔猪日粮中短期添加10%豌豆纤维会降低其盲肠中厚壁菌门的细菌比例, 提高变形菌门的细菌比例, 且极显著增加乳杆菌属和Desulfovibrio desulfuricans的数量[3]。日粮中添加低聚木糖会提高粪便中乳酸杆菌数量, 降低大肠杆菌数量[4]。体外试验证实, 甘露寡糖和甜菜汁能够促进肠道微生物发酵, 提高挥发性脂肪酸(volatile fatty acids, VFA)尤其是丁酸比例[5]。在维持肠道健康方面, 除微生物作用外, 肠道屏障也发挥着重要作用。血清学指标检测是诊断肠道屏障功能障碍的重要依据。血清中D-乳酸含量和二胺氧化酶(diamine oxidase, DAO)活性可以作为肠道损伤的早期指标, 监测肠道渗透性, 间接反映肠道屏障功能。肖定福等[6]报道日粮中添加壳聚糖显著降低仔猪血浆中D-乳酸含量和DAO活性, 增强肠道屏障功能。目前, 国内外已有关于膳食纤维能够改变动物肠道微生物区系的研究报道, 而关于可溶性玉米纤维对仔猪盲肠微生物菌群结构及肠道屏障功能影响的研究却很少。因此, 本试验通过在仔猪日粮中添加不同剂量的Fib2研究其对盲肠微生物多样性、有机酸及肠道屏障功能的影响, 旨在探索Fib2与肠道健康之间的关系, 为Fib2更好地应用于动物及人类营养提供试验依据。
1 材料与方法 1.1 试验材料本试验所用可溶性玉米纤维(Fib2)由艾地盟生物科技有限公司(天津)提供, 其抗性麦芽糊精含量≥98%。
1.2 试验设计选用28日龄、初始体质量为(9.65±0.44)kg的杜×长×大三元杂交仔猪448头, 采用单因素随机分组, 试验设计分为4组, 每组8个重复, 每个重复14头, 分别饲喂4种日粮:基础日粮分别加0(对照组)、1、2和4 g·kg-1 Fib2。基础日粮原料和营养组成及水平见表 1。预试期7 d, 正试期28 d。
| 原料组成Ingredients composition | 水平Level | 营养组成Nutrient composition | 水平Level | |
| 玉米Corn | 558.00 | 干物质Dry mater | 892.10 | |
| 次粉Wheat middling | 45.00 | 消化能2)Digestible energy | 13.81 | |
| 豆粕Soybean meal | 163.00 | 粗蛋白Crude protein | 196.30 | |
| 发酵豆粕Fermented soybean meal | 70.00 | 粗脂肪Ether extract | 39.80 | |
| 鱼粉Fish meal | 25.00 | 赖氨酸Lysine | 13.20 | |
| 肠膜蛋白粉Dried porcine solubles | 25.00 | 蛋氨酸Methionine | 4.30 | |
| 乳清粉Whey powder | 62.50 | 蛋氨酸+胱氨酸Methionine+cystine | 7.70 | |
| 大豆油Soy oil | 16.50 | 苏氨酸Threonine | 8.10 | |
| 赖氨酸Lysine | 2.50 | 钙Calcium | 9.60 | |
| 蛋氨酸Methionine | 1.00 | 总磷Total phosphorus | 6.00 | |
| 石粉Limestone | 10.50 | |||
| 磷酸氢钙Calcium phosphate dibasic | 8.00 | |||
| 氯化钠Sodium chloride | 3.00 | |||
| 预混料1)Premix | 10.00 | |||
| 注:1)预混料为每千克日粮提供:维生素A 8 000 IU, 维生素D3 2 500 IU, 维生素E 15 mg, 烟酸20 mg, 泛酸钙10 mg, 核黄素4 mg, 生物素0.06 mg, 叶酸0.20 mg, 硫胺素2 mg, 氯化胆碱500 mg, 铜165 mg, 铁110 mg, 锰80 mg, 锌330 mg, 硒0.20 mg, 碘0.30 mg; 2)消化能为计算值, 单位为MJ·kg-1, 其余为实测值。 | ||||
| Note:1)Premix provided per kilogram feed:vitamin A 8 000 IU, vitamin D3 2 500 IU, vitamin E 15 mg, nicotinic acid 20 mg, calcium pantothenate 10 mg, riboflavin 4 mg, biotin 0.06 mg, folic acid 0.20 mg, thiamine 2 mg, choline chloride 500 mg, Cu 165 mg, Fe 110 mg, Mn 80 mg, Zn 330 mg, Se 0.20 mg, I 0.30 mg; 2)Digestible energy was calculated according to ingredients energy and its unit was MJ·kg-1, while others were measured values. | ||||
试验在扬州加农畜牧科技有限公司进行。试验仔猪饲养于全封闭、高床漏缝式地板的控温猪舍, 自由采食、饮水。每天清扫, 定期清粪, 并按场内常规计划对猪群进行免疫接种与消毒。
1.4 样品采集及指标测定 1.4.1 微生物多样性分析试验结束时, 从每个重复组随机选择1头仔猪称体质量, 屠宰, 采集盲肠食糜样品用于分析微生物多样性。盲肠食糜中总DNA提取参照王伟兰[7]的方法进行。利用NanoDrop 2000分光光度计(NanoDrop Technologies, USA)定量所提取的DNA, 纯度和浓度合适的DNA样品由上海凌恩生物工程有限公司利用Illumina MiSeq平台(Illumina PE250, USA)进行高通量测序。
1.4.2 测序数据分析利用MOTHUR软件包(1.30.1)优化和分析原始序列[8]。将平均质量值小于20、长度短于50 bp, 具有模糊碱基或含有重叠长度<10 bp的序列从数据集中去除。通过Donovo和Reference结合的方式, 利用Usearch(7.1)软件从有效序列中移除嵌合体, 进一步将剩余优化序列以97%相似性截止值聚类到可操作分类单元(operational taxonomic units, OTU)中。利用QIIME(1.7.0)软件的RDP分类器贝叶斯算法(2.2)[9]鉴定代表性序列集, 并以70%的置信度阈值与来自Silva数据库的高质量16S rRNA基因序列进行比对[10]。基于OTU数据绘制所有样品的稀疏曲线。利用MOTHUR程序[8]计算每个样品的平均Chao1指数和Shannon指数。利用主坐标分析(principal co-ordinates analysis, PCoA)及非度量多维尺度(non-metric multidimensional scaling, NMDS)分析显示不同样本间的相似性和差异性[11-12]。
1.4.3 有机酸含量测定采集盲肠食糜样品测定有机酸含量。乳酸含量采用试剂盒(南京建成生物工程研究所)测定。参照Zhuang等[13]的方法利用气相色谱仪(GC2014AFsc, Japan)测定乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸含量, 再计算总挥发性脂肪酸(TVFA)含量。
1.4.4 肠道渗透性指标分析分别于正试期14和28 d, 从仔猪前腔静脉采血, 静置后以3 500 r·min-1离心10 min, 分离血清后于-20 ℃保存, 用于肠道渗透性指标的测定。采用南京建成生物工程研究所测定试剂盒测定血清中DAO活性和D-乳酸含量。参照张瑞阳等[14]的方法测定血清中细菌内毒素(脂多糖)含量(测定试剂盒购自厦门鲎试剂生物工程有限公司)。
1.5 数据分析采用SPSS 21.0统计软件对试验数据进行单因素方差分析(One-way ANOVA), 利用多项式对比进行线性和二次效应分析, 再用Duncan’s法进行多重比较。数据表示为平均数和总均标准误。使用Pearson相关性检验对微生物和有机酸及肠道渗透性指标之间的相关性进行分析, 当相关系数(r)的绝对值大于0.4且P<0.05时表示显著相关。
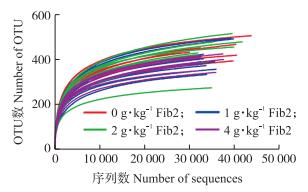
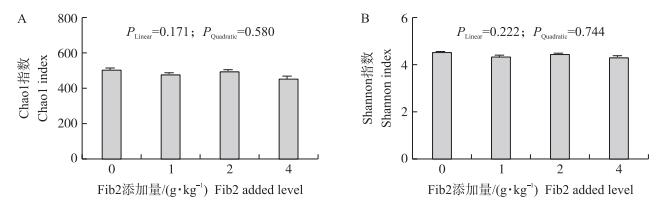
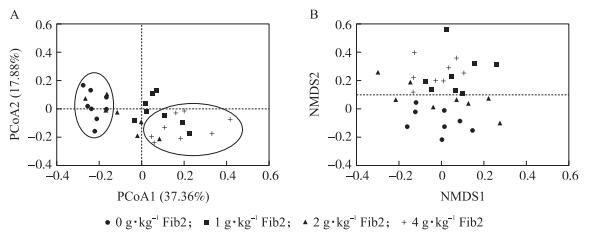
2 结果与分析 2.1 Fib2对仔猪盲肠食糜微生物多样性指数的影响在优化和分析原始序列后, 从32个盲肠食糜样品中共获得1 187 237个序列。所有样品中获得的序列和OTU的平均数分别为37 101和415。从图 1可以看出:当序列数超过30 000时OTU的稀疏曲线趋于平缓, 表明该测序覆盖度已达饱和。图 2显示:日粮中添加Fib2对Chao1和Shannon指数无显著影响(P>0.05)。PCoA分析(图 3-A)显示, 4组之间虽无显著差异, 但是0和4 g·kg-1 Fib2添加组的盲肠食糜样品沿PCoA1轴有分离的趋势。NMDS分析(图 3-B)显示, 4组盲肠食糜样品未重叠, 表明组间肠道菌群组成有明显差异。
|
图 1 仔猪盲肠微生物的稀疏曲线(序列相似度大于97%, n=8) Fig. 1 Rarefaction curves of microbiota in cecum of piglets(greater than 97% of 16S rRNA sequence similarity) |
|
图 2 Fib2对仔猪盲肠微生物多样性指数的影响(n=8) Fig. 2 Effects of Fib2 on the microbial diversity indexes of cecum of piglets |
|
图 3 多样本主坐标分析(PCoA)及非度量多维尺度(NMDS)分析(n=8) Fig. 3 Multi-sample principal coordinate analysis(PCoA)and non-metric multidimensional scaling(NMDS)analysis |
由表 2可知:仔猪盲肠食糜微生物在门水平上, 厚壁菌门(相对丰度为39.58%~62.24%)和拟杆菌门(相对丰度为32.59%~57.59%)是2个优势门, 变形菌门(0.51%~1.86%)、软壁菌门(0.81%~1.72%)和放线菌门(0.61%~1.18%)的相对丰度较低。5个门观察的总细菌丰度超过99.0%。日粮中添加Fib2显著降低软壁菌门和放线菌门的相对丰度(P<0.05, 线性), 提高拟杆菌门而降低厚壁菌门和变形菌门的相对丰度(P<0.05, 线性和二次)。在科水平上, Fib2显著提高普雷沃氏菌科、拟杆菌科和紫单胞菌科的相对丰度而降低瘤胃菌科、毛螺菌科、梭菌科、丹毒丝菌科和unclassified Mollicutes RF9的相对丰度(P<0.05, 线性), 提高Bacteroidales S24-7 group的相对丰度(P<0.05, 二次), 提高乳杆菌科而降低消化链球菌科的相对丰度(P<0.05, 线性和二次)。在属水平上, Fib2显著提高普氏菌属、拟普雷沃氏菌属、拟杆菌属和紫单胞菌属的相对丰度, 降低瘤胃球菌属、Lachnospiraceae NK4A136 group、梭菌属和unknown genus的相对丰度(P<0.05, 线性), 提高unclassified Bacteroidales S24-7 group的相对丰度(P<0.05, 二次), 提高乳杆菌属和Prevotellaceae UCG的相对丰度, 降低Eubacterium coprostanoligenes group、罕见小球菌属和地孢子菌属的相对丰度(P<0.05, 线性和二次)。
| 分类项目 Category items |
Fib2添加量/(g·kg-1)Fib2 added level | 标准误 SEM |
P值P-value | ||||
| 0 | 1 | 2 | 4 | 线性Linear | 二次Quadratic | ||
| 厚壁菌门Firmicutes | 62.24c | 40.33a | 53.01b | 39.58a | 2.00 | <0.001 | 0.021 |
| 瘤胃菌科Ruminococcaceae | 32.00b | 20.94a | 27.74b | 21.75a | 1.16 | 0.002 | 0.121 |
| Ruminococcaceae UCG | 14.48 | 9.24 | 13.39 | 10.71 | 0.66 | 0.129 | 0.244 |
| Eubacterium coprostanoligenes group | 5.82b | 2.53a | 3.37a | 2.96a | 0.31 | <0.001 | 0.001 |
| 罕见小球菌属Subdoligranulum | 3.60c | 1.69a | 2.70b | 2.35ab | 0.19 | 0.023 | 0.008 |
| 瘤胃球菌属Ruminococcus 1 | 1.56b | 0.42a | 1.19b | 0.24a | 0.14 | 0.001 | 0.584 |
| Unclassified Ruminococcaceae | 0.84 | 1.14 | 1.20 | 1.20 | 0.07 | 0.066 | 0.269 |
| 毛螺菌科Lachnospiraceae | 11.69c | 9.43b | 8.52ab | 7.61a | 0.40 | <0.001 | 0.264 |
| Unclassified Lachnospiraceae | 3.32 | 3.05 | 3.31 | 2.64 | 0.23 | 0.407 | 0.688 |
| 布劳特氏菌属Blautia | 1.37 | 1.09 | 1.80 | 1.13 | 0.12 | 0.973 | 0.425 |
| Lachnospiraceae NK4A136 group | 1.15b | 0.97a | 0.86a | 0.56a | 0.10 | 0.046 | 0.761 |
| 梭菌科Clostridiaceae 1 | 7.24b | 4.85a | 5.02a | 3.95a | 0.31 | <0.001 | 0.143 |
| 梭菌属Clostridium sensu stricto 1 | 5.80b | 4.81ab | 4.99ab | 3.90a | 0.24 | 0.008 | 0.915 |
| 消化链球菌科Peptostreptococcaceae | 3.79b | 1.58a | 2.23a | 2.08a | 0.21 | 0.001 | 0.001 |
| 地孢子菌属Terrisporobacter | 3.37b | 1.34a | 2.66b | 1.82a | 0.20 | 0.006 | 0.031 |
| 丹毒丝菌科Erysipelotrichaceae | 3.07b | 1.65a | 2.26a | 1.75a | 0.16 | 0.003 | 0.068 |
| 乳杆菌科Lactobacillaceae | 0.33a | 0.26a | 0.32a | 0.82b | 0.05 | <0.001 | <0.001 |
| 乳杆菌属Lactobacillus | 0.33a | 0.26a | 0.32a | 0.82b | 0.05 | <0.001 | <0.001 |
| 拟杆菌门Bacteroidetes | 32.59a | 57.52c | 42.57b | 57.59c | 2.25 | <0.001 | 0.018 |
| 普雷沃氏菌科Prevotellaceae | 23.23a | 33.04b | 28.86ab | 40.96c | 1.55 | <0.001 | 0.602 |
| 普氏菌属Prevotella | 7.81a | 10.76ab | 11.90b | 12.61b | 0.62 | 0.003 | 0.311 |
| Prevotellaceae NK3B31 group | 5.08 | 8.00 | 4.92 | 7.07 | 0.37 | 0.231 | 0.480 |
| Prevotellaceae UCG | 4.54a | 7.96b | 4.39a | 11.17c | 0.59 | <0.001 | 0.011 |
| 拟普雷沃氏菌属Alloprevotella | 3.27a | 5.07b | 4.95b | 6.02b | 0.28 | <0.001 | 0.397 |
| Unclassified Prevotellaceae | 2.11 | 3.01 | 2.10 | 2.56 | 0.17 | 0.719 | 0.488 |
| Bacteroidales S24-7 group | 4.82a | 7.06b | 6.36b | 6.40b | 0.28 | 0.051 | 0.029 |
| Unclassified Bacteroidales S24-7 group | 4.82a | 7.06b | 6.36b | 6.40b | 0.28 | 0.051 | 0.029 |
| 理研菌科Rikenellaceae | 1.65 | 2.26 | 2.28 | 1.72 | 0.12 | 0.720 | 0.073 |
| Rikenellaceae RC9 gut group | 1.48 | 2.03 | 1.97 | 1.45 | 0.12 | 0.948 | 0.105 |
| 拟杆菌科Bacteroidaceae | 1.11a | 2.13b | 1.28a | 2.54b | 0.13 | <0.001 | 0.494 |
| 拟杆菌属Bacteroides | 1.11a | 2.13b | 1.28a | 2.54b | 0.13 | <0.001 | 0.494 |
| 紫单胞菌科Porphyromonadaceae | 0.96a | 3.09b | 3.34b | 4.60c | 0.28 | <0.001 | 0.098 |
| 紫单胞菌属Parabacteroides | 0.96a | 3.08b | 3.34b | 4.60c | 0.28 | <0.001 | 0.090 |
| 变形菌门Proteobacteria | 1.86c | 0.51a | 1.39b | 1.02b | 0.12 | 0.011 | 0.003 |
| 软壁菌门Tenericutes | 1.72b | 0.81a | 1.48b | 1.02a | 0.10 | 0.029 | 0.141 |
| Unclassified Mollicutes RF9 | 1.52b | 0.71a | 1.25b | 0.80a | 0.09 | 0.013 | 0.208 |
| Unknown genus | 1.52b | 0.71a | 1.25b | 0.80a | 0.09 | 0.013 | 0.208 |
| 放线菌门Actinobacteria | 1.18c | 0.61a | 0.96bc | 0.76ab | 0.06 | 0.046 | 0.082 |
| 红椿菌科Coriobacteriaceae | 1.14 | 0.60 | 0.94 | 0.76 | 0.06 | 0.079 | 0.101 |
| 注:SEM:4组总均标准误。同行数据肩标不同小写字母表示差异显著(P<0.05)。下同。 | |||||||
| Note:SEM:Total standard error of means in the four groups. Values with different superscript small letters in the same row mean significant difference among the treatments(P<0.05). The same as below. | |||||||
如表 3所示:日粮中添加Fib2显著提高仔猪盲肠食糜中乳酸、乙酸、丙酸、戊酸、TVFA(P<0.05, 线性)、异丁酸和异戊酸含量(P<0.05, 线性和二次)。
| 项目 Items |
Fib2添加量/(g·kg-1)Fib2 added level | 标准误 SEM |
P值P-value | ||||
| 0 | 1 | 2 | 4 | 线性Linear | 二次Quadratic | ||
| 乳酸Lactate | 0.42a | 0.54ab | 0.56b | 0.63b | 0.02 | 0.002 | 0.593 |
| 乙酸Acetate | 54.78a | 72.81bc | 60.55ab | 81.16c | 3.21 | 0.012 | 0.818 |
| 丙酸Propionate | 20.68a | 22.51a | 19.36a | 26.37b | 0.78 | 0.023 | 0.056 |
| 丁酸Butyrate | 9.27 | 9.22 | 8.63 | 10.97 | 0.37 | 0.160 | 0.097 |
| 戊酸Valerate | 0.86a | 1.01ab | 0.88a | 1.17b | 0.04 | 0.014 | 0.296 |
| 异丁酸Isobutyrate | 0.43a | 0.43a | 0.39a | 0.57b | 0.02 | 0.012 | 0.018 |
| 异戊酸Isovalerate | 0.51a | 0.51a | 0.47a | 0.69b | 0.02 | 0.008 | 0.009 |
| 总挥发性脂肪酸TVFA | 86.53a | 106.50ab | 90.29a | 120.94b | 4.09 | 0.008 | 0.443 |
| Note:TVFA:Total volatile fatty acid. | |||||||
14 d时, 日粮中添加Fib2显著降低仔猪肠道血清D-乳酸、内毒素含量(P<0.05, 线性)和DAO活性(P<0.05, 线性和二次)(表 4)。28 d时, Fib2未显著影响血清DAO活性和D-乳酸、内毒素含量(P>0.05)。
| 项目 Items |
Fib2添加量/(g·kg-1)Fib2 added level | 标准误 SEM |
P值P-value | ||||
| 0 | 1 | 2 | 4 | 线性Linear | 二次Quadratic | ||
| 二胺氧化酶活性/(U·L-1)Diamine oxidase activity | |||||||
| 14 d血清14 d serum | 10.43b | 8.16a | 7.58a | 7.97a | 0.34 | 0.004 | 0.027 |
| 28 d血清28 d serum | 8.30 | 8.28 | 7.60 | 7.67 | 0.34 | 0.420 | 0.952 |
| D-乳酸含量/(μg·mL-1)D-lactate content | |||||||
| 14 d血清14 d serum | 2.10b | 1.93b | 1.49a | 1.56a | 0.07 | 0.001 | 0.310 |
| 28 d血清28 d serum | 0.84 | 0.76 | 0.71 | 0.79 | 0.02 | 0.303 | 0.062 |
| 内毒素含量/(EU·mL-1)Endotoxin content | |||||||
| 14 d血清14 d serum | 2.93b | 2.19a | 2.36ab | 1.93a | 0.12 | 0.007 | 0.481 |
| 28 d血清28 d serum | 0.68 | 0.59 | 0.57 | 0.57 | 0.06 | 0.533 | 0.721 |
由图 4显示:仔猪肠道Eubacterium coprostanoligenes group的相对丰度与14 d血清DAO活性呈正相关关系(r=0.407, P=0.049);Prevotellaceae UCG的相对丰度分别与盲肠食糜中乙酸、丙酸、戊酸、异丁酸和异戊酸含量呈正相关关系(r=0.499, P=0.013;r=0.784, P<0.001;r=0.458, P=0.024;r=0.720, P<0.001;r=0.672, P<0.001);拟普雷沃氏菌属的相对丰度分别与戊酸和异戊酸含量呈正相关关系(r=0.430, P=0.036;r=0.476, P=0.019);紫单胞菌属的相对丰度分别与异丁酸和异戊酸含量呈正相关关系(r=0.539, P=0.007;r=0.607, P=0.002);Lachnospiraceae NK4A136 group的相对丰度与14 d血清D-乳酸含量呈正相关关系(r=0.483, P=0.017)。而梭菌属的相对丰度分别与戊酸、异丁酸和异戊酸含量呈负相关关系(r=-0.532, P=0.007;r=-0.610, P=0.002;r=-0.609, P=0.002);unknown genus的相对丰度分别与乙酸、丙酸和戊酸含量呈负相关关系(r=-0.432, P=0.035;r=-0.478, P=0.018;r=-0.419, P=0.041)。

|
图 4 盲肠细菌属与有机酸或渗透性指标间的Pearson相关系数 Fig. 4 Pearson correlation coefficient between the bacterial genera of cecum and organic acids or permeability |
猪胃肠道内定殖着高度分化的细菌, 以97%相似度为标准共识别出375种门类型[15], 其中优势菌门与碳水化合物的代谢有关[16]。拟杆菌门和厚壁菌门是猪盲肠中的优势菌门。拟杆菌门参与多种可溶性多糖的代谢, 上调可溶性多糖降解酶的表达; 厚壁菌门参与纤维素的降解, 其降解能力很大程度上受限于细胞壁组成, 并与特定纤维素分解菌种类有关[17-18]。本试验中, 日粮中添加Fib2显著提高仔猪盲肠食糜中拟杆菌门的相对丰度, 降低厚壁菌门的相对丰度。此结果与Miyazato等[2]的结果基本一致。变形菌门含有一些已知的病原菌, 能够引起代谢紊乱与炎性疾病, 可作为疾病的微生物信号指标[19]。本试验中, Fib2显著降低变形菌门的相对丰度, 改善仔猪肠道健康。此外, Fib2显著降低软壁菌门和放线菌门的相对丰度, 其原因有待进一步研究。
瘤胃菌科是盲肠微生物中的优势菌科之一, 其成员中瘤胃球菌属的丰度值与纤维素和不溶性非淀粉多糖(non-starch polysaccharide, NSP)组分的摄入量呈正相关关系[20], 说明瘤胃球菌属具有强烈降解纤维素和不溶性NSP的能力。在本试验中, Fib2显著降低瘤胃菌科和瘤胃球菌属的相对丰度, 分析可能的原因:一是Fib2不是瘤胃菌科和瘤胃球菌属的最佳降解底物; 二是纤维素主要在结肠末端而不是盲肠中被发酵[21]。Eubacterium sp.在肠道中主要产丁酸, 对果糖、葡萄糖、纤维二糖等的降解能力较弱[22]。在本试验中, Fib2显著降低Eubacterium coprostanoligenes group的相对丰度, 可能归因于较弱的发酵糖能力。毛螺菌科是肠道中另一种产丁酸菌, 也是果胶降解菌。Fib2显著降低其含量可能与添加物含可溶性葡聚糖而非果胶有关。梭菌科和消化链球菌科的细菌通常被认为是肠道中的淀粉分解菌。本试验中, Fib2显著降低梭菌科、消化链球菌科、梭菌属和地孢子菌属的相对丰度, 表明Fib2未能被这些细菌很好利用。此外, 日粮的淀粉消化在回肠末端接近完成[23]。乳杆菌科是肠道中的有益菌群, 主要发酵糖类产生乳酸。本试验中, Fib2显著提高乳酸菌科和乳酸菌属的相对丰度, 增加乳酸含量, 由此推断可溶性葡聚糖能够被这类菌更好地利用。值得注意的是, 这类细菌在盲肠食糜中所占比例较低(小于1%), 这是因为乳杆菌类细菌是回肠中的优势菌[24], 其丰度提高以及乳酸含量增加则有益于肠道健康。丹毒丝菌(Erysipelothrix spp.)是一种致病菌, 可感染动物及人类引发丹毒病或类丹毒病, 是疾病的微生物信号[25]。在本试验中, Fib2显著降低丹毒丝菌科的相对丰度, 改善仔猪肠道健康。
普雷沃氏菌科是盲肠微生物中另一种优势菌科, 其成员虽然不是纤维主要分解菌, 但是能够利用低聚糖、淀粉、非纤维素多糖和果胶作为能量源[26-27]。在本试验中, Fib2显著提高普雷沃氏菌科、普氏菌属、Prevotellaceae UCG和拟普雷沃氏菌属的相对丰度, 表明Fib2具有促进肠道中普雷沃氏菌群生长的作用。从本试验还发现, Fib2添加组的紫单胞菌科和紫单胞菌属的相对丰度显著高于对照组, 并与有机酸含量的增加呈正相关关系。这是因为紫单胞菌属可以利用低聚糖产生琥珀酸、乙酸、丙酸和乳酸[28]。然而, 该菌属在盲肠中所占比例较低, 可能是因为该菌群与普氏菌群之间存在底物竞争关系。拟杆菌科也参与碳水化合物发酵和可溶性多糖代谢, 维持肠道正常生理功能, 改善动物健康[29]。在本试验中, Fib2显著提高拟杆菌科和拟杆菌属的相对丰度, 说明Fib2能够促进这类菌群在盲肠中的生长。此外, 从本试验还发现仔猪盲肠中存在着几种未知菌属, 如unclassified Bacteroidales S24-7 group、unclassified Mollicutes RF9和unknown genus, 未来对这几种菌属的种类及功能还需进一步研究。
Fib2作为可溶性膳食纤维对仔猪盲肠微生物菌群的结构组成产生重要影响(如上所述), 而这些影响与微生物多样性指数及PCoA结果不一致。本试验中, Fib2未显著改变Chao1和Shannon指数, 且PCoA图显示4组之间无显著差异, 分析其可能的原因:一是Fib2的添加量较低, 二是动物处于健康状态而不是病理状态, 不足以影响仔猪盲肠微生物的整体多样性。然而, NMDS图显示4组仔猪盲肠食糜样品未重叠, 表明组间肠道菌群组成有明显差异。这些结果与He等[30]的研究结果基本一致。
3.2 Fib2对仔猪盲肠食糜有机酸含量的影响肠道特定部位微生物菌群的结构组成受可利用底物种类和数量的影响, 有机酸如乙酸、丙酸、丁酸及乳酸等作为微生物的发酵产物, 其种类和含量受到可发酵底物和菌群组成的影响。在本试验中, Fib2显著提高乳酸含量, 并与乳酸菌相对丰度正相关。此外, Fib2显著提高乙酸、丙酸、戊酸、异丁酸、异戊酸和TVFA含量。笔者认为, 这一结果与日粮中较高含量的可溶性多糖促进拟杆菌门的普氏菌科、拟杆菌科和紫单胞菌科等诸多菌属的生长有关。Pearson相关性分析也进一步说明特定菌群与有机酸之间存在密切关系。本试验结果与杭苏琴等[31]的结果基本一致。据报道, 由梭菌类细菌产生的丁酸盐能够诱导调节性T细胞分化并预防结肠炎, 同时丁酸又是结肠细胞和肠细胞重要的能源物质[32-33], 说明丁酸对动物肠道健康至关重要。本试验中, Fib2未显著提高丁酸含量, 这一结果可能与瘤胃菌科、毛螺菌科、梭菌科和消化链球菌科等产丁酸菌[34]相对丰度的降低有关。但是, Fib2增加有机酸及TVFA含量, 有利于降低肠道pH值, 维持微生态平衡, 提高免疫性能, 防止内源病原菌在肠道中定殖, 对动物肠道健康有益[2, 32]。
3.3 Fib2对仔猪肠道渗透性指标的影响DAO是由肠上皮绒毛细胞分泌的高活性酶, D-乳酸是细菌发酵、代谢和裂解底物的产物, 细菌内毒素是革兰氏阴性菌细胞壁的独特结构组成成分, 在细菌死亡后被释放出来并表现毒性, 其主要成分为脂多糖[35-37]。正常情况下, 血清中DAO活性和D-乳酸、内毒素含量较低, 当肠道黏膜受损后, 上皮绒毛细胞释放的DAO、肠道中细菌产生的D-乳酸、细菌裂解后释放的内毒素通过受损肠黏膜入血, 使血清DAO活性和D-乳酸、内毒素含量升高。因此, 它们可以作为反映肠道渗透性的检测指标。在本试验中, Fib2显著降低14 d血清的DAO活性和D-乳酸、内毒素含量, 说明Fib2能够降低试验前期的肠道渗透性, 增强肠道屏障功能。随着试验期延长, 仔猪逐渐适应该日粮, 肠道屏障功能趋于稳定, 表现为28 d血清的DAO活性和D-乳酸、内毒素含量无显著变化, 但均低于对照组。Pearson相关性分析结果表明, 特定菌群与肠道渗透性指标之间存在密切关系, 说明微生物与肠道屏障共同维持仔猪的肠道健康。
在本试验条件下, 日粮中添加Fib2改变仔猪盲肠微生物区系结构, 提高有机酸含量, 降低肠道渗透性, 最终改善仔猪肠道健康。
| [1] |
Ohkuma K, Wakabayashi S. Fibersol-2: a soluble, non-digestible, starch-derived dietary fibre[M]//McCleary B V, Prosky L. Advanced Dietary Fibre Technology. Oxford: Blackwell Science Ltd., 2008: 509-523.
|
| [2] |
Miyazato S, Kishimoto Y, Takahashi K, et al. Continuous intake of resistant maltodextrin enhanced intestinal immune response through changes in the intestinal environment in mice[J]. Bioscience of Microbiota, Food and Health, 2016, 35(1): 1-7. DOI:10.12938/bmfh.2015-009 |
| [3] |
罗玉衡, 陈洪, 余冰, 等. 短期或长期饲喂高水平豌豆纤维对猪盲肠微生物群落结构和代谢产物的影响[J]. 畜牧兽医学报, 2017, 48(8): 1459-1467. Luo Y H, Chen H, Yu B, et al. Short-term or long-term intake of high-level pea fiber specifically affects the bacterial community and metabolites in the cecum of pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(8): 1459-1467 (in Chinese with English abstract). |
| [4] |
王保哲, 王雨雨, 范程瑞, 等. 低聚木糖对育肥猪生长性能、血清生化、免疫指标和粪便微生物菌群的影响[J]. 畜牧与兽医, 2018, 50(5): 36-42. Wang B Z, Wang Y Y, Fan C R, et al. Effects of xylo-oligosaccharide on growth performance, serum biochemical, immune indexes and fecal bacterial community in fattening pigs[J]. Animal Husbandry and Veterinary Medicine, 2018, 50(5): 36-42 (in Chinese with English abstract). |
| [5] |
杭苏琴, 毛胜勇, 于卓腾, 等. 体外法评定甘露寡糖和甜菜汁对肠道微生物发酵的影响[J]. 南京农业大学学报, 2007, 30(1): 79-83. Hang S Q, Mao S Y, Yu Z T, et al. Effect of mannan-oligosaccharide and sugar beet pulp on intestinal microbial fermentation in vitro[J]. Journal of Nanjing Agricultural University, 2007, 30(1): 79-83 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2007.01.016 |
| [6] |
肖定福, 唐志如, 印遇龙, 等. 壳聚糖对仔猪肠黏膜通透性及Occludin和ZO-1表达的影响[J]. 畜牧兽医学报, 2012, 43(6): 894-900. Xiao D F, Tang Z R, Yin Y L, et al. Effects of chitosan on intestine permeability, Occludin and ZO-1 expression in piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(6): 894-900 (in Chinese with English abstract). |
| [7] |
王伟兰.不同日粮纤维对猪肠道微生物多样性及挥发性脂肪酸的影响[D].南京: 南京农业大学, 2014. Wang W L. Influence of different diet fiber on swine gastrointestinal tract microbial diversity and volatile fatty acid[D]. Nanjing: Nanjing Agricultural University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1016037505.htm |
| [8] |
Schloss P D, Gevers D, Westcott S L. Reducing the effects of PCR amplification and sequencing artifacts on 16s rRNA-based studies[J]. PLoS One, 2011, 6(12): e27310. DOI:10.1371/journal.pone.0027310 |
| [9] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [10] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project:improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41: D590-D596. |
| [11] |
Jiang X T, Peng X, Deng G H, et al. Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J]. Microbial Ecology, 2013, 66(1): 96-104. |
| [12] |
Rivas M N, Burton O T, Wise P, et al. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J]. Journal of Allergy and Clinical Immunology, 2013, 131(1): 201-212. DOI:10.1016/j.jaci.2012.10.026 |
| [13] |
Zhuang S, Zhang T, Chang G J, et al. The metabolism of volatile fatty acids by portal-drained viscera and liver of goats fed diets with different forage to concentrate ratio[J]. Pakistan Journal of Zoology, 2014, 46(2): 391-400. |
| [14] |
张瑞阳, 王东升, 朱伟云, 等. 奶牛静脉血内毒素浓度及其与产奶量的相关性[J]. 动物营养学报, 2012, 24(5): 822-827. Zhang R Y, Wang D S, Zhu W Y, et al. Endotoxin concentration in venous blood and its correlation with milk yield of dairy cows[J]. Chinese Journal of Animal Nutrition, 2012, 24(5): 822-827 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2012.05.005 |
| [15] |
Leser T D, Amenuvor J Z, Jensen T K, et al. Culture-independent analysis of gut bacteria:the pig gastrointestinal tract microbiota revisited[J]. Applied and Environmental Microbiology, 2002, 68(2): 673-690. |
| [16] |
Lamendella R, Domingo J W S, Ghosh S, et al. Comparative fecal metagenomics unveils unique functional capacity of the swine gut[J]. BMC Microbiology, 2011, 11(1): 103-119. |
| [17] |
Flint H J, Bayer E A, Rincon M T, et al. Polysaccharide utilization by gut bacteria:potential for new insights from genomic analysis[J]. Nature Reviews Microbiology, 2008, 6(2): 121-131. DOI:10.1038/nrmicro1817 |
| [18] |
White B A, Lamed R, Bayer E A, et al. Biomass utilization by gut microbiomes[J]. Annual Review of Microbiology, 2014, 68(1): 279-296. DOI:10.1146/annurev-micro-092412-155618 |
| [19] |
Rizzatti G, Lopetuso L R, Gibiino G, et al. Proteobacteria:a common factor in human diseases[J]. Biomed Research International, 2017, 2017: 1-7. |
| [20] |
Pieper R, Bindelle J, Rossnagel B, et al. Effect of carbohydrate composition in barley and oat cultivars on microbial ecophysiology and proliferation of salmonella enterica in an in vitro model of the porcine gastrointestinal tract[J]. Applied and Environmental Microbiology, 2009, 75(22): 7006-7016. DOI:10.1128/AEM.01343-09 |
| [21] |
Zhang Y J, Liu Q, Zhang W M, et al. Gastrointestinal microbial diversity and short-chain fatty acid production in pigs fed different fibrous diets with or without cell wall-degrading enzyme supplementation[J]. Livestock Science, 2018, 207: 105-116. DOI:10.1016/j.livsci.2017.11.017 |
| [22] |
Freier T A, Beitz D C, Li L, et al. Characterization of Eubacterium coprostanoligenes sp. nov. a cholesterol-reducing anaerobe[J]. International Journal of Systematic Bacteriology, 1994, 44(1): 137-142. DOI:10.1099/00207713-44-1-137 |
| [23] |
Ivarsson E, Roos S, Liu H Y, et al. Fermentable non-starch polysaccharides increases the abundance of Bacteroides-Prevotella-Porphyromonas in ileal microbial community of growing pigs[J]. Animal, 2014, 8(11): 1777-1787. DOI:10.1017/S1751731114001827 |
| [24] |
Zhang L, Wu W D, Lee Y K, et al. Spatial heterogeneity and co-occurrence of mucosal and luminal microbiome across swine intestinal tract[J]. Frontiers in Microbiology, 2018, 9: 1-14. |
| [25] |
Brooke C J, Riley T V. Erysipelothrix rhusiopathiae:bacteriology, epidemiology and clinical manifestations of an occupational pathogen[J]. Journal of Medical Microbiology, 1999, 48(9): 789-799. DOI:10.1099/00222615-48-9-789 |
| [26] |
Filippo C D, Cavalieri D, Paola M D, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J]. Proc Natl Acad Sci USA, 2010, 107(33): 14691-14696. DOI:10.1073/pnas.1005963107 |
| [27] |
Pajarillo E A B, Chae J P, Balolong M P, et al. Characterization of the fecal microbial communities of duroc pigs using 16S rRNA gene pyrosequencing[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(4): 584-591. DOI:10.5713/ajas.14.0651 |
| [28] |
Sakamoto M, Tanaka Y, Benno Y, et al. Parabacteroides faecis sp. nov. isolated from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65: 1342-1346. DOI:10.1099/ijs.0.000109 |
| [29] |
Salyers A A. Bacteroides of the human lower intestinal tract[J]. Annual Review of Microbiology, 1984, 38(1): 293-313. DOI:10.1146/annurev.mi.38.100184.001453 |
| [30] |
He B, Nohara K, Ajami N J, et al. Transmissible microbial and metabolomic remodeling by soluble dietary fiber improves metabolic homeostasis[J]. Scientific Reports, 2015, 5: 10604-10614. DOI:10.1038/srep10604 |
| [31] |
杭苏琴, 时祺, 丁立人, 等. 果寡糖对断奶前仔猪胃肠道组织形态、消化酶、有机酸及乳酸杆菌菌群的影响[J]. 草业学报, 2014, 23(2): 260-267. Hang S Q, Shi Q, Ding L R, et al. Effects of fructo-oligosaccharides on mucosal morphology, digestive enzyme activity, organic acid and Lactobacillus of the gastrointestinal tract of unweaned piglets[J]. Acta Prataculturae Sinica, 2014, 23(2): 260-267 (in Chinese with English abstract). |
| [32] |
Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504: 446-450. DOI:10.1038/nature12721 |
| [33] |
Donohoe D R, Garge N, Zhang X X, et al. The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon[J]. Cell Metabolism, 2011, 13(5): 517-526. DOI:10.1016/j.cmet.2011.02.018 |
| [34] |
Vital M, Howe A C, Tiedje J M. Revealing the bacterial butyrate synthesis pathways by analyzing(meta)genomic data[J]. mBio, 2014, 5(2): e00889. |
| [35] |
Luk G D, Bayless T M, Baylin S B. Plasma postheparin diamine oxidase.sensitive provocative test for quantitating length of acute intestinal mucosal injury in the rat[J]. Journal of Clinical Investigation, 1983, 71(5): 1308-1315. DOI:10.1172/JCI110881 |
| [36] |
Johnston S D, Smye M, Watson R P. Intestinal permeability tests in coeliac disease[J]. Clinical Laboratory, 2001, 47: 143-150. |
| [37] |
Ammori B J, Fitzgerald P, Hawkey P, et al. The early increase in intestinal permeability and systemic endotoxin exposure in patients with severe acute pancreatitis is not associated with systemic bacterial translocation:molecular investigation of microbial DNA in the blood[J]. Pancreas, 2003, 26(1): 18-22. DOI:10.1097/00006676-200301000-00004 |




