文章信息
- 赵熙君, 冷雪梅, 张旭辉, 应多, 刘晓雨, 郑聚锋, 卞荣军, 李恋卿, 潘根兴
- ZHAO Xijun, LENG Xuemei, ZHANG Xuhui, YING Duo, LIU Xiaoyu, ZHENG Jufeng, BIAN Rongjun, LI Lianqing, PAN Genxing
- 生物质炭施用对重金属污染水稻土有机碳矿化的影响
- Effect of biochar addition on soil organic carbon mineralization in a heavy metal-contaminated paddy soil
- 南京农业大学学报, 2020, 43(3): 468-476
- Journal of Nanjing Agricultural University, 2020, 43(3): 468-476.
- http://dx.doi.org/10.7685/jnau.201904050
-
文章历史
- 收稿日期: 2019-04-23
土壤有机碳库是陆地生态系统最大的碳库[1], 其稳定性对于全球温室气体排放有着重要影响[2]。水稻土是我国重要的农业土壤资源, 是耕作土壤中表层有机碳密度最高的农田土壤类型, 具有显著的固碳效应[3], 在我国粮食安全、农田土壤碳库保持及农业的可持续发展中占有重要地位[4]。
20世纪中期以来, 随着我国化工产业的迅速发展和化肥、农药等的不合理施用, 农田重金属污染问题日益严重[5]。其中, 南方重金属污染稻田的镉污染相对严重, 其浓度范围为0.01~5.5 mg·kg-1[6]。重金属污染可对土壤酶活性、土壤微生物量及微生物群落结构等产生影响, 从而改变土壤有机碳的矿化和周转等过程[7]。同时, 不同程度重金属污染对土壤有机碳矿化的影响不同, 如低浓度的重金属可刺激土壤呼吸和土壤碳代谢作用, 增加土壤的矿化速率, 而高浓度的重金属则会抑制微生物的分解活动从而导致土壤有机碳矿化率降低。这可能是因为不同污染程度下分解有机碳的微生物群落响应不同。在重度污染条件下, 真菌的响应比细菌更为敏感, 随着污染程度的增加, 抗逆真菌的数量会显著增加, 而敏感真菌数量会急剧减少[7]。
生物质炭是生物质在无氧或者缺氧条件下的热解产物, 其化学组成以芳香烃等结构复杂的稳定有机化合物为主, 其比表面积大、吸附性强, 在改善土壤质量、提高养分有效性、增加作物产量、吸附重金属污染物和减缓温室气体排放等方面具有积极作用[8-9]。如:生物质炭可以吸附重金属污染物, 也可改变重金属的形态从而降低重金属的迁移性以及生物有效性, 从而降低污染物的环境风险[9]。更多的研究表明, 施用生物质炭可显著减少土壤CH4、N2O等温室气体的排放并增加土壤碳汇[8]。然而, 重金属污染土壤中施用生物质炭后土壤有机碳矿化及碳库组分的变化研究较少。本研究利用室内培养法, 借助稳定性碳同位素示踪技术, 探讨生物质炭添加对不同程度重金属污染土壤中新添加碳和原有有机碳矿化的影响, 分析土壤重金属污染治理过程中土壤有机碳的激发效应和不同碳组分的变化, 为重金属污染条件下制定合理的水稻土有机碳库管理措施提供科学依据。
1 材料与方法 1.1 研究区概况试验地位于江苏省宜兴市某村。其土壤类型是太湖地区第四纪湖积物发育的典型的脱潜型水稻土——乌泥土。当地气候属亚热带季风气候, 全年温暖湿润。年平均气温为15.7 ℃, 年均降水量为1 177 mm。以地形和相同农业管理措施的非污染土壤(31°24′N, 119°41′E)和污染土壤(31°24′N, 119°41′E)稻田为采样区。该污染采样区是20世纪60年代末金属冶炼和加工产业区。以工厂旧址为污染源原点分别选取距离污染源原点下风向60、10 m处2个重金属污染水平土壤样品, 分别记为P1、P2, 再选取临近未污染土壤作为对照, 记为P0。
1.2 样品采集与处理于2017年11月水稻收获期采集土壤样品, 采样深度为0~15 cm, 用不锈钢铁铲采集, 采用混合样品采样法, 在距离污染源相同距离的土壤中采集3个重复, 每个重复分别随机采取3个样品, 野外混匀, 同时在野外采用四分法获得混合样品。所采集样品分为2份, 一份放在冰袋中带回后置于4 ℃冰箱中保存, 用于微生物量碳和溶解性有机碳的测定。另一份自然风干, 去除土壤中植物残体和其他侵入体, 磨细过筛, 混匀备用。
1.3 测定方法 1.3.1 供试土壤基本理化性质测定供试土壤基本理化性质参照文献[10]相关方法测定, 采用水土质量比为1:2.5的电位法测定土壤pH值; 采用重铬酸钾容量法-外加热法测定土壤有机质含量; 采用半微量凯氏定氮法测定土壤全氮含量; 采用NH4F-HCl浸提-钼锑抗比色法测定土壤有效磷含量; 采用NH4OAC浸提-火焰光度计法测定土壤速效钾含量, 供试土壤基本理化性质见表 1。
| 土壤 Soil |
含水量/(g·kg-1) Water content |
pH值 pH value |
有机碳含量/(g·kg-1) Organic C content |
速效P含量/(mg·kg-1) Avail P content |
速效K含量/(mg·kg-1) Avail K content |
| P0 | 541.91±1.05 | 6.27±0.20 | 18.91±5.42 | 32.03±4.69 | 124.33±16.23 |
| P1 | 473.05±3.02 | 6.71±0.06 | 20.03±2.97 | 8.24±8.89 | 108.00±8.63 |
| P2 | 532.17±7.02 | 5.81±0.13 | 17.28±1.06 | 16.88±2.62 | 124.83±39.51 |
| 注:P0代表未污染土壤, P1和P2分别代表距离污染源60、10 m处2个重金属污染水平土壤样品。 Note:P0 represents uncontaminated soil, P1 and P2 represent two soil samples of heavy metal contamination at 60 and 10 meters respectively from the source of the contamination. |
|||||
供试秸秆生物质炭来源于南京三聚生物质新材料科技有限公司, 采用便携式生物质炭化机炭化(SSBP 5000), 该炭化机采用电加热棒加热, 分为炭化系统、冷却分离系统和出炭系统。将收集的原料适当破碎, 由进料口放入, 设定炭化温度350 ℃, 炭化时间1 h。当温度达到300 ℃时打开冷却水, 并在裂解气出口点燃气体, 待炭化结束后, 出炭口温度冷却至60 ℃以下, 打开出炭口, 取出生物质炭, 称量并收集备用。经测定生物质炭的pH值为10.19±0.01, 电导率为(2.02±0.02)ms·cm-1, 有机碳含量为(588.15±0.87)g·kg-1, 阳离子交换量为(69.98±17.05)cmol·kg-1, 颗粒态有机碳含量为(600.04±12.31)mg·kg-1, 灰分含量为(102.35±0.36)g·kg-1。
1.3.2 重金属含量测定土壤样品中全量Pb、Cd、Cu、Zn的测定采用HF-HClO4-HNO3消煮, 采用DTPA浸提法测定土壤重金属有效态含量。测定过程中所用试剂均为优级纯, 标准样品测定结果在误差允许的范围内。其中Cu、Zn含量的测定采用火焰原子吸收分光光度法, Pb、Cd含量采用石墨炉原子吸收分光光度法测定。土壤重金属本底情况见表 2。评价重金属污染水平的高低, 常用内梅罗污染指数[11]表示。内梅罗指数计算公式: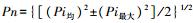
| 土壤 Soil |
重金属全量/(mg·kg-1) Total heavy metal |
重金属有效态含量/(mg·kg-1) Avail heavy metal |
内梅罗指数 Nemero index |
|||||
| Cu | Zn | Cd | Pd | Cd | Pd | |||
| P0 | 27.89±4.75c | 113.33±8.02b | 0.46±0.26c | 25.15±7.29c | 0.03±0.03c | 1.58±0.07c | 0.67 | |
| P1 | 74.34±0.48b | 172.33±9.36b | 4.33±1.05b | 231.01±15.85b | 1.31±0.30b | 20.17±0.07b | 3.57 | |
| P2 | 123.71±1.45a | 391.37±11.27a | 33.97±3.62a | 430.67±19.46a | 21.26±2.39a | 80.03±0.36a | 29.08 | |
| 注:平均值±标准差(n=3);同列不同小写字母表示差异显著(P < 0.05)。 Note:Means±standard deviation(n=3). The different small letters in the same column mean significant difference at 0.05 level. |
||||||||
采用氯仿熏蒸-K2SO4浸提法测定土壤微生物量碳(MBC)含量[12]; 采用0.5 mol·L-1 K2SO4提取法, 用TOC/TN3100德国耶拿自动分析仪测定可溶性有机碳(DOC)含量[13]; 采用5 g·L-1六偏磷酸钠提取法分散土壤样品, 测定颗粒态有机碳(POC)含量, 计算其占全部土壤样品的比例并测定烘干样品中的有机碳含量, 将烘干样品中的土壤有机碳含量换算成全部土壤样品的对应颗粒有机碳组分含量[14]; 采用0.333 mol KMnO4氧化法测定土壤易氧化态碳(LOC)含量[15]。
1.4 土壤有机碳矿化培养试验称取100 g土壤样品于MFP-500 mL密封培养瓶中。试验共设置3个处理:1)不添加生物质炭记为(C0);2)添加10 g·kg-1生物质炭处理(C1);3)添加20 g·kg-1生物质炭处理(C2), 每个处理设置3个重复, 同时以不加土壤的培养瓶作为空白对照, 添加去离子水调节土壤含水量为60%。把密封好的培养瓶放入25 ℃恒温培养箱中, 在黑暗条件下培养60 d。定期采集气体样品, 并按称重法补充土壤水分。采用Agilent公司的GC-7890A气相色谱仪测定采集的气体CO2样品。采用Delta pius型气体稳定同位素质谱仪测定CO2δ13C值。分析方法遵循质谱方法准则[16]。
CO2-C气体释放速率的计算公式[17]: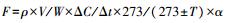
添加秸秆炭后相对激发效应(RPE, %)的计算:
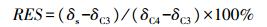
|
(1) |
式中:RES为加入的秸秆生物质炭对土壤呼吸的贡献率; δs为加入玉米秸秆炭土壤释放CO2的δ13C(%); δC3为对照土壤的δ13C(%); δC4为玉米秸秆炭的δ13C(%)。
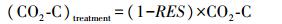
|
(2) |
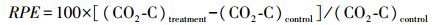
|
(3) |
式中:CO2-C为土壤的总CO2释放量; (CO2-C)treatment为添加秸秆炭处理后土壤SOC的CO2释放量; (CO2-C)control为未添加玉米秸秆土壤SOC的CO2释放量[18]。
1.5 数据处理与分析试验数据采用Excel 2013处理, 采用SPSS 20.0软件对处理间的差异进行方差分析及多重比较。
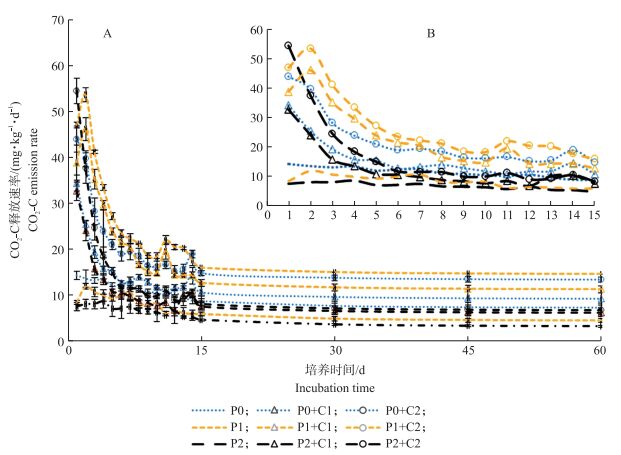
2 结果与分析 2.1 添加生物质炭对重金属污染水稻土有机碳矿化速率和累积矿化量的影响从图 1可知:各处理CO2-C释放速率随培养时间的延长均呈下降趋势, 且表现出显著的阶段性特征。第1阶段为0~7 d, 这一时期是CO2-C释放速率下降最快的时期, 在此阶段, 同一污染水平下, 土壤的呼吸速率随生物质炭的添加呈显著升高的趋势; 第2阶段为8~20 d, CO2-C释放速率下降幅度较为缓慢; 第3阶段为21~60 d, CO2-C释放速率渐趋稳定。
|
图 1 添加玉米秸秆生物质炭对不同程度重金属污染水稻土CO2-C释放速率的影响 Fig. 1 Effects of corn straw biochar addition on CO2-C emission rate of different polluted paddy soils C1代表添加10 g·kg-1生物质炭; C2代表添加20 g·kg-1生物质炭。下同。 C1 represents adding 10 g·kg-1 of biomass carbon; C2 represents adding 20 g·kg-1 of biomass carbon. The same as follows. |
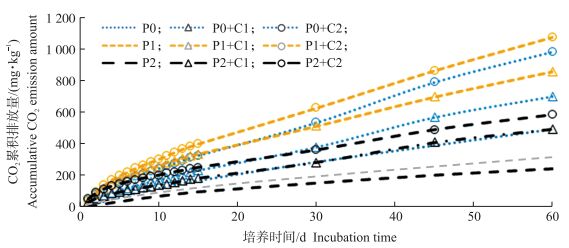
从图 2可知:对照土壤CO2累积排放量从大到小依次为P0、P1、P2;添加10 g·kg-1生物质炭处理土壤CO2累积排放量从大到小的处理依次为P1+C1、P0+C1、P2+C1;添加20 g·kg-1生物质炭处理土壤CO2累积排放量从大到小的处理依次为P1+C2、P0+C2、P2+C2。其中:P1+C2处理的CO2累积排放量最大, 为1 075 mg·kg-1; P2土壤的CO2累积排放量最低, 为248 mg·kg-1。在同一污染水平下, 土壤CO2累积排放量随生物质炭添加量的增加呈增加的趋势, P0土壤C1和C2处理分别比C0的CO2累积排放量增加40.9%和98.2%。P1土壤C1和C2处理分别比C0的CO2累积排放量增加1.7和2.4倍。P2土壤C1和C2处理的CO2累积排放量与C0相比分别增加1.0和1.3倍。
|
图 2 添加玉米秸秆生物质炭对不同程度重金属污染水稻土CO2累积排放量的影响 Fig. 2 Effects of corn straw biochar addition on accumulative CO2 emission of different polluted paddy soils |
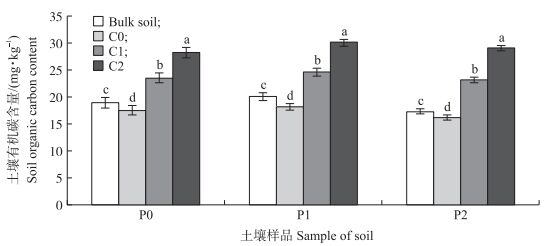
从图 3可知:在同一污染水平下, 添加生物质炭后各处理土壤有机碳含量显著增加。P0土壤中, C1和C2处理有机碳含量比原土分别提高23.8%和49.1%;P1土壤中, C1和C2处理分别比原土有机碳含量提高22.3%和49.6%;P2重度污染土壤中, C1和C2处理比原土有机碳含量分别提高33.6%和67.8%。在C1处理下, P0、P1、P2土壤有机碳含量比C0处理分别增加34.2%、35.6%和43.5%;C2处理下, P0、P1、P2土壤的有机碳含量比C0处理分别增加61.5%、65.6%和80.2%。2种施炭处理下高污染水稻土中有机碳累积量最高。
|
图 3 添加玉米秸秆生物质炭对不同程度重金属污染的水稻土有机碳含量的影响 Fig. 3 Effects of corn straw biochar addition on soil organic carbon contents of different polluted soils Bulk soil:原土。不同小写字母表示同一土壤不同处理间差异显著(P < 0.05)。下同。 Bulk soil:Soil of pre-incubation. The different letters mean significant difference among the different treatments in the same soil(P < 0.05). The same as follows. |
添加生物质炭可显著提高土壤微生物量碳含量。P0土壤中C1和C2处理土壤微生物量碳含量比原土分别增加27.7%和25.1%;P1土壤中C1和C2处理比原土分别增加23.1%和27.1%, P2土壤C1和C2处理比原土分别提高49.7%和41.7%。同一污染水平下, 施炭处理提高了微生物量碳含量, 但C1和C2处理间差异不显著(图 4-A)。3类土壤的施炭处理和对照相比可溶性有机碳含量都显著降低(图 4-B), 但P0土壤与施炭处理间无显著差异, 且C0、C1、C2处理间可溶性有机碳含量持平, 添加生物质炭对P0土壤可溶性有机碳含量没有显著影响。在P1和P2污染土壤中, 对照和施炭处理与原土相比可溶性有机碳含量下降, 施炭处理与对照相比其含量增加, 其中P1土壤中C1和C2处理分别比C0提高2.9%和12.4%, C2处理相比C0和C1处理差异显著; P2土壤C1和C2处理可溶性有机碳含量分别比C0提高2.3%和7.7%, 且施炭处理与对照间无显著差异。添加生物质炭对不同土壤易氧化态碳含量的影响不同, 其中C2处理不同程度地提高了易氧化态碳含量且差异显著, P0土壤中C2处理比C0的易氧化态碳含量提高240.1%;P1土壤C2处理相比C0提高26.1%;P2土壤C2处理相比C0提高48.0%。在生物质炭添加量相同处理下, P0土壤的2种施炭处理易氧化态碳含量均高于P1、P2土壤2种处理(图 4-C)。在同一施炭水平下, 随污染程度加重, 3种污染土壤的颗粒态有机碳含量增加, 在高污染原土中达到最大值。P0各处理土壤培养60 d后C1、C2处理土壤颗粒态有机碳含量显著高于C0, 分别增加46.8%和121.1%, P1土壤中C1和C2处理颗粒态有机碳含量分别比C0提高66.9%和200.2%, P2土壤C1和C2处理分别比C0土壤提高22.2%和45.8%(图 4-D)。
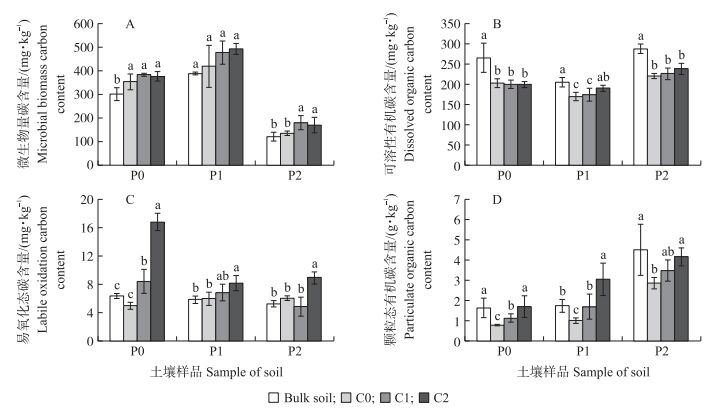
|
图 4 添加玉米秸秆生物质炭60 d后对不同程度重金属污染的水稻土活性炭库组分的影响 Fig. 4 Effects of corn straw biochar addition by the end of incubation on soil labile organic carbon content of different polluted soils |
从表 3可知:生物质炭添加1 d后释放的CO2主要来源于新碳, 且随着施炭量的增加其对于CO2排放量的贡献率也增加, 在P1和P2土壤的C2处理中, 其新碳的贡献率高达96.44%和98.13%。随培养时间的延长, 新碳的贡献率锐降, 后期土壤老碳是土壤释放CO2的主要来源。
| 处理Treatment | 1 d | 7 d | 60 d | |||||
| 丰度值/% δ13C value |
贡献率/% Contribution rate |
丰度值/% δ13C value |
贡献率/% Contribution rate |
丰度值/% δ13C value |
贡献率/% Contribution rate |
|||
| P0 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | ||
| P0+C1 | -17.21±0.03 | 70.93 | -23.43±0.03 | 0.26 | -25.38±0.01 | 0.15 | ||
| P0+C2 | -13.72±0.01 | 94.78 | -22.38±0.03 | 0.34 | -21.24±0.04 | 0.43 | ||
| P1 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | ||
| P1+C1 | -17.05±0.03 | 72.07 | -22.58±0.01 | 0.32 | -22.86±0.03 | 0.32 | ||
| P1+C2 | -13.48±0.03 | 96.44 | -20.56±0.02 | 0.46 | -18.41±0.02 | 0.63 | ||
| P2 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | -27.61±0.05 | 0.00 | ||
| P2+C1 | -15.34±0.03 | 83.73 | -25.63±0.01 | 0.10 | -25.63±0.01 | 0.13 | ||
| P2+C2 | -13.23±0.03 | 98.13 | -24.56±0.03 | 0.18 | -23.38±0.03 | 0.28 | ||
从图 5可知:在培养期间生物质炭的添加对土壤中原有有机碳的矿化产生负激发效应, 表明添加生物质炭抑制了土壤中原有有机碳的分解。培养1 d时, 同一污染水平的C1和C2处理中, P0土壤引发的相对负激发效应值分别为-46.95%和-82.38%, P1土壤培养负激发效应值分别为-44.51%和-88.54%, P2土壤培养负激发效应值分别为-54.55%和-92.78%。随培养时间的延长, 生物质炭的活性组分逐渐分解, 负激发效应强度逐渐降低。在60 d时, C1和C2处理中P0和P2其负激发效应强度分别降为-9.14%、-0.46%和-4.07%、-14.45%。虽然P1土壤的变化趋势也表现为随培养时间的延长呈下降趋势, 但在60 d时负激发效应依然较强。激发效应的强弱与施炭量有关, 施炭量越高起始激发效应越强。在同一施炭量水平下, P1土壤的累积激发效应强度强于P0和P2土壤。
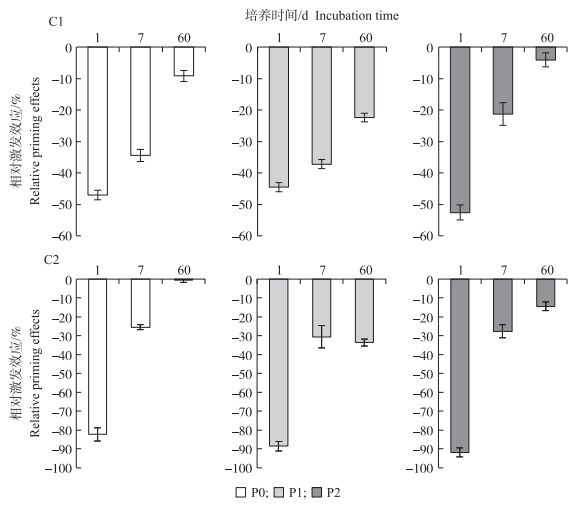
|
图 5 不同生物质炭添加量对3种土壤激发效应的影响 Fig. 5 Effect of different biochar addition amount on three kinds of soil priming effects |
重金属污染胁迫会显著影响土壤微生物量、群落结构及多样性[19]。本研究中同一施炭处理下, 高浓度污染土壤中有机碳分解速率最慢, 累计矿化量最低, 有机碳累积增加量最高。2种施炭处理下低污染处理的累积矿化量最高。这是由于低污染土壤各处理土壤微生物量碳含量均高于对照和高污染土壤, 这一结果进一步验证了低浓度重金属刺激微生物的生长, 高浓度则抑制微生物的生长[20]。
生物质炭由于自身的芳香多孔结构及其较强的稳定性, 在改良重金属污染土壤、固碳减排等领域广泛应用[21]。生物质炭含有大量的活性物质, 施加生物质炭可能会影响土壤中碳组分的重新分配[22]。本研究中生物质炭处理下土壤微生物量碳、颗粒态有机碳以及易氧化态碳的含量均高于对照, 这种变化可能来自于生物质炭本身的输入, 而水溶性有机碳含量降低可能是由于生物质炭大孔隙对活性有机碳的吸附作用造成的[23]。本研究中, 试验组中土壤的呼吸速率均表现为前期较快后期缓慢的特征, 主要是由于土壤中易分解的活性物质被优先分解, 难分解的有机物质再逐渐转变为易分解活性物质来维持有机碳周转[24]。
在重金属Cd污染土壤中土壤呼吸速率随施炭量的增加而增强[25]。本研究表明同一污染水平下, 施用生物质炭显著增加了土壤CO2释放速率, 且随施炭量的增大而增强, 这可能与生物质炭的性质和土壤中的微生物活性密切相关[23]。土壤有机质的矿化速率受环境因子、土壤性质、微生物等多种因素影响。生物质炭的施入不仅能改善土壤的酸碱度等理化性质, 生物质炭由于含有易分解、结构丰富的速效养分和活性组分, 也为微生物提供了良好的生存环境, 从而改变土壤的矿化速率。同一施炭处理水平下, 低污染土壤的有机碳累积矿化量最高, 其次为未污染土壤, 高污染土壤的累积矿化量最低, 这可能是由于生物质炭对重金属的吸附效应降低了对微生物的胁迫, 以及低污染对微生物活性刺激引起的综合作用的结果, 从而加速了微生物的生长繁殖和有机碳的矿化[26]。
土壤有机碳矿化是土壤微生物为获取化学能量和营养物质, 满足自身新陈代谢和生长繁殖等生物过程需求的结果, 土壤微生物对外源有机质输入的响应是形成激发效应的内在驱动力[27]。不同于秸秆直接还田后引发土壤的正激发效应[28], 生物质炭施入土壤后可以显著抑制土壤中原有有机碳的分解从而表现为负激发效应。本研究中高炭处理土壤相比低炭处理土壤在培养初期所引发的负激发效应更强烈, 这可能与生物质炭含有丰富的活性物质有关[29]。生物质炭中大量的活性组分诱导了r型微生物的生长和利用, k型微生物也转向利用易分解有机质, 减少了对土壤中原有有机碳的利用。在生物质炭添加初期, 活性成分最高, 负激发效应最强, 随着活性组分快速分解, 微生物对土壤中原有有机碳的利用比例增大, 负激发效应减弱。低污染土壤中高炭处理的激发效应表现为随时间延长略有上升的趋势, 这可能是由于重金属污染对微生物群落长期影响的结果:高浓度的重金属污染降低了土壤微生物活性以及群落结构的多样性, 高浓度Cd污染土壤中细菌和放线菌的数量下降而真菌数量无显著变化[19]。添加生物质炭对低污染土壤的负激发效应更为强烈, 长期不同程度的污染早已使土壤形成了不同的微生物群落组成及结构[7], 从而影响微生物对有机碳的分解利用, 这可能是外源生物质炭和重金属污染协同作用的结果。
综上所述, 添加生物质炭抑制了不同程度重金属污染水稻土中原有有机碳的矿化分解, 存在显著的负激发效应, 且此效应的强弱与生物质炭的添加量有关, 同时也和土壤污染程度相关。生物质炭添加量越大, 其累积负激发效应越强烈; 低浓度污染土壤相比高浓度污染土壤的累积负激发效应更强烈。生物质炭的添加在短期内可降低重金属污染水稻土中原有有机碳的矿化, 有利于重金属污染水稻土中有机碳的积累, 但其长期效应还需进一步研究。
| [1] |
袁红朝, 李春勇, 简燕, 等. 稳定同位素分析技术在农田生态系统土壤碳循环中的应用[J]. 同位素, 2014, 27(3): 170-178. Yuan H Z, Li C Y, Jian Y, et al. Stable isotope technique in the soil carbon cycling research of agricultural ecosystems[J]. Journal of Isotopes, 2014, 27(3): 170-178. |
| [2] |
Lal R. Soil carbon sequestration impacts on global climate change and food security[J]. Science, 2004, 304(5677): 1623-1627. DOI:10.1126/science.1097396 |
| [3] |
潘根兴, 赵其国. 我国农田土壤碳库演变研究:全球变化和国家粮食安全[J]. 地球科学进展, 2005, 20(4): 384-393. Pan G X, Zhao Q G. Study on evolution of organic carbon stock in agricultural soils of China:facing the challenge of global change and food security[J]. Advances in Earth Science, 2005, 20(4): 384-393. DOI:10.3321/j.issn:1001-8166.2005.04.003 |
| [4] |
于贵瑞, 王绍强, 陈泮勤, 等. 碳同位素技术在土壤碳循环研究中的应用[J]. 地球科学进展, 2005, 20(5): 568-577. Yu G R, Wang S Q, Chen P Q, et al. Isotope tracer approaches in soil organic carbon cycle research[J]. Advances in Earth Science, 2005, 20(5): 568-577. DOI:10.3321/j.issn:1001-8166.2005.05.013 |
| [5] |
Tan Z X, Wang Y H, Kasiulienė A, et al. Cadmium removal potential by rice straw-derived magnetic biochar[J]. Clean Technologies and Environmental Policy, 2017, 19(3): 761-774. DOI:10.1007/s10098-016-1264-2 |
| [6] |
Liu X J, Tian G J, Jiang D, et al. Cadmium(Cd)distribution and contamination in Chinese paddy soils on national scale[J]. Environmental Science and Pollution Research, 2016, 23(18): 17941-17952. DOI:10.1007/s11356-016-6968-7 |
| [7] |
闫华, 欧阳明, 张旭辉, 等. 不同程度重金属污染对稻田土壤真菌群落结构的影响[J]. 土壤, 2018, 50(3): 513-521. Yan H, Ouyang M, Zhang X H, et al. Effects of different gradients of heavy metal contamination on soil fungi community structure in paddy soils[J]. Soils, 2018, 50(3): 513-521. |
| [8] |
张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义[J]. 农业环境科学学报, 2009, 28(12): 2459-2463. Zhang A F, Pan G X, Li L Q. Biochar and the effect on C stock enhancement, emission reduction of greenhouse gases and soil reclaimation[J]. Journal of Agro-Environment Science, 2009, 28(12): 2459-2463. DOI:10.3321/j.issn:1672-2043.2009.12.004 |
| [9] |
Anderson C R, Condron L M, Clough T J, et al. Biochar induced soil microbial community change:implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia, 2011, 54(5/6): 309-320. DOI:10.1016/j.pedobi.2011.07.005 |
| [10] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. Lu R K. Soil Chemical Analysis Methods[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [11] |
李小曼, 徐梦洁, 刘勤, 等. 基于内梅罗指数法及其改进方法的小尺度区域土壤重金属污染评价——以苏南地区为例[J]. 江苏农业科学, 2017, 45(3): 241-245. Li X M, Xu M J, Liu Q, et al. Evaluation of soil heavy metal pollution in small scale regions based on nemero index method and its improvement method:a case study of southern Jiangsu[J]. Jiangsu Agricultural Science, 2017, 45(3): 241-245. |
| [12] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [13] |
Wright A L, Provin T L, Hons F M, et al. Dissolved organic carbon in soil from compost-amended bermudagrass turf[J]. Hort Science, 2005, 40(3): 830-835. DOI:10.21273/HORTSCI.40.3.830 |
| [14] |
Cambardella C A, Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal, 1992, 56(3): 777-783. DOI:10.2136/sssaj1992.03615995005600030017x |
| [15] |
吴健利, 刘梦云, 赵国庆, 等. 黄土台塬土地利用方式对土壤有机碳矿化及温室气体排放的影响[J]. 农业环境科学学报, 2016, 35(5): 1006-1015. Wu J L, Liu M Y, Zhao G Q, et al. Effects of land-use types on soil organic carbon mineralization and greenhouse gas emissions in Loess tableland[J]. Journal of Agro-Environment Science, 2016, 35(5): 1006-1015. |
| [16] |
曹亚澄, 孙国庆, 韩勇, 等. 大气浓度下N2O、CH4和CO2中氮、碳和氧稳定同位素比值的质谱测定[J]. 土壤学报, 2008, 45(2): 249-258. Cao Y C, Sun G Q, Han Y, et al. Determination of nitrogen, carbon and oxygen stable isotope ratios in N2O, CH4 and CO2 at natural abundance levels by mass spectrometer[J]. Acta Pedologica Sinica, 2008, 45(2): 249-258. DOI:10.3321/j.issn:0564-3929.2008.02.009 |
| [17] |
刘志伟, 朱孟涛, 郭文杰, 等. 秸秆直接还田与炭化还田下土壤有机碳稳定性和温室气体排放潜力的对比研究[J]. 土壤通报, 2017, 48(6): 1371-1378. Liu Z W, Zhu M T, Guo W J, et al. Comparison of soil organic carbon stability and greenhouse gas emissions potential under straw or straw-derived biochar amendment[J]. Chinese Journal of Soil Science, 2017, 48(6): 1371-1378. |
| [18] |
罗煜, 赵小蓉, 李贵桐, 等. 酸性和碱性土壤中芒草生物质炭激发效应的特征与差异[J]. 土壤学报, 2014, 51(1): 90-95. Luo Y, Zhao X R, Li G T, et al. Characteristics of difference in priming effect of miscanthus-derived biochar in acid and alkaline soils[J]. Acta Pedologica Sinica, 2014, 51(1): 90-95. |
| [19] |
张秀, 尚艺婕, 王海波, 等. 重金属污染条件下生物质炭对土壤微生物群落结构及多样性影响的研究进展[J]. 中国农学通报, 2016, 32(25): 147-152. Zhang X, Shang Y J, Wang H B, et al. Advances in biochar effects on soil microbial community structure and diversity under heavy metal contamination[J]. Chinese Agricultural Science Bulletin, 2016, 32(25): 147-152. DOI:10.11924/j.issn.1000-6850.casb16010082 |
| [20] |
Zhang A F, Liu Y M, Pan G X, et al. Effect of biochar amendment on maize yield and greenhouse gas emissions from a soil organic carbon poor calcareous loamy soil from Central China Plain[J]. Plant and Soil, 2012, 351(1/2): 263-275. |
| [21] |
马孟园, 钱欢, 贾露露, 等. 生物质炭对重金属的修复及机理研究进展[J]. 广州化工, 2018, 46(16): 23-26. Ma M Y, Qian H, Jia L L, et al. Research progress on recovery and mechanism of biomass charcoal on heavy metals[J]. Guangzhou Chemical Industry, 2018, 46(16): 23-26. DOI:10.3969/j.issn.1001-9677.2018.16.013 |
| [22] |
裴俊敏, 李金全, 李兆磊, 等. 生物质炭施加对水-旱轮作农田土壤CO2排放及碳库的影响[J]. 亚热带资源与环境学报, 2016, 11(3): 72-80. Pei J M, Li J Q, Li Z L, et al. Effects of biochar on soil CO2 emissions and carbon pool in rice-wheat rotation croplands[J]. Journal of Subtropical Resources and Environment, 2016, 11(3): 72-80. DOI:10.3969/j.issn.1673-7105.2016.03.009 |
| [23] |
章明奎, Walelign D Bayou, 唐红娟. 生物质炭对土壤有机质活性的影响[J]. 水土保持学报, 2012, 26(2): 127-131, 137. Zhang M K, Bayou W D, Tang H J. Effects of biochar's application on active organic carbon fractions in soil[J]. Journal of Soil and Water Conservation, 2012, 26(2): 127-131, 137. |
| [24] |
邬建红, 潘剑君, 葛序娟, 等. 不同土地利用方式下土壤有机碳矿化及其温度敏感性[J]. 水土保持学报, 2015, 29(3): 130-135. Wu J H, Pan J J, Ge X J, et al. Variations of soil organic carbon mineralization and temperature sensitivity under different land use types[J]. Journal of Soil and Water Conservation, 2015, 29(3): 130-135. |
| [25] |
周涵君, 于晓娜, 秦燚鹤, 等. 施用生物炭对Cd污染土壤生物学特性及土壤呼吸速率的影响[J]. 中国烟草学报, 2017, 23(6): 61-68. Zhou H J, Yu X N, Qin Y H, et al. Effect of biochar application on soil biological characteristics and soil respiration rate in Cd contaminated soil[J]. Acta Tabacaria Sinica, 2017, 23(6): 61-68. |
| [26] |
郭碧林, 陈效民, 景峰, 等. 生物质炭添加对重金属污染稻田土壤理化性状及微生物量的影响[J]. 水土保持学报, 2018, 32(4): 279-284, 290. Guo B L, Chen X M, Jing F, et al. Effects of biochar addtion on physicochemical properties and microbial biomass of the red paddy soil polluted by heavy metals[J]. Journal of Soil and Water Conservation, 2018, 32(4): 279-284, 290. |
| [27] |
魏圆云, 崔丽娟, 张曼胤, 等. 土壤有机碳矿化激发效应的微生物机制研究进展[J]. 生态学杂志, 2019, 38(4): 1202-1211. Wei Y Y, Cui L J, Zhang M Y, et al. Research advances in microbial mechanisms underlying priming effect of soil organic carbon mineralization[J]. Journal of Ecology, 2019, 38(4): 1202-1211. |
| [28] |
徐学池, 苏以荣, 王桂红, 等. 秸秆还田配施氮肥对喀斯特农田微生物群落及有机碳矿化的影响[J]. 环境科学, 2019, 40(6): 2912-2919. Xu X C, Su Y R, Wang G H, et al. Straw returning plus nitrogen fertilizer affects soil microbial community and organic carbon mineralization in Karst farmland[J]. Environmental Science, 2019, 40(6): 2912-2919. |
| [29] |
匡崇婷, 江春玉, 李忠佩, 等. 添加生物质炭对红壤水稻土有机碳矿化和微生物生物量的影响[J]. 土壤, 2012, 44(4): 570-575. Kuang C T, Jiang C Y, Li Z P, et al. Effects of biochar amendments on soil organic carbon mineralization and microbial biomass in red paddy soils[J]. Soils, 2012, 44(4): 570-575. DOI:10.3969/j.issn.0253-9829.2012.04.007 |




