文章信息
- 郭玛丽, 张晓婷, 彭珍珍, 蔡亚非, 陆汉希, 黄文佳, 刘蓉, 张威
- GUO Mali, ZHANG Xiaoting, PENG Zhenzhen, CAI Yafei, LU Hanxi, HUANG Wenjia, LIU Rong, ZHANG Wei
- 家畜冷冻精液DNA的纯化及影响因素分析
- DNA purification from livestock frozen semen and analysis of influencing factors
- 南京农业大学学报, 2020, 43(2): 309-317
- Journal of Nanjing Agricultural University, 2020, 43(2): 309-317.
- http://dx.doi.org/10.7685/jnau.201907006
-
文章历史
- 收稿日期: 2019-07-05
2. 南京农业大学动物科技学院, 江苏 南京 210095;
3. 南京农业大学动物科学类国家级实验教学示范中心, 江苏 南京 210095;
4. 南京农业大学农业农村部牛冷冻精液质量监督检验测试中心(南京), 江苏 南京 210095
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
3. National Experimental Teaching Demonstration Center of Animal Science, Nanjing Agricultural University, Nanjing 210095, China;
4. Quality Supervision and Test Center of Cattle Frozen Sperm of Ministry of Agriculture and Rural Affairs(Nanjing), Nanjing Agricultural University, Nanjing 210095, China
雄性哺乳动物的精液由精浆和精子组成。其中, 精浆占精液体积的90%以上, 还有大量水、蛋白质、脂肪(甘油三酯)和果糖等物质[1-5], 为精子提供营养和能量。精子是雄性动物传递遗传物质的重要载体, 精子DNA的序列和质量对授精成功率和后代健康至关重要。为此, 在畜牧领域, 精液冷冻技术常被用来延长精液的保存时间, 维持其授精能力, 以便于人工授精的推广和优良种畜的繁育。传统的精液冷冻技术是在精液中添加含有甘油、果糖、棉子糖和无机盐等成分的保护剂[6-10], 以减轻冷冻复苏过程对精子细胞及DNA的损伤[11-12]。
与体细胞不同, 精子细胞的DNA是被精蛋白而非组蛋白包裹[13-14], 这使精子细胞核能高度凝聚压缩。因此精子细胞内染色质的密度要比体细胞内组蛋白结合的DNA至少高出6倍, 导致针对体细胞的高质量DNA提取技术不适用于精液DNA[15-16]。目前, 从人类精液中提取基因组DNA的方法已基本建立, 并有相应的试剂应用[17]。但从大型家畜, 如牛、马、驴等冷冻精液中纯化DNA的报道有限, 人类精液DNA提取方法是否适用于畜牧业, 以及冷冻精液中蛋白质、甘油/甘油三酯和果糖含量是否会影响DNA纯化的质量仍不清楚。
高纯度DNA是进行分子生物学研究的基础, 高效无毒的DNA提取方法是一个重要的研究方向。本试验基于人类精液DNA试剂盒法, 对家畜冷冻精液DNA纯化的初始样品量及蛋白酶解时间进行了优化, 尝试寻找最优的家畜冷冻精子DNA提取方法。同时探讨蛋白质、甘油/甘油三酯、果糖含量以及冻存时间对精液DNA纯化的影响, 并分析影响纯化DNA浓度的原因, 为提高纯化DNA的浓度和纯度提供指导, 为从配子DNA这一侧面研究家畜遗传改良及繁育生产奠定基础。同时, 冷冻精液DNA提取的高效性、便利性也会为保护优良地方家畜品种及进行深入进化起源关系分析等表观遗传学研究提供便利。
1 材料与方法 1.1 冷冻精液来源69份不同家畜(牛、马、驴)品种的冷冻精液样品由南京农业大学农业农村部牛冷冻精液质量监督检验测试中心(南京)提供, 具体信息如表 1所示。记录所有样品冻存日期, 以解冻提取DNA与冷冻时间的节点间月份差为冻存时间, 若当月冻存则计为1个月。取2头摩拉水牛的细管冻存精液用于DNA纯化条件的优化。
| 品种Breed | 样本量Sample number | 来源Source |
| 摩拉水牛# Murrah buffalo | 2 | 湖北省武汉市Wuhan City, Hubei Province |
| 黑牦牛Black yak | 18 | 青海省西宁市Xining City, Qinghai Province |
| 安格斯牛Angus cattle | 2 | 河南省许昌市Xuchang City, Henan Province |
| 红安格斯牛Red Angus cattle | 2 | 河南省许昌市Xuchang City, Henan Province |
| 中国荷斯坦牛Chinese Holstein cattle | 3 | 山东省临沂市Linyi City, Shandong Province |
| 夏洛莱牛Charolais cattle | 3 | 河南省许昌市Xuchang City, Henan Province |
| 西门塔尔牛Simmental cattle | 2 | 河南省郑州市Zhengzhou City, Henan Province |
| 蒙古牛Mongolian cattle | 3 | 新疆Xinjiang |
| 三河牛Sanhe cattle | 6 | 内蒙古呼伦贝尔市Hulun Buir City, Inner Mongolia |
| 德州驴Dezhou donkey | 13 | 山东省聊城市Liaocheng City, Shandong Province |
| 纯血马Thoroughbred horses | 15 | 山东省青岛市Qingdao City, Shandong Province |
| 注:#仅用于优化家畜冷冻精液样品DNA的提取方法。 Note:# represents livestock frozen semen samples that was used to optimize DNA extraction only. |
||
使用Omega提取试剂盒(D3591-02)并对试验步骤进行优化, 具体如下:在100 μL(或200 μL)解冻后的精液样品中加入等体积的裂解液[20 mmol · L-1 Tris-HCl(pH8.0), 20 mmol · L-1 EDTA, 200 mmol · L-1 NaCl, 80 mmol · L-1 DTT, 40 g · L-1 SDS]和1/4体积的蛋白酶K(20 mg · mL-1, D3591-02, Omega), 涡旋混匀后放入55 ℃水浴中酶解, 每隔30 min取出振荡混匀。分别孵育酶解0.5、1、1.5、2、3和5 h后, 取出样品降至室温, 然后每100 μL初始精液中加入220 μL BL溶液, 涡旋混匀后加入210 μL的无水乙醇再混匀。用吸头除去混合液中团状黏稠物。将剩下的混合液加入试剂盒提供的吸附柱中, 8 000 g离心1 min; 弃滤液后, 再加入500 μL的HB溶液, 8 000 g离心1 min, 弃滤液后用500 μL DNA洗涤溶液洗涤吸附柱3次, 每次静置5 min; 8 000 g离心1 min, 弃滤液, 再以最大转速离心吸附2 min, 除去残留乙醇。最后用100 μL 50 ℃预热的灭菌超纯水洗脱吸附柱2次。每次50 ℃金属浴静置5 min后8 000 g离心1 min, 收集DNA洗脱液。表示DNA浓度、纯度的A260/A280、A260/A230值由NanoDropTM One/OneC微量分光光度计(Thermo Fisher Scientific)测定。取上述所有纯化的DNA洗脱液各10 μL用于10 g · L-1琼脂糖凝胶电泳。
1.3 PCR扩增PCR反应总体系20 μL:DNA模板1 μL, 上、下游引物各1.2 μmol · L-1, 2×Taq Plus Master Mix Ⅱ(诺维赞生物)10 μL, 灭菌超纯水补齐。扩增牛核基因组ACTIN基因及5个线粒体基因CYTB、ND1、ATP6、16S、CO1, 所用引物如表 2所示。PCR条件:95 ℃ 3 min; 95 ℃ 20 s, 退火温度如表 2所示, 时间30 s, 72 ℃延伸42 s(CO1基因延伸时间为48 s), 35个循环; 最后72 ℃延伸10 min。取2 μL PCR产物用于10 g · L-1琼脂糖凝胶电泳成像检测。
| 引物对名称 Primer pairs name |
引物对序列 Primer pairs sequence(5′→3′) |
产物大小/bp Product size | 退火温度/℃ Annealing temperature |
| B-ACTIN-F/R | CGCTCATTGCCAATGGTGATC/CAGATCATGTTCGAGACGTTC | 400 | 55 |
| B-CYTB-F/R | TTCTCAGTAGAYAAAGCAACCCT/TGTCCTCCRATYCATGTGAGTGT | 520 | 61 |
| BE-ND1-F/R | AGCYCTACGRGCAGTAGCACA/GGRTAGGAWGCTCGGATTCA | 440 | 63 |
| BE-ATP6-F/R | STYCAACTTRYATCAAAACAAATAAT/TAGGCTTGGATTATAGCTACTGC | 487 | 50 |
| 16S-L/H | CGCCTGTTTATCAAAAACAT/CCGGTCTGAACTCAGATCACGT | 554 | 61 |
| CO1-2/4 | AYTCAACAAATCATAAAGATATTGG/ACYTCRGGRTGACCAAAAAATCA | 658 | 50 |
用北京索莱宝科技有限公司的Bradford法蛋白浓度测定试剂盒(PC0010)测定解冻精液中蛋白质含量。步骤如下:梯度稀释蛋白质标准品并绘制蛋白浓度与吸光值(A595)标准曲线。根据标准曲线的线性范围, 将样品分别稀释30倍和50倍, 分别取25 μL稀释液加入500 μL考马斯亮蓝G-250染料, 混匀后取200 μL混合液至96孔板, 在Tecan Spark型多功能酶标仪上测定吸光值(A595), 2次重复取均值。以同体积灭菌超纯水与染料混合液为空白对照。样品的蛋白相对含量由相对吸光值乘以相应的稀释倍数计算获得。
1.5 甘油/甘油三酯含量测定用南京建成生物工程研究所的甘油三酯(TG)测试盒(F001-1), 先将样品中的甘油三酯在酯蛋白酶作用下转换为甘油, 测定546 nm波长下吸光值(A546), 计算总甘油的相对含量。步骤如下:各解冻精液根据标准曲线稀释50和100倍, 按说明书的方法处理后在96孔板中测定吸光值(A546), 2次重复取均值。以灭菌超纯水经相应处理后为空白对照。样品的甘油/甘油三酯相对含量由相对吸光值乘以相应的稀释倍数计算获得。
1.6 果糖含量测定用南京建成生物工程研究所的果糖测试盒(A085)测定冷冻精液中果糖含量。将样品分别稀释2、4、8和10倍, 按说明书的方法处理后在96孔板中测定吸光值(A285), 2次重复取均值。以灭菌超纯水经相应处理后为空白对照。选择在标准曲线范围内的相对吸光值乘以稀释倍数计算得到样品的果糖相对含量。
1.7 数据的统计分析本试验数据的统计学分析用SPSS 25.0软件完成。差异显著性分析:2组数据比较采用双尾Student ’ s t测验, 2组以上数据比较采用单因素方差分析(ANOVA), 用LSD法检验差异显著性。采用斯皮尔曼(Spearman)相关系数法确定变量间的相关性。
2 结果与分析 2.1 牛冷冻精液DNA的纯化效果来自同一时间同一摩拉水牛的5 mL冷冻精液按100和200 μL初始样品量, 以及0.5、1、1.5和2 h蛋白酶解时间分成8组, 每组4个重复。灭菌超纯水2次洗脱后的DNA从浓度和A260/A280、A260/A230值3方面进行比较的结果显示:大部分吸附的DNA可由第1次超纯水洗脱获得, 第2次洗脱的DNA在A260/A280和A260/A230值方面均比第1次低(表 3)。这表示其中可能有更多蛋白、酚类或糖类等物质[18-20], 不可用于后续的研究。
| 样品处理 Sample treatment |
样本量/μL Sample volume |
DNA质量指标 DNA quality index |
酶解时间/h Protease digestion time | |||
| 0.5 | 1 | 1.5 | 2 | |||
| 第1次洗脱 | 100 | ρ(DNA)/(ng·μL-1) | 56.100±11.880b | 23.500±8.090d | 40.430±5.080c | 71.900±9.190a |
| 1st DNA elution | A260/A280 | 1.785±0.010a | 1.678±0.049b | 1.780±0.014a | 1.758±0.032a | |
| A260/A230 | 1.763±0.155a | 1.443±0.115b | 1.828±0.053a | 1.813±0.291a | ||
| 200 | ρ(DNA)/(ng·μL-1) | 19.100±2.540 | 28.500±9.110 | 18.730±1.460 | 26.450±2.800 | |
| A260/A280 | 1.668±0.069 | 1.678±0.047 | 1.703±0.017 | 1.708±0.030 | ||
| A260/A230 | 1.233±0.203 | 1.585±0.101 | 1.455±0.105 | 1.648±0.063 | ||
| 第2次洗脱 | 100 | ρ(DNA)/(ng·μL-1) | 24.530±12.070 | 21.330±4.620 | 18.430±4.200 | 26.450±5.000 |
| 2nd DNA elution | A260/A280 | 1.623±0.100 | 1.640±0.048 | 1.673±0.045 | 1.688±0.033 | |
| A260/A230 | 1.315±0.264 | 1.398±0.094 | 1.563±0.136 | 1.438±0.076 | ||
| 200 | ρ(DNA)/(ng·μL-1) | 11.550±1.980 | 18.630±1.940 | 10.630±0.830 | 15.150±2.950 | |
| A260/A280 | 1.505±0.071 | 1.668±0.080 | 1.598±0.013 | 1.583±0.114 | ||
| A260/A230 | 1.130±0.195 | 1.465±0.130 | 1.123±0.114 | 1.218±0.306 | ||
| 注:向吸附柱膜中滴加2次灭菌超纯水, 洗脱所得DNA即为第1次洗脱液和第2次洗脱液。 Note: Adding sterilization ultrapure water twice to the adsorption column membrane, the DNA obtained by centrifugation is the 1st and the 2nd elutions. |
||||||
2种初始样品量的比较结果显示:在大多数情况下100 μL初始量可以比200 μL取得更高的DNA浓度, A260/A280和A260/A230值也在较好范围之内(A260/A280:1.68~1.79;A260/A230:1.44~1.83)。部分条件下100 μL的DNA浓度和纯度显著优于200 μL样品(表 3)。
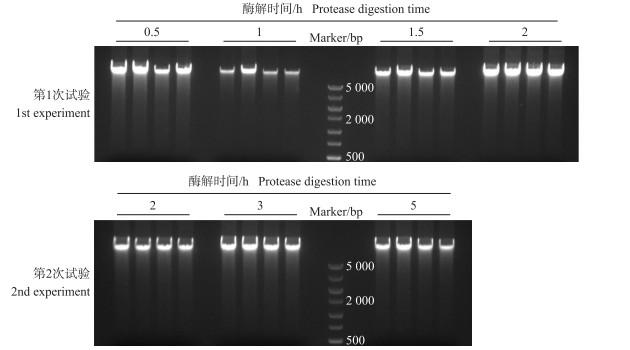
在蛋白酶解方面, 100 μL初始样品在酶解2 h后可以获得最高的DNA浓度。常理而言, 蛋白酶K处理时间越长对细胞裂解越彻底。为此, 来自同一时间另一头摩拉水牛的1.2 mL冷冻精液, 按100 μL初始样品量, 以及2、3和5 h蛋白酶解时间分成3组, 每组4个重复, 对样品裂解时间进一步优化。前后2次试验2 h组的第1次洗脱产物无显著差异, 说明试验重复性较好(表 3和表 4)。综合2次试验结果, 100 μL初始样品的DNA提取效果与酶解时间呈先降再升后平的非线性关系。其中, 在酶解3 h可以获得最纯的DNA产物, 为最佳提取条件, 更长裂解时间已不能再提升DNA质量(表 4)。7组100 μL初始精液的凝胶电泳显示:第1次洗脱下来的DNA完整性在各酶解时间下无明显差异, 但2和3 h酶解时间的3组DNA样品重复性和均一性最好(图 1)。
| 样品处理 Sample treatment |
DNA质量指标 DNA quality index |
酶解时间/h Protease digestion time | ||
| 2 | 3 | 5 | ||
| 第1次洗脱 | ρ(DNA)/(ng·μL-1) | 76.230±7.640b | 92.930±7.910a | 88.630±5.960a |
| 1st DNA elution | A260/A280 | 1.795±0.044 | 1.778±0.019 | 1.790±0.014 |
| A260/A230 | 1.928±0.220 | 1.905±0.035 | 1.778±0.243 | |
| 第2次洗脱 | ρ(DNA)/(ng·μL-1) | 38.280±2.410 | 42.200±2.910 | 35.480±2.350 |
| 2nd DNA elution | A260/A280 | 1.738±0.026 | 1.698±0.029 | 1.618±0.036 |
| A260/A230 | 1.573±0.134 | 1.568±0.078 | 1.400±0.065 | |
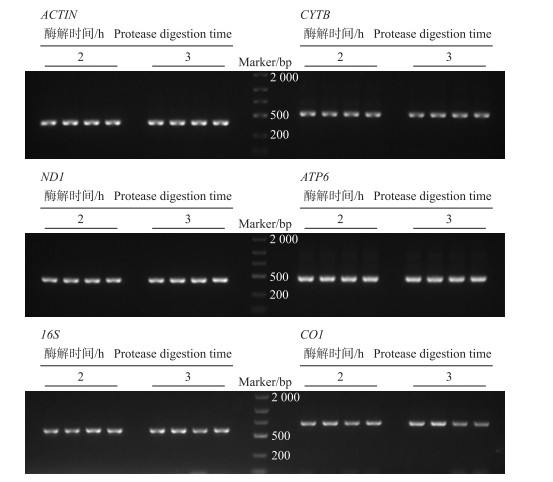
|
图 2 100 μL初始样品蛋白酶解2和3 h后产物的PCR扩增 Fig. 2 PCR amplification of products from 100 μL initial sample after 2 and 3 h protease digestion |
对初始量为100 μL、酶解2和3 h的8个DNA提取产物分别进行核基因组ACTIN基因和线粒体基因组CYTB、ND1、ATP6、16S、CO1的PCR扩增, 结果均为阳性(图 2)。凝胶电泳检测结果显示组内4个PCR产物条带亮度无明显差异, 说明试剂盒法可同时提取核基因组和线粒体基因组的DNA。这些结果表明, 初始量为100 μL、酶解2和3 h条件下的冷冻精液DNA不仅可以完全满足常规PCR试验的要求, 还能满足对核基因组和线粒体基因组的后续研究。
2.3 冷冻精液成分及冻存时间对DNA质量的影响理论上蛋白含量会随蛋白酶解时间延长而降低, 但0.5、1和3 h这3个酶解时间点的检测结果却显示果糖含量先增加16.4%, 随后又降低了51.4%(图 3-A)。而甘油/甘油三酯含量则总体呈微降趋势, 整个过程只降低了14.4%, 显示了甘油/甘油三酯的热稳定性(图 3-B)。酶解1 h时果糖含量的增加可能与冷冻保护剂中的多糖, 如棉子糖、褐藻胶、红景天多糖等的加热水解有关[6, 10], 其结果可能直接导致DNA的提取效果最差(表 3和图 3)。这表明果糖是影响DNA提取的一个关键干扰因素, 但可以随裂解时间的延长得以控制。
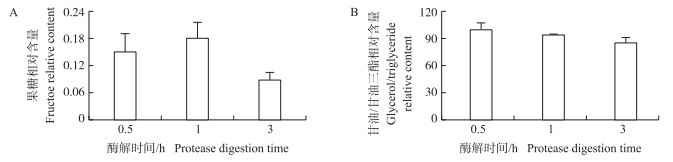
|
图 3 不同酶解时间的果糖、甘油/甘油三酯相对变化 Fig. 3 The relative changes of fructose, glycerol/triglyceride at different protease digestion time |
精液冷冻技术要求在含有大量蛋白质、脂肪(甘油三酯)和果糖的家畜精液中继续加入甘油、糖、盐等物质作为保护剂。因此, 与普通精液相比, 冷冻精液的成分及所处环境更为复杂。蛋白质、甘油/甘油三酯和果糖的含量及冻存时间可能会对DNA的纯化及其后续研究产生一定影响。为此, 取67份有明确冷冻时间记录的不同家畜(牛、马、驴)冷冻精液样品, 来研究蛋白质、甘油/甘油三酯、果糖含量及冻存时间与DNA纯化质量间的关系。每份冷冻精液分成4份, 分别用于蛋白质、甘油/甘油三酯和果糖的测定以及DNA的提取。考虑到100 μL样品5 h蛋白酶K处理可能已处于完全裂解状态, 所以采用2 h蛋白酶解条件用于各影响因素的分析。
试验结果显示:蛋白质、甘油/甘油三酯和果糖含量的升高都会对DNA的纯化质量产生负面影响(图 4)。从斯皮尔曼相关性系数r值来看, 蛋白质和果糖含量与DNA含量呈极显著负相关关系, 对DNA纯度的影响要强于对浓度的影响。而甘油/甘油三酯对DNA浓度的影响是三者中相对较强的, 略高于果糖, 但甘油/甘油三酯对DNA纯度的影响却是最弱的, 对纯度指标(A260/A280)无明显影响。DNA纯度的2个指标中, A260/A230比A260/A280对杂质的敏感度更高, 特别是冷冻精液中果糖含量与A260/A230的负相关性系数r是所有因素中最高的, 这与230 nm主要是碳水化合物最高吸收峰的吸收波长相一致[18]。
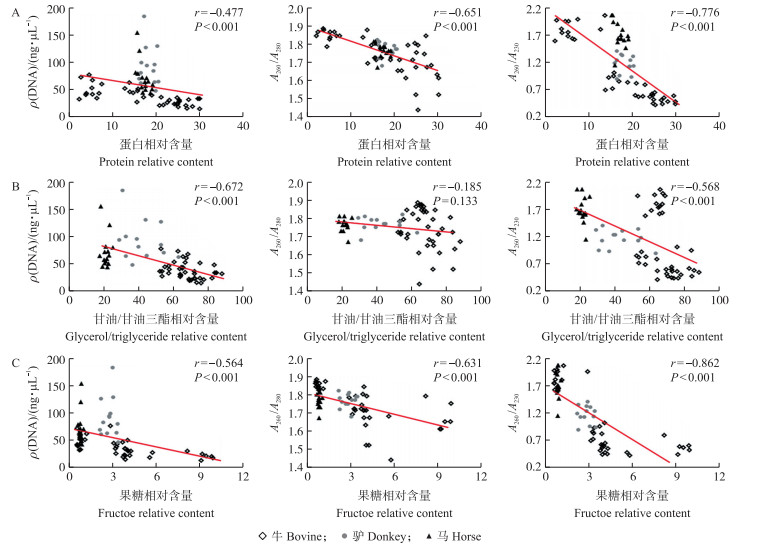
|
图 4 蛋白质(A)、甘油/甘油三酯(B)和果糖(C)相对含量对DNA纯化(第1次洗脱)质量的影响 Fig. 4 Influence of protein(A), glycerol/triglyceride(B)and fructose(C)relative content on DNA purification quality for the first elution |
本试验结果同样显示:冷冻精液冻存时间的延长也有利于提高精子DNA纯化的效果, 因为相关性分析结果表明, 第1次洗脱DNA的浓度、A260/A230与冻存时间显著正相关(图 5-A、C), 这可能与保护剂中蛋白质和果糖等物质的消耗有关。
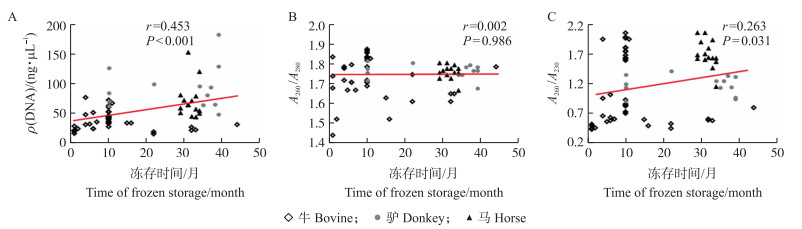
|
图 5 冻存时间对DNA质量指标的影响 Fig. 5 Influence of frozen storage time on DNA quality index A—C.第1次洗脱所得DNA的浓度(A)、A260/A280(B)和A260/A230(C)与冻存时间的关系。 A-C. The correlation between the concentration(A), A260/A280(B)and A260/A230(C)of DNA obtained from the first elution and time of frozen storage. |
精液能直观反映雄性配子的状态, 相对于其他组织更容易获得, 且对机体的损伤很小。因此, 精液被广泛用于生命科学领域的重要研究对象。精液冷冻技术也被广泛用于畜牧等领域[21], 用来延长精液的保存时间, 便于人工授精和优良种畜的繁育[8, 22], 同时也便于对与雄性配子DNA有关的遗传改良方面研究[23]。
本试验利用摩拉水牛的冷冻精液, 比较不同的初始冷冻精液样本量和蛋白酶解时间对DNA提取效率的影响, 优化适合冷冻精液提取的条件。试验结果显示, 包含冷冻保护剂的精液样品体积为100 μL, 蛋白酶解时间为3 h时, 提取效果最好、重复性最佳。同时, 蛋白酶解时间与DNA的得率无明显相关性, 以3 h为最佳, 5 h与之无显著差异, 2 h次之, 但2和3 h的DNA产物均可用于对核基因组和线粒体基因组的研究。相对心脏、肌肉等组织, 精子常被认为含有相对较少的线粒体, 且精子线粒体是冷冻保存过程中受损最严重的细胞器之一[24-25]。本试验纯化的DNA可用于线粒体基因CYTB、ND1、ATP6、16S、CO1的扩增, 多个基因位点的检测表明本试验的纯化方法效率较高。
在本试验之前, 已有针对人、水牛和山羊的不同精子DNA提取方法的报道[16, 26-27], 这些方法都是基于蛋白酶的水解功能[28], 再利用不同的DNA沉淀、吸附方法进行纯化。因为, 精液中蛋白质含量可以影响DNA纯化的质量[1, 29]。除了蛋白质, 精浆中还含有大量的果糖和脂肪(甘油三酯)[29-30], 为精子的生命活动提供能量。在不同的家畜物种间甚至个体间, 果糖浓度都存在很大的差异, 如羊和牛的果糖浓度较高, 而马、猪和鸡含量较低[31], 这些因素都有可能影响精子DNA的纯化。另外, 精液冷冻作为一种冻存手段, 常会根据不同物种添加不定量的甘油和糖类等物质[21]。这些外加因素使冷冻精液DNA的纯化更具不确定性。本试验提供的67份不同家畜冷冻精液的数据证明, 冷冻精液中的蛋白质、甘油/甘油三酯和果糖的含量确实会对DNA的纯化产生一定的负面影响。这也部分解释了包含冷冻保护剂在内的100 μL初始精液量优于200 μL的可能原因, 同时也为用于不同生产科研目的的冷冻精液添加保护剂提出了挑战。蛋白质、甘油/甘油三酯和果糖等物质虽可减少精子的冷冻伤害, 但是会影响DNA纯化的效率, 增加提取的难度, 所以需进一步探讨精液冷冻保护剂的组成成分, 平衡其中各物质的加入量, 或考虑其他的冷冻保护剂代替, 但其他糖类如葡萄糖、蔗糖、乳糖等, 及其他抗冻物质如二甲基亚砜(DMSO)、乙二醇等对精液DNA提取的影响还需进一步研究[32]。
一般认为, 酶解时间越长, 蛋白质裂解更充分, 但是酶解0.5 h的DNA浓度高于酶解1 h, 测定后1 h的果糖含量明显高于0.5和3 h, 说明果糖是干扰DNA纯化的关键因素。酶解时间从1 h延长到3 h时, 精液中果糖含量大幅度降低, 在DNA纯化过程中, 可通过适当延长样品的酶解时间来降低果糖对纯化的影响。冷冻精子在超低温状态下可长期保存, 一般可保存几十年之久。当温度回升时, 精子的代谢和运动及授精能力得以恢复。有研究表明长时间冻存, 冷冻复苏率显著降低, 可能由于冻存时间越长, 管中物质会发生一定变化[33], 对DNA纯化影响减小, 所以冻存时间越长, DNA浓度和A260/A280值有一定提高。但是冻存时间过长必会影响精子的质量, 实际应用中还需平衡精子的冻存时间。
综合本试验结果, 优化后的人精液DNA试剂盒提取法可满足家畜冷冻精液DNA的纯化要求, 使用100 μL的样品, 酶解3 h的DNA纯化效果最佳。冷冻精液中蛋白质、甘油/甘油三酯和果糖等含量的增加, 会降低DNA纯化的质量, 而冻存时间的延长可能因样品中各种物质如果糖、蛋白质等的消耗, 使DNA纯化质量得到改善。故对用于DNA研究的精液, 对冻存时间的要求较低, 较长时间的冻存不影响DNA纯化的质量, 同时可以调整糖类物质、抗冻物质的添加量, 保证精液品质的同时适当减少使用量。
| [1] |
Virji N, Eliasson R. LDH-C4 in human seminal plasma and testicular function. Ⅲ. Relationship to other semen variables[J]. Int J Androl, 1985, 8(5): 376-384. DOI:10.1111/j.1365-2605.1985.tb00850.x |
| [2] |
张红烨, 陆金春, 冯瑞祥. 24种精浆生化指标与精液常规参数的相关性研究[J]. 中华男科学杂志, 2015, 21(12): 1087-1092. Zhang H Y, Lu J C, Feng R X. Correlations of 24 biochemical markers in seminal plasma with routine semen parameters[J]. National Journal of Andrology, 2015, 21(12): 1087-1092 (in Chinese with English abstract). |
| [3] |
Giarola A. Biochemical and physical analysis of human semen. Ⅲ. Fructolysis index[J]. Ann Ostet Ginecol, 1954, 76(10): 1145-1153. |
| [4] |
Lu J C, Zhang H Y, Hu Y A, et al. A survey on the status of semen analysis in 118 laboratories in China[J]. Asian J Androl, 2010, 12(1): 104-110. DOI:10.1038/aja.2008.41 |
| [5] |
Strzezek J, Glogowski J. Chemical composition of the seminal plasma in animals and status of the reproductive system[J]. Med Weter, 1977, 33(2): 115-118. |
| [6] |
张少华, 张春香, 岳文斌, 等. 稀释液中添加棉子糖对冻融后绵羊精液品质的影响[J]. 中国畜牧兽医, 2011, 38(12): 138-141. Zhang S H, Zhang C X, Yue W B, et al. The effect of raffinose on frozen/thawed ujumqin sheep semen quality[J]. Chinese Animal Husbandry and Veterinary Medicine, 2011, 38(12): 138-141 (in Chinese with English abstract). |
| [7] |
Aitken R J, Jones K T, Robertson S A. Reactive oxygen species and sperm function-in sickness and in health[J]. J Androl, 2012, 33(6): 1096-1106. DOI:10.2164/jandrol.112.016535 |
| [8] |
Sieme H, Oldenhof H. Cryopreservation of semen from domestic livestock[J]. Methods Mol Biol, 2015, 1257: 277-287. |
| [9] |
Jeyendran R S, Graham E F. An evaluation of cryoprotective compounds on bovine spermatozoa[J]. Cryobiology, 1980, 17(5): 458-464. DOI:10.1016/0011-2240(80)90055-3 |
| [10] |
南向斌.三种多糖和冷冻平衡时间对牛精液冷冻效果影响的研究[D].杨凌: 西北农林科技大学, 2010. Nan X B. Study on three polysaccharides and equilibrium time for crypreservation of bull semen[D]. Yangling: Northwest A&F University, 2010(in Chinese with English abstract). |
| [11] |
Grotter L G, Cattaneo L, Marini P E, et al. Recent advances in bovine sperm cryopreservation techniques with a focus on sperm post-thaw quality optimization[J]. Reprod Dom Anim, 2019, 54(4): 655-665. DOI:10.1111/rda.13409 |
| [12] |
Al-Essawe E M, Wallgren M, Wulf M, et al. Seminal plasma influences the fertilizing potential of cryopreserved stallion sperm[J]. Theriogenology, 2018, 115: 99-107. DOI:10.1016/j.theriogenology.2018.04.021 |
| [13] |
Govin J, Caron C, Lestrat C, et al. The role of histones in chromatin remodelling during mammalian spermiogenesis[J]. Eur J Biochem, 2004, 271(17): 3459-3469. DOI:10.1111/j.1432-1033.2004.04266.x |
| [14] |
Hammoud S S, Nix D A, Zhang H, et al. Distinctive chromatin in human sperm packages genes for embryo development[J]. Nature, 2009, 460(7254): 473-478. DOI:10.1038/nature08162 |
| [15] |
Wu H, de Gannes M K, Luchetti G, et al. Rapid method for the isolation of mammalian sperm DNA[J]. Biotechniques, 2015, 58(6): 293-300. |
| [16] |
Silva E C, Pelinca M A, Acosta A C, et al. Comparative study of DNA extraction methodologies from goat sperm and its effects on polymerase chain reaction analysis[J]. Genet Mol Res, 2014, 13(3): 6070-6078. DOI:10.4238/2014.August.7.21 |
| [17] |
Crouse C A, Ban J D, D'Alessio J K. Extraction of DNA from forensic-type sexual assault specimens using simple, rapid sonication procedures[J]. Biotechniques, 1993, 15(4): 641-644. |
| [18] |
Shiurba R, Nandi S. Isolation and characterization of germ line DNA from mouse sperm[J]. Proc Natl Acad Sci USA, 1979, 76(8): 3947-3951. DOI:10.1073/pnas.76.8.3947 |
| [19] |
Santella R M. Approaches to DNA/RNA extraction and whole genome amplification[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(9): 1585-1587. DOI:10.1158/1055-9965.EPI-06-0631 |
| [20] |
Lienhard A, Schaffer S. Extracting the invisible:obtaining high quality DNA is a challenging task in small arthropods[J]. Peer J, 2019, 7: e6753. DOI:10.7717/peerj.6753 |
| [21] |
Papa P M. Effect of glycerol on the viability and fertility of cooled bovine semen[J]. Theriogenology, 2015, 83(1): 107-113. DOI:10.1016/j.theriogenology.2014.08.009 |
| [22] |
Welch J L, Madison M N, Margolick J B, et al. Effect of prolonged freezing of semen on exosome recovery and biologic activity[J]. Sci Rep, 2017, 7: 45034. DOI:10.1038/srep45034 |
| [23] |
Somashekar L, Selvaraju S. Comparative sperm protein profiling in bulls differing in fertility and identification of phosphatidylethanolamine-binding protein 4, a potential fertility marker[J]. Andrology, 2017, 5(5): 1032-1051. DOI:10.1111/andr.12404 |
| [24] |
Ball B A. Oxidative stress, osmotic stress and apoptosis:impacts on sperm function and preservation in the horse[J]. Anim Reprod Sci, 2008, 107(3/4): 257-267. |
| [25] |
Gonzalez-Fernandez L, Morrell J M, Pena F J, et al. Osmotic shock induces structural damage on equine spermatozoa plasmalemma and mitochondria[J]. Theriogenology, 2012, 78(2): 415-422. DOI:10.1016/j.theriogenology.2012.02.021 |
| [26] |
覃莉, 江莉, 李慕军, 等. 人类精液DNA提取方法的探讨及影响因素分析[J]. 广西医学, 2013, 35(4): 406-410. Qin L, Jiang L, Li M J, et al. Discussion on extraction of human semen DNA and analysis of its influencing factors[J]. Guangxi Medical Journal, 2013, 35(4): 406-410 (in Chinese with English abstract). |
| [27] |
李芳芳, 郭亚芬, 江明生, 等. 动物组织DNA试剂盒提取水牛精液基因组DNA效果观察[J]. 黑龙江畜牧兽医, 2018(9): 192-193. Li F F, Guo Y F, Jiang M S, et al. Observation on the effect of extracting buffalo semen genomic DNA from animal tissue DNA kit[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(9): 192-193 (in Chinese). |
| [28] |
Mesquita R A, Anzai E K, Oliveira R N, et al. Evaluation of 3 methods of DNA extraction from paraffin-embedded material for the amplification of genomic DNA using PCR[J]. Pesqui Odontol Bras, 2001, 15(4): 314-319. DOI:10.1590/S1517-74912001000400008 |
| [29] |
Amaral A, Lourenco B, Marques M, et al. Mitochondria functionality and sperm quality[J]. Reproduction, 2013, 146(5): R163-R174. DOI:10.1530/REP-13-0178 |
| [30] |
Foote R H, Kaprotht M T. Large batch freezing of bull semen:effect of time of freezing and fructose on fertility[J]. J Dairy Sci, 2002, 85(2): 453-456. DOI:10.3168/jds.S0022-0302(02)74094-0 |
| [31] |
王锋, 叶绍辉, 庞训胜, 等. 动物繁殖学[M]. 北京: 中国农业大学出版社, 2012: 101-102. Wang F, Ye S H, Pang X S, et al. Animal Thremmatology[M]. Beijing: China Agricultural University Press, 2012: 101-102 (in Chinese). |
| [32] |
贾永宏, 朱庆超, 杨海涛, 等. 牛精液冷冻保护剂研究进展[J]. 家畜生态学报, 2014, 35(1): 5-8. Jia Y H, Zhu Q C, Yang H T, et al. Research progress in cryoprotectant of bull semen cryopreservation[J]. Journal of Domestic Animal Ecology, 2014, 35(1): 5-8 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-1182.2014.01.002 |
| [33] |
彭向杰, 王斯洋, 范立青, 等. 精液长时间冷冻储存与冷冻复苏率的相关性研究[J]. 中国现代医学杂志, 2015, 25(26): 101-103. Peng X J, Wang S Y, Fan L Q, et al. Relationship between sperm survival rate after thaw and long-term cryostorage[J]. China Journal of Modern Medicine, 2015, 25(26): 101-103. DOI:10.3969/j.issn.1005-8982.2015.26.022 |