文章信息
- 吕朋安, 赵敏孟, 高天, 李蛟龙, 张林, 高峰
- Lü Peng'an, ZHAO Minmeng, GAO Tian, LI Jiaolong, ZHANG Lin, GAO Feng
- 胚蛋注射丙酮酸肌酸对肉鸡空肠消化吸收功能的影响
- Effects of in ovo feeding of creatine pyruvate on jejunum digestion and absorption function in broilers
- 南京农业大学学报, 2020, 43(2): 300-308
- Journal of Nanjing Agricultural University, 2020, 43(2): 300-308.
- http://dx.doi.org/10.7685/jnau.201903040
-
文章历史
- 收稿日期: 2019-03-20
不同于哺乳动物的持续母体营养供给, 鸟类胚胎发育所需营养物质全部来自于胚蛋。出壳前后, 肉鸡会经历营养供给从内源性卵黄到外源性日粮的转变[1], 其生长发育依赖于胃肠道的消化和吸收功能, 出壳前肠道在形态、细胞和分子水平发育迅速, 且在出壳时其肠道仍发育不成熟[2-3]。在实际生产中, 由于雏鸡出壳时间的差异以及出壳后雏鸡的饲养管理和转运等因素, 致使雏鸡在出壳后24~72 h难以及时开食和饮水, 残留的卵黄囊在出壳后消耗迅速, 不足以满足雏鸡能量需要[4]。研究表明, 雏鸡延迟开食降低肠道重量、绒毛长度和面积、隐窝深度及隐窝细胞密度, 这不利于肠道的消化、吸收和发育[5-6]。
胚蛋注射是指在家禽胚胎孵化后期, 在其羊膜腔注射营养物质或者活性物质, 家禽胚胎在孵化后期能够吞噬羊水, 注射的物质能够随着羊水被胚胎吞噬经肠道吸收利用, 从而改善雏鸡早期营养状况[7]。研究发现, 胚蛋注射氨基酸、碳水化合物、甘油、β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate, HMB)等外源营养素能够提高家禽肠道消化吸收能力[8-12]。丙酮酸肌酸(creatine pyruvate, CrPyr)是一种新型双功能营养素, CrPyr进入机体后, 发挥功效的为丙酮酸和肌酸。研究表明, 饲喂丙酮酸和肌酸增加肉鸡能量存储和蛋白质的沉积, 并有利于能量代谢[13]。本实验室前期研究表明, 胚蛋注射12 mg CrPyr能够提高肉鸡1~21 d生长性能[14], 这可能和促进肉鸡肠道发育相关。因此, 本试验拟采用胚蛋注射技术研究CrPyr对肉鸡空肠消化、吸收功能的影响, 为其在肉鸡生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料试验种蛋为从安徽和威农业开发股份有限公司购入的爱拔益加(Arbor Acres, AA)商品代受精蛋; 丙酮酸肌酸(CrPyr, 纯度≥98%)购自湖北巨胜科技有限公司。
1.2 试验方法 1.2.1 胚蛋孵化及注射试验采用单因素试验设计。选取大小相近的AA肉鸡商品代受精蛋1 400枚, 用0.1%(体积分数)新洁尔灭溶液进行消毒并晾干, 然后将所有种蛋放入全自动孵化器中。按照正常孵化程序孵化, 孵化温度(37.8±0.1)℃, 相对湿度60%。从开始孵化到孵化19 d, 每隔1.5 h翻蛋1次, 持续180 s。分别在孵化10和16 d进行照蛋, 将未受精的蛋和死胚蛋淘汰。第2次照蛋后, 选取720枚大小相近的胚蛋, 随机分成3组, 每组8个重复, 每个重复30枚, 称质量并编号, 继续按正常程序孵化。
在孵化17.5 d时进行胚蛋注射试验, 分3个处理组:空白对照组; 盐水组(0.6 mL 0.75%生理盐水); CrPyr组(12 mg CrPyr溶于0.6 mL 0.75%生理盐水)。配制生理盐水和CrPyr注射液所需的烧杯、量筒、溶液瓶、玻璃棒和双蒸水等物品在121.3 ℃、103.4 kPa条件下灭菌杀毒15 min。注射液经过0.22 μm无菌过滤器过滤除菌后放入孵化器中预温2 h至温度达到37.8 ℃左右。照蛋灯下确定羊膜腔位置, 将要注射部位用75%乙醇擦拭消毒, 用消毒后的锥子在注射部位钻大约1 mm深的孔, 将含有注射液的1 mL无菌注射器(8号针头)垂直插入孔中约2 cm, 将注射液注入羊膜腔中。每个鸡胚注射0.6 mL。注射完成后用石蜡封住注射部位, 待石蜡干燥后将胚蛋转入孵化中继续按正常程序孵化。
1.2.2 饲养试验雏鸡出壳后, 将每组的公雏挑出并称体质量, 从各组选出平均体质量接近的80只公雏, 随机分成8个重复, 每个重复10只。肉鸡采取笼饲养, 每笼1个重复, 笼子规格为110 cm×50 cm×60 cm。雏鸡可自由饮食和饮水, 鸡舍温度在饲养期前3 d设定为32~34 ℃, 之后每周温度调低2~3 ℃。日常管理参照AA肉鸡常规管理方法, 并进行常规的肉鸡免疫。日粮参考AA肉鸡的营养需要进行配制, 配方及营养水平见表 1。饲养期为21 d。
| 原料组成Ingredients composition | 水平Level |
| 玉米Corn | 57.61 |
| 豆粕Soybean meal | 31.00 |
| 玉米蛋白粉1 Corn gluten meal | 3.29 |
| 豆油Soybean oil | 3.11 |
| 石粉Limestone | 1.20 |
| 磷酸氢钙Dicalcium phosphate | 2.00 |
| L-赖氨酸盐酸盐L-lysine hydrochloride | 0.34 |
| DL-蛋氨酸DL-methionine | 0.15 |
| 食盐Sodium chloride | 0.30 |
| 预混料2 Premix | 1.00 |
| 代谢能3 Metabolizable energy | 12.56 |
| 粗蛋白质Crude protein | 21.10 |
| 钙Calcium | 1.00 |
| 有效磷Available phosphorus | 0.46 |
| 赖氨酸Lysine | 1.20 |
| 蛋氨酸Methionine | 0.50 |
| 注: 1)玉米蛋白粉粗蛋白含量为60%。2)预混料为每千克日粮提供:维生素A(VA)12 000 IU, VD3 3 000 IU, VE 20 IU, VK3 1.3 mg, 硫胺素2.2 mg, 核黄素8.0 mg, 烟酸40 mg, 氯化胆碱400 mg, 泛酸钙10 mg, 吡哆醇4 mg, 生物素0.04 mg, 叶酸1 mg, VB120.013 mg, 铁80 mg, 铜8.0 mg, 锰110 mg, 锌60 mg, 碘1.1 mg, 硒0.3 mg。3)代谢能单位为MJ · kg-1。 Note: 1)Crude protein content of corn gluten meal was 60%. 2)Premix provided the follow per kg of basal diet:vitamin A(VA)12 000 IU, VD3 3 000 IU, VE 20 IU, VK3 1.3 mg, thiamine 2.2 mg, riboflavin 8.0 mg, nicotinic acid 40 mg, choline chloride 400 mg, calcium pantothenate 10 mg, pyridoxine 4 mg, biotin 0.04 mg, folic acid 1 mg, VB12 0.013 mg, Fe 80 mg, Cu 8.0 mg, Mn 110 mg, Zn 60 mg, I 1.1 mg, Se 0.3 mg. 3)The unit of metabolizable energy is MJ · kg-1. |
|
在孵化19 d, 每个重复随机挑选胚蛋, 75%乙醇消毒后敲破蛋壳, 完整剥离并解剖胚胎, 参照Burke[15]鉴别雄性鸡胚的方法, 每个重复选取2个雄性鸡胚。在出壳当天(0 d)及出壳后7和21 d, 每个重复随机挑选1只与本重复平均体质量相近的雄性肉鸡, 颈部放血处死。将空肠组织剪开, 用消毒后玻璃片刮取空肠黏膜, 迅速放入1.5 mL无RNA酶冻存管中, 于-80 ℃冰箱保存待测。
1.4 指标测定 1.4.1 黏膜酶活性分别取孵化19 d(-19 d)与出壳0、7和21 d的空肠组织黏膜样约50 mg, 放入9倍于空肠组织体积的冷生理盐水中, 冰浴下机械匀浆后, 4 ℃、1 467 g离心, 取上清液分样后放入-20 ℃冰箱中待测。
碱性磷酸酶(alkaline phosphatase, AKP)和二糖酶(蔗糖酶和麦芽糖酶)活性采用南京建成生物研究所的试剂盒测定, 具体操作严格遵循试剂盒说明书。N-氨基肽酶活性测定参照文献[16], 以L-丙氨酸-P-硝基苯胺作为底物。
1.4.2 空肠黏膜胃肠激素称取空肠黏膜样品50 mg, 然后加入9倍体积的预冷的0.75%生理盐水, 冰浴条件下机械匀浆30 s。将空肠组织匀浆液在4 ℃、3 500 g离心15 min, 取上清液于-20 ℃保存待测。
采用ELISA试剂盒(南京奥青生物技术有限公司)分别测定空肠的胰高血糖素样肽2(glucagon-like peptide 2, GLP-2)、胃饥饿素(ghrelin)、血管活性肠肽(vasoactive intestinal peptide, VIP)含量。
1.4.3 空肠黏膜营养素转运载体和味觉感受体基因mRNA表达水平采用TaKaRa(大连)的试剂盒提取空肠总RNA, 再反转录成cDNA(反转录体系为60 μL)。在NCBI(https://www.ncbi.nlm.nih.gov/)查询目的基因Na+依赖性葡萄糖转运载体1(SGLT1)、易化葡萄糖转运载体2(GLUT2)、易化葡萄糖转运载体5(GLUT5)、肽转运载体1(PepT1)、氨基酸转运载体(CAT1、rBAT、EAAT3)和管家基因GADPH的mRNA序列, 由上海生工生物技术有限公司设计引物。目标基因引物序列见表 2。
| 目的基因 Target gene |
引物对序列 Primer pair sequence(5′→3′) |
产物大小/bp Product size | 基因序列号 GenBank ID |
| SGLT1 | F:TTTGGGATTTCTGCCATTGT/R:ATGCGTTCCTCTTTGCTGTT | 113 | NM_001293240.1 |
| GLUT2 | F:CCGCAGAAGGTGATAGAAGC/R:CCTGGGATGGTGACAGTGAT | 113 | NM_207178.1 |
| GLUT5 | F:CCTTGGCATCCTCATAGCTC/R:GCAGCGTAAGGAGCTGAAGT | 119 | XM_004947446.3 |
| CAT1 | F:CTGGATACCAACAGCCCATT/R:GAAACATGGAGCCAAGGAGA | 121 | NM_001145490.1 |
| rBAT | F:CTGAAGTTCTCCAGCCAAGC/R:ACTTTGGGGACAGAGCAATG | 121 | XM_004935370.3 |
| B0AT1[18] | F:TATCCTGGCTGGGTCTATGC/R:AGGCCTGTACGATCCCTTCT | 125 | XM_419056.6 |
| EAAT3 | F:TGATTGTTCTGAGCGCTGTC/R:TACCAAAGGCATCTCCCAAG | 117 | XM_424930.6 |
| PepT1 | F:CACGTTTGTTGCTCTGTGCT/R:GACTGCCTGCCCAATTGTAT | 121 | NM_204365.1 |
| FATP4[18] | F:ATACCTCTGGCACTACGGGAAT/R:CATACATCACATCATCGGGTCT | 117 | XM_015279553.2 |
| T1R1 | F:TTCAGCCTGCACAAGAGCTA/R:TGAAAGCTCCAACCACATCA | 121 | XM_015297004.2 |
| T1R3 | F:TAGCTGCCTCCATCCCAAAC/R:GAGCTTACGTGGCGGTAGAA | 166 | XM_025142692.1 |
| CaSR | F:AAACCATGAGCTGGAGGATG/R:GGCAAAGAAGAAGCAGATGG | 118 | XM_416491.6 |
| GAPDH | F:GAGGGTAGTGAAGGCTGCTG/R:CATCAAAGGTGGAGGAATGG | 113 | NM_204305.1 |
| 注: SGLT1 :Na+依赖性葡萄糖转运载体1基因Sodium-glucose transporter 1 gene; GLUT 2 :易化葡萄糖转运载体2基因Glucose transporter 2 gene; GLUT5 :易化葡萄糖转运载体5基因Glucose transporter 5 gene; CAT1 :系统氨基酸转运载体基因Caustic amino acid transporter gene; rBAT:b 0, +系统氨基酸转运载体基因Amino acid transporter related to b 0, + gene; B0AT1:B0型氨基酸转运载体1基因Amino acid transporter related to B 0 gene; EAAT3 :酸性氨基酸转运载体基因Excitatory amino acid transporter 3 gene; PepT1 :肽转运载体1基因Peptide transporter 1 gene; FATP4 :脂肪酸转运蛋白4基因Fatty acid transporter protein 4 gene; T1R1 :味觉受体1基因Taste receptor type 1 member 1 gene; T1R3 :味觉受体3基因Taste receptor type 1 member 3 gene; CaSR:钙离子传感受体基因Calcium-sensing receptor gene; GAPDH:内参基因House keeping gene. | |||
实时荧光定量PCR(qPCR)反应试剂盒为SYBR Premix Ex Taq(TaKaRa, 大连)。反应体系(20 μL):10 μL SYBR Premix Ex Taq(2×), 0.4 μL ROX Reference Dye Ⅱ(50×), 1.0 μL cDNA模板, 上、下游引物各0.4 μL, 7.8 μL无RNA酶的双蒸水。反应程序:95 ℃ 30 s; 95 ℃ 5 s(循环40次), 60 ℃ 30 s; 然后95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。每个样本每个基因平行测定3次, 取平均(CT)值。基因表达水平计算方法采用2-ΔΔCT法[17]。
1.5 数据统计与分析数据经Excel 2010初步整理后, 应用SPSS 20.0统计软件的One-way ANOVA程序进行单因素方差分析和Tukey ’ s多重比较。表中数据结果以平均值(x)和平均标准误(SEM)表示, 图中数据结果均以平均值±标准误(x±SE)表示。
2 结果与分析 2.1 胚蛋注射CrPyr对肉鸡空肠黏膜酶活性的影响由表 3可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著提高了孵化19 d(-19 d)鸡胚及出壳当天(0 d)肉鸡空肠黏膜二糖酶(蔗糖酶、麦芽糖酶)和AKP的活性(P < 0.05);出壳7和21 d各组肉鸡空肠黏膜二糖酶和AKP活性无显著差异(P>0.05)。胚蛋注射CrPyr对4个时期肉鸡或鸡胚空肠的N-氨基肽酶活性无显著影响(P>0.05)。
| 黏膜酶 Mucosa enzymes |
出壳后时间/d Time post-hatch | 处理Treatment | 平均标准误 SEM |
||
| 对照组 Control |
盐水组 Saline group |
丙酮酸肌酸组 CrPyr group |
|||
| 蔗糖酶活性/(U·mg-1) Sucrase activity |
-19 | 6.48b | 6.29b | 7.89a | 0.213 |
| 0 | 42.77b | 44.75b | 55.55a | 1.686 | |
| 7 | 23.45 | 22.06 | 25.10 | 0.715 | |
| 21 | 65.18 | 62.57 | 64.16 | 1.985 | |
| 麦芽糖酶活性/(U·mg-1) Maltase activity |
|||||
| -19 | 41.23b | 43.40b | 51.48a | 1.481 | |
| 0 | 436.33b | 449.63b | 616.22a | 23.094 | |
| 7 | 126.61 | 129.34 | 152.74 | 5.108 | |
| 21 | 789.43 | 774.99 | 740.64 | 21.323 | |
| 碱性磷酸酶活性/(U·mg-1) Alkaline phosphatase (AKP)activity |
-19 | 0.09b | 0.09b | 0.18a | 0.010 |
| 0 | 0.99b | 1.13b | 1.86a | 0.091 | |
| 7 | 0.52 | 0.50 | 0.57 | 0.018 | |
| 21 | 1.08 | 1.09 | 1.00 | 0.032 | |
| N-氨基肽酶活性/(U·mg-1) N-aminopeptidase activity |
-19 | 44.98 | 49.56 | 52.22 | 1.433 |
| 0 | 48.38 | 49.48 | 49.41 | 1.364 | |
| 7 | 17.70 | 19.85 | 17.33 | 0.537 | |
| 21 | 26.51 | 26.20 | 24.30 | 0.921 | |
| 注: 1)-19、0、7、21日龄分别是指孵化19 d、出壳当天、出壳后7和21 d。2)同一行平均值肩标字母不同表示差异显著(P < 0.05)。下同。 Note: 1)-19、0、7、21 d stand for 19 d of incubation, the day of hatch, 7 d and 21 d post-hatch. 2)Means within a row with different superscript are significantly different(P < 0.05). The same as follows. |
|||||
比较空肠胃肠激素结果(表 4):胚蛋注射CrPyr显著降低了孵化19 d鸡胚和出壳7、21 d肉鸡空肠黏膜胃饥饿素水平(P < 0.05), 对出壳0 d肉鸡空肠黏膜胃饥饿素无显著影响(P>0.05);与对照组和盐水组相比, CrPyr注射组显著提高了孵化19 d鸡胚和出壳0 d雏鸡空肠黏膜血管活性肠肽(VIP)水平(P < 0.05), 对出壳7和21 d肉鸡空肠黏膜VIP水平无显著影响(P>0.05);此外, 3个组的GLP-2水平无显著差异(P>0.05)。
| 胃肠激素 Gastrointestinal hormones |
出壳后时间/d Time post-hatch | 处理Treatments | 平均标准误 SEM |
||
| 对照组Control | 盐水组Saline group | 丙酮酸肌酸组CrPyr group | |||
| 胰高血糖素样肽2/ (pg·mg-1) Glucagon-like peptide-2 (GLP-2) |
-19 | 7.53 | 7.19 | 7.24 | 0.152 |
| 0 | 6.54 | 6.75 | 6.58 | 0.174 | |
| 7 | 4.01 | 3.90 | 3.85 | 0.088 | |
| 21 | 4.03 | 3.85 | 3.72 | 0.095 | |
| 胃饥饿素/ (ng·mg-1) Ghrelin |
-19 | 165.16a | 159.33a | 134.93b | 4.313 |
| 0 | 129.72 | 124.65 | 128.46 | 3.775 | |
| 7 | 76.91a | 70.01a | 56.20b | 2.675 | |
| 21 | 65.23a | 62.19a | 48.83b | 2.098 | |
| 血管活性肠肽/ (ng·mg-1) Vasoactive intestinal peptide(VIP) |
-19 | 74.08b | 72.24b | 88.79a | 2.653 |
| 0 | 61.36b | 62.16b | 77.65a | 2.776 | |
| 7 | 45.78 | 42.73 | 44.85 | 1.374 | |
| 21 | 36.13 | 38.51 | 36.00 | 1.088 | |
由图 1-A和图 1-B可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳7、21 d肉鸡空肠SGLT1、GLUT2基因mRNA的表达水平(P < 0.05), 对出壳当天的mRNA表达水平无显著影响(P>0.05);由图 1-C可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳7 d肉鸡空肠GLUT5基因mRNA的表达水平(P < 0.05), 对出壳0、21 d肉鸡空肠的GLUT5基因mRNA表达水平无显著影响(P>0.05)。
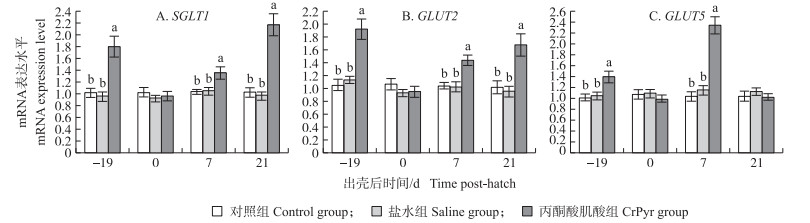
|
图 1 胚蛋注射CrPyr对肉鸡空肠黏膜糖转运载体基因mRNA表达水平的影响 Fig. 1 Effects of IOF of CrPyr on relative expression level of carbohydrate transporters mRNA in jejunum of embryos or broilers 同一时间点不同处理上标字母表示差异显著(P < 0.05)。下同。 Different letters within the same time point indicate significant difference among the three treatments(P < 0.05). The same as follows. |
由图 2-A可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了出壳21 d肉鸡空肠CAT1基因mRNA表达水平(P < 0.05), 而对孵化19 d和出壳7 d CAT1基因mRNA表达水平无显著影响(P>0.05);各组EAAT 3基因表达水平无显著差异(P>0.05)(图 2-B); 图 2-C和D表明, 与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳7 d肉鸡空肠B 0AT和rBAT基因mRNA表达水平(P < 0.05), 对出壳0 d和21 d基因mRNA表达水平无显著影响(P>0.05);由图 2-E可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳7、21 d肉鸡空肠PepT1基因mRNA表达水平(P < 0.05), 对出壳当天基因mRNA表达水平无显著影响(P>0.05)。
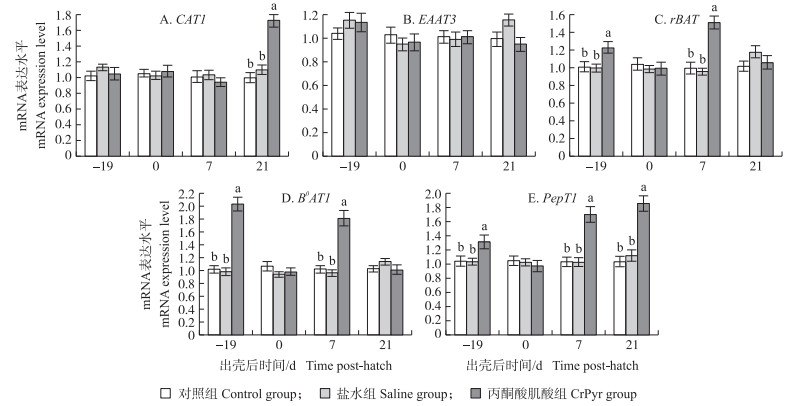
|
图 2 胚蛋注射CrPyr对肉鸡空肠氨基酸转运载体和肽转运载体基因mRNA表达水平的影响 Fig. 2 Effects of IOF of CrPyr on relative expression level of amino acid and peptide transporter mRNA in jejunum of embryos or broilers |
由图 3可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著上调了出壳0、7和21 d肉鸡空肠FATP4基因mRNA表达水平(P < 0.05), 对孵化19 d鸡胚空肠FATP4基因mRNA表达水平无显著影响(P>0.05)。
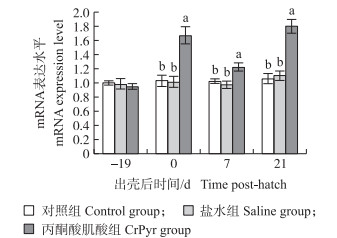
|
图 3 胚蛋注射CrPyr对肉鸡空肠黏膜脂肪酸转运蛋白4基因mRNA表达水平的影响 Fig. 3 Effects of IOF of CrPyr on relative expression level of FATP4 mRNA in jejunum of embryos or broilers |
由图 4可知:与对照组和盐水组相比, 胚蛋注射CrPyr显著提高了孵化19 d胚胎和出壳7 d肉鸡空肠黏膜T1R1基因mRNA的表达水平(P < 0.05), 而对出壳0和21 d肉鸡空肠黏膜的T1R1基因mRNA表达水平无显著影响(P>0.05);此外, 胚蛋注射CrPyr对胚胎或肉鸡空肠黏膜CaSR和T1R3基因mRNA表达水平无显著影响(P>0.05)。
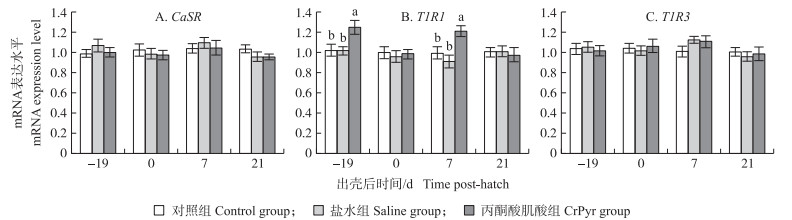
|
图 4 胚蛋注射CrPyr对肉鸡空肠黏膜味觉感受体相关基因mRNA表达的影响 Fig. 4 Effects of IOF of CrPyr on relative expression level of sensing receptors mRNA in jejunum of embryos or broilers |
本实验室前期研究表明, 与对照组和注射生理盐水相比, 胚蛋注射不同剂量的CrPyr对胚蛋孵化率无显著影响; 胚蛋注射12 mg CrPyr显著提高了肉鸡出壳当天及出壳3、7和21 d体质量; 胚蛋注射6或12 mg CrPyr显著提高了8~21日龄肉鸡体增重和采食量[14]。机体生长发育依赖肠道消化吸收, CrPyr对肉鸡生产性能的改善可能与肠道发育有关。
日粮中大分子营养物需经过刷状缘酶水解成小分子的单糖、氨基酸或者小肽才能被上皮细胞吸收利用。二糖酶和寡肽酶在营养物质的最终消化中有非常重要的作用。本试验结果显示, 胚蛋注射CrPyr组显著提高了孵化19 d和出壳当天二糖酶活性, 且活性优势一直持续到出壳后7 d。二糖酶活性的增加可提高空肠上皮细胞对二糖的消化能力[19]。与本研究结果相似, 胚蛋注射精氨酸也能够提高火鸡或肉鸡空肠二糖酶活性[8, 11], 这说明非底物对二糖酶活性也有调控作用。碱性磷酸酶(AKP)被认为是肠道细胞成熟的标志物[20], 能调节十二指肠碳酸氢盐分泌及其表面pH值, 调控肠道脂肪酸的吸收, 通过对磷脂A的脱磷酸作用脱毒细菌的脂多糖, 进而缓解由脂多糖引起的肠道炎症[21]。与二糖酶结果类似, 胚蛋注射CrPyr组显著提高了孵化19 d和出壳当天AKP活性。AKP活性能够被许多营养素如脂肪酸、碳水化合物、氨基酸、维生素和矿物元素等影响[21], 但其具体机制仍不明确。二糖酶和AKP活性的提高, 在一定程度上改善空肠肠道健康和消化吸收能力, 有利于出壳后雏鸡对富含碳水化合物日粮的适应。
胃饥饿素最早在小鼠胃中发现, 小鼠注射胃饥饿素后发现其能刺激生长激素释放, 促进摄食[22]。而在肉鸡上静脉或侧脑室注射胃饥饿素能抑制采食[23-24]。本研究中, 胚蛋注射CrPyr组孵化19 d鸡胚或出壳7和21 d肉鸡空肠胃饥饿素浓度显著低于对照组和盐水组, 这有利于雏鸡出壳后的采食和体质量增加。而前期研究表明, 胚蛋注射12 mg CrPyr显著提高了肉鸡8~21 d的采食量和体增重[14], 这可能和CrPyr组肉鸡胃饿素浓度降低有关。血管活性肠肽(VIP)是一种广泛分布于鸟类消化管和生殖管及腔上囊的神经肽[25]。VIP能够促使肠道主细胞分泌胃蛋白酶原, 抑制胃肠道平滑肌收缩, 调节小肠上皮细胞分泌水和电解质等, 这有利于胃肠道消化吸收功能[26]。本研究中, 胚蛋注射CrPyr提高了孵化19 d鸡胚和出壳当天肉鸡空肠黏膜VIP浓度, 这有利于雏鸡提高消化吸收能力。
进入肠道的大分子营养物质被消化分解成小分子物质后, 最终经过肠道上皮被吸收进血液。肠道中发挥作用的糖转运蛋白主要有SGLT1、GLUT2和GLUT5。葡萄糖和半乳糖由SGLT1主动运输到肠道上皮细胞中, 果糖则是由GLUT5易化扩散转运到肠道上皮细胞, 进入到肠上皮细胞中的3种单糖则经GLUT2易化扩散到血液中供机体利用[27]。本研究中, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳后肉鸡空肠黏膜碳水化合物转运载体SGLT1、GLUT2、GLUT5基因mRNA的表达水平。由本试验结果可知, CrPyr组二糖酶活性显著升高, 这与糖转运蛋白mRNA表达水平升高相一致。肠道糖转运能力和二糖消化能力的提高有利于空肠对日粮中碳水化合物消化和吸收, 这对于机体维持能量供给和生长发育非常重要。日粮中蛋白被分解成氨基酸或者小肽后, 被相关的氨基酸转运载载体或H+依赖性的肽转运载体1(PepT1)转运进入肠上皮, 其中后者为主要的转运途径[28]。本研究中, 胚蛋注射CrPyr显著上调了孵化19 d鸡胚和出壳7、21 d肉鸡空肠的PepT1和氨基酸转运载体基因mRNA的表达水平。空肠更好摄取氨基酸和小肽, 有益于机体的生长发育。虽然长链脂肪酸能自由扩散穿过浆膜, 但是大多数长链脂肪酸的摄取呈现出蛋白调节, 而FATP4为肠道中重要的脂肪酸调控因子[29-31]。目前关于脂肪酸转运载体调控因子的研究鲜有报道, 本研究中胚蛋注射CrPyr显著上调了出壳当天及出壳7和21 d肉鸡空肠黏膜FATP4等基因mRNA的表达水平, 这有利于肠道对于脂肪酸的摄取。
胃肠道不仅是机体主要的消化和吸收场所, 胃肠道中的内分泌细胞能够感受、检测和反馈肠腔中的营养物质和非营养性的化学信号, 进而启动下游的一系列反应, 如促进激素分泌, 引起肠道蠕动和排空, 影响消化和吸收活性等[32]。肠道内分泌细胞表达的T1R1和T1R3组成的聚合体能够感受L-脂肪族氨基酸和核苷酸, T1R2和T1R3组成的二聚体为甜味受体[32]; 禽类缺少T1R2受体, 推测T1R3可作为单体感受甜味[32]。本试验中, 胚蛋注射CrPyr组在孵化19 d鸡胚和出壳7 d肉鸡空肠的T1R1基因表达水平显著升高, 而对T1R3基因的表达水平无影响。这有利于肉鸡对进入肠道的营养素进行感受、识别和后续的消化吸收。
本试验中, CrPyr注射组显著提高了肉鸡空肠黏膜二糖酶和碱性磷酸酶活性, 上调了糖、氨基酸、肽和脂肪酸相关转运蛋白基因mRNA的表达水平; 同时, 可有效抑制胃饥饿素的分泌并促进VIP激素的分泌, 上调T1R1基因的表达量。
综上所述, 在肉鸡胚蛋孵化17.5 d通过羊膜腔注射12 mg CrPyr可增强肉鸡空肠对日粮中糖的消化与吸收及蛋白质与脂肪酸消化后的转运, 这有利于改善雏鸡出壳后对富含糖和蛋白质日粮的适应能力, 促进其生长发育。
| [1] |
Cardeal P C, Caldas E O L, Lara L J C, et al. In ovo feeding and its effects on performance of newly-hatched chicks[J]. World's Poultry Science Journal, 2015, 71(4): 655-662. DOI:10.1017/S0043933915002445 |
| [2] |
Uni Z, Geyra A, Ben-Hur H, et al. Small intestinal development in the young chick:crypt formation and enterocyte proliferation and migration[J]. British Poultry Science, 2000, 41(5): 544-551. DOI:10.1080/00071660020009054 |
| [3] |
Uni Z, Tako E, Gal-Garber O, et al. Morphological, molecular, and functional changes in the chicken small intestine of the late-term embryo[J]. Poultry Science, 2003, 82(11): 1747-1754. DOI:10.1093/ps/82.11.1747 |
| [4] |
Noy Y, Uni Z. Early nutritional strategies[J]. World's Poultry Science Journal, 2010, 66(4): 639-646. DOI:10.1017/S0043933910000620 |
| [5] |
Lamot D M, van de Linde I B, Molenaar R, et al. Effects of moment of hatch and feed access on chicken development[J]. Poultry Science, 2014, 93(10): 2604-2614. DOI:10.3382/ps.2014-04123 |
| [6] |
Mahmoud K Z, Edens F W. Breeder age affects small intestine development of broiler chicks with immediate or delayed access to feed[J]. British Poultry Science, 2012, 53(1): 32-41. DOI:10.1080/00071668.2011.652596 |
| [7] |
Kadam M M, Barekatain M R, Bhanja S K, et al. Prospects of in ovo feeding and nutrient supplementation for poultry:the science and commercial applications:a review[J]. Journal of the Science of Food and Agriculture, 2013, 93(15): 3654-3661. DOI:10.1002/jsfa.6301 |
| [8] |
Foye O T, Ferket P R, Uni Z. The effects of in ovo feeding arginine, β-hydroxy-β-methyl-butyrate, and protein on jejunal digestive and absorptive activity in embryonic and neonatal turkey poults[J]. Poultry Science, 2007, 86(11): 2343-2349. DOI:10.3382/ps.2007-00110 |
| [9] |
Dong X Y, Wang Y M, Song H H, et al. Effects of in ovo injection of carbohydrate solution on small intestine development in domestic pigeons(Columba livia)[J]. Journal of Animal Science, 2013, 91(8): 3742-3749. DOI:10.2527/jas.2013-6400 |
| [10] |
Gao T, Zhao M M, Li Y J, et al. Effects of in ovo feeding of L-arginine on the development of digestive organs, intestinal function and post-hatch performance of broiler embryos and hatchlings[J]. Journal of Animal Physiology & Animal Nutrition, 2017, 102(1): 1-10. |
| [11] |
Gao T, Zhao M M, Zhang L, et al. Effects of in ovo feeding of L-arginine on the hatchbility, growth performance, gastrointestinal hormones and jejunal digestive and absorptive capacity of posthatch broilers[J]. Journal of Animal Science, 2017, 95: 3079-3092. |
| [12] |
Neves D G, Retes P L, Rocha R R, et al. Effects of in ovo feeding with glycerol for broilers[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(3): 434-440. DOI:10.1111/jpn.12578 |
| [13] |
陈娟.丙酮酸肌酸对肉鸡脂肪代谢和蛋白质代谢的影响及其机制研究[D].南京: 南京农业大学, 2011: 1-143. Chen J. Effects of creatine pyruvate on lipid and protein metabolism on broiler chickens[D]. Nanjing: Nanjing Agricultural University, 2011: 1-143(in Chinese with English abstract). |
| [14] |
Zhao M M, Gao T, Zhang L, et al. Effects of in ovo feeding of creatine pyruvate on the hatchability, growth performance and energy status in embryos and broiler chickens[J]. Animal, 2017, 11(10): 1-9. |
| [15] |
Burke W H. Sex differences in weight of turkey embryos[J]. Poultry Science, 1994, 73(5): 749-753. DOI:10.3382/ps.0730749 |
| [16] |
董信阳.鸽早期小肠发育及碳水化合物对其调控的研究[D].杭州: 浙江大学, 2013: 35. Dong X Y. Research on early development of the pigeon small intestine and its regulation by carbohydrates[D]. Hangzhou: Zhejiang University, 2013: 35(in Chinese with English abstract). |
| [17] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
张爱华.肉仔鸡肠道主要营养素转运载体mRNA表达发育规律的研究[D].北京: 中国农业科学院, 2014: 17-37. Zhang A H. Ontogenetic regulation of nutrient transporters in the small intestine of broilers[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014: 17-37(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326610.htm |
| [19] |
Moreno M J, Pellicer S, Fernandezotero M P. Lindane treatment alters both intestinal mucosa composition and brush border enzymatic activity in chickens[J]. Pesticide Biochemistry and Physiology, 1995, 52(3): 212-221. DOI:10.1006/pest.1995.1046 |
| [20] |
Traber P G, Gumucio D L, Wang W. Isolation of intestinal epithelial cells for the study of differential gene expression along the crypt-villus axis[J]. American Journal of Physiology, 1991, 260: G895-G903. |
| [21] |
Lallès J P. Intestinal alkaline phosphatase:novel functions and protective effects[J]. Nutrition Reviews, 2014, 72(2): 82-94. DOI:10.1111/nure.12082 |
| [22] |
Kaiya H, Kangawa K, Miyazato M. Update on ghrelin biology in birds[J]. Gen Comp Endocrinol, 2013, 190(9): 170-175. |
| [23] |
Buyse J, Janssen S, Geelissen S, et al. Ghrelin modulates fatty acid synthase and related transcription factor mRNA levels in a tissue-specific manner in neonatal broiler chicks[J]. Peptides, 2009, 30(7): 1342-1347. DOI:10.1016/j.peptides.2009.04.015 |
| [24] |
Furuse M, Tachibana T, Ohgushi A, et al. Intracerebroventricular injection of ghrelin and growth hormone releasing factor inhibits food intake in neonatal chicks[J]. Neuroscience Letters, 2001, 301(2): 123-126. DOI:10.1016/S0304-3940(01)01621-4 |
| [25] |
Liu J, Qin J, Feng Y, et al. Distribution of vasoactive intestinal peptide and substance P messenger ribonucleic acid in intestinal nerve of remak of chicken[J]. Poultry Science, 2009, 88(7): 1421-1426. DOI:10.3382/ps.2008-00290 |
| [26] |
Dickson L, Finlayson K. VPAC and PAC receptors:from ligands to function[J]. Pharmacology and Therapeutics, 2009, 121(3): 294-316. DOI:10.1016/j.pharmthera.2008.11.006 |
| [27] |
Kaminski N A, Wong E A. Differential mRNA expression of nutrient transporters in male and female chickens[J]. Poultry Science, 2018, 97(1): 313-318. DOI:10.3382/ps/pex262 |
| [28] |
Gilbert E R, Li H, Emmerson D A, et al. Developmental regulation of nutrient transporter and enzyme mRNA abundance in the small intestine of broilers[J]. Poultry Science, 2007, 86(8): 1739-1753. DOI:10.1093/ps/86.8.1739 |
| [29] |
Stahl A, Evans J G, Pattel S, et al. Insulin causes fatty acid transport protein translocation and enhanced fatty acid uptake in adipocytes[J]. Developmental Cell, 2002, 2(4): 477-488. DOI:10.1016/S1534-5807(02)00143-0 |
| [30] |
侯振平, 蒋桂韬, 王满生, 等. 蛋白酶对22~42日龄肉鸡屠宰性能、肠道形态结构和养分消化率的影响[J]. 畜牧与兽医, 2018, 50(1): 47-53. Hou Z P, Jiang G T, Wang M S, et al. Effects of protease on slaughter performance, intestinal villi structure and nutrient digestibility of 22 to 42 day-old broilers[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(1): 47-53 (in Chinese with English abstract). |
| [31] |
Lenz L S, Marx J, Chamulitrat W, et al. Adipocyte-specific inactivation of acyl-CoA synthetase fatty acid transport protein 4(Fatp4) in mice causes adipose hypertrophy and alterations in metabolism of complex lipids under high fat diet[J]. Journal of Biological Chemistry, 2011, 286(41): 35578-35587. DOI:10.1074/jbc.M111.226530 |
| [32] |
Cheled-Shoval S L, Druyan S, Uni Z. Bitter, sweet and umami taste receptors and downstream signaling effectors:expression in embryonic and growing chicken gastrointestinal tract[J]. Poultry Science, 2015, 94(8): 1928-1941. DOI:10.3382/ps/pev152 |




