文章信息
- 刘文韬, 朱雪竹, 陈雪梅, 孙彦伟, 吕百韬, 王丹琴, 王雪
- LIU Wentao, ZHU Xuezhu, CHEN Xuemei, SUN Yanwei, Lü Baitao, WANG Danqin, WANG Xue
- 功能内生菌株Enterobacter sp. PRd5定殖降低农作物芘污染技术研究
- Colonization of functional endophytic Enterobacter sp. PRd5 to reduce pyrene contamination in crops
- 南京农业大学学报, 2020, 43(2): 274-283
- Journal of Nanjing Agricultural University, 2020, 43(2): 274-283.
- http://dx.doi.org/10.7685/jnau.201904048
-
文章历史
- 收稿日期: 2019-04-22
2. 上海市建设用地和土地整理事务中心, 上海 200003
2. Shanghai Construction Land and Land Consolidation Service Center, Shanghai 200003, China
多环芳烃(PAHs)因致癌性、致畸性及致突变性受到广泛的关注, 易被农作物吸收积累且通过食物链传递危害人群健康[1-2]。2014年《全国土壤污染状况调查公报》显示, 全国耕地土壤PAH超标率为1.4%, 重度污染占到0.2%[3]。2017年调查显示长三角地区工业区周边农田土壤中PAHs浓度为103.8~1 070.4 mg·kg-1, 农作物中为244.1~2 234.6 mg·kg-1[4]。污染农田土壤中的PAHs通过农作物的生长代谢积累在体内[5]。
植物-功能内生细菌体系在降低植物PAHs污染上有巨大的潜力[6]。Zhu等[7]发现将沙雷氏菌PW7定殖于小麦体内, 茎叶中芘的去除率提高了35.7%~86.3%, 根系中芘去除率提高了26.8%~60.1%。在植物-微生物的共生体系中, 部分微生物是通过产吲哚乙酸(IAA)、铁载体和提高溶磷能力促进目标植物生长[8]。IAA是一类植物生长激素, 铁载体可螯合环境中难溶的Fe3+, 为宿主植物提供高利用率的铁元素, 溶磷能力是指细菌可分泌有机酸等物质溶解不溶性磷[9]。内生菌可提高植物体内有机污染物降解酶活力等促进污染物降解过程[10-11]。Kvesitadze等[12]发现过氧化物酶(POD)能有效去除植物体内过量活性氧, 多酚氧化酶(PPO)可将酚类化合物氧化为醌类, 功能内生菌有提高与降低植物体内PAHs的双重趋势。如何选择合适的植物-功能内生菌定殖体系, 确保降低农作物中PAHs污染, 是该定殖技术的关键。
芘作为四环多环芳烃的典型代表, 在全国土壤PAHs总量中占10.4%[13], 常用作PAHs污染测定的指示物和生物降解研究的模型分子[14]。本试验选择芘作为PAHs的代表污染物, 空心菜、小麦、不结球白菜、菠菜、茼蒿作为定殖的目标农作物, 利用本实验室筛选获得的高效芘降解功能内生细菌Enterobacter sp. PRd5[15], 通过体外试验筛选功能植物内生菌适配的农作物, 并进行体内试验验证。
1 材料与方法 1.1 试验材料供试功能内生细菌为本实验室保存的菌株Enterobacter sp. PRd5, 抗性试验表明其对氨苄青霉素(Amp)以及红霉素(Et)具有良好抗性。
供试农作物:小麦(Triticum aestivum L.)、空心菜(Ipomoea aquatic Forsk)、不结球白菜(Brassica chinensis L.)、菠菜(Spinacia oleracea L.)、茼蒿(Chrysanthemum coronarium L.), 购自南京万邦种业有限公司。
1.2 接种体的制备 1.2.1 促生试验的接种菌株将功能菌株Enterobacter sp. PRd5接种至LB液体培养基中, 在LB培养基中加入芘丙酮溶液(丙酮含量低于0.05%), 使芘终浓度均为10 mg·L-1。30 ℃、150 r·min-1摇床培养12 h, 菌株在芘污染胁迫下达到对数生长期, 保持对芘的降解能力。6 000 r·min-1离心10 min后弃掉上清液, 收集的菌体加入无机盐培养基, 使菌体冲洗混匀, 再次离心收集菌体。重复2次后以达到充分去除菌体表面残留LB的目的, 最后用无机盐培养基重悬, 使菌悬液D600值为1.0(约5.88×108 CFU·mL-1), 4 ℃保存备用。
1.2.2 农作物适配与定殖试验的接种将功能菌株Enterobacter sp. PRd5接种至芘质量浓度为10 mg·L-1的LB液体培养基中, 并在培养基中加入Amp、Et, 使抗生素终浓度为50 mg·L-1。30 ℃、150 r·min-1摇床培养12 h, 菌株在污染胁迫下达到对数生长期, 保持对芘的降解能力, 同时保持对抗生素的抗性。利用无机盐培养基培养具有抗生素抗性的菌株, 收集, 备用。
1.3 菌株Enterobacter sp. PRd5促生长试验 1.3.1 产吲哚乙酸(IAA)能力测定参考王欢等[16]的方法, 将菌悬液接入含500 mg·L-1色氨酸的有氮培养基培养24 h后, 8 000 r·min-1离心10 min, 取2 mL上清液加入4 mL Salkowski试剂, 于黑暗中静置30 min, 测定D530值, 同时设置不接菌为对照组。用不同浓度IAA的D530值作标准曲线, 计算培养液中IAA含量(μg·mL-1)。
1.3.2 产铁载体能力测定参照文献[16]将菌悬液接入有氮培养基培养24 h后, 8 000 r·min-1离心10 min, 取3 mL上清液加入等量的CAS检测液, 充分混匀后静置1 h, 测定D630值(A)。另取不接菌的有氮培养基与等体积CAS检测液混匀后测定的D630值作为参比值(Ar), 计算铁载体相对含量(A/Ar)。比值越小表明菌株产铁载体能力越强。
1.3.3 溶磷能力测定无机磷、有机磷分别以Ca3(PO4)2和卵磷脂为代表。将菌悬液分别涂布于有机磷和无机磷固体培养基上, 培养12 d后测定并计算菌落溶磷透明圈直径(D)与菌落直径(d)的比值。比值越大, 表明菌株溶磷能力越强, 比值为1时表示菌落无溶磷能力[17]。
1.4 定殖适配性筛选试验设计选择具有抗生素抗性的菌株Enterobacter sp. PRd5为定殖功能菌, 种植面积广的小麦、空心菜、不结球白菜、菠菜、茼蒿为目标农作物, 进行农作物-功能内生菌定殖适配筛选试验。
1.4.1 植物匀浆液的制备农作物依次用75%(体积分数)的乙醇浸泡3 min、0.1%次氯酸钠浸泡2 min进行表面灭菌, 最后用无菌水冲洗至植物表面无残留消毒液。将10 g表面灭菌的植物样本中加入10 mL无菌水, 无菌条件下研磨、沉淀[18], 上清液为适配试验所用的1 g·mL-1的农作物匀浆液。部分匀浆液经121 ℃高压蒸汽灭菌20 min, 为灭菌匀浆液(NB), 其余为未灭菌匀浆液(B)。
1.4.2 芘降解培养基的制备在灭菌的三角瓶中加入适量的过0.22 μm孔径滤膜除菌后的芘丙酮母液, 待丙酮挥发后, 加入20 mL已灭菌的无机盐培养基, 配置10 mg·L-1芘无机盐培养基。20 mL芘无机盐培养基中农作物匀浆液添加量分别为0、0.1、0.2、0.3、0.4和0.5 mL; 农作物匀浆液处理设置匀浆液灭菌组(NB)和未灭菌组(B); 以在筛选培养基中仅添加了相对应的未灭菌农作物匀浆液处理作为对照; 每个处理设置3组重复。菌株Enterobacter sp. PRd5接种量为5%。30 ℃、150 r·min-1摇床培养10 d后取样, 测定培养基中芘残留浓度、菌株Enterobacter sp. PRd5的数量。
1.4.3 可培养细菌总数的测定取培养液涂布于含50 mg·L-1 Amp和Et的1/10 LB固体抗性培养基上, 30 ℃恒温培养48 h, 计算菌株Enterobacter sp. PRd5数量。利用LB平板涂布法测定添加未灭菌农作物匀浆液的芘无机盐培养基中可培养细菌总数。
1.4.4 芘无机盐培养基中芘的提取向整瓶芘无机盐培养基中加入双倍体积甲醇, 超声萃取30 min, 静置后过0.22 μm滤膜, 收集滤液, 利用高效液相色谱法(HPLC)测定其中芘含量[19]。
1.4.5 植物匀浆液的碳氮比测定将1 g新鲜农作物样本研磨, 用0.45 μm滤膜过滤, 滤液备用。用TOC分析仪测定总碳含量[20], 碱性过硫酸钾-紫外分光光度法测定提取液中总氮含量[21], 计算C/N值。
1.5 水培定殖试验根据适配筛选试验结果, 选择小麦、空心菜作为目标植物, 进行短期定殖验证试验。试验处理组为浸种定殖组(SS)和未定殖对照组(CK), 分别置于含0、0.1和0.5 mg·L-1芘的Hoagland营养液中培养。利用抗性平板涂布法测定目标植物体内菌株定殖效率。
浸种定殖方法:种子经表面灭菌后, 无菌条件下催芽育种48 h后, 置于接种菌株Enterobacter sp. PRd5的培养液中浸泡6 h, 同时对照组(CK)在灭菌无机盐培养基中浸泡6 h。植物株高为10 cm后, 转移至装有含不同芘浓度的Hoagland营养液中, 置于25 ℃/20 ℃的人工气候箱中培养。每天变动棕色瓶位置, 以排除光照的干扰因素。培养4 d后采集植物样品, 测定相关指标。
1.5.1 定殖植物体内Enterobater sp. PRd5细菌数量的测定表面灭菌的植物样品在无菌条件下研磨。取上清液测定菌株Enterobacter sp. PRd5数量。通过菌落形态与16S rRNA基因鉴定为菌株Enterobacter sp. PRd5, 计算每克新鲜组织中菌株Enterobacter sp. PRd5定殖数量(Q)。计算公式:Q=Np/m, 式中:Np表示培养基中涂布的Enterobacter sp. PRd5菌落数(CFU); m表示匀浆液的植物鲜质量(g)。
1.5.2 芘的提取及测定植物体内芘的提取与测定参照文献[19], Hoagland营养液中芘采用整瓶提取法, 提取条件同芘无机盐培养基。芘测定的HPLC参数:烷基C18反相色谱柱(150 mm×4.6 mm, 5 μm), 流动相V(甲醇):V(水)=90:10, 流速1.0 mL·min-1, 柱温40 ℃, 检测波长245 nm, 进样量20 μL。
1.5.3 植物酶活性的测定采用孙凯等[22]的研究方法, 测定植物样品体内的PPO和POD活性。酶活性(R)单位定义为每分钟D值增加0.01, 单位为U·g-1·min-1, 计算公式:R=ΔD×A/(0.01W×t), 式中:ΔD为反应时间内D值的变化; W为样品鲜质量(g); t为反应时间(min); A为稀释倍数。
2 结果与分析 2.1 菌株Enterobacter sp. PRd5对植物促生能力的测定植物促生试验表明, 功能内生菌株Enterobacter sp. PRd5在有氮培养基上可以分泌IAA和铁载体, 其中产IAA能力为4.413 μg·mL-1。铁载体相对含量为0.598, 说明菌株对Fe3+利用能力较强。同时, 菌株Enterobacter sp. PRd5也具备溶磷能力。与有机磷相比较, 菌株Enterobacter sp. PRd5在无机磷固体培养基上的D/d更大, 说明菌株对无机磷的利用能力高于有机磷。这3项指标表明, 菌株Enterobacter sp. PRd5具有促进植物生长、提高植物生物量的潜力和优势。并且, 功能菌株Enterobacter sp. PRd5可以有效去除环境中PAHs[15], 因此选择菌株Enterobacter sp. PRd5作为定殖菌株, 探讨目标农作物-功能菌定殖技术。
2.2 定殖适配性筛选试验 2.2.1 植物匀浆液对菌株Enterobacter sp. PRd5降解芘效率的影响只接种菌株Enterobacter sp. PRd5的芘无机盐培养基中10 d芘残留质量浓度为5.66 mg·L-1, 菌株Enterobacter sp. PRd5数量为7.03×106 CFU·mL-1, 考虑到挥发等非生物因素其芘去除率为39.2%。
与只添加了农作物匀浆液的芘无机盐培养基相比, 功能菌株Enterobacter sp. PRd5的接种显著降低了芘残留(图 1); 与只添加了菌株Enterobacter sp. PRd5的芘无机盐培养基相比, 农作物匀浆液(包括灭菌、未灭菌的匀浆液)的添加可以显著降低芘残留, 且芘残留随植物匀浆液添加量的增加而下降, 说明培养液中芘去除率随植物匀浆液添加量的增加而提高。比较5种农作物未灭菌匀浆液对Enterobacter sp. PRd5芘去除的提高作用, 从大到小依次为空心菜、小麦、不结球白菜、菠菜、茼蒿, 芘去除率分别为83.7%、75.3%、72.6%、70.1%和61.4%。在含10 mg·L-1芘的无机盐培养基中, 空心菜匀浆液添加量为0.4 mL时, 菌株Enterobacter sp. PRd5的芘去除率最高, 达到83.7%。比较匀浆液的灭菌作用, 除茼蒿、不结球白菜匀浆液外, 未灭菌的其他3种农作物匀浆液对芘去除效果均高于灭菌组。这说明小麦、菠菜、空心菜体内原有内生菌可与Enterobacter sp. PRd5产生协同作用去除培养基中的芘。
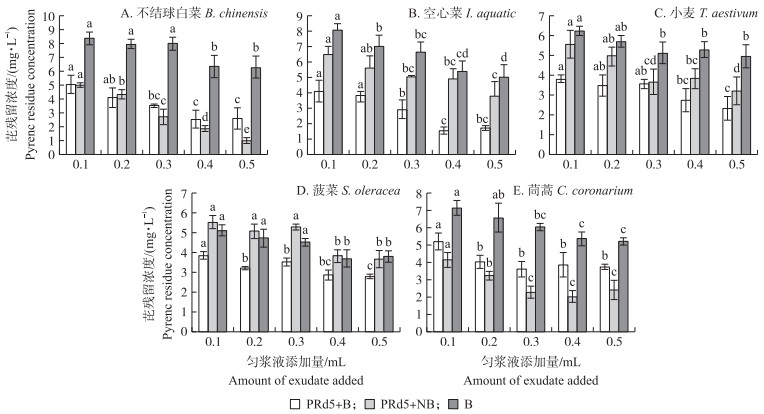
|
图 1 不同农作物匀浆液对Enterobacter sp. PRd5菌的芘降解影响
Fig. 1 Pyrene residual concentration of Enterobacter sp. PRd5 bacteria in different crop exudate
1)PRd5+B表示培养液中含有Enterobacter sp. PRd5菌与植物匀浆液; PRd5+NB表示培养液中含有Enterobacter sp.PRd5菌与灭菌后的植物匀浆液; B表示培养液添加了未灭菌的植物匀浆液。PRd5+B represents the presence of Enterobacter sp. PRd5 and plant exudate in culture medium; PRd5+NB represents the presence of Enterobacter sp. PRd5 and sterilized plant exudate in culture medium; B represents the presence of plant exudate in culture medium. 2)A、B、C、D、E分别代表不结球白菜、空心菜、小麦、菠菜和茼蒿的匀浆液处理。匀浆液添加量为20 mL芘无机盐培养基中匀浆液添加量。A, B, C, D and E represent the crop extraction treatment of Brassica chinensis, Ipomoea aquatic, Triticum aestivum, Spinacia oleracea, Chrysanthemum coronarium, respectively. The amount of exudate in 20 mL pyrene mineral salt medium. 3)不同小写字母表示相同处理匀浆液不同添加量处理组间芘残留浓度差异显著(P < 0.05)。下同。Different letters mean significant difference at 0.05 level between same crop extraction. The same as follows. |
在芘无机盐培养基中, 菌株Enterobacter sp. PRd5数量随匀浆液添加量的增加而提高(图 2)。当匀浆液添加量为2%时, 各作物灭菌与未灭菌匀浆液对菌株Enterobacter sp. PRd5的生长产生差异化的影响, 故推荐芘无机盐培养基中添加2%植物匀浆液培养基作为农作物-内生细菌定殖适配筛选, 易于预测功能菌株在各作物中的定殖效率。未灭菌农作物匀浆液对菌株生长具有促进作用, 说明其中的碳、氮等营养成分有利于菌株生长。未灭菌小麦、空心菜、不结球白菜、菠菜匀浆液均显著提高菌株Enterobacter sp. PRd5的数量, 表明这4种农作物原生菌群未抑制菌株Enterobacter sp. PRd5生长。未灭菌的植物匀浆液对菌株Enterobacter sp. PRd5数量的提高率从大到小依次为小麦、不结球白菜、空心菜、菠菜、茼蒿, 分别为17.3%、13.1%、12.9%、7.6%和2.4%。添加小麦匀浆液的芘无机盐培养基中菌株Enterobacter sp. PRd5数量达到了4.48×108CFU·mL-1。未灭菌的茼蒿匀浆液降低了芘无机盐中菌株Enterobacter sp. PRd5数量, 推测这是芘无机盐中芘残留较高的原因。
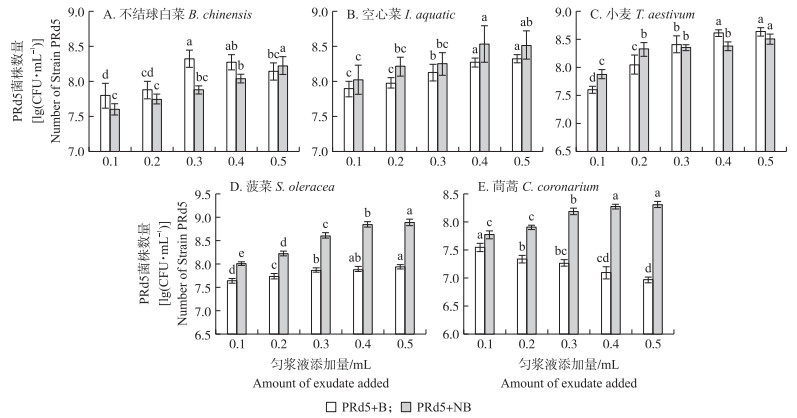
|
图 2 不同植物研磨匀浆液中菌株Enterobacter sp. PRd5数量 Fig. 2 Number of strain Enterobacter sp. PRd5 bacteria in different plant exudate |
从图 3可知:添加未灭菌的处理中, 随农作物匀浆液添加量的增加其可培养细菌数量也增加。其中, 添加未灭菌空心菜匀浆液的芘无机盐培养基中, 可培养细菌总数最多, 达到3.11×109 CFU·mL-1。表明小麦、空心菜、不结球白菜和菠菜匀浆液对细菌生长具有促进作用, 然而添加了未灭菌茼蒿匀浆液的处理中, 随匀浆液添加量提高, 可培养细菌数量增加量不大。
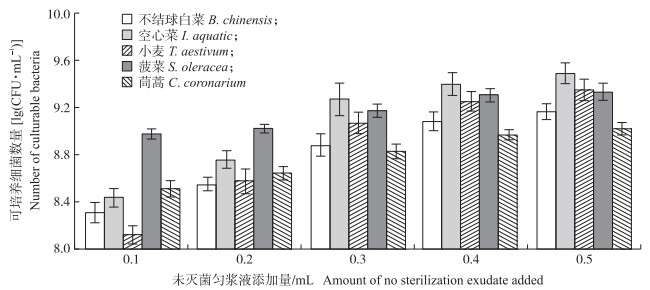
|
图 3 不同植物研磨匀浆液中可培养细菌的数量 Fig. 3 Number of culturable bacteria in different plant exudate |
从表 1可知:5种农作物匀浆液的C/N从大到小依次为空心菜、不结球白菜、小麦、菠菜、茼蒿, 排序与对应的芘无机盐培养基中芘去除率的趋势基本一致。添加了空心菜、不结球白菜、小麦、菠菜和茼蒿匀浆液的无机盐培养基中, 去除率分别提高了83.7%、72.6%、75.3%、70.1%和61.4%。相关性分析结果显示, 农作物匀浆液C/N与芘去除率具有显著正相关性, Pearson相关系数为0.954。
| 指标Index | 不结球白菜B.chinensis | 空心菜I.aquatic | 小麦T.aestivum | 菠菜S.oleracea | 茼蒿C.coronarium |
| TC/(g·L-1) | 6.143±0.067d | 8.308±0.075a | 6.882±0.052b | 6.457±0.076c | 4.330±0.071e |
| TN/(g·L-1) | 0.208±0.005d | 0.201±0.008d | 0.252±0.004b | 0.265±0.005a | 0.226±0.005c |
| C/N | 29.397 | 41.183 | 27.288 | 24.327 | 19.118 |
| 注:不同小写字母表示不同农作物间存在显著差异(P < 0.05)。Different letters mean significant difference at 0.05 level between different crop extraction. | |||||
未定殖功能菌的小麦、空心菜生物量随着芘浓度增加而减小, 功能菌株Enterobacter sp. PRd5定殖后, 与对照组相比, 小麦和空心菜生物量呈增加趋势, 但未达到显著差异(P>0.05)(图 4)。在无芘污染条件下, Enterobacter sp. PRd5定殖对农作物生长无显著影响。在0.1 mg·L-1芘污染条件下, SS处理的小麦和空心菜鲜质量分别提高了10.8%和10.4%;在0.5 mg·L-1芘污染条件下, SS处理的小麦、空心菜鲜质量比CK分别提高了6.3%、19.0%。可见, 菌株Enterobacter sp. PRd5定殖能够提高作物生物量。
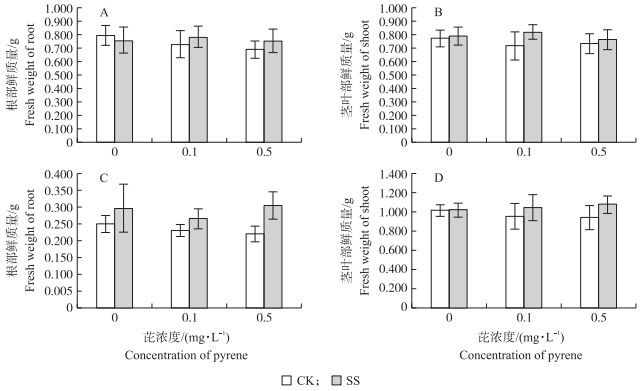
|
图 4 不同处理条件下小麦(A、B)和空心菜(C、D)的生物量 Fig. 4 The biomass of T.aestivum(A, B)and I.aquatic(C, D)in different treatments SS代表植物进行功能菌定殖处理; CK代表未定殖处理。下同。 SS represents colonized plant; CK represents uncolonized plant. The same as follows. |
菌株Enterobacter sp. PRd5定殖数量随着芘质量浓度的增加而增加(表 2)。菌株在作物根部数量远远大于茎叶部位, 说明该内生菌主要定殖于植物根部。
| 芘浓度/(mg·L-1) Concentration of pyrene |
处理 Treatment |
小麦T.aestivum | 空心菜I.aquatic | |||
| 根Root | 茎叶Shoot | 根Root | 茎叶Shoot | |||
| 0 | CKSS | —5.07±0.12c | —3.79±0.13b | —4.35±0.04b | —2.95±0.04a | |
| 0.1 | CKSS | —5.48±0.15b | —3.94±0.17ab | —4.51±0.09a | —3.08±0.02a | |
| 0.5 | CKSS | —5.62±0.09a | —4.05±0.17a | —4.44±0.05ab | —3.11±0.22a | |
| 注:1)—表示未检测到。— means undetected; 2)同列不同小写字母表示显著差异(P < 0.05)。下同。Different letters mean significant difference at 0.05 level between the same column. The same as follows. | ||||||
菌株Enterobacter sp. PRd5定殖可降低Hoagland营养液中芘残留浓度(图 5)。在0.1 mg·L-1芘Hoagland营养液中, 与未定殖组相比, 菌株Enterobacter sp. PRd5定殖使小麦、空心菜营养液中的芘残留浓度分别降低了34.6%和53.0%(P < 0.05);在0.5 mg·L-1芘Hoagland养液中, Enterobacter sp. PRd5定殖使小麦、空心菜营养液中的芘残留分别显著降低了33.6%和32.8%(P < 0.05)。
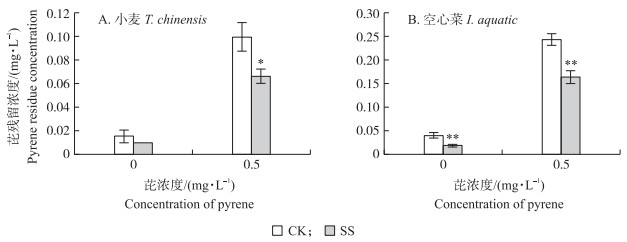
|
图 5 小麦(A)和空心菜(B)营养液中芘的残留浓度 Fig. 5 Pyrene residue concentration in media of T.aestivum and I.aquatic *P < 0.05, ** P < 0.01. |
植物体内芘浓度与营养液中芘污染浓度成正相关, 根部芘浓度远高于茎叶部(表 3)。菌株Enterobacter sp. PRd5定殖可显著降低小麦与空心菜根部芘污染(P < 0.05)。而在小麦茎叶中, 菌株Enterobacter sp. PRd5定殖显著降低了芘浓度。0.1 mg·L-1芘条件时, 菌株Enterobacter sp. PRd5定殖的空心菜根部芘浓度降低了29.7%, 为71.99 mg·kg-1; SS处理小麦根和茎叶芘含量比CK显著降低了40.3%和8.2%, 分别为59.16 mg·kg-1和7.03 mg·kg-1。0.5 mg·L-1芘条件时, SS处理的小麦与空心菜根中芘浓度分别极显著降低了16.7%和43.2%。
| 芘浓度/(mg·L-1) Concentration of pyrene |
处理 Treatments |
小麦T.aestivum | 空心菜I.aquatic | |||
| 根Root | 茎叶Shoot | 根Root | 茎叶Shoot | |||
| 0.1 | CK | 99.09±8.56 | 7.66±0.16 | 102.38±8.53 | 3.74±1.13 | |
| SS | 59.16±22.23 | 7.03±0.13* | 71.99±6.63** | 5.11±1.12 | ||
| 0.5 | CK | 348.93±7.93 | 11.34±4.49 | 190.22±13.20 | 7.64±1.57 | |
| SS | 290.57±12.83** | 8.39±0.93 | 108.05±13.61** | 7.01±0.48 | ||
| 注:*和**分别表示相同芘浓度条件下, 同种作物同种组织间芘残留浓度存在显著和极显著差异。* and ** represent that there is a significant difference in pyrene residue concentration among the same crop tissues under the same pyrene concentration(* P < 0.05, ** P < 0.01). | ||||||
由表 4可知, 菌株Enterobacter sp. PRd5定殖能有效提高芘条件下小麦、空心菜根与茎叶中的POD活性(P < 0.05)。无芘污染条件时, 菌株Enterobacter sp. PRd5定殖可诱导小麦与空心菜体内的POD活性, 但未达到显著水平(P>0.05);0.5 mg·L-1芘条件下, 芘污染和SS处理共同显著提高了小麦根部POD活性18.2%, 空心菜根和茎叶POD活性分别显著提高了13.5%和18.3%(P < 0.05)。
| 芘浓度/(mg·L-1) Concentration of pyrene |
处理 Treatments |
小麦T.aestivum | 空心菜I.aquatic | |||
| 根Root | 茎叶Shoot | 根Root | 茎叶Shoot | |||
| 0 | CK | 1 121.72±54.41b | 711.53±90.84b | 2 579.49±106.93b | 1 023.91±44.56b | |
| SS | 1 196.27±15.34ab | 819.74±35.08ab | 2 732.55±71.05ab | 1 136.09±78.94ab | ||
| 0.1 | CK | 1 187.35±125.09ab | 766.48±43.42ab | 2 785.16±146.27ab | 1 116.61±85.32ab | |
| SS | 1 251.10±138.70ab | 947.82±103.63a | 2 935.65±188.13a | 1 246.19±106.06a | ||
| 0.5 | CK | 1 169.80±85.50ab | 836.56±43.42ab | 2 691.20±234.04ab | 1 173.73±62.98ab | |
| SS | 1 325.96±103.40a | 914.15±141.82ab | 2 928.09±153.93a | 1 211.06±113.44a | ||
芘与菌株Enterobacter sp. PRd5定殖共同作用可显著提高小麦与空心菜体内PPO酶活性(P < 0.05)(表 5)。与对照相比, 菌株Enterobacter sp. PRd5定殖对小麦体内PPO活性具有显著的诱导作用。在无污染的营养液中, 菌株Enterobacter sp. PRd5定殖小麦根的PPO活性显著提高34.0%。0.5 mg·L-1芘胁迫下, 菌株Enterobacter sp. PRd5定殖后小麦根和茎叶部PPO活性分别比CK显著提高了26.5%和22.8%(P < 0.05)。
| 芘浓度/(mg·L-1) Concentration of pyrene |
处理 Treatments |
小麦T.aestivum | 空心菜I.aquatic | |||
| 根Root | 茎叶Shoot | 根Root | 茎叶Shoot | |||
| 0 | CK | 95.91±7.53d | 61.44±10.71c | 883.86±75.01c | 645.59±25.78b | |
| SS | 128.50±11.50bc | 81.06±3.59bc | 979.39±52.49abc | 698.67±81.10ab | ||
| 0.1 | CK | 127.82±7.41bc | 76.79±14.14bc | 948.38±76.28abc | 721.81±72.95ab | |
| SS | 137.93±6.66ab | 91.18±7.04b | 1 046.55±23.77a | 754.24±65.18ab | ||
| 0.5 | CK | 119.06±2.43c | 98.61±11.66b | 919.28±67.38bc | 769.63±36.81a | |
| SS | 150.64±13.03a | 121.11±17.23a | 1 018.07±42.80ab | 795.74±39.71a | ||
IAA、铁载体以及溶磷能力可作为筛选定殖技术功能菌株筛选指标。IAA作为植物生长素, 可刺激细胞伸长, 促进植物生长, 铁载体可将难溶性Fe3+转化为菌体易利用的铁[9]。王欢等[16]将4株产IAA、铁载体菌株对空心菜进行灌根处理, 20 d后鲜质量提高了34.9%~83.3%。本研究促生试验结果显示, 功能菌株Enterobacter sp. PRd5具有分泌IAA、铁载体以及溶磷能力。定殖试验证实, 经过Enterobacter sp. PRd5定殖, 小麦与空心菜鲜质量提高了6.3%~19.1%。
植物匀浆液中的营养物质可促进植物功能菌的生长[23], 而植物匀浆液中植物次生代谢产物以及原有菌群可竞争抑制功能菌群的生长[24]。Muter等[23]研究结果表明, 在M8液体培养基中, 卷心菜提取液的加入促进了TNT降解菌团A43的生长, 同时卷心菜中的胆碱等化合物刺激了细菌的生长, 提高了A43对TNT的降解率, 达90%。同时Hosni等[25]报道茼蒿中含有绿原酸、木犀草素-7-O-葡萄糖苷等化感物质, 可抑制铜绿假单胞菌及黄色金葡萄球菌等微生物的生长。本研究结果表明农作物匀浆液C/N与芘去除率显著正相关, 定殖试验验证了空心菜与小麦为菌株Enterobacter sp. PRd5提供代谢芘所需要的碳、氮养分, 促进了Enterobacter sp. PRd5的生长, 降低了植物中芘污染。而茼蒿匀浆液的低C/N, 以及体内的抑制细菌活力的次生代谢产物, 抑制功能菌株的生长, 故用于茼蒿定殖的功能菌株需要适应其体内次生代谢物质。
农作物体内芘残留随着功能菌株定殖效率提高而降低。菌株Enterobacter sp. PRd5易于在芘存在的条件下的小麦与空心菜体内定殖, 说明该功能菌株适宜应用与防治植物芘污染。降低农作物体内芘污染需要提高功能菌株定殖效率。本研究短期定殖培养试验结果显示, 植株根部定殖数量高于茎叶部1~2个数量级, 推测是根部芘残留浓度高于茎叶部, 其产生的选择压力有利于菌株Enterobacter sp. PRd5生存。
植物体内的多酚氧化酶、过氧化物酶等在有机污染物的代谢过程中发挥着重要作用[12]。植物受到外界污染胁迫时, 植物体内的POD和PPO等被诱导, 酶活性增加以提高自由基的清除, 减轻对植物的毒害作用[26-27]。低浓度的菲污染对黑麦草体内POD和PPO活性有促进作用, 随着污染浓度的提高, 酶活性有下降趋势[27]。功能菌株的定殖可有效诱导POD和PPO活性, 促进有机污染在植物体内的去除。Saravanakumar等[28]的研究结果表明, 当绿豆接种假单胞菌pf1后, 其生物量以及POD活性均提高。孙凯等[22]研究发现, 在混合功能内生菌株的共同作用下, 受菲、芘混合污染的植物体内PPO和POD活性显著提高。本研究中, 菌株Enterobacter sp. PRd5定殖可显著提高小麦与空心菜中POD和PPO活性, 特别是在0.5 mg·L-1芘条件下, Enterobacter sp. PRd5定殖诱导酶活性显著提高。表明, 在短期定殖试验中菌株Enterobacter sp. PRd5定殖通过提高POD和PPO活性以降低体内芘污染。
在功能菌株定殖技术中, 适配的目标农作物-功能植物内生菌系统是关键。本研究推荐以IAA、铁载体以及溶磷能力作为促生指标筛选适合定殖的功能菌株, 芘无机盐培养基中添加2%植物匀浆液作为农作物-内生细菌定殖适配筛选培养基, 利用功能菌芘降解培养试验筛选适配的农作物-功能菌株定殖体系, 进行目标农作物定殖防治多环芳烃污染。本研究建立了一种简单易行的农作物-功能菌株适配性试验方法, 此植物-微生物联合修复法能有效治理环境PAHs污染, 规避污染区农作物污染风险。
| [1] |
Alshaarawy O, Elbaz H A, Andrew M E. The association of urinary polycyclic aromatic hydrocarbon biomarkers and cardiovascular disease in the US population[J]. Environment International, 2016, 89/90: 174-178. |
| [2] |
White A J, Bradshaw P T, Herring A H, et al. Exposure to multiple sources of polycyclic aromatic hydrocarbons and breast cancer incidence[J]. Environment International, 2016, 89/90: 185-192. |
| [3] |
环境保护部和国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014, 36(5): 10-11. Ministry of Environmental Protection and Ministry of Land and Resource of the People's Republic of China. The bulletin of nationwide soil pollution status survey[J]. China Environmental Protection Industry, 2014, 36(5): 10-11 (in Chinese). |
| [4] |
Wang J, Zhang X F, Ling W T, et al. Contamination and health risk assessment of PAH in soils and crops in industrial areas of the Yangtze River Delta region, China[J]. Chemosphere, 2017, 168: 976-987. |
| [5] |
Ding C, Ni H G, Zeng H. Parent and halogenated polycyclic aromatic hydrocarbons in rice and implications for human health in China[J]. Environmental Pollution, 2012, 168: 80-86. |
| [6] |
李爽, 左尚武, 王万清, 等. 菌株Serratia sp. PW7不同定殖方式对黑麦草中芘污染去除及其内生菌群的影响[J]. 农业环境科学学报, 2018, 37(12): 2755-2764. Li S, Zuo S W, Wang W Q, et al. Determining the effects of Serratia sp. PW7 on pyrene removal and the endophytic bacterial community in ryegrass(Lolium multiflorum L.) via different inoculation methods[J]. Journal of Agro-Environment Science, 2018, 37(12): 2755-2764 (in Chinese with English abstract). |
| [7] |
Zhu X Z, Wang W Q, Sun K, et al. Inoculating wheat(Triticum aestivum L.) with the endophytic bacterium Serratia sp. PW7 to reduce pyrene contamination[J]. International Journal of Phytoremediation, 2017, 19(8): 718-724. |
| [8] |
Naveed M, Mitter B, Yousaf S, et al. The endophyte Enterobacter sp. FD17:a maize growth enhancer selected based on rigorous testing of plant beneficial traits and colonization characteristics[J]. Biology and Fertility of Soils, 2014, 50(2): 249-262. DOI:10.1007/s00374-013-0854-y |
| [9] |
Gaiero J R, McCall C A, Thompson K A, et al. Inside the root microbiome:bacterial root endophytes and plant growth promotion[J]. American Journal of Botany, 2013, 100(9): 1738-1750. |
| [10] |
Afzal M, Khan Q M, Sessitsch A. Endophytic bacteria:prospects and applications for the phytoremediation of organic pollutants[J]. Chemosphere, 2014, 117: 232-242. |
| [11] |
Sinsabaugh R L. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology and Biochemisty, 2010, 42(3): 391-404. |
| [12] |
Kvesitadze E, Sadunishvili T, Kvesitadze G. Mechanisms of organic contaminants uptake and degradation in plants[J]. World Academy of Science, Engineering and Technology, International Journal of Biomedical and Biological Engineering, 2009, 3(7): 361-371. |
| [13] |
张俊叶, 俞菲, 俞元春. 中国主要地区表层土壤多环芳烃含量及来源解析[J]. 生态环境学报, 2017, 26(6): 1059-1067. Zhang J Y, Yu F, Yu Y C. Content and source apportionment of polycyclic aromatic hydrocarbons in surface soil in major areas of China[J]. Ecology and Environmental Sciences, 2017, 26(6): 1059-1067 (in Chinese with English abstract). |
| [14] |
Chen G S, White P A. The mutagenic hazards of aquatic sediments:a review[J]. Mutation Research/Reviews in Mutation Research, 2004, 567(2): 151-225. |
| [15] |
陶佳雨, 洪亚军, 陈雪梅, 等. 功能植物内生细菌筛选及对多环芳烃降解效能研究[J]. 生态与农村环境学报, 2019, 35(1): 83-90. Tao J Y, Hong Y J, Chen X M, et al. Isolation, identification and PAH-degrading performance of an endophytic bacterium Enterobacter sp. PRd5[J]. Journal of Ecology and Rural Environment, 2019, 35(1): 83-90 (in Chinese with English abstract). |
| [16] |
王欢, 韩丽珍. 4株茶树根际促生菌菌株的鉴定及促生作用[J]. 微生物学通报, 2019, 46(3): 548-562. Wang H, Han L Z. Identification of four plant growth-promoting rhizobacteria isolated from tea rhizosphere[J]. Microbiology China, 2019, 46(3): 548-562 (in Chinese with English abstract). |
| [17] |
李海云, 蒋永梅, 姚拓, 等. 蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J]. 植物保护学报, 2018, 45(4): 836-845. Li H Y, Jiang Y M, Yao T, et al. Isolation, screening, identification and growth promoting characteristics of plant growth promoting rhizobacteria of vegetable crops[J]. Journal of Plant Protection, 2018, 45(4): 836-845 (in Chinese with English abstract). |
| [18] |
Zhang X, Cui Q X, Zhao Y, et al. Allelopathic potential of Koelreuteria bipinnata var. integrifoliola on germination of three turf grasses[J]. Russian Journal of Plant Physiology, 2018, 65(6): 833-841. |
| [19] |
凌婉婷, 高彦征, 李秋玲, 等. 植物对水中菲和芘的吸收[J]. 生态学报, 2006, 26(10): 3332-3338. Ling W T, Gao Y Z, Li Q L, et al. Uptake of phenanthrene and pyrene by ryegrass from water[J]. Acta Ecologica Sinica, 2006, 26(10): 3332-3338 (in Chinese with English abstract). |
| [20] |
何海龙, 君珊, 张学宽. 总有机碳(TOC)分析仪测定土壤中TOC的研究[J]. 分析仪器, 2014(5): 59-61. He H L, Jun S, Zhang X K. Analysis of total organic carbon in soil by TOC analyzer[J]. Analytical Instrumentation, 2014(5): 59-61 (in Chinese with English abstract). |
| [21] |
潘忠成, 李敏. HJ 636-2012测定总氮时影响空白值因素分析[J]. 环境工程, 2016, 34(1): 126-129, 167. Pan Z C, Li M. Analysis of influencing factors on the blank value of total nitrogen determination by HJ 636-2012[J]. Environmental Engineering, 2016, 34(1): 126-129, 167 (in Chinese with English abstract). |
| [22] |
孙凯, 李舜尧, 陈明雨, 等. 接种混合功能细菌降低黑麦草体内菲和芘污染的机理初探[J]. 环境科学学报, 2019, 39(4): 1303-1311. Sun K, Li S Y, Chen M Y, et al. Inoculation with mixed PAH-degrading bacteria mitigates the contamination of phenanthrene and pyrene in ryegrass(Lolium multiflorum Lam) using greenhouse pot experiments[J]. Acta Scientiae Circumstantiae, 2019, 39(4): 1303-1311 (in Chinese with English abstract). |
| [23] |
Muter O, Versilovskis A, Scherbaka R, et al. Effect of plant extract on the degradation of nitroaromatic compounds by soil microorganisms[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(11): 1539-1543. |
| [24] |
Gupta S, Pathak B, Fulekar M H. Molecular approaches for biodegradation of polycyclic aromatic hydrocarbon compounds:a review[J]. Rev Environ Sci Biotechnol, 2015, 14(2): 241-269. |
| [25] |
Hosni K, Hassen I, Sebei H, et al. Secondary metabolites from Chrysanthemum coronarium(Garland) flowerheads:chemical composition and biological activities[J]. Industrial Crops and Products, 2013, 44: 263-271. |
| [26] |
胡增辉, 沈应柏, 王宁宁, 等. 不同挥发物诱导的合作杨叶片中POD、PPO及PAL活性变化[J]. 林业科学, 2009, 45(10): 44-48. Hu Z H, Shen Y B, Wang N N, et al. Activities of POD, PPO and PAL in poplar(Populus simonii×P. pyramidalis 'opera 8277') leaves exposed to different volatiles[J]. Scientia Silvae Sinicae, 2009, 45(10): 44-48 (in Chinese with English abstract). |
| [27] |
盛月慧, 刘娟, 高彦征, 等. 黑麦草体内POD和PPO活性及可培养内生细菌种群对不同浓度菲污染的响应[J]. 南京农业大学学报, 2013, 36(6): 51-59. Sheng Y H, Liu J, Gao Y Z, et al. Effects of phenanthrene on the POD and PPO activities and endophytic bacteria population characteristics in ryegrass(Lolium multiflorum Lam)[J]. Journal of Nanjing Agricultural University, 2013, 36(6): 51-59 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2013.06.009 |
| [28] |
Saravanakumar D, Kavino M, Raguchander T, et al. Plant growth promoting bacteria enhance water stress resistance in green gram plants[J]. Acta Physiologiae Plantarum, 2011, 33(1): 203-209. |




