文章信息
- 孙媛媛, 悦晓孟, 贾礼, 王涛, 苏娜娜, 崔瑾
- SUN Yuanyuan, YUE Xiaomeng, JIA Li, WANG Tao, SU Nana, CUI Jin
- 亚硒酸钠促进大豆芽苗菜下胚轴花青苷合成的机制
- The mechanism of sodium selenite promoting the synthesis of anthocyanin in the hypocotyl of soybean sprouts
- 南京农业大学学报, 2020, 43(2): 267-273
- Journal of Nanjing Agricultural University, 2020, 43(2): 267-273.
- http://dx.doi.org/10.7685/jnau.201904042
-
文章历史
- 收稿日期: 2019-04-20
硒是植物、动物、人类和一些微生物生长发育时所必需的微量元素。亚硒酸钠(Na2SeO3)是自然界中无机硒的存在方式之一[1-2]。研究表明, Na2SeO3能显著提高作物的营养品质。Na2SeO3浸泡鹰嘴豆种子能提高异黄酮含量[3]; 浸泡西兰花种子能提高总黄酮含量[4]; 在富硒土壤中生长的小麦, 其籽粒总黄酮含量比低硒土壤中高[5]; 此外, Na2SeO3还能提高紫莴苣花青苷的含量[6]。
花青苷属于黄酮类化合物, 是植物次生代谢产物, 也是一种天然色素, 赋予植物缤纷的色彩, 易溶于水、甲醇等溶剂。花青苷是植物中一种非常有价值的营养物质, 能提高植物抗氧化能力使植物免受紫外光损伤等[7-12]。近年来, 花青苷因其在人体中的抗氧化、预防心血管疾病和癌症等功能而受到广泛关注[13]。花青苷的合成是通过苯丙烷类代谢途径完成, 其合成受结构基因与转录因子的调控, 且主要是转录水平上的调控[14]。大豆芽苗菜是广泛消费的芽苗菜之一, 富含异黄酮、氨基酸、蛋白质等营养物质, 营养价值丰富, 深受消费者喜爱[15], 但富含花青苷的大豆芽苗菜目前还尚未广泛生产与销售。因此, 通过安全有效的方法提高大豆下胚轴花青苷含量, 从而提高大豆芽苗菜的营养品质, 吸引消费者购买, 提高经济效益, 在实际生产中具有重要意义。
目前尚未有关于硒提高大豆芽苗菜下胚轴中花青苷含量的报道, 且其中机制尚不明确。因此, 本文以大豆芽苗菜为试验材料, 探究Na2SeO3能否促进下胚轴花青苷合成, 并探究其中的机制, 为大豆芽苗菜的研发和工业化生产提供科学依据。
1 材料与方法 1.1 试验材料供试大豆(Glycine max L. Merr.)品种为‘东农690’, 购于江苏苏芽食品有限公司。
1.2 试验设计大豆种子在纯净水中浸泡6~8 h后, 置于24~26 ℃的黑暗培养箱内催芽24 h, 待芽长约1 cm时, 选取长势一致的幼苗, 对照组和处理组分别播种于含1/4 Hoagland培养液和含8 μmol·L-1 Na2SeO3的1/4 Hoagland培养液的育苗盆里。将苗放于黑暗培养箱内暗培30 h, 开启白光(复合光)模式, 利用光量子计(GLZA, 浙江托普仪器有限公司)测定光照强度, 光照强度为(30±2)μmol·m-2·s-1, 湿度为85%。连续白光下培养0、12、18、24和36 h, 分别采收下胚轴, 贮存于-80 ℃冰箱中。
1.3 测定项目与方法 1.3.1 大豆芽苗菜下胚轴、花青苷总含量的测定称取2.0 g大豆芽苗菜下胚轴鲜样浸泡于15 mL 1%(体积分数)盐酸-甲醇溶液中, 以1%盐酸-甲醇溶液为空白, 低温超声15 min后, 避光浸泡30 h。6 000 r·min-1离心10 min后, 采用酶标仪(TECAN, Inifinitc M200)测定A530、A657值, 花青苷相对含量=(A530-0.25×A657)·g-1(以鲜质量测)[16]。
1.3.2 花青苷单体的测定采用超高效液相色谱串联质谱(UPLC-MS)对花青苷单体进行定性定量分析[17]。用氯化矢车菊素、氯化天竺葵素、氯化锦葵色素、氯化矮牵牛素、氯化飞燕草素标准品(上述标准品购于上海源叶生物科技公司), 绘制标准曲线。称取2 g大豆芽苗下胚轴鲜样, 向样品中加入25 μL 25 μmol·L-1芒柄花黄素标准品作为内参, 加液氮研磨成粉末, 再加入7.5 mL 1%盐酸-甲醇混合液, 超声波提取15 min。4 ℃、8 000 r·min-1离心25 min, 取上清液, 向沉淀中再加入7.5 mL提取液, 提取后合并上清液, 经0.22 μm有机滤膜过滤后测定。试验所用的UPLC系统(Dionex, Thermo, USA)连接于LTQ-Orbitrap XL hybrid质谱仪(Thermo Fisher Scientific), 质谱条件:色谱柱为Hypersil GOLD C18柱(100 mm×2.10 mm, 3 μm particle size, Thermo Fisher Scientific); 流动相A为0.1%(体积分数)甲酸水溶液, 流动相B为0.1%甲酸乙腈(体积分数); 流速为0.2 mL min-1; 进样体积为5 μL; 洗脱程序为0~4 min、5% B, 4~21 min、95% B, 21~25 min、95% B, 25~30 min、5% B。得到的数据用Xcalibur软件处理, 用样品峰面积代入标曲得到花青苷各单体的含量。
1.3.3 过氧化氢、丙二醛和超氧阴离子自由基含量测定过氧化氢(H2O2)含量按过氧化氢含量测定的试剂盒(南京建成生物公司)说明书测定; 丙二醛(MDA)含量测定参照文献[18]; 超氧阴离子自由基(
L-苯丙氨酸裂解酶(PAL)、查尔酮异构酶(CHI)提取和活性测定参照文献[19]; 查尔酮合酶(CHS)提取方法参照文献[20], 按照Elisa检测试剂盒(GE Healthcare)说明书; 二氢黄酮醇还原酶(DFR)、葡萄糖黄酮糖基转移酶(UFGT)采用0.01 mol·L-1磷酸钠缓冲液(pH 7.4)提取, 酶活性测定和计算按照酶联免疫分析说明书。
1.3.5 植物总RNA提取、DNA消解、cDNA反转录及荧光定量PCR测定总RNA提取方法参考文献[17]。DNA消解参照试剂盒(Rever Tra AceRqPCR RT Master Mix with gDNA Remover, TOYOBO, Japan)说明书; cDNA反转录参照试剂盒(Rever Tra AceRqPCR RT Master Mix with gDNA Remover, TOYOBO, Japan)说明书; 荧光定量PCR参照试剂盒(DBI, Bioscience Inc., Germany)说明书。PCR反应; 95 ℃ 30 s, 60 ℃ 30 s, 40次循环。花青苷合成相关转录基因(MYB75)、L-苯丙氨酸裂解酶基因(PAL)、肉桂酸羟化酶基因(C4H)、对香豆酸-CoA连接酶基因(4CL)、查尔酮合酶基因(CHS)、查尔酮异构酶基因(CHI)、类黄酮3羟化酶基因(F3H)、类黄酮3′羟化酶基因(F3′H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)、葡萄糖黄酮糖基转移酶基因(UFGT)的相对表达量用CT值法计算, 以ACTIN为内参基因, 每个样品设置3个平行样本。引物由金唯智公司(苏州)合成, 核苷酸序列见表 1。
| 基因名称 Gene name |
正向引物序列 Forward sequence(5′→3′) |
反向引物序列 Reverse sequence(5′→3′) |
| ACTIN | TCCCAGTATTGTTGGCCGA | TTCCATGTCATCCCAGTTGCTTA |
| MYB75 | CATGGACTGAAGATGAACAC | CAACTTGTGTCGGAGTCTTA |
| PAL | CAACCAGGATGTCAACTCTT | TTGGCTCACGGTGTTCTT |
| C4H | GGATGAGATTGACAGAGTTCTAG | TGCCATTCTAAGACGAAGAG |
| 4CL | TTCGGAATAGTGGCTCTAC | TGGCTTGTGGATTGTTGT |
| CHS | AGTGTTGGTGCCTATATGG | TGAGTAATCTTGGACTTGGA |
| CHI | CTTCAGAGGAGTTAGTTCACA | TTCAGCATCACCGTAAGTC |
| F3H | GCCTTCGTCGTCAATCTT | CTCTCCTTCTCTTATCTTCAGA |
| F3′H | TGGCAAGTTCAGACACAA | CACCTCCATCACCATAGC |
| DFR | TGCCGTAGAGTTAAGATGAC | AGAGGTGGAATGATAGTGATG |
| ANS | GGTGTGATGAACTTGGTGA | CATTGGCGTACTTCTCCTT |
| UFGT | AGAATTAGCGGAAGCAGAG | GGCGAATCAAGTCAGTGT |
试验均重复3次, 采用SPSS 21.0分析数据、Origin 8.0绘图, 利用Duncan’s新复极差法进行显著性差异分析, 结果以x±SD表示。
2 结果与分析 2.1 亚硒酸钠对大豆芽苗菜下胚轴花青苷含量的影响由图 1可知:相同照光时间下, Na2SeO3处理组的花青苷含量明显高于对照组, 且两组的花青苷呈紫色, 都集中在下胚轴外围(图 1-A); 相同光照时间下, Na2SeO3处理组的花青苷提取液的颜色更红(图 1-B); 由图 1-C可以看出, 在36 h时, Na2SeO3处理组花青苷含量约是对照组的1.72倍, 图 1-C数据趋势与图 1-A、B一致。综上, 8 μmol·L-1 Na2SeO3显著提高了下胚轴花青苷总量。
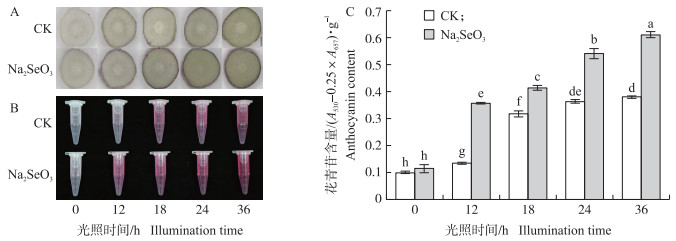
|
图 1 亚硒酸钠对大豆芽苗菜下胚轴中花青苷含量的影响 Fig. 1 Effect of Na2SeO3 on the content of anthocyanin in the hypocotyl of soybean sprouts A.对照组和亚硒酸钠处理组大豆芽苗菜下胚轴横切图(标尺=0.4 mm); B.下胚轴花青苷提取液; C.下胚轴中花青苷含量。 A. The cross section of hypocotyl of soybean sprouts in the control group and the Na2SeO3 treatment group(bar=0.4 mm); B. Hypocotyl anthocyanin extract; C. Anthocyanin content. |
从表 2可知:在光照0 h时, 与对照组相比, Na2SeO3显著提高矢车菊素-3-O-芸香糖苷-5-O-β-D葡萄糖苷、氯化锦葵色素-3, 5-双葡萄糖苷含量; 显著降低天竺葵素-3-O-葡萄糖苷含量; 锦葵色素-3-O-葡萄糖苷、矮牵牛素-3-O-半乳糖苷、飞燕草素-3-O-葡萄糖苷在2组中均未检测到; Na2SeO3处理组中这6种单体的总量是对照组的1.77倍。在光照36 h时, Na2SeO3显著提高矢车菊素-3-O-芸香糖苷-5-O-β-D葡萄糖苷、氯化锦葵色素-3, 5-双葡萄糖苷、锦葵色素-3-O-葡萄糖苷单体含量, 其中矢车菊素-3-O-芸香糖苷-5-O-β-D葡萄糖苷和氯化锦葵色素-3, 5-双葡萄糖苷含量增加更显著, 分别是对照组的2.93和1.69倍; Na2SeO3处理组中矮牵牛素-3-O-半乳糖苷和飞燕草素-3-O-葡萄糖苷含量分别是4.82和0.24 μg·g-1, 而对照组未检测到这2种单体; Na2SeO3处理组中这6种单体总量是对照组的1.76倍。综上, 8 μmol·L-1 Na2SeO3提高了大豆芽苗菜下胚轴中花青苷主要单体含量。
| 花青苷单体 Anthocyanin monomers |
含量/(μg·g-1)Content | |||
| CK(0 h) | Na2SeO3(0 h) | CK(36 h) | Na2SeO3(36 h) | |
| 矢车菊素-3-O-芸香糖苷-5-O-β-D葡萄糖苷 Cyanidin-3-O-rutinoside-5-O-β-D-glucoside |
0.57±0.07d | 4.37±1.07b | 1.76±2.07c | 5.17±3.07a |
| 天竺葵素-3-O-葡萄糖苷 Pelargonidin-3-O-glucoside |
7.93±0.57b | 4.86±0.11c | 9.96±0.07a | 7.73±0.09b |
| 氯化锦葵色素-3, 5-双葡萄糖苷 Malvidin chloride-3, 5-diglucoside |
5.86±0.54d | 16.14±0.40c | 157.51±4.17b | 266.48±5.85a |
| 锦葵色素-3-O-葡萄糖苷 Malvidin-3-O-glucoside |
ND | ND | 18.70±0.82b | 38.89±0.06a |
| 矮牵牛素-3-O-半乳糖苷 Petunidin-3-O-galactoside |
ND | ND | ND | 4.82±0.64a |
| 飞燕草素-3-O-葡萄糖苷 Delphinidin-3-O-glucoside |
ND | ND | ND | 0.24±0.004a |
| 总计Total | 14.37±1.02d | 25.38±0.32c | 184.93±4.84b | 323.32±6.14a |
| 注:ND表示未检测到; 小写字母表示在0.05水平差异显著。下同。ND indicates undetected. The small letters indicate significant difference at 0.05 level. The same as follows. | ||||
由图 2可知:大豆芽苗菜在光照培养0、12 h时, Na2SeO3处理组中MDA和
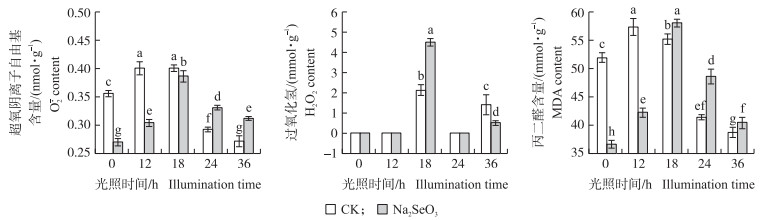
|
图 2 亚硒酸钠处理下大豆芽苗菜下胚轴中超氧阴离子自由基、过氧化氢和丙二醛含量
Fig. 2 |
由图 3可知:Na2SeO3处理组和对照组中大豆芽苗菜下胚轴PAL、CHI和CHS活性均是在光照18 h时最高, Na2SeO3处理组这3种酶的活性分别是对照组的1.18、1.91和1.18倍。Na2SeO3处理组的DFR活性在光照24 h时最高, 是对照组的1.43倍。在光照下(除0 h外)Na2SeO3处理组UFGT活性显著高于对照组。在相同光照时间时, Na2SeO3处理组PAL、CHI、CHS和DFR活性均高于对照组。
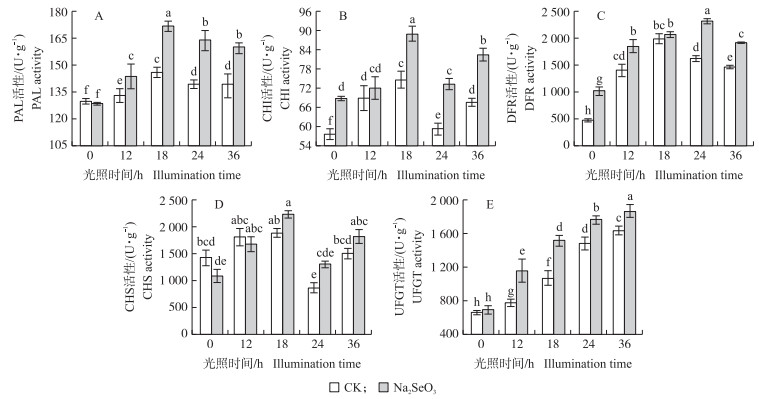
|
图 3 亚硒酸钠对大豆芽苗菜下胚轴花青苷合成相关酶活性的影响 Fig. 3 Effects of Na2SeO3 on activity of anthocyanin biosynthesis-related enzymes of soybean sprouts hypocotyls |
由图 4可知:负责调控花青苷合成的转录因子MYB75在大豆芽苗菜光照12 h时相对表达量最高, Na2SeO3处理组中的相对表达量约是对照组的8.37倍。大豆芽苗菜在光照12、18、24 h时, 结构基因PAL、C4H、4CL、CHS、CHI、F3H、F3′H、DFR、ANS、UFGT在Na2SeO3处理组中的相对表达量均显著高于对照组。在12 h时, Na2SeO3处理组中4CL基因相对表达量最高, 是对照组的271倍; 在18 h时, C4H、CHS、F3H、F3′H基因在Na2SeO3处理组中的相对表达量最高, 分别是对照组的4.59、12.25、4.80和2.66倍; 在24 h时, PAL、CHI、DFR、ANS、UFGT基因在Na2SeO3处理组中的相对表达量最高, 分别是对照组的9.71、7.34、26.03、7.91和16.16倍。因此, 8 μmol·L-1 Na2SeO3处理提高了花青苷合成关键结构基因和转录因子的表达, 从而促进花青苷的合成。
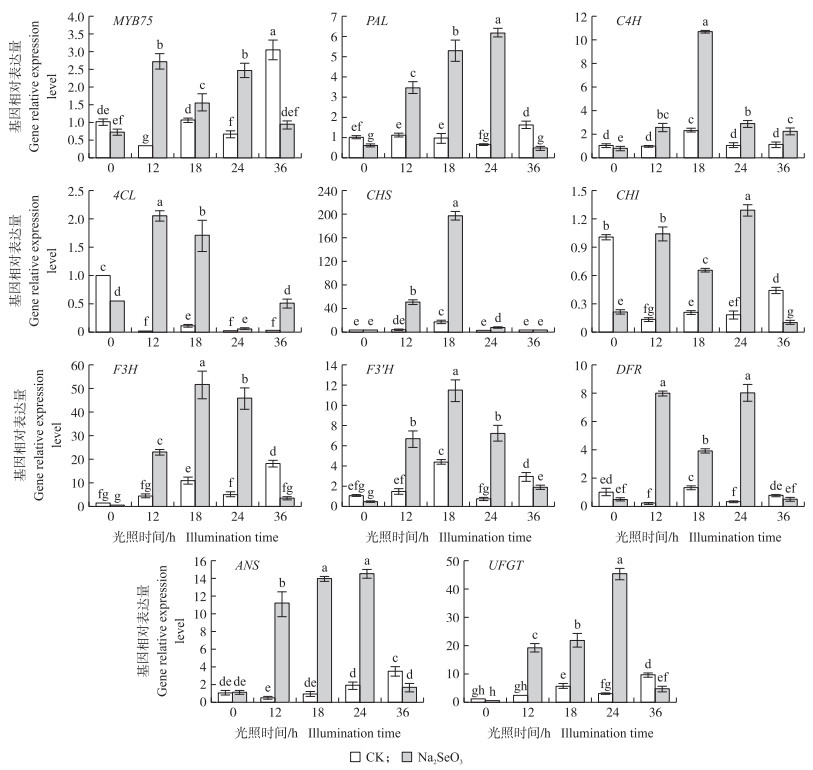
|
图 4 亚硒酸钠对大豆芽苗菜下胚轴花青苷合成相关基因和转录因子表达量的影响 Fig. 4 Effects of Na2SeO3 on the expression level of anthocyanin biosynthesis-related genes in soybean sprouts hypocotyls |
目前已有多篇文献报道硒会影响植物体内花青苷的含量[21-27], 然而关于硒参与植物中花青苷代谢及相关机制的报道较少。用浓度为50~100 μmol·L-1的Na2SeO4和C5H11NO2Se的营养液培养玉米幼苗, 花青苷含量随培养液浓度增加而降低, 其机制尚未被完全阐明[21]。20 mg·L-1硒溶液, 对意大利甘蓝造成轻微胁迫, 从而引起花青苷含量提高[24]。100 μmol·L-1 SeO2喷施甘蓝(Brassica rapa ssp. rapa), 甘蓝因受SeO2轻微胁迫而显著提高其花青苷含量[25]。Abbas等[26]也发现浸泡高粱种子(Sorghum bicolor L.)时添加不同浓度的Na2SeO3, 当Na2SeO3浓度在3和6 mg·L-1时会促进花青苷的合成, 而浓度为12 mg·L-1时则会抑制花青苷的合成, 但Na2SeO3如何影响花青苷合成的机制尚不清楚。有趣的是, Hawrylak-Nowak等[27]也发现Na2SeO4喷施甜罗勒(Ocimum basilicum L.)幼苗叶面时不会对植株产生毒害和胁迫影响, 却能显著提高植物体内的花青苷含量, 其机制尚不清楚[27]。
在本研究中, 8 μmol·L-1 Na2SeO3促进大豆芽苗菜花青苷总含量的增加, 花青苷合成受苯丙烷类代谢途径中关键酶和关键结构基因以及转录因子的调节。同时, 我们还发现, 与对照组相比, Na2SeO3处理组大豆芽苗菜在光照18 h时, H2O2、MDA和
综上所述, 与对照组相比, 8 μmol·L-1 Na2SeO3处理显著提高了大豆芽苗菜花青苷的含量。通过对其机制的研究, 有助于了解Na2SeO3促进大豆芽苗菜下胚轴花青苷积累, 为新型大豆芽苗菜的生产和推广提供一定理论依据。
| [1] |
Germ M, Stibilj V, Osvald J, et al. Effect of selenium foliar application on chicory(Cichorium intybus L.)[J]. Journal of Agricultural and Food Chemistry, 2007, 55(3): 795-798. DOI:10.1021/jf0629888 |
| [2] |
Du M, Zhao L, Li C R, et al. Purification and characterization of a novel fungi Se-containing protein from Se-enriched Ganoderma lucidum mushroom and its Se-dependent radical scavenging activity[J]. European Food Research and Technology, 2007, 224(5): 659-665. DOI:10.1007/s00217-006-0355-4 |
| [3] |
Guardado-Félix D, Serna-Saldivar S O, Cuevas-Rodríguez E O, et al. Effect of sodium selenite on isoflavonoid contents and antioxidant capacity of chickpea(Cicer arietinum L.) sprouts[J]. Food Chemistry, 2017, 226: 69-74. DOI:10.1016/j.foodchem.2017.01.046 |
| [4] |
Tian M, Xu X Y, Liu Y L, et al. Effect of Se treatment on glucosinolate metabolism and health-promoting compounds in the broccoli sprouts of three cultivars[J]. Food Chemistry, 2016, 190: 374-380. DOI:10.1016/j.foodchem.2015.05.098 |
| [5] |
Jaiswal S K, Prakash R, Skalny A V, et al. Synergistic effect of selenium and UV-B radiation in enhancing antioxidant level of wheatgrass grown from selenium rich wheat[J]. Journal of Food Biochemistry, 2018, 42(5): e12577. DOI:10.1111/jfbc.12577 |
| [6] |
Liu D D, Li H, Wang Y Z, et al. How exogenous selenium affects anthocyanin accumulation and biosynthesis-related gene expression in purple lettuce[J]. Polish Journal of Environmental Studies, 2017, 26(2): 717-722. DOI:10.15244/pjoes/66707 |
| [7] |
Pourcel L, Routaboul J M, Cheynier V, et al. Flavonoid oxidation in plants:from biochemical properties to physiological functions[J]. Trends in Plant Science, 2007, 12(1): 29-36. DOI:10.1016/j.tplants.2006.11.006 |
| [8] |
Mouradov A, Spangenberg G. Flavonoids:a metabolic network mediating plants adaptation to their real estate[J]. Frontiers in Plant Science, 2014, 5: 620. |
| [9] |
Tanaka Y, Ohmiya A. Seeing is believing:engineering anthocyanin and carotenoid biosynthetic pathways[J]. Current Opinion in Biotechnology, 2008, 19(2): 190-197. DOI:10.1016/j.copbio.2008.02.015 |
| [10] |
Zhu Z, Chen Y L, Shi G Q, et al. Selenium delays tomato fruit ripening by inhibiting ethylene biosynthesis and enhancing the antioxidant defense system[J]. Food Chemistry, 2017, 219: 179-184. DOI:10.1016/j.foodchem.2016.09.138 |
| [11] |
Baenas N, Ferreres F, García-Viguera C, et al. Radish sprouts:characterization and elicitation of novel varieties rich in anthocyanins[J]. Food Research International, 2015, 69: 305-312. DOI:10.1016/j.foodres.2015.01.009 |
| [12] |
Matera R, Gabbanini S, Berretti S, et al. Acylated anthocyanins from sprouts of Raphanus sativus cv. Sango:isolation, structure elucidation and antioxidant activity[J]. Food Chemistry, 2015, 166: 397-406. DOI:10.1016/j.foodchem.2014.06.056 |
| [13] |
Bowen-Forbes C S, Zhang Y J, Nair M G. Anthocyanin content, antioxidant, anti-inflammatory and anticancer properties of blackberry and raspberry fruits[J]. Journal of Food Composition and Analysis, 2010, 23(6): 554-560. DOI:10.1016/j.jfca.2009.08.012 |
| [14] |
Dubos C, Stracke R, Grotewold E, et al. MYB transcription factors in Arabidopsis[J]. Trends in Plant Science, 2010, 15(10): 573-581. DOI:10.1016/j.tplants.2010.06.005 |
| [15] |
Gan R Y, Wang M F, Lui W Y, et al. Dynamic changes in phytochemical composition and antioxidant capacity in green and black mung bean(Vigna radiata) sprouts[J]. International Journal of Food Science & Technology, 2016, 51(9): 2090-2098. |
| [16] |
Su N N, Wu Q, Cui J. Increased sucrose in the hypocotyls of radish sprouts contributes to nitrogen deficiency-induced anthocyanin accumulation[J]. Frontiers in Plant Science, 2016, 7: 1976. |
| [17] |
Su N N, Wu Q, Liu Y Y, et al. Hydrogen-rich water reestablishes ROS homeostasis but exerts differential effects on anthocyanin synthesis in two varieties of radish sprouts under UV-A irradiation[J]. Journal of Agricultural and Food Chemistry, 2014, 62(27): 6454-6462. DOI:10.1021/jf5019593 |
| [18] |
赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 1994, 30(3): 207-210. Zhao S J, Xu C C, Zou Q, et al. Improvements of method for measurement of malondialdehvde in plant tissues[J]. Plant Physiology Communications, 1994, 30(3): 207-210 (in Chinese). |
| [19] |
Lister C E, Lancaster J E, Walker J R L. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal of the Science of Food and Agriculture, 1996, 71(3): 313-320. DOI:10.1002/(SICI)1097-0010(199607)71:3<313::AID-JSFA586>3.0.CO;2-N |
| [20] |
Li Y Y, Mao K, Zhao C, et al. MdCOP1 ubiquitin E3 ligases interact with MdMYB1 to regulate light-induced anthocyanin biosynthesis and red fruit coloration in apple[J]. Plant Physiology, 2012, 160(2): 1011-1022. DOI:10.1104/pp.112.199703 |
| [21] |
Hawrylak-Nowak B. Changes in anthocyanin content as Indicator of maize sensitivity to selenium[J]. Journal of Plant Nutrition, 2008, 31(7): 1232-1242. DOI:10.1080/01904160802134962 |
| [22] |
Krupa Z, Baranowska M, Orzol D. Can anthocyanins be considered as heavy metal stress indicator in higher plants?[J]. Acta Physiologiae Plantarum, 1996, 18: 147-151. |
| [23] |
Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress[J]. Current Opinion in Plant Biology, 2002, 5(3): 218-223. DOI:10.1016/S1369-5266(02)00256-X |
| [24] |
Mechora Š, Placido Torres D, Bruns R E, et al. Effect of selenium treated broccoli on herbivory and oviposition preferences of Delia radicum and Phyllotreta spp[J]. Scientia Horticulturae, 2017, 225: 445-453. DOI:10.1016/j.scienta.2017.07.032 |
| [25] |
Thiruvengadam M, Chung I M. Selenium, putrescine, and cadmium influence health-promoting phytochemicals and molecular-level effects on turnip(Brassica rapa ssp. rapa)[J]. Food Chemistry, 2015, 173: 185-193. DOI:10.1016/j.foodchem.2014.10.012 |
| [26] |
Abbas S M. Effects of low temperature and selenium application on growth and the physiological changes in sorghum seedlings[J]. Journal of Stress Physiology & Biochemistry, 2012, 8(1): 268-286. |
| [27] |
Hawrylak-Nowak B. Enhanced selenium content in sweet basil(Ocimum basilicum L.) by foliar fertilization[J]. Vegetable Crops Research Bulletin, 2008, 69(1): 63-72. |




