文章信息
- 沈煜洋, 孟玲
- SHEN Yuyang, MENG Ling
- 土壤添加生物质炭对稻纵卷叶螟幼虫生长和末龄幼虫食物利用效率的影响
- Effects of biochar amendment to soils on larval growth and final instar larval food utilization efficiency of Cnaphalocrocis medinalis(Lepidoptera: Pyralidae)
- 南京农业大学学报, 2020, 43(2): 247-252
- Journal of Nanjing Agricultural University, 2020, 43(2): 247-252.
- http://dx.doi.org/10.7685/jnau.201905052
-
文章历史
- 收稿日期: 2019-05-29
生物质炭是生物有机体在缺氧或低氧条件下进行热解而产生的一种固态物质, 具有颗粒细度小、孔隙度高、芳香化程度高、碳含量高的特点, 同时具备一定的生物化学和热稳定性[1]。因此, 将生物质炭施于土壤中常被推荐为碳减排措施之一[2]。生物质炭作为土壤改良剂施用可以降低土壤容重, 提高土壤松软程度, 改善土质; 还可以提高土壤微生物繁殖所需的碳源和氮源, 改善土壤营养状况[3-4]。有研究表明, 施用生物质炭可提高土壤pH值, 使土壤释放出部分可供作物利用的游离态养分[5-6]; 同时能有效增加土壤中的有机碳和有效磷含量, 并在相对较长的时期内保持稳定[7-8]。生物质炭可显著提高土壤离子交换能力, 促进土壤团聚体形成, 增加根际微生物丰富度, 并能促进植物地上部分生长[9]和提高作物产量[10]。生物质炭对土壤和作物的这些影响势必会影响取食作物的害虫。
2010年在以色列首次观察到, 侧多食跗线螨[Polyphagotarsonemus latus(Banks)]对生长在生物质炭处理土壤中的辣椒(Capsicum annuum L.)取食为害程度减轻[11]。此后陆续开展了一系列试验专门探究土壤施用生物质炭对植食性害虫的影响。盆栽试验发现, 取食添加生物质炭处理的水稻(Oryza sativa L.)可抑制褐飞虱[Nilaparvata lugens(Stål)][12-13]、灰飞虱[Laodelphax striatellus(Fallén)][14]和麦长管蚜[Sitobion avenae(Fabricius)][15]等刺吸口器害虫的发育和生殖。其原因之一是, 害虫在刺吸生物质炭处理的植物叶片时口针的有效刺吸活动受到抑制[16]。麦田小区试验也发现, 施用生物质炭可明显降低麦长管蚜种群密度[17]。然而, 对咀嚼口器害虫的研究发现了不完全相同的结果:取食高添加量(50 g·kg-1)生物质炭处理的小麦(Triticum aestivum L.)叶片的黏虫[Mythimna separata(Walker)]幼虫, 发育历期缩短, 但生殖力不受影响[18]; 类似表现也出现在稻纵卷叶螟(Cnaphalocrocis medinalis Güenée)上, 施用生物质炭的大田中稻纵卷叶螟种群数量略低于对照[19]。昆虫具有很强的发育可塑性, 以应对复杂多变、充满不确定性的环境[20]。据此推测:虽然土壤施用生物质炭对取食稻叶的稻纵卷叶螟幼虫早期生长产生负面影响, 但高龄幼虫具有很强的取食和营养利用的补偿能力, 可能减缓生物质炭对生殖的不利影响。
本研究首先确认土壤施用生物质炭对稻纵卷叶螟幼虫生长具有负面影响, 然后精确测定末龄幼虫取食生物质炭处理下稻叶的消化利用指标, 以验证上述推测。
1 材料与方法 1.1 试验材料供试土壤为红棕壤(砂质壤土), 取自南京东郊的一块撂荒农田(118°51′36″ E, 32°1′12″ N), 采集深度0~15 cm。测得土壤pH值为7.30, 全氮含量0.93 g·kg-1, 有机碳含量11.65 g·kg-1。采回的土壤经室外阳光暴晒及自然风干, 用粉碎机粉碎后备用。参考大田推荐用量(20~40 t·hm-2)设置4个生物质炭施用量处理水平:0(对照)、15、30和50 g·kg-1(土壤以干质量计)。
供试生物质炭由勤丰众成生物质新材料有限公司(南京市六合区)生产, 原材料为小麦秸秆, 全氮含量0.46 g·kg-1, 全钾含量1.85 g·kg-1, 有机碳含量567.41 g·kg-1。
供试水稻品种为‘淮香粳15号’(由南京农业大学农学院细胞遗传研究所提供)。播撒已催芽2 d、芽长约2~3 cm的水稻种子, 放在始终有水的托盘上, 将添加生物质炭的土壤装于150 mL塑料杯中, 并置于温度为(27±1)℃、相对湿度为(75±10)%、光照/黑暗时间为14 h/10 h的人工气候箱(GYZ-430A, 宁波江南仪器有限公司产)内培养20 d后备用。
供试稻纵卷叶螟由南京农业大学植物保护学院信息生态实验室提供虫卵, 在温度为(25±1)℃、相对湿度为(65±10)%、光照/黑暗培养时间为14 h/10 h的养虫室内用营养栽培基质(镇江兴农有机肥有限公司)种植小麦苗, 待生长10~15 d后饲喂幼虫, 建立试验种群。试验前用水稻苗繁殖1代后供试。
1.2 方法将产有稻纵卷叶螟卵的保鲜膜置于各处理水稻幼苗顶部, 并用罩笼遮蔽, 以防止幼虫孵化后逃逸, 根据幼虫取食情况及时更换新鲜水稻苗, 直至其生长至4龄。之后挑选同日蜕皮进入5龄(末龄)的幼虫, 单头接入直径5 cm的培养皿内。随机选取10头刚脱皮5龄幼虫置于烘箱(80 ℃)内恒温烘干, 24 h后单头称干质量。其余20头幼虫饥饿24 h后单头称体鲜质量, 然后单头饲养, 剪取稻叶称鲜质量后饲喂幼虫; 每隔24 h更换1次叶片, 称虫体鲜质量, 并收集粪便和剩余叶片置于烘箱(80 ℃)内烘干24 h后分别称干质量; 饲喂3 d后称虫体鲜质量, 然后烘干24 h后称虫体干质量。每处理30个重复。
1.3 数据分析计算经典的食物利用效率指标[21]:
| $ 近似消化效率 = \frac{{取食量 - 粪便量}}{{取食量}} \times 100\% $ | (1) |
| $ 食物利用效率 = \frac{{体质量增加量}}{{取食量}} \times 100\% $ | (2) |
| $ 食物转化效率 = \frac{{体质量增加量}}{{取食量 - 粪便量}} \times 100\% $ | (3) |
| $ 相对取食速率 = \frac{{取食量}}{{初始虫体干质量 \times 取食天数}} $ | (4) |
| $ 相对生长速率 = \frac{{初始虫体质量}}{{初始虫体质量 \times 取食天数}} $ | (5) |
用方差分析比较这些指标在不同生物质炭处理间的差异, 若发现存在显著差异(α=0.05, 双尾), 再用Tukey’s HSD测验进行逐对比较。数据分析用R软件[22]。
2 结果与分析 2.1 生物质炭处理对幼虫发育至末龄时体干质量的影响生物质炭处理对稻纵卷叶螟幼虫发育至末龄时的体干质量有显著影响(F3, 116=13.41, P < 0.001)(图 1)。与对照相比, 添加生物质炭15、30和50 g·kg-1的各处理末龄幼虫体干质量分别下降30.13%(t=-4.88, P < 0.001)、29.46%(t=-4.77, P=0.059)和37.87%(t=-6.06, P < 0.001);3个添加量处理水平之间没有显著差异。
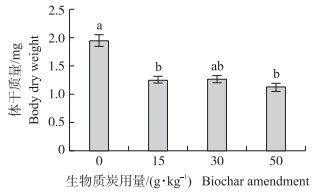
|
图 1 生物质炭不同添加量处理下稻纵卷叶螟发育至末龄(5龄)幼虫的体干质量(x±SE) Fig. 1 Body dry weight of the final(5th)instar larva atmolting at different levels of biochar treatmentin Cnaphalocrocis medinalis 柱顶端不同小写字母代表处理间差异显著(P < 0.05)。下同。 Different lowercase letters at the top of bars indicate a significant difference between biochar amendment levels(P < 0.05). The same as follows. |
生物质炭处理对稻纵卷叶螟末龄幼虫的相对取食速率有显著影响(F3, 116=18.70, P < 0.001)。3个不同添加量处理的相对取食速率不同(图 2):与对照(0.092 g·g-1·d-1)相比, 添加15 g·kg-1(t=6.24, P < 0.001)和50 g·kg-1(t=4.64, P < 0.001)生物质炭处理的幼虫相对取食速率显著增加, 添加30 g·kg-1生物质炭处理的幼虫相对取食速率与对照无显著差异(t=0.57, P=0.57)。
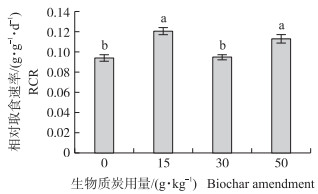
|
图 2 生物质炭不同添加量处理下稻纵卷叶螟末龄幼虫的相对取食速率(x±SE) Fig. 2 Relative consumption rate(RCR)by the finalinstar larva at different levels of biochartreatment in C.medinalis |
生物质炭处理对稻纵卷叶螟末龄幼虫的近似消化效率有显著影响(F3, 116=59.35, P < 0.001)。与对照相比, 3个生物质炭添加处理的幼虫近似消化效率均提高, 其中, 添加15 g·kg-1处理提高幅度最大, 其次是50 g·kg-1添加量处理(图 3-A)。生物质炭处理对稻纵卷叶螟末龄幼虫的食物转化效率有显著影响(F3, 116=3.88, P=0.01)。添加生物质炭50 g·kg-1处理的幼虫食物转化效率显著高于对照(t=3.03, P=0.02), 添加15 g·kg-1处理(t=-0.38, P=0.71)和30 g·kg-1处理(t=1.45, P=0.15)均与对照没有显著差异(图 3-B)。
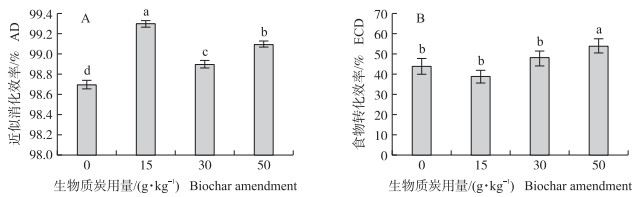
|
图 3 生物质炭不同添加量处理下稻纵卷叶螟末龄幼虫的近似消化效率(A)和食物转化效率(B)(x±SE) Fig. 3 Approximate digestibility(AD)(A)and efficiency of conversion of digested food to body substance(ECD)(B)by the final instar larva at different levels of biochar treatment in C.medinalis |
生物质炭处理对稻纵卷叶螟末龄幼虫的食物利用效率有显著影响(F3, 116=3.90, P=0.01)。添加生物质炭50 g·kg-1处理的幼虫食物利用效率高于其他处理, 添加15 g·kg-1处理(t=-0.33, P=0.74)和30 g·kg-1处理(t=1.47, P=0.14)的幼虫食物利用效率均与对照无显著差异(图 4-A)。生物质炭处理对稻纵卷叶螟末龄幼虫的相对生长速率有显著影响(F3, 116=7.10, P < 0.001)。添加生物质炭50 g·kg-1处理的幼虫相对生长速率高于其他处理, 添加15 g·kg-1处理(t=1.80, P=0.07)和30 g·kg-1处理(t=1.67, P=0.10)的幼虫相对生长速率与对照无显著差异(图 4-B)。
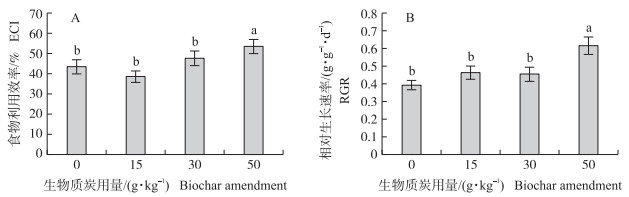
|
图 4 生物质炭不同添加量处理下稻纵卷叶螟末龄幼虫的食物利用效率(A)和相对生长速率(B)(x±SE) Fig. 4 Efficiency of conversion of ingested food to body substance(ECI)(A)and relative growth rate(RGR)(B)by the final instar larva at different levels of biochar treatment in C.medinalis |
本研究表明, 添加生物质炭可使稻纵卷叶螟从初孵幼虫发育到末龄时的体质量降低; 然而, 添加50 g·kg-1的生物质炭可促进末龄幼虫取食、消化吸收和生长, 添加较低量的生物质炭可提高相对取食速率和近似消化效率。该结果说明, 稻纵卷叶螟末龄幼虫表现出一定的补偿能力, 可在一定程度上抵消幼虫前期受到生物质炭的不利影响, 从而支持本研究拟验证的推测:生物质炭可增强末龄幼虫的食物消化吸收效率。
生物质炭影响稻纵卷叶螟幼虫生长表现可能与寄主植物营养元素变化有关。植食性昆虫取食和营养利用与植物体内元素含量有关, 某些元素抑制昆虫取食和代谢, 例如硅、磷; 另一些元素刺激昆虫取食和利用, 例如氮[23]。土壤添加生物质炭可促进稻株对硅的吸收[24], 而许多研究表明植物含硅量增加可提高植物的抗虫性[25-26], 因为植物组织表皮中无定形硅氧化物(SiO2)的沉积可增强植物组织的机械抗性, 从而增大植食性昆虫的取食和消化难度[25, 27], 而且硅可通过调节多酚氧化酶等酶的活性增强诱导抗性[28]。例如, 施硅肥能显著降低田间稻纵卷叶螟种群密度和水稻受害程度[29]。除硅元素外, 植株的氮素含量与植食性昆虫取食和生长发育密切相关。生物质炭虽然本身不是一个通常意义上的氮肥[30], 但它具有很强的蓄氮能力[31]。当土壤含氮量较低时, 生物质炭由于吸附氮而可能降低水稻对氮素的吸收[24], 因此当水稻中氮含量较低时, 稻纵卷叶螟幼虫生长发育受到抑制。然而, 取食和消化能力较强的末龄幼虫通过增大取食量来获取足够的氮营养元素。
在较高生物质炭添加量处理下, 稻纵卷叶螟末龄幼虫可通过提高取食速率和食物消化利用效率而加速生长, 表现出补偿能力。高龄幼虫的这种补偿能力, 可以解释此前研究所观察到的现象:黏虫幼虫取食生物质炭处理的小麦苗后, 虽然幼虫生长发育受阻, 但发育至成虫后生殖力反而增强[18]; 稻纵卷叶螟虽然幼虫存活率降低, 但成虫生殖力不受影响[19]。昆虫具有很强的发育可塑性[20], 其中, 表观遗传学机制发挥着重要作用[32]。例如, 蜜蜂社群中由营养调节的基因组结构的不同甲基化水平, 会导致蜜蜂居群内的社会分工[33-34]。黏虫和稻纵卷叶螟这2种咀嚼取食昆虫对施用生物质炭的反应, 与刺吸韧皮部汁液的稻飞虱和蚜虫的反应不完全一致, 差异在于生殖力是否受影响。差异的原因可能在于施用生物质炭不仅通过改变植物组织内营养元素含量而影响刺吸取食活动, 即“营养效应”, 而且可能通过增强植物的虫害诱导抗性而影响刺吸害虫。例如, 施用生物质炭可提高白背飞虱[Sogatella furcifera(Horváth)]取食的水稻植株中与抗性直接相关的茉莉酸水平[35]; 可使麦长管蚜取食的小麦植株中与抗虫相关的基因表达水平上调[15]。我们推测, 生物质炭对咀嚼取食昆虫的影响可能主要通过前一机制即营养效应而实现的, 虫害诱导抗性的效应可能比较小。咀嚼取食危害诱导植物防卫反应的机制与刺吸取食的不完全一致, 前者主要涉及茉莉酸信号通道, 而后者通过茉莉酸或水杨酸信号通道来诱导植物的防卫反应[36]。进一步研究亟待明确, 施用生物质炭是否增强植物因咀嚼危害诱导的防卫反应。
综上所述, 本研究首先确认了生物质炭对稻纵卷叶螟幼虫前期生长产生不良影响。然后, 进一步精确测定了末龄幼虫的相对取食速率、食物消化吸收效率和生长速率后发现, 土壤添加较多生物质炭可刺激末龄幼虫取食, 提高食物消化吸收效率, 加速生长。这些结果说明, 稻纵卷叶螟末龄幼虫具有补偿性取食、食物利用和生长的反应, 这种补偿反应可能减缓生物质炭对幼虫前期生长的不良影响, 从而验证了本研究提出的推测。
致谢: 南京农业大学植物保护学院信息生态实验室樊茹静提供稻纵卷叶螟卵。
| [1] |
Hayes M H B. Biochar and biofuels for a brighter future[J]. Nature, 2006, 443(7108): 144. |
| [2] |
陈温福, 张伟明, 孟军. 农用生物炭研究进展与前景[J]. 中国农业科学, 2013, 46(16): 3324-3333. Chen W F, Zhang W M, Meng J. Advances and prospects in research of biochar utilization in agriculture[J]. Scientia Agricultura Sinica, 2013, 46(16): 3324-3333 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2013.16.003 |
| [3] |
Lehmann J, da Silva J P, J r, Steiner C, et al. Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin:fertilizer, manure and charcoal amendments[J]. Plant and Soil, 2003, 249(2): 343-357. DOI:10.1023/A:1022833116184 |
| [4] |
Warnock J, Scherer R, Loubere P. A quantitative assessment of diatom dissolution and late quaternary primary productivity in the Eastern Equatorial Pacific[J]. Deep-Sea Research Part Ⅱ, 2007, 54(5/6/7): 772-783. |
| [5] |
Schmidt M W I. Biogeochemistry:carbon budget in the black[J]. Nature, 2004, 427(6972): 305-307. DOI:10.1038/427305a |
| [6] |
Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 2009, 174(2): 105-112. |
| [7] |
Deenik J L, McClellan A T, Uehara G. Biochar volatile matter content effects on plants growth and nitrogen transformations in a tropical soil[C]. Western Nutrient Management Conference, Salt Lake City, UT, USA, 2009, 8: 26-31.
|
| [8] |
Kimetu J M, Lehmann J. Stability and stabilisation of biochar and green manure in soil with different organic carbon contents[J]. Australian Journal of Soil Research, 2010, 48(7): 577-585. DOI:10.1071/SR10036 |
| [9] |
Biederman L A, Harpole W S. Biochar and its effects on plant productivity and nutrient cycling:a meta-analysis[J]. Global Change Biology Bioenergy, 2013, 5(2): 202-214. DOI:10.1111/gcbb.12037 |
| [10] |
Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils:a review[J]. Plant and Soil, 2010, 337(1/2): 1-18. |
| [11] |
Elad Y, David D R, Harel Y M, et al. Induction of systemic resistance in plants by biochar, a soil-applied carbon sequestering agent[J]. Phytopathology, 2010, 100(9): 913-921. DOI:10.1094/PHYTO-100-9-0913 |
| [12] |
Hou X, Meng L, Li L, et al. Biochar amendment to soils impairs developmental and reproductive performances of a major rice pest Nilaparvata lugens(Homopera:Delphacidae)[J]. Journal of Applied Entomology, 2015, 139(10): 727-733. DOI:10.1111/jen.12218 |
| [13] |
侯晓青, 许笠, 李保平, 等. 土壤添加生物质炭和施肥对褐飞虱生长发育和生殖的协同效应[J]. 植物保护学报, 2017, 44(6): 982-988. Hou X Q, Xu L, Li B P, et al. The combined effect of biochar and fertilizer application to paddy soils on developmental and reproductive performance of the brown rice planthopper Nilaparvata lugens(Hemiptera:Delphacidae)[J]. Journal of Plant Protection, 2017, 44(6): 982-988 (in Chinese with English abstract). |
| [14] |
傅强, 李保平, 孟玲. 土壤施用生物质炭对取食水稻的灰飞虱生活史特征的影响[J]. 中国水稻科学, 2018, 32(2): 200-206. Fu Q, Li B P, Meng L. Effects of biochar amendment to soil on life history traits of Laodelphax striatellus(Hemiptera:Delphacidae) on rice plants[J]. Chinese Journal of Rice Science, 2018, 32(2): 200-206 (in Chinese with English abstract). |
| [15] |
Chen Y, Li R, Li B P, et al. Biochar applications decrease reproductive potential of the English grain aphid Sitobion avenae and upregulate defense-related gene expression[J]. Pest Management Science, 2019, 75(5): 1310-1316. DOI:10.1002/ps.5245 |
| [16] |
Chen Y, Rong X, Fu Q, et al. Effects of biochar amendment to soils on stylet penetration activities by aphid Sitobion avenae and planthopper Laodelphax striatellus on their host plants[J]. Pest Management Science, 2020, 76: 360-365. DOI:10.1002/ps.5522 |
| [17] |
Chen Y, Shen Y Y, Meng L, et al. The effect of biochar with different feedstock materials on the English grain aphid Sitobion avenae Fab.(Hemiptera:Aphididae)[J]. Crop Protection, 2019, 124: 104859. DOI:10.1016/j.cropro.2019.104859 |
| [18] |
张婧, 李保平, 孟玲. 土壤添加生物质炭对黏虫生长发育和生殖的影响[J]. 麦类作物学报, 2017, 37(11): 1512-1517. Zhang J, Li B P, Meng L. Effects of biochar amendment to soils on immature growth and adult reproduction of the oriental armyworm Mythimna seperata(Lepidoptera:Noctuidae)[J]. Journal of Triticeae Crops, 2017, 37(11): 1512-1517 (in Chinese with English abstract). DOI:10.7606/j.issn.1009-1041.2017.11.15 |
| [19] |
Chen Y, Shen Y Y, Li B P, et al. The effect of biochar amendment to soils on Cnaphalocrocis medinalis Güenée(Lepidoptera:Pyralidae) on rice[J]. Crop Protection, 2019, 124: 104842. DOI:10.1016/j.cropro.2019.06.002 |
| [20] |
Harrison J F, Woods H A, Roberts S P. Ecological and Environmental Physiology of Insects[M]. London: Oxford University Press, 2012: 11.
|
| [21] |
Waldbauer G P. The consumption and utilization of food by insects[J]. Advances in Insect Physiology, 1968, 5: 229-288. DOI:10.1016/S0065-2806(08)60230-1 |
| [22] |
R Core Team. R: a language and environment for statistical computing[EB/OL]. R Foundation for Statistical Computing, Vienna, Austria, 2016. URL http://www.Rproject.org/.
|
| [23] |
Schoonhoven L M, van Loon J A, Kiche M. Insect-Plant Biology[M]. London: Oxford University Press, 2005.
|
| [24] |
Liu X Y, Li L Q, Bian R J, et al. Effect of biochar amendment on soil-silicon availability and rice uptake[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(1): 91-96. DOI:10.1002/jpln.201200582 |
| [25] |
Reynolds O L, Padula M P, Zeng R S, et al. Silicon:potential to promote direct and indirect effects on plant defense against arthropod pests in agriculture[J]. Frontiers in Plant Science, 2016, 7: 744. |
| [26] |
Liang Y C, Nikolic M, Bélanger R, et al. Silicon in Agriculture[M]. Netherland: Springer Netherlands, 2015: 197-207.
|
| [27] |
Massey F P, Hartley S E. Physical defences wear you down:progressive and irreversible impacts of silica on insect herbivores[J]. Journal of Animal Ecology, 2009, 78: 281-291. DOI:10.1111/j.1365-2656.2008.01472.x |
| [28] |
Ye M, Song Y Y, Long J, et al. Priming of jasmonate-mediated antiherbivore defense responses in rice by silicon[J]. Proc Natl Acad Sci USA, 2013, 110(38): E3631-E3639. DOI:10.1073/pnas.1305848110 |
| [29] |
Han Y Q, Lei W B, Wen L Z, et al. Silicon-mediated resistance in a susceptible rice variety to the rice leaf folder, Cnaphalocrocis medinalis Güenée(Lepidoptera:Pyralidae)[J]. PLoS One, 2015, 10(4): e0120557. DOI:10.1371/journal.pone.0120557 |
| [30] |
Xie Z B, Xu Y P, Liu G L, et al. Impact of biochar application on nitrogen nutrition of rice, greenhouse-gas emissions and soil organic carbon dynamics in two paddy soils of China[J]. Plant and Soil, 2013, 370(1/2): 527-540. |
| [31] |
Liu Q, Liu B J, Zhang Y H, et al. Biochar application as a tool to decrease soil nitrogen losses(NH3 volatilization, N2O emissions, and N leaching) from croplands:options and mitigation strength in a global perspective[J]. Global Change Biology, 2019, 25(6): 2077-2093. DOI:10.1111/gcb.14613 |
| [32] |
Chittka A, Chittka L. Epigenetics of Royalty[J]. PLoS Biology, 2010, 8(11): e1000532. DOI:10.1371/journal.pbio.1000532 |
| [33] |
Patel A, Fondrk M K, Kaftanoglu O, et al. The making of a queen:tor pathway is a key player in diphenic caste development[J]. PLoS One, 2007, 2(6): e509. DOI:10.1371/journal.pone.0000509 |
| [34] |
Lyko F, Foret S, Kucharski R, et al. The honey bee epigenomes:differential methylation of brain DNA in queens and workers[J]. PLoS Biology, 2010, 8(11): e1000506. DOI:10.1371/journal.pbio.1000506 |
| [35] |
Waqas M, Shahzad R, Hamayun M, et al. Biochar amendment changes jasmonic acid levels in two rice varieties and alters their resistance to herbivory[J]. PLoS One, 2018, 13(1): e0191296. DOI:10.1371/journal.pone.0191296 |
| [36] |
Kessler A, Baldwin I T. Plant responses to insect herbivory:the emerging molecular analysis[J]. Annual Review of Plant Biology, 2002, 53: 299-328. DOI:10.1146/annurev.arplant.53.100301.135207 |




