文章信息
- 张群, 贾倩茹, 章文华
- ZHANG Qun, JIA Qianru, ZHANG Wenhua
- 磷脂介导的生长素信号转导研究进展
- Recent advance in phospholipids-mediated auxin signal transduction
- 南京农业大学学报, 2020, 43(2): 195-203
- Journal of Nanjing Agricultural University, 2020, 43(2): 195-203.
- http://dx.doi.org/10.7685/jnau.201909006
-
文章历史
- 收稿日期: 2019-09-03
盐、高温等非生物胁迫都会导致植物发育迟缓、植物生长和分化被抑制、新陈代谢减缓和蛋白功能受到破坏, 对农业生产和生态环境带来了巨大的负面影响[1]。植物通过调控各种生理、细胞和遗传机制, 使其在胁迫条件下得以生存, 这些调控过程包括植物激素、抗氧化防护系统、渗透调节物质和膜脂信号等[2-3]。磷脂是细胞膜的主要组分, 同时也参与细胞感受外界刺激和传递信号。磷脂酶(phospholipase)代谢磷脂生成多种产物, 例如:溶血磷脂酸(lysophospholipid, LPA)、磷脂酸(phosphatidic acid, PA)、二酰甘油(diacylglycerol, DAG)和脂肪酸(free fatty acid, FA)等。研究结果表明, 它们也参与植物生长、发育和胁迫应答等重要生物过程[4]。
生长素作为植物个体发育、形态发生的整联蛋白, 也参与植物应答干旱、盐害和重金属等非生物胁迫[5]。生长素信号在生物合成、极性运输以及胞内信号转导等多层面得以调控。其中, 膜脂介导的生长素信号的研究已成为近些年植物研究的热点方向。细胞膜最先感受和应答外界胁迫与刺激。脂酶代谢底物产生相应的脂分子, 作用于下游靶蛋白以应答生长素刺激, 传递和放大信号。其中, 磷脂介导的生长素信号在植物发育和抗逆应答方面都扮演重要角色。本文结合本课题组和前人的研究成果, 综述了磷脂酶及其磷脂小分子在生长素信号途径的研究进展, 尤其在生长素介导的极性转运和抗逆应答等方面, 并结合相关的研究技术, 为后期的深入研究提供参考。
1 植物磷脂磷脂(phospholipids)是指含有磷酸的脂类, 是组成生物膜的主要成分, 分为甘油磷脂与鞘磷脂两大类。其中, 甘油磷脂包括磷脂酰胆碱(phosphatidylcholines, PC)、磷脂酰乙醇胺(phosphatidylethanolamine, PE)、磷脂酰丝氨酸(phosphatidylserine, PS)、DAG和磷脂酰肌醇(phosphatidylinositol, PtdIns)等。根据水解甘油磷脂的位置不同, 磷脂酶分为磷脂酶A1(phospholipase A1, PLA1)、磷脂酶A2(PLA2)、磷脂酶C(phospholipase C, PLC)和磷脂酶D(phospholipase D, PLD)[6]。根据水解底物专一性的不同, PLC又分为磷脂酰肌醇特异性磷脂酶C(phosphoinositides-specific PLC, PI-PLC)和非特异性磷脂酶C(nonspecific phospholipase C, NPC)[7](图 1)。不同的磷脂酶定位于不同的细胞器, 具有不同的生化特征, 共同或协同应答外界刺激、胁迫。例如:拟南芥PLD家族的PLDδ定位于质膜, 偏好以PE为底物, 特异性结合周质微管调控植物的耐热性[8]; 在低温胁迫下, PLDδ也被激活代谢膜脂, 调控植物细胞的抗冻性[9]。拟南芥胞质PLDα1主要通过产物PA调控植物盐、脱落酸(abscisic acid, ABA)和生长素等信号过程[10-11]。

|
图 1 植物磷脂代谢途径 Fig. 1 Plant phospholipids metabolism pathway G3P:甘油-3-磷酸Glycerol-3-phosphate; LPA:溶血磷脂酸Lysophosphatidic acid; PA:磷脂酸Phosphatidic acid; DAG:二酰甘油Diacylglycerol; PC:磷脂酰胆碱Phosphatidylcholine; LPC:溶血磷脂酰胆碱Lysophosphatidylcholine; TAG:三酰甘油Triacylglycerol; MGDG:半乳糖基二酰基甘油Monogalactosyldiacylglycerol; DGDG:双半乳糖基二酰基甘油Digalactosyldiacylglycerol; CMP-PA:胞苷二磷酸二酰甘油Cytidine monophosphate; PI:磷脂酰肌醇Phosphatidylinositol; PI3P(PtdIns3P):3-磷酸肌醇Phosphatidylinositol-3-phosphate; PI5P(PtdIns5P):5-磷酸肌醇Phosphatidylinositol-5-phosphate; PI4P(PtdIns4P):4-磷酸肌醇Phosphatidylinositol-4-phosphate; PI(4, 5)P2[PtdIns(4, 5)P2]:4, 5-二磷酸肌醇Phosphatidylinositol 4, 5-bisphosphate; PI(3, 5)P2[PtdIns(3, 5)P2]:3, 5-二磷酸肌醇Phosphatidylinositol 3, 5-bisphosphate; GPAT:磷酸甘油脂酰转移酶Glycerol-3-phosphate acyltransferase; LPAAT:溶血磷脂酸酰基转移酶Lysophosphatidic acid acyltransferase; PLA:磷脂酶A Phospholipase A; PLD:磷脂酶D Phospholipase D; PAP:磷脂酸磷酸酶PA phosphatase; DGK:二酰甘油激酶DAG kinase; DGAT:二酰甘油酰基转移酶Diacylglycerol acyltransferase; PDCT:磷脂酰胆碱二酰甘油胆碱磷酸转移酶Phosphatidylcholine diacylglycerol cholinephosphotransferase; LPCAT:溶血磷脂酰胆碱酰基转移酶LPC acyltransferase; PDAT:磷脂二酰甘油酰基转移酶Phospholipid diacylglycerol acyltransferase; NPC:非特异性磷脂酶C Nonspecific phospholipase C; PI-PLC:磷脂酰肌醇特异性磷脂酶C Phosphoinositide-specific phospholipase C; PIS:磷脂酰肌醇合酶PI synthase; PI4K:磷脂酰肌醇4-激酶PI-4-kinase; PI3K:磷脂酰肌醇3-激酶PI-3-kinase; PIP5K:4-磷酸肌醇-5-激酶PI4P 5-kinase; PIP3K:5-磷酸肌醇-3-激酶PI5P 3-kinase; CDS:胞苷二磷酸DAG合酶Cytidine diphosphate-DAG synthase. ER:内质网Endoplasmic reticulum; Golgi:高尔基体Golgiosome.下同。The same as follows. |
生长素的运输主要包括两种途径:被动运输(不消耗能量, 非定向运输)与极性运输(消耗能量)。生长素的梯度分布对植物器官的形成发育至关重要, 而其极性运输是维持生长素梯度分布所必需的。例如:根尖分生区的生长素呈梯度分布, 决定了静止中心和周围干细胞的位置[12]。质膜和内膜定位的生长素转运载体蛋白的稳态和再分布, 参与生长素运输方向的调控。这些转运蛋白包括生长素输入蛋白AUX1/LAXs(auxin-resistant1/AUX1-LIKEs)和输出载体蛋白PIN-FORMEDs(PINs)和ABCB/PGP(ATP-binding-cassette B/P-glycoprotein members)等[13]。其中, 生长素输出载体蛋白PINs决定了生长素的极性运输方向。在根中, 生长素运输方向分为向基运输和向顶运输。一方面, 生长素在地上合成后通过中柱细胞运往根尖; 另一方面, 生长素通过表皮细胞从根尖运输到根茎连接处。这两种运输方向主要是由PINs在根细胞膜的非对称分布决定的。
2.2 生长素输出载体蛋白PINs目前, 拟南芥PINs蛋白家族由8个成员组成。在结构上, PIN蛋白是由2个疏水区和1个亲水区构成的膜内在蛋白, 每个疏水区均有5个跨膜螺旋结构。它们定位于不同的器官、组织或者细胞层, 共同调控生长素的转运和再分布。其中PIN1和PIN2负责根部生长素的较长距离运输。在根部, PIN1主要定位于根中柱细胞, 负责根中的向顶式运输, pin1突变体的发育表型包括针状花序和侧生器官异常[14]。PIN2定位于根表皮层和皮层细胞, 负责根中生长素的向基运输, 其突变体的向性运动发生改变[15]。PIN3和PIN4分别分布于根中柱细胞和根尖静止细胞及下方细胞, 突变体均出现跟生长素相关的生理表型[16]。
低盐胁迫下, 生长素信号突变体axr1、axr4和tir1的侧根数目显著减少, PIN2蛋白表达量降低, 最终导致根发育速度、方向均发生显著变化[17]; 低盐处理抑制PIN2蛋白的表达, 降低PIN2-GFP在根尖伸长区的分布, 暗示盐信号可能通过转录水平和转录后水平调节生长素的运输[18]。另外, 植物的SOS(salt overly sensitive)系统可能是生长素应答盐胁迫的关键调控途径。拟南芥蛋白激酶SOS3基因的敲除, 导致盐处理条件下子叶和根原基生长素含量显著下降, 抑制盐胁迫下侧根的发育; sos3突变体中PIN1蛋白活性下降, 导致生长素从茎向根运输量明显减少, 这可能是SOS系统调控侧根发育和应答盐胁迫的重要机制之一[18]。
PINs蛋白的极性分布受ARF(ADF-ribosylation fator)-GEFs(genunine exchange factors)、可逆磷酸化、脂组分、泛素系统和小G蛋白等多方面的调控[13], 同时受生长素含量、自身基因表达和蛋白稳定性等因素影响[19]。蛋白激酶和磷酸酶抑制剂处理均影响生长素的细胞内外运输。蛋白激酶AGCⅧ家族和蛋白磷酸酶(protein phosphatase 2A, PP2A)是调控PINs可逆磷酸化的关键蛋白。AGCⅧ激酶家族包括D6PK(D6 protein kinases)、PID(PINOID)和WAG1/2等成员[20]。其中, 过表达PID基因促进根部PIN1、PIN2和PIN4蛋白由“向基流”到“向顶流”的极性变化。
拟南芥pid突变体花序呈针状, 花器官和子叶也发育异常, 其表型与pin1突变体类似[21-22]; d6pk突变体则在侧根发育、根向重力性和花芽分化等方面出现异常[23]。与二者不同的是, wag1/2双突变体的根波数量增加[24]。总之, 上述表型都与生长素的转运紧密相关。可见, AGCⅧ蛋白激酶是调控生长素极性运输和植物极性建立的关键调控因子[25]。
3 磷脂介导的生长素信号转导 3.1 参与生长素信号途径的磷脂受体蛋白磷脂分子可以直接结合靶蛋白, 调控其表达水平、细胞定位或蛋白活性等来应答刺激和传递信号。带负电荷的PA被认为是非常重要的第二信使, 其直接结合和调控的蛋白种类很多, 包括蛋白激酶、蛋白磷酸酶、转录因子、细胞骨架结合蛋白和氧化酶等[4, 11, 26]。可逆磷酸化是PINs的极性分布和活性调控的重要机制之一。PINs转运活性受PP2A和蛋白激酶家族AGCⅧ的调控[25, 27]。在生长素信号途径中, PP2A的支架蛋白亚基PP2AA1是第1个被鉴定的PA靶蛋白[26]。体外试验证实PA特异性结合PP2AA1, 并促使后者在质膜募集并提高PP2A活性; 该过程直接导致PIN1去磷酸化水平的提高, 最终调控了生长素的极性运输和分布[26]。与之相反的是, 蛋白磷酸酶家族PP2C成员ABI1和PP2CA, 也可以与PA互作, 但其结合减弱了二者的磷酸酶活性, 参与调控ABA信号和细胞骨架重排等过程[28-29]。这预测了在不同的外源刺激或信号通路中, PA可以与不同蛋白磷酸酶互作, 通过截然不同的作用机制传递信号和调控细胞应答。
PID(PINOID)激酶是生长素转运的关键调控蛋白之一。PID功能主要分为两个方面; 一是在根部PID通过磷酸化PIN2调控根细胞的生长和发育; 二是PID作用于PIN1调控地上器官的发育。Zegzouti等[30]研究发现, PA和磷酸肌醇(phosphoinositides, PIs)都可以结合PID蛋白, 暗示PID在质膜上可能与膜脂存在交叉对话。最近研究表明, 质膜电荷的分布特征对于PID的质膜定位和功能非常重要[31]。其中, 4-磷酸肌醇(phosphatidylinositol-4-phosphate, PtdIns4P)体外结合PID蛋白, 其结合区域位于第248~270位氨基酸残基。突变PID蛋白与PtdIns4P结合的关键区域, 显著抑制了PID蛋白向质膜募集[31]。因此, PtdIns4P决定了PID的质膜定位。我们最近研究发现, PA也可以结合PID蛋白, 并提高其磷酸化PIN2的活性, 显著提高后者转运生长素能力[11](图 2)。PID结合PA的关键区域位于第119~121位的赖氨酸; 突变该3个赖氨酸导致PA诱导的PID活性消失, PIN2的磷酸化水平和活性均受显著抑制, 最终导致根分生区生长素梯度分布受到破坏[11]。进一步研究表明, PA结合区域在AGCⅧ蛋白家族, 包括PID1、WAG1和WAG2, 具有较高的保守性, AGCⅧ是磷脂调控生长素信号的重要节点[11]。有意思的是, 突变PID蛋白的PA结合位点, 并没有影响其在花序和子叶发育、PIN2极性分布、根避盐性和向重力性等方面的功能。另外, 与PtdIns4P-PID互作机制不同, PA分子并不决定PID蛋白的膜定位, 体外试验也表明PtdIns4P不能激活PID蛋白[11]。
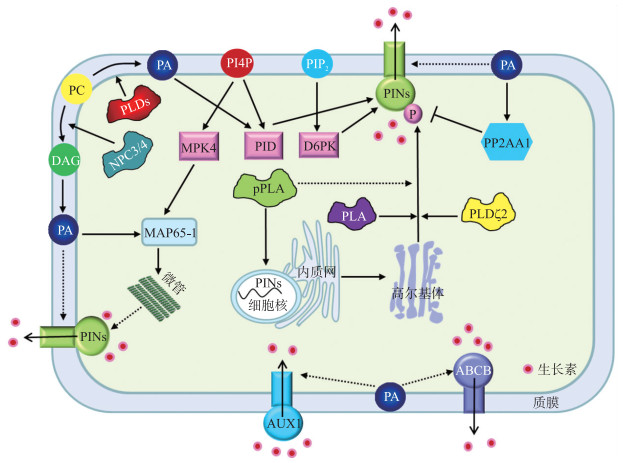
|
图 2 磷脂介导的生长素信号通路 Fig. 2 Phospholipids-mediated auxin signal pathway PINs:生长素输出载体PIN-FORMED; PLDζ2:磷脂酶Dζ2Phospholipase Dζ2;AUX1:生长素输入载体AUXIN-RESISTANT1;ABCB:ATP结合盒B转运蛋白ATP-binding cassette subfamily B; PP2AA1:PP2A蛋白磷酸酶A1亚基Protein phosphatase 2A scaffolding A1 subunit; MPK4:促分裂原活化蛋白激酶4Mitogen-activated protein kinase 4;PID:丝氨酸/苏氨酸蛋白激酶PINOID; D6PK:D6蛋白激酶D6 protein kinase; pPLA:马铃薯贮藏蛋白类似的磷脂酶A Patatin-related phospholipase A. |
膜脂组分和特征对蛋白的膜定位起决定性作用。AGCⅧ家族的D6PK在细胞膜呈极性分布, 并与PINs蛋白共定位。D6PK通过其富含赖氨酸的结构域与磷脂结合, 参与调控PIN3磷酸化和生长素相关的向性生长; 主根表皮细胞的PIP5K1(PI4P5-kinase)和PIP5K2参与该过程[32]。在根毛形成过程中, 小G蛋白ROPs(Rho-of-plant)、DRPs(dynamin-related protein)和PIP5K3等聚集在富含胆固醇和极性膜区域。研究表明D6PK参与上述蛋白的细胞膜聚集过程。另一方面, D6PK的极性改变又依赖于4, 5-二磷酸肌醇[phosphatidylinositol 4, 5-bisphosphate, PtdIns(4, 5)P2]和胆固醇的分布[33]。
3.2 磷脂与生长素介导的向重力性植物根系在植物个体发育和逆境适应中扮演重要角色, 其生长、发育受生长素的精细调控。其中, 植物向性反应对其生长发育、水分和营养吸收及光能利用等都十分重要; 生长素是调控植物根向重力性的关键激素。磷脂酶PLA2较早被证实参与调控植物的向重力性[34-35]。PLA2主要水解磷脂sn-2位置, 生成溶血磷脂酸和脂肪酸。外源生长素能够激活欧芹(Petrosilenum crispum L.)和大豆(Glycine max L.)中的PLA2, 推测PLA2是较早应答生长素信号的磷脂酶之一[34]。PLA专一性抑制处理显著抑制了受生长素诱导的IAA1、IAA5、IAA19和ARF19等基因的表达[36]。拟南芥PLA2β不仅调控生长素介导的叶柄和茎的伸长, 还参与茎和下胚轴向重力性的调节[35]。利用药物学和遗传学等手段证实, PLA2主要通过调节生长素囊泡运输来调控生长素信号[37]。譬如, 抑制高尔基体定位的PLA2α表达或PLA特异性抑制剂处理, 均显著诱导反式高尔基体网格蛋白囊泡的形成, 促进了PINs从质膜脱落; 外源补充LPA能有效缓解上述效应[37]。总之, 植物PLA2及其产物LPA主要通过调控PINs的囊泡运输, 调节生长素的极性运输、分布和植物的向重力性(图 2)。
拟南芥PLDζ2也被证实参与PINs蛋白的囊泡运输和向重力性的调节[30]。拟南芥pldζ2突变体表现为生长素不敏感、向重力性减弱和下胚轴伸长减慢等表型; 过表达PLDζ2或外源补充PA均能促进囊泡运输。利用PIN2-GFP转基因材料, 研究证实PLDζ2产生的PA是维持细胞PIN2囊泡的正常运输所必需的, 其直接影响到生长素的转运、分布及生长素应答等重要过程[38]。利用非损伤微测技术, Mancuso等[39]也证实了PLDζ2/PA参与拟南芥根分生区生长素的转运调控。有趣的是, 有研究表明PLDζ2介导的生长素极性运输, 也参与调控植物的避盐性[40]。盐胁迫能够抑制主根的向重力性, 但其具体的调控机制尚不清楚[41-42]。土壤中的植物主根能感受盐环境, 改变根生长方向促使其主动避开盐环境, PLDζ2介导的生长素信号参与该过程[40]。虽然基于PIN2蛋白的生长素非对称分布是植物主根避开盐害的关键, 但是PLDζ2/PA如何实时调控PIN2囊泡运输及其相关的分子机制仍需进一步研究。另外, 尚未报道PA或者其他磷脂分子是否直接调控生长素载体蛋白AUX1和ABCB。
Chen等[43]最近研究揭示了PI-PLC2参与生长素信号过程。PI-PLC2代谢PtdIns(4, 5)P2成信号分子三磷酸肌醇(phosphatidylinositol-1, 4, 5-trisphosphate, PtdInsP3)和DAG。因此, 脂分子PA和DAG可能通过调节生长素信号途径的关键蛋白, 共同调节生长素信号系统和植物向重力性等过程。另一方面, 生长素也可以通过信号分子一氧化氮(nitric oxide, NO)反馈激活PLD, 应答胞外刺激和胁迫[44]。
值得注意的是, 具有磷脂酶和半乳糖脂酶活性的pPLAⅠ(patatin-related phospholipase A), 也被证实参与生长素信号和向重力性反应。与野生型相比, 利用倾斜培养的pplaⅠ-1突变体会形成更多根波, 且用生长素外向转运抑制剂萘乙酸(1-naphthylphtalamic acid, NPA)和内向转运抑制剂萘氧乙酸(1-naphthoxyacetic acid, 1-NOA)处理均显著增加其根波数目[45]。pPLAⅠ主要存在于胞质和叶绿体, 偏好以氧化态半乳糖脂为底物, 生成单酰基产物和脂肪酸[46]。已有证据暗示脂肪酸可能是调节生长素信号的关键信号分子[34]。pPLAⅠ及其产物脂肪酸是否直接通过生长素调控向重力性仍需细胞、分子和遗传方面的证据。另外, 外源生长素处理可诱导pPLAⅣB的大量表达, 但其突变体却无显著的发育表型[47]。Labusch等[48]推测pPLAs家族的pPLA-Ⅲδ可能直接参与应答和调控生长素信号; 与野生型相比, ppla-Ⅲδ突变体的主根长度和侧根数目显著减少, 其生长素响应基因的表达显著下降。可见, pPLA家族调控生长素途径相关基因的表达, 可能是其调节生长素信号途径的重要机制。
3.3 磷脂与生长素介导的胁迫应答生长素信号途径不仅对植物生长、发育至关重要, 也在植物缺素症和逆境应答中具有重要功能[49-50]。低磷条件下, 生长素受体蛋白(transport inhibitor response 1, TIR1)表达被诱导; 在tir1突变体中, 低磷诱导的侧根和根毛发育均受到抑制[50-52]。盐胁迫下, SOS系统基因的突变导致根柱细胞淀粉体降解和PIN2基因表达减少[17-18]。在植物避盐方面, 盐胁迫促使PIN2蛋白的分布发生改变, 导致根部生长素重分布, 从而改变植物根生长方向以避开胁迫; 该信号过程受PLD/PA调控[40]。另外, 生长素在植物适应其他环境胁迫, 如冷害[53-54]、干旱[55-56]和离子毒害[57]等方面均发挥重要作用。
拟南芥基因组有6个基因编码NPC蛋白, 分别命名为NPC1—NPC6。与PI-PLC不同的是, NPC并不水解PIP2, 而偏好以PC、PE和LPA等脂类为底物[58], 其活性不依赖于钙离子[59-60](图 1)。NPC蛋白参与调控植物应答盐害和干旱、油菜素内酯信号和根发育等生物过程。其中, NPC4参与植物应答盐和ABA信号途径的调节。拟南芥npc4突变体在种子萌发、根发育和气孔运动等方面均表现为ABA不敏感表型, 而对水分和盐胁迫较为敏感。研究表明, NPC4产生的DAG及其转化的PA, 可能是植物应答ABA和盐信号的重要调节因子[59](图 2)。已有研究初步表明, 拟南芥NPC3和NPC4可能参与生长素信号过程[60]。NPC3和NPC4启动子的GUS活性在根尖较强, 且受生长素的诱导; 与野生型相比, npc3和npc4突变体的主根显著变短, 暗示其可能与生长素的信号途径相关[60]。另外, 拟南芥NPC5参与低盐胁迫下侧根的发育[61]。在75 mmol·L-1 NaCl处理下, npc5侧根发育受到显著抑制, 其表型与体内DAG含量变化相吻合, 推测DAG可能作为信号分子应答低盐胁迫和调控侧根发育[61]。
PLD介导的PA通过调控不同的靶蛋白, 参与调节植物的干旱、盐害和温度胁迫响应。其中, 在生长素信号系统中, PID激酶可能是PA的关键调控因子[11]。盐胁迫下, 植物根生长、发育均受阻。PLD/PA介导的生长素信号参与植物根对盐胁迫的应答, 主要表现在两个方面:一方面, PLDζ2调节根分生区PIN2囊泡运输, 诱导生长素的非对称分布, 促进根发生偏生长以避开盐环境[40]; 另一方面, PLDα1和PLDδ来源的PA, 结合PID激酶, 提高其磷酸化PIN2以提高后者转运生长素活性, 调节根部生长素的再分布, 维持根的正常伸长和发育[11]。值得注意的是, 盐胁迫下, PA参与质膜PID稳定性和活性的调控, 而并没有影响其质膜定位; PtdIns4P是PID质膜定位的关键脂分子[31]。
3.4 磷酸肌醇与PINs极性分布膜PtdIns被磷酸化生成的PIs, 也是膜脂的重要组分。早期研究表明, PIs可以将作用蛋白和信号分子招募到不同细胞器膜。PtdIns4P和PtdIns(4, 5)P2是PIs中主要的信号分子, 它们不仅在根毛和花粉管呈极性分布, 而且存在于周质分裂中的细胞板[62-63]。PIP5K1/2激酶磷酸化PtdIns4P生成PtdIns(4, 5)P2(图 1)。研究表明, PIP5K1/2、PtdIns4P和PtdIns(4, 5)P2均特异性分布于根细胞质膜的顶端和底端。pip5k1、pip5k2双突变体植株矮小, 其PINs和生长素的极性分布均发生改变[64]。上述研究表明PIP5K1/2是PINs极性分布、生长素转运和细胞发育所必需的。深入研究表明, PtdIns(4, 5)P2调控的网格蛋白介导的PINs内吞过程是其调控生长素信号的重要机制[64]。生长素诱导PIP5K1/2表达, 并增加质膜PtdIns4P和PtdIns(4, 5)P2的含量, 表明生长素和PIs存在反馈调控。另外, 最近研究表明, 拟南芥磷酸化PtdIns生成PtdIns4P的激酶PI4Kβ1/2(phosphatidylinositol 4-kinase)可以与MPK4互作, 共同调控微管结合蛋白MAP65-3(microtubule-associated protein 65-3)活性, 调节微管动态和细胞分裂[65]。同时, 外源生长素处理促使细胞微管从横向向纵向发生重排, 抑制细胞伸长[66]; PA可以通过MAP65-1实时调控微管稳定, 提高细胞耐盐性[67](图 2)。因此, 微管可能是磷脂分子调控PINs极性分布的重要因子。
3.5 磷脂介导的生物节律植物磷脂含量呈节律性变化, 该节律可能是磷脂调控机制的一个重要发现[68]。拟南芥开花时间与膜PC含量密切相关, 其也依赖于FT(flowering locus t)基因表达; 有趣的是, PC可以直接结合FT蛋白[69]。另外, 最新研究表明, PA可结合生物钟节律调控因子—转录因子LHY(late elongated hypocotyl)和CCA1(circadian clock associated1), 减弱二者与靶基因启动子的结合能力[70], 调节植物生物钟节律。尚无报道PA及其他磷脂分子是否直接结合、调控生长素途径相关的转录因子。值得注意的是, 植物生物节律已被证实是生长素介导侧根发育的重要调控因子[71]。因此, 脂分子、生物节律和生长素信号是否存在交叉对话, 仍需进一步的深入研究。
4 展望生长素的重要特征是细胞之间的极性运输, 最终导致生长素的极性分布; 生长素的转运具有一定的细胞、组织或者器官依赖性。以根为例, 生长素在不同细胞层的转运方向和机制均存在较大差异。同时, 生长素进出细胞需要不同的载体蛋白协同完成, 其相关的调控机制也存在很大差异。但是, 这些载体蛋白都定位于细胞膜等膜系统, 其定位和活性肯定受脂筏(lipid rafts)调控。外界胁迫或刺激会实时影响磷脂代谢酶类活性, 导致磷脂分子种类和数量的变化, 最终改变膜特征, 调控磷脂与生长素通路靶蛋白的互作。因此, 磷脂可能是生长素转运及其信号转导的精细调控分子之一。磷脂作为脂质代谢的重要中间产物, 其对激素的作用是复杂的。同时, 在生长素信号转导过程中, PLC、PLD及其他脂酶的功能与机制, 也将是今后研究的重要内容。
在细胞水平, 生长素相关指示探针(如DR5-GUS、DⅡ-Venus和DR5-n3GFP-DR5ν2-ntdTomato)的创建和应用, 远远优于磷脂分子探针。值得欣慰的是, 植物PtdIns4P和PtdIns(4, 5)P2探针已得到广泛研究和应用。基于FAPP1(PtdIns4P adaptor protein-1)的PtdIns4P探针主要定位于细胞膜、细胞分裂期的细胞板和根毛顶端, 暗示其可能调控生长素和细胞极性生长[62]。基于动物蛋白激酶PKC(protein kinase C)的结构域C1α构建的DAG探针, 其荧光主要分布在胞质和细胞核[72]。同时, 值得注意的是, 基于动物蛋白的植物脂探针, 在植物细胞是否仍能特异地指示脂分子, 现在尚不明确。另外, PA探针在植物中的应用仍然较少。最近, 研究者利用Förster共振能量转移(FRET)原理, 设计了PA特异性结合的光遗传学生物传感器PAleon[73]。PAleon对PA的敏感强, 能特异地监测活细胞质膜PA的浓度变化[73], 为磷脂信号研究提供了有效的研究工具。
利用吸电离质谱成像(matrix-assisted laser desorption/ionization-MS imaging, MALDI-MSI)技术, 可以实时观察种子胚胎磷脂分子种的动态分布[74]。该技术的广泛应用将对磷脂信号的研究, 尤其在生长素方面, 具有很大的推动作用。值得注意的是, 除了经典的PtdIns4P、PtdIns(4, 5)P2和PA信号分子, 最近, 磷脂酰丝氨酸(phosphatidylserine, PS)也被证实是生长素信号的重要调节因子, 参与调控生长素刺激下ROP6(Rho of plants 6)向质膜的募集[75]。因此, 基于磷脂分子生长素信号的调节网络, 具有较高的交叉性和复杂性。结合脂组学和MALDI-MSI技术的应用, 磷脂分子探针的发展, 将从细胞、组织和植株水平, 分别建立磷脂分子感受和转导生长素的调控网络, 并结合磷脂代谢酶类, 有助于在植物细胞发育及其应答胁迫的细胞机制、遗传机制和小分子互作机制等方面创建新的基础理论和技术体系, 促进人们深入认识植物生长发育的基本规律。
| [1] |
Verslues P E, Agarwal M, Katiyar-Agarwal S, et al. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status[J]. The Plant Journal, 2006, 45(4): 523-539. DOI:10.1111/j.1365-313X.2005.02593.x |
| [2] |
Flowers T J, Colmer T D. Plant salt tolerance:adaptations in halophytes[J]. Annals of Botany, 2015, 115(3): 327-331. DOI:10.1093/aob/mcu267 |
| [3] |
Julkowska M M, Testerink C. Tuning plant signaling and growth to survive salt[J]. Trends in Plant Science, 2015, 20(9): 586-594. DOI:10.1016/j.tplants.2015.06.008 |
| [4] |
Hong Y Y, Zhao J, Guo L, et al. Plant phospholipases D and C and their diverse functions in stress responses[J]. Progress in Lipid Research, 2016, 62: 55-74. DOI:10.1016/j.plipres.2016.01.002 |
| [5] |
Korver R A, Koevoets I T, Testerink C. Out of shape during stress:a key role for auxin[J]. Trends in Plant Science, 2018, 23(9): 783-793. DOI:10.1016/j.tplants.2018.05.011 |
| [6] |
Wang X M. Regulatory functions of phospholipase D and phosphatidic acid in plant growth, development, and stress responses[J]. Plant Physiology, 2005, 139(2): 566-573. DOI:10.1104/pp.105.068809 |
| [7] |
Nakamura Y. NPC: Nonspecific Phospholipase Cs in Plant Functions[M]//Signaling and Communication in Plants. Heidelberg: Springer, 2013: 55-67.
|
| [8] |
Zhang Q, Song P, Qu Y N, et al. Phospholipase Dδ negatively regulates plant thermotolerance by destabilizing cortical microtubules in Arabidopsis[J]. Plant, Cell & Environment, 2017, 40(10): 2220-2235. |
| [9] |
Li W Q, Li M Y, Zhang W H, et al. The plasma membrane-bound phospholipase Dδ enhances freezing tolerance in Arabidopsis thaliana[J]. Nature Biotechnology, 2004, 22(4): 427-433. DOI:10.1038/nbt949 |
| [10] |
Zhang Y Y, Zhu H Y, Zhang Q, et al. Phospholipase Dα1 and phosphatidic acid regulate NADPH oxidase activity and production of reactive oxygen species in ABA-mediated stomatal closure in Arabidopsis[J]. The Plant Cell, 2009, 21(8): 2357-2377. DOI:10.1105/tpc.108.062992 |
| [11] |
Wang P P, Shen L K, Guo J H, et al. Phosphatidic acid directly regulates PINOID-dependent phosphorylation and activation of the PIN-FORMED 2 auxin efflux transporter in response to salt stress[J]. The Plant Cell, 2019, 31(1): 250-271. DOI:10.1105/tpc.18.00528 |
| [12] |
Sabatini S, Beis D, Wolkenfelt H, et al. An auxin-dependent distal organizer of pattern and polarity in the Arabidopsis root[J]. Cell, 1999, 99(5): 463-472. DOI:10.1016/S0092-8674(00)81535-4 |
| [13] |
Ganguly A, Cho H T. Polar Auxin Transport[M]//Signaling in Polar Auxin Transport. Heidelberg: Springer Berlin Heidelberg, 2013: 1-24.
|
| [14] |
Blilou I, Xu J, Wildwater M, et al. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots[J]. Nature, 2005, 433(7021): 39-44. DOI:10.1038/nature03184 |
| [15] |
Müller A, Guan C H, Gälweiler L, et al. AtPIN2 defines a locus of Arabidopsis for root gravitropism control[J]. The EMBO Journal, 1998, 17(23): 6903-6911. DOI:10.1093/emboj/17.23.6903 |
| [16] |
Friml J, Wiśniewska J, Benková E, et al. Lateral relocation of auxin efflux regulator PIN3 mediates tropism in Arabidopsis[J]. Nature, 2002, 415(6873): 806-809. DOI:10.1038/415806a |
| [17] |
Sun F F, Zhang W S, Hu H Z, et al. Salt modulates gravity signaling pathway to regulate growth direction of primary roots in Arabidopsis[J]. Plant Physiology, 2008, 146(1): 178-188. DOI:10.1104/pp.107.109413 |
| [18] |
Zhao Y K, Wang T, Zhang W S, et al. SOS3 mediates lateral root development under low salt stress through regulation of auxin redistribution and maxima in Arabidopsis[J]. New Phytologist, 2011, 189(4): 1122-1134. DOI:10.1111/j.1469-8137.2010.03545.x |
| [19] |
Garay-Arroyo A, Ortiz-Moreno E, de la Paz Sánchez M, et al. The MADS transcription factor XAL2/AGL14 modulates auxin transport during Arabidopsis root development by regulating PIN expression[J]. The EMBO Journal, 2013, 32(21): 2884-2895. DOI:10.1038/emboj.2013.216 |
| [20] |
Ganguly A, Sasayama D, Cho H T. Regulation of the polarity of protein trafficking by phosphorylation[J]. Molecules and Cells, 2012, 33(5): 423-430. DOI:10.1007/s10059-012-0039-9 |
| [21] |
Bennett S R M, Alvarez J, Bossinger G, et al. Morphogenesis in pinoid mutants of Arabidopsis thaliana[J]. The Plant Journal, 1995, 8(4): 505-520. DOI:10.1046/j.1365-313X.1995.8040505.x |
| [22] |
Dhonukshe P, Huang F, Galvan-Ampudia C S, et al. Plasma membrane-bound AGC3 kinases phosphorylate PIN auxin carriers at TPRXS(N/S) motifs to direct apical PIN recycling[J]. Development, 2010, 137(19): 3245-3255. DOI:10.1242/dev.052456 |
| [23] |
Zourelidou M, Muller I, Willige B C, et al. The polarly localized D6 PROTEIN KINASE is required for efficient auxin transport in Arabidopsis thaliana[J]. Development, 2009, 136(4): 627-636. DOI:10.1242/dev.028365 |
| [24] |
Santner A A, Watson J C. The WAG1 and WAG2 protein kinases negatively regulate root waving in Arabidopsis[J]. The Plant Journal, 2006, 45(5): 752-764. DOI:10.1111/j.1365-313X.2005.02641.x |
| [25] |
Zourelidou M, Absmanner B, Weller B, et al. Auxin efflux by PIN-FORMED proteins is activated by two different protein kinases, D6 PROTEIN KINASE and PINOID[J]. eLife, 2016, 3: e02860. |
| [26] |
Gao H B, Chu Y J, Xue H W. Phosphatidic acid(PA) binds PP2AA1 to regulate PP2A activity and PIN1 polar localization[J]. Molecular Plant, 2013, 6(5): 1692-1702. DOI:10.1093/mp/sst076 |
| [27] |
Huang F, Kemel Zago M, Abas L, et al. Phosphorylation of conserved PIN motifs directs Arabidopsis PIN1 polarity and auxin transport[J]. The Plant Cell, 2010, 22(4): 1129-1142. DOI:10.1105/tpc.109.072678 |
| [28] |
Zhang W, Qin C, Zhao J, et al. Phospholipase D α1-derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling[J]. Proc Natl Acad Sci USA, 2004, 101(25): 9508-9513. DOI:10.1073/pnas.0402112101 |
| [29] |
Qu Y N, Song P, Hu Y W, et al. Regulation of stomatal movement by cortical microtubule organization in response to darkness and ABA signaling in Arabidopsis[J]. Plant Growth Regulation, 2018, 84(3): 467-479. DOI:10.1007/s10725-017-0353-5 |
| [30] |
Zegzouti H, Anthony R G, Jahchan N, et al. Phosphorylation and activation of PINOID by the phospholipid signaling kinase 3-phosphoinositide-dependent protein kinase 1(PDK1) in Arabidopsis[J]. Proc Natl Acad Sci USA, 2006, 103(16): 6404-6409. DOI:10.1073/pnas.0510283103 |
| [31] |
Simon M L A, Platre M P, Marquès-Bueno M M, et al. A PI4P-driven electrostatic field controls cell membrane identity and signaling in plants[J]. Nature Plants, 2016, 2(7): 16089. DOI:10.1038/nplants.2016.89 |
| [32] |
Barbosa I C, Shikata H, Zourelidou M, et al. Phospholipid composition and a polybasic motif determine D6 PROTEIN KINASE polar association with the plasma membrane and tropic responses[J]. Development, 2016, 143(24): 4687-4700. DOI:10.1242/dev.137117 |
| [33] |
Stanislas T, Hüser A, Barbosa I C R, et al. Arabidopsis D6PK is a lipid domain-dependent mediator of root epidermal planar polarity[J]. Nature Plants, 2015, 1(11): 15162. DOI:10.1038/nplants.2015.162 |
| [34] |
André Holk R U P, Scherer G F E. Fatty acids and lysophospholipids as potential second messengers in auxin action. Rapid activation of phospholipase A2 activity by auxin in suspension-cultured parsley and soybean cells[J]. The Plant Journal, 1998, 16(5): 601-611. DOI:10.1046/j.1365-313x.1998.00333.x |
| [35] |
Lee H Y, Bahn S C, Kang Y M, et al. Secretory low molecular weight phospholipase A2 plays important roles in cell elongation and shoot gravitropism in Arabidopsis[J]. The Plant Cell, 2003, 15(9): 1990-2002. DOI:10.1105/tpc.014423 |
| [36] |
Scherer G F E, Zahn M, Callis J, et al. A role for phospholipase A in auxin-regulated gene expression[J]. FEBS Letters, 2007, 581(22): 4205-4211. DOI:10.1016/j.febslet.2007.07.059 |
| [37] |
Lee O R, Kim S J, Kim H J, et al. Phospholipase A2 is required for PIN-FORMED protein trafficking to the plasma membrane in the Arabidopsis root[J]. The Plant Cell, 2010, 22(6): 1812-1825. DOI:10.1105/tpc.110.074211 |
| [38] |
Li G, Xue H W. Arabidopsis PLDζ2 regulates vesicle trafficking and is required for auxin response[J]. The Plant Cell, 2007, 19(1): 281-295. DOI:10.1105/tpc.106.041426 |
| [39] |
Mancuso S, Marras A M, Mugnai S, et al. Phospholipase Dζ2 drives vesicular secretion of auxin for its polar cell-cell transport in the transition zone of the root apex[J]. Plant Signaling & Behavior, 2007, 2(4): 240-244. |
| [40] |
Galvan-Ampudia C S, Julkowska M M, Darwish E, et al. Halotropism is a response of plant roots to avoid a saline environment[J]. Current Biology, 2013, 23(20): 2044-2050. DOI:10.1016/j.cub.2013.08.042 |
| [41] |
Dinneny J R, Long T A, Wang J Y, et al. Cell identity mediates the response of Arabidopsis roots to abiotic stress[J]. Science, 2008, 320(5878): 942-945. DOI:10.1126/science.1153795 |
| [42] |
Sun F F, Zhang W S, Hu H Z, et al. Salt modulates gravity signaling pathway to regulate growth direction of primary roots in Arabidopsis[J]. Plant Physiology, 2008, 146(1): 178-188. DOI:10.1104/pp.107.109413 |
| [43] |
Chen X, Li L, Xu B X, et al. Phosphatidylinositol-specific phospholipase C2 functions in auxin-modulated root development[J]. Plant, Cell & Environment, 2019, 42(5): 1441-1457. |
| [44] |
Lanteri M L, Laxalt A M, Lamattina L. Nitric oxide triggers phosphatidic acid accumulation via phospholipase D during auxin-induced adventitious root formation in cucumber[J]. Plant Physiology, 2008, 147(1): 188-198. DOI:10.1104/pp.107.111815 |
| [45] |
Perrineau F, Wimalasekera R, Effendi Y, et al. Inhibition of auxin transport and auxin signaling and treatment with far red light induces root coiling in the phospholipase-A mutant ppla-Ⅰ-1. Significance for surface penetration?[J]. Journal of Plant Physiology, 2016, 196/197: 53-59. DOI:10.1016/j.jplph.2016.03.010 |
| [46] |
Yang W Y, Zheng Y, Bahn S C, et al. The patatin-containing phospholipase A pPLAIIα modulates oxylipin formation and water loss in Arabidopsis thaliana[J]. Molecular Plant, 2012, 5(2): 452-460. DOI:10.1093/mp/ssr118 |
| [47] |
Rietz S, Dermendjiey G, Oppermann E, et al. Roles of Arabidopsis patatin-related phospholipases A in root development are related to auxin responses and phosphate deficiency[J]. Molecular Plant, 2010, 3(3): 524-538. DOI:10.1093/mp/ssp109 |
| [48] |
Labusch C, Shishova M, Effendi Y, et al. Patterns and timing in expression of early auxin-induced genes imply involvement of phospholipases A(pPLAs) in the regulation of auxin responses[J]. Molecular Plant, 2013, 6(5): 1473-1486. DOI:10.1093/mp/sst053 |
| [49] |
Li B H, Li G J, Kronzucker H J, et al. Ammonium stress in Arabidopsis:signaling, genetic loci, and physiological targets[J]. Trends in Plant Science, 2014, 19(2): 107-114. DOI:10.1016/j.tplants.2013.09.004 |
| [50] |
López-Arredondo D L, Leyva-González M A, González-Morales S I, et al. Phosphate nutrition:improving low-phosphate tolerance in crops[J]. Annual Review of Plant Biology, 2014, 65(1): 95-123. DOI:10.1146/annurev-arplant-050213-035949 |
| [51] |
López-Bucio J, Hernández-Abreu E, Sánchez-Calderón L, et al. Phosphate availability alters architecture and causes changes in hormone sensitivity in the Arabidopsis root system[J]. Plant Physiology, 2002, 129(1): 244-256. DOI:10.1104/pp.010934 |
| [52] |
Pérez-Torres C A, López-Bucio J, Cruz-Ramírez A, et al. Phosphate availability alters lateral root development in Arabidopsis by modulating auxin sensitivity via a mechanism involving the TIR1 auxin receptor[J]. The Plant Cell, 2008, 20(12): 3258-3272. DOI:10.1105/tpc.108.058719 |
| [53] |
Shibasaki K, Uemura M, Tsurumi S, et al. Auxin response in Arabidopsis under cold stress:underlying molecular mechanisms[J]. The Plant Cell, 2009, 21(12): 3823-3838. DOI:10.1105/tpc.109.069906 |
| [54] |
Du H, Wu N, Fu J, et al. A GH3 family member, OsGH3-2, modulates auxin and abscisic acid levels and differentially affects drought and cold tolerance in rice[J]. Journal of Experimental Botany, 2012, 63(18): 6467-6480. DOI:10.1093/jxb/ers300 |
| [55] |
Zhang Q, Li J J, Zhang W J, et al. The putative auxin efflux carrier OsPIN3t is involved in the drought stress response and drought tolerance[J]. The Plant Journal, 2012, 72(5): 805-816. DOI:10.1111/j.1365-313X.2012.05121.x |
| [56] |
Remy E, Cabrito T R, Baster P, et al. A major facilitator superfamily transporter plays a dual role in polar auxin transport and drought stress tolerance in Arabidopsis[J]. The Plant Cell, 2013, 25(3): 901-926. DOI:10.1105/tpc.113.110353 |
| [57] |
Kopittke P M, Moore K L, Lombi E, et al. Identification of the primary lesion of toxic aluminum in plant roots[J]. Plant Physiology, 2015, 167(4): 1402-1411. DOI:10.1104/pp.114.253229 |
| [58] |
Peters C, Li M Y, Narasimhan R, et al. Nonspecific phospholipase C NPC4 promotes responses to abscisic acid and tolerance to hyperosmotic stress in Arabidopsis[J]. The Plant Cell, 2010, 22(8): 2642-2659. DOI:10.1105/tpc.109.071720 |
| [59] |
Reddy V S, Rao D K V, Rajasekharan R. Functional characterization of lysophosphatidic acid phosphatase from Arabidopsis thaliana[J]. Biochimica et Biophysica Acta, 2010, 1801(4): 455-461. DOI:10.1016/j.bbalip.2009.12.005 |
| [60] |
Wimalasekera R, Pejchar P, Holk A, et al. Plant phosphatidylcholine-hydrolyzing phospholipases C NPC3 and NPC4 with roles in root development and brassinolide signaling in Arabidopsis thaliana[J]. Molecular Plant, 2010, 3(3): 610-625. DOI:10.1093/mp/ssq005 |
| [61] |
Peters C, Kim S C, Devaiah S, et al. Non-specific phospholipase C5 and diacylglycerol promote lateral root development under mild salt stress in Arabidopsis[J]. Plant, Cell & Environment, 2014, 37(9): 2002-2013. |
| [62] |
Vermeer J E M, Thole J M, Goedhart J, et al. Imaging phosphatidylinositol 4-phosphate dynamics in living plant cells[J]. The Plant Journal, 2009, 57(2): 356-372. DOI:10.1111/j.1365-313X.2008.03679.x |
| [63] |
Ischebeck T, Stenzel I, Heilmann I. Type B phosphatidylinositol-4-phosphate 5-kinases mediate Arabidopsis and Nicotiana tabacum pollen tube growth by regulating apical pectin secretion[J]. The Plant Cell, 2008, 20(12): 3312-3330. DOI:10.1105/tpc.108.059568 |
| [64] |
Ischebeck T, Werner S, Krishnamoorthy P, et al. Phosphatidylinositol 4, 5-bisphosphate influences PIN polarization by controlling clathrin-mediated membrane trafficking in Arabidopsis[J]. The Plant Cell, 2013, 25(12): 4894-4911. DOI:10.1105/tpc.113.116582 |
| [65] |
Lin F, Krishnamoorthy P, Schubert V, et al. A dual role for cell plate-associated PI4Kβ in endocytosis and phragmoplast dynamics during plant somatic cytokinesis[J]. The EMBO Journal, 2019, 38(4): e100303. |
| [66] |
Chen X, Grandont L, Li H J, et al. Inhibition of cell expansion by rapid ABP1-mediated auxin effect on microtubules[J]. Nature, 2014, 516(7529): 90-93. DOI:10.1038/nature13889 |
| [67] |
Zhang Q, Lin F, Mao T L, et al. Phosphatidic acid regulates microtubule organization by interacting with MAP65-1 in response to salt stress in Arabidopsis[J]. The Plant Cell, 2012, 24(11): 4555-4576. DOI:10.1105/tpc.112.104182 |
| [68] |
Nakamura Y. Membrane lipid oscillation:an emerging system of molecular dynamics in the plant membrane[J]. Plant and Cell Physiology, 2018, 59(3): 441-447. DOI:10.1093/pcp/pcy023 |
| [69] |
Colin L A, Jaillais Y. Phospholipids across scales:lipid patterns and plant development[J]. Current Opinion in Plant Biology, 2020, 53: 1-9. DOI:10.1016/j.pbi.2019.08.007 |
| [70] |
Kim S C, Nusinow D A, Sorkin M L, et al. Interaction and regulation between lipid mediator phosphatidic acid and circadian clock regulators[J]. The Plant Cell, 2019, 31(2): 399-416. DOI:10.1105/tpc.18.00675 |
| [71] |
Voß U, Wilson M H, Kenobi K, et al. The circadian clock rephases during lateral root organ initiation in Arabidopsis thaliana[J]. Nature Communications, 2015, 6: 7641. DOI:10.1038/ncomms8641 |
| [72] |
Vermeer J E M, van Wijk R, Goedhart J, et al. In vivo imaging of diacylglycerol at the cytoplasmic leaflet of plant membranes[J]. Plant and Cell Physiology, 2017, 58(7): 1196-1207. DOI:10.1093/pcp/pcx012 |
| [73] |
Li W, Song T Z, Wallrad L, et al. Tissue-specific accumulation of pH-sensing phosphatidic acid determines plant stress tolerance[J]. Nature Plants, 2019, 5(9): 1012-1021. DOI:10.1038/s41477-019-0497-6 |
| [74] |
Horn P J, Korte A R, Neogi P B, et al. Spatial mapping of lipids at cellular resolution in embryos of cotton[J]. The Plant Cell, 2012, 24(2): 622-636. DOI:10.1105/tpc.111.094581 |
| [75] |
Platre M P, Bayle V, Armengot L, et al. Developmental control of plant Rho GTPase nano-organization by the lipid phosphatidylserine[J]. Science, 2019, 364(6435): 57-62. DOI:10.1126/science.aav9959 |




