文章信息
- 李秋霞, 郭加汛, 周晓辉, 何也, 刘叶楠, 许斌, 赵耕毛
- LI Qiuxia, GUO Jiaxun, ZHOU Xiaohui, HE Ye, LIU Yenan, XU Bin, ZHAO Gengmao
- 江苏盐城大丰滨海滩涂典型湿地土壤细菌群落结构分析
- Composition structure of soil bacterial community in typical wetland of tidal flat, Dafeng, Yancheng, Jiangsu Province
- 南京农业大学学报, 2019, 42(6): 1108-1117
- Journal of Nanjing Agricultural University, 2019, 42(6): 1108-1117.
- http://dx.doi.org/10.7685/jnau.201901047
-
文章历史
- 收稿日期: 2019-01-28
江苏盐城地区滨海滩涂湿地, 属于淤进型海岸湿地类型, 面积4 500 km2, 约占江苏省滨海湿地面积的70%[1], 是我国最为重要的海岸带湿地之一。作为我国最大的连续潮间带湿地生态系统[2], 盐城滨海滩涂湿地对于区域生物多样性保护和生态功能维持具有极为重要的意义[3]。我国东部沿海人多地少, 滩涂围垦一直是获得补充耕地的重要方法。盐城滩涂围垦发展滩涂养殖和种植业已有百余年的历史, 随着江苏沿海开发上升为国家战略, 在未来的一段时间内还将有270 hm2滩涂要进行围垦与开发, 这导致人为干扰加剧, 湿地生态系统可能会遭到破坏[4-6]。因此, 滩涂湿地开发和保护研究已被提上重要研究日程。
江苏盐城滩涂湿地主要有芦苇(Phragmites australis)湿地、盐地碱蓬(Artemisia salina, 俗称盐蒿)湿地以及碱蓬(Suaeda salsa)湿地等类型, 分别位于潮上带和大潮高潮位以上的潮间带[7]。占据了潮间带上部高潮位附近大部分面积的互花米草湿地属于外来物种互花米草(Spartina alterniflora)引种后形成的人工湿地。互花米草是北美地区海岸盐沼湿地的重要物种, 于1979年引入我国[8]。互花米草的引种改变了原生湿地生物多样性, 引起了广泛争议。土壤微生物在滨海湿地生态系统的形成、演化、稳定等过程, 以及生态功能中发挥着重要作用, 与滩涂湿地环境之间的关系十分密切, 两者相互影响、相互制约[9]。一方面, 滩涂植物生长所产生的根系分泌物和凋落物可以供给土壤微生物生命活动所需的营养物质[10]; 另一方面, 微生物又是有机质代谢和植物养分转化的驱动力, 参与所有土壤生化过程, 包括有机质分解、腐殖质形成以及营养盐的转化和循环等, 其生命过程能够改变土壤微环境和植物群落的演替方向, 进而影响整个生态系统[11-12]。土壤微生物的生长和活动又受控于土壤环境因子, 如:盐分、pH、土壤形态、土壤温度和含水量等, 因此微生物对土壤环境的变化极为敏感[13-14]。
本研究通过分析盐城大丰滨海湿地主要植被类型的土壤细菌群落结构特征, 阐明不同滨海湿地生境对土壤微生物群落的调控作用及驱动机制, 为滨海湿地生物多样性保护及滩涂合理开发利用提供理论依据。
1 材料与方法 1.1 研究区域概况研究区域位于江苏省盐城市大丰港附近(33°2′39 ″N— 33°10′22″N, 120°39′39″E—120°49′44 ″E)。该区域位于亚热带向暖温带的过渡地带, 季风气候显著, 受南北气流和海洋、大陆双重气候的影响, 年平均气温为13.7~14.8 ℃, 年降水量为900~1 100 mm, 日光辐射总量为487~508 kJ · cm-2。采样地点以碱蓬湿地(SuW)、互花米草湿地(SW)、芦苇湿地(PW)、盐蒿湿地(AW)和原始光滩地(PB)为主, 间或有少量茅草生长。采样地点位置如图 1所示。
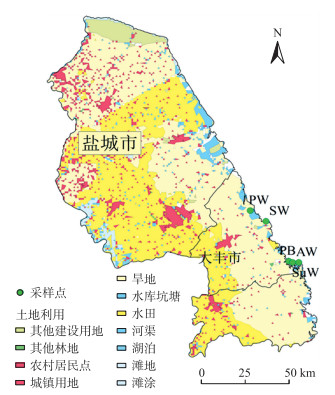
|
图 1 研究区域及采样点示意图 Fig. 1 Study area and sampling sites PB:原始光滩地; SuW:碱蓬湿地; SW:互花米草湿地; PW:芦苇湿地; AW:盐蒿湿地。下同。 PB:Primordial beach; SuW:Suaeda salsa wetland; SW:Spartina alterniflora wetland; PW:Phragmites australis wetland; AW:Artemisia salina wetland. The same as follows. |
采用样方调查方法, 每种湿地类型设置3块平行地块, 每个地块间隔150 m左右, 使用土钻(直径10 cm, 长度20 cm)按照“S”布点法对每种湿地类型采集10个样品, 采样深度为0~20 cm。采集的土壤样品按照同一湿地类型同一地块混合, 制作成3个平行样本, 当天送回实验室于4 ℃冰箱中保存。实验室样品处理分为鲜样和干样(风干), 鲜样在4 ℃和-80 ℃保存, 分别用于土壤生化指标分析和DNA提取; 干样分别过孔径为830和150 μm筛, 用于土壤理化性质分析。
1.3 土壤总DNA提取与PCR扩增以及16S rRNA测序采用CTAB方法提取土壤样品的基因组DNA, 利用琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量样品于离心管中, 使用无菌水稀释样品至1 ng · μL-1。以稀释后的基因组DNA为模板, 细菌16S rRNA基因V4区采用通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′), 使用带Barcode的特异引物, New England Biolabs公司Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR扩增, 确保扩增效率和准确性。2 g · L-1琼脂糖凝胶电泳检测PCR产物; 根据PCR产物浓度等量混样, 充分混匀后使用2 g · L-1琼脂糖凝胶电泳检测PCR产物, 使用Qiagen公司提供的胶回收试剂盒回收目的条带。采用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建, 基于Illumina HiSeq测序平台将纯化产物进行高通量测序。
1.4 土壤理化性质采用pH计测定土壤pH值(水、土质量比为1 : 5)。采用全氮凯氏定氮法制作待测液, 使用流动分析仪测定土壤中全氮含量; 采用氯化钾制作土壤浸提液, 使用流动分析仪测定土壤中硝态氮和铵态氮含量。采用酸溶法制作待测液, 使用ICP-OES测定土壤中全磷含量; 采用碳酸氢钠-钼锑抗比色法测定土壤中有效磷含量。采用氢氟酸-高氯酸硝煮法制作待测液, 使用ICP-OES测定土壤中全钾含量; 采用乙酸铵提取法, 使用ICP-OES测定土壤中速效钾含量。采用乙酸钠-火焰光度法测定土壤中Na+含量。采用土壤水浸提液法和ICP-OES测定土壤中Ca2+、Mg2+含量; 使用电导计测定土壤中总盐含量。采用低温外热重铬酸钾氧化-比色法测定土壤有机质含量。采用苏州科铭公司试剂盒测定土壤过氧化氢酶、土壤碱性磷酸酶、土壤脲酶以及土壤多酚氧化酶活性。
1.5 数据分析采用Qiime 1.7.0软件计算物种数目(observed species)、均匀度(Shannon)、辛普森多样性指数(Simpson)、OTU数目指数(Chao 1)、测序深度指数(goods coverage)和系统发育多样性(PD whole tree)等指数。OTU(operational taxonomic units)利用R语言生成NMDS(non-metric multi-dimensional scaling)、Venn图、物种相对丰度柱形图、UPGMA聚类树(unweighted pair-group method with arithmetic mean)、物种丰度聚类热图、Spearman分析热图以及CCA分析图(canonical correspondence analysis)。采用Python语言生成FAPROTAX(functional annotation of prokaryotic taxa)进行生态功能预测。数据处理软件主要包括OriginPro 2017、SPSS 20、Excel 2010。
2 结果与分析 2.1 滨海湿地土壤细菌群落组成及功能基于OTU生成的NMDS模型与UPGMA聚类树(图 2), 反映出湿地生境之间土壤细菌群落的显著差异, 其中芦苇湿地与原始光滩地的细菌群落相似度较高, 互花米草湿地与盐蒿湿地的细菌群落相似, 碱蓬湿地的土壤细菌群落则不同于其他4种生境。采样区域内的优势物种为Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Gemmatimonadetes(芽单胞菌门)、Actinobacteria(放线菌门)、Euryarchaeota(广古菌门)、Planctomycetes(浮霉菌门)、Verrucomicrobia(疣微菌门)、Firmicutes(厚壁菌门), 其中Bacteroidetes(拟杆菌门)、Euryarchaeota(广古菌门)在碱蓬湿地中丰度最高, 而Euryarchaeota(广古菌门)在其他生境中比例较低(图 3-A)。5种湿地生境OTU数目共有2 574个, 其特有的OTU为碱蓬湿地(SuW)384个, 互花米草湿地(SW)390个、芦苇湿地(PW)430个、原始光滩地(PB)340个、盐蒿湿地(AW)553个, 盐蒿湿地的特有OTU数目最多, 原始光滩地的最少(图 3-B)。

|
图 2 OTU聚类样品比较分析 Fig. 2 Comparative analysis of OTU cluster samples A.非度量多维尺度NMDS; B.基于距离加权UniFrac的UPGMA聚类树。 A. NMDS(non-metric multi-dimensional scaling)plot of soil bacterial communities; B. UPGMA(unweighted pair-group method with arithmetic mean)clustering tree based on weighted uniFrac distance. |
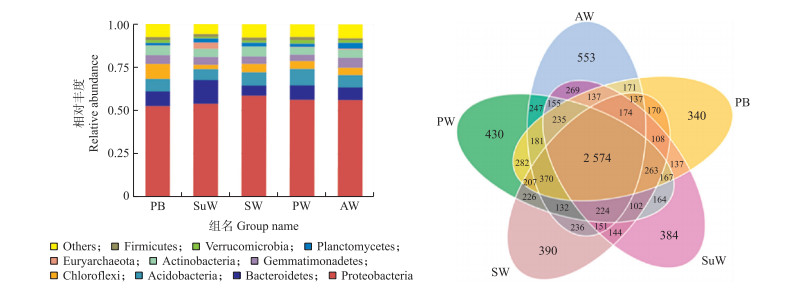
|
图 3 门水平下的物种相对丰度柱形图(A)和Venn图(B) Fig. 3 The relative abundance columnar accumulations of bacterial phyla(A)and Venn(B) |
物种丰度聚类热图结果(图 4)显示, 高丰度物种中出现了新门物种, 如盐蒿湿地中的Deferribaeteres(脱铁杆菌门), 以及众多的候选门类, 如原始光滩地Cloacimonetes, 互花米草湿地Latescibacteria, 芦苇湿地Aminicenantes、TA06、Saccharibacteria(螺旋体菌门), 盐蒿湿地JL-ETNP-Z39等。在碱蓬湿地和互花米草湿地中还含有高丰度的古菌门类物种:Euryarchaeota(古生菌门)、Woesearchaeota_DHVEG-6、Thaumarchaeota(奇古菌门)。在科水平下, 碱蓬湿地含有大量的海洋性盐生细菌, 如:Ectothiorhodospiraceae[15](节外硫红螺菌科)、Oceanospirillaceae[16-17]、Sphingomonadaceae(鞘酯菌科)、Alcanivoracaceae(食烷菌科)、Halomonadaceae(盐单胞菌科)、Alteromonadaceae(异单胞菌科), 同时还有嗜盐古生菌Halobcateriaceae; 原始光滩地中高丰度嗜盐细菌有Ectothiorhodospiraceae和广泛存在于海洋中或海洋沉积物中的Cytophagaceae(噬纤维菌科)、Flavobacteriaceae、Desulfobacteraceae(脱硫杆菌科); 互花米草湿地高丰度物种, 如Desulfobulbaceae(脱硫球菌科)、JTB255 marine benthic group、Halieaceae[18]、OM1 clade, 多数生活于海洋环境; 芦苇湿地和盐蒿湿地所拥有的海洋环境细菌较少, 如Saprospiraceae(腐螺旋菌科)、Desulfuromonadaceae(脱硫单胞菌科)、PAUC43f marine benthic group。
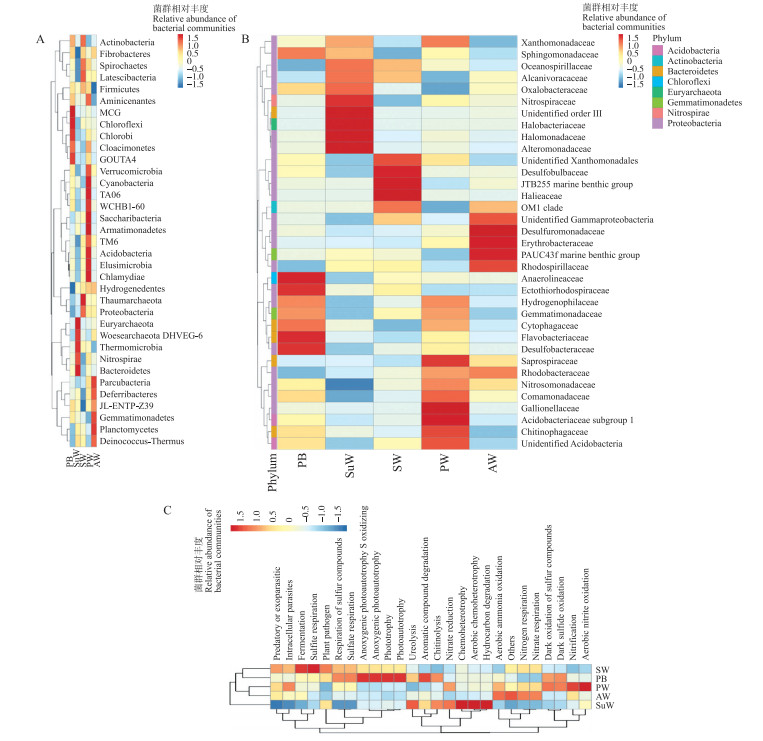
|
图 4 门水平(A)、科水平(B)物种聚类热图和FAPROTAX功能预测热图(C) Fig. 4 Species clustering heat map of the OTU of bacterial phyla(A), the OTU of bacterial families(B) and functional prediction of FAPROTAX(C) |
FAPROTAX群落功能预测(图 4-C)中:发酵作用、亚硫酸盐呼吸、硫化物呼吸、硫酸盐呼吸、无氧光自养含硫氧化、无氧光自养、光养以及光能自养等作用主要集中于互花米草湿地和原始光滩地; 尿素分解、芳香化合物降解、几丁质分解、硝酸还原作用、化能异养以及烃降解等作用主要集中于碱蓬湿地; 芦苇湿地中主要有硝化作用和好氧亚硝酸盐氧化作用; 盐蒿湿地与芦苇湿地主要有耗氧氨氧化、氮呼吸以及硝酸盐呼吸等作用; 而含硫化合物的暗氧化作用和暗硫化氧化作用主要集中于芦苇湿地和原始光滩地。
2.2 滨海湿地土壤细菌群落多样性指数利用Qiime生成常用多样性指数, 如:物种数目(observed species)、OTU数目指数(Chao 1)、均匀度(Shannon)、辛普森多样性指数(Simpson)、测序深度指数(goods coverage)以及系统发育多样性(PD whole tree)。从表 1可知:碱蓬湿地中各项多样性指数都低于其他生境, 芦苇湿地的多样性指数最高, 其次为盐蒿湿地, 原始光滩地和互花米草湿地次之。将湿地植被类型作为单一预测变量的统计学模型[19]进行分析, 研究区域内不同植被类型对多样性指标的影响程度(Adjust R2)为0.218~0.441。
| 湿地类型 Wetland type |
物种数目 Observedspecies |
均匀度 Shannon |
辛普森多样性指数 Simpson |
OTU数目指数 Chao 1 |
测序深度指数 Goods coverage |
系统发育多样性 PD whole tree |
| 原始光滩地Primordial beach | 5 205.000 | 10.733 | 0.998 | 5 594.063 | 0.986 | 346.906 |
| 碱蓬湿地Suaeda salsa wetland | 4 926.000 | 10.333 | 0.997 | 5 281.289 | 0.987 | 332.235 |
| 芦苇湿地Phragmites australis wetland | 5 573.000 | 10.984 | 0.999 | 5 883.396 | 0.985 | 364.960 |
| 互花米草湿地Spartina alterniflora wetland | 5 236.000 | 10.763 | 0.998 | 5 557.012 | 0.986 | 349.159 |
| 盐蒿湿地Artemisia salina wetland | 5 464.000 | 10.885 | 0.999 | 5 829.960 | 0.985 | 370.487 |
| Adjust R2 | 0.271 | 0.218 | 0.321 | 0.240 | 0.321 | 0.441 |
| 注:Adjust R2表示模型适用性测试。 Note:Adjust R2 is given as a measure of model goodness of fit. | ||||||
从表 2可知:不同湿地生境土壤全氮(TN)、硝态氮(NO3--N)、全磷(TP)、有效磷(AP)、有机质(OM)、全钾(TK)、可溶性盐总量(TSS)、速效钾(AK)、Ca2+、Mg2+、Na+、钠吸附比(SAR)含量存在明显差异。土壤TSS、Mg2+、Na+、SAR含量在碱蓬湿地最高, 在互花米草湿地、芦苇湿地和盐蒿湿地次之, 在原始光滩地最低。AK含量由高到低, 依次为互花米草湿地、原始光滩地、碱蓬湿地、盐蒿湿地、芦苇湿地。Ca2+含量在芦苇湿地最高, 其次为碱蓬湿地, 盐蒿湿地与原始光滩地含量最低。
| 指标 Index |
原始光滩地 Primordialbeach |
碱蓬湿地 Suaeda salsawetland |
芦苇湿地 Phragmites australiswetland |
互花米草湿地 Spartina alterniflorawetland |
盐蒿湿地 Artemisia salinawetland |
| pH值pH value | 8.25±0.01a | 8.12±0.27a | 8.11±0.06a | 7.97±0.09a | 8.10±0.16a |
| 含水率/% Moisture | 18±1b | 18±1b | 24±2a | 28±2a | 19±8b |
| TN含量/(g·kg-1)TN content | 0.60±0.06a | 0.25±0.03d | 0.45±0.03bc | 0.47±0.01b | 0.33±0.06cd |
| NH4+-N含量/(g·kg-1)NH4+-N content | 0.014 3±0.001 6b | 0.014 1±0.000 3b | 0.028 6±0.003 6a | 0.017 3±0.000 6b | 0.014 4±0.000 6b |
| NO3--N含量/(g·kg-1)NO3--N content | 0.038 2±0.002 6a | 0.009 9±0.001 1c | 0.011 2±0.000 4c | 0.006 7±0.000 2c | 0.019 4±0.004 7b |
| TP含量/(g·kg-1)TP content | 0.650 0±0.017 0ab | 0.621 0±0.011 0b | 0.586 0±0.016 0c | 0.610 0±0.016 0bc | 0.634 0±0.008 0a |
| AP含量/(g·kg-1)AP content | 0.061 8±0.001 0b | 0.036 4±0.002 0c | 0.062 5±0.008 0b | 0.089 7±0.002 0a | 0.043 8±0.020 0c |
| OM含量/% OM content | 1.76±0.18b | 0.90±0.10c | 1.05±0.07c | 2.33±0.25a | 1.21±0.23c |
| TK含量/(g·kg-1)TK content | 12.24±0.67a | 9.17±0.20c | 9.31±0.67c | 12.36±0.57a | 10.73±0.48b |
| TSS含量/(g·kg-1)TSS content | 6.30±0.27c | 19.88±2.93a | 8.19±0.42c | 13.40±0.22b | 7.53±0.26c |
| AK含量/(g·kg-1)AK content | 0.465±0.027b | 0.326±0.047c | 0.199±0.016d | 0.534±0.009a | 0.325±0.023c |
| Ca2+含量/(g·kg-1)Ca2+ content | 0.131±0.001d | 0.321±0.049b | 0.382±0.039a | 0.257±0.020c | 0.145±0.014d |
| Mg2+含量/(g·kg-1)Mg2+ content | 0.092±0.006c | 0.547±0.116a | 0.232±0.025b | 0.237±0.021b | 0.113±0.008c |
| Na+含量/(g·kg-1)Na+content | 1.41±0.09c | 6.89±0.92a | 1.72±0.21c | 4.34±0.42b | 1.94±0.11c |
| SAR/(mmol·L-1)1/2SAR | 5.81±0.30d | 13.67±0.53a | 4.31±0.34e | 11.84±0.70b | 7.40±0.40c |
| 注: TN:全氮Total nitrogen; NH4+-N:铵态氮Ammonium nitrogen; NO3--N:硝态氮Nitrate nitrogen; TP:全磷Total phosphorus; AP:有效磷Available phosphorus; OM:有机质Organic matter; TK:全钾:Total potassium; TSS:可溶性盐总量Total soluble salt; AK:速效钾Available potassium; SAR:钠吸附比Sodium adsorption ratio.下同。The same as follows. | |||||
不同生境土壤过氧化氢酶(CAT)、土壤碱性磷酸酶(AKP)活性差异较大, 土壤多酚氧化酶(PPO)、土壤脲酶(UE)活性的差异不明显(表 3)。PPO活性在碱蓬湿地、互花米草湿地和盐蒿湿地最高, 其次为原始光滩地和芦苇湿地; AKP活性由高到低依次为芦苇湿地、原始光滩地、盐蒿湿地、互花米草湿地、碱蓬湿地。
| 酶的种类 Type of enzymes |
原始光滩地 Primordial beach |
碱蓬湿地 Suaeda salsawetland |
芦苇湿地 Phragmites australiswetland |
互花米草湿地 Spartina alterniflorawetland |
盐蒿湿地 Artemisia salinawetland |
| CAT活性/(μmol·g-1·d-1) CAT activity | 55.10±0.53b | 49.86±0.16c | 42.86±1.06d | 54.92±0.27b | 56.95±0.03a |
| PPO活性/(mg·g-1·d-1) PPO activity | 95.17±11.11b | 136.57±21.24a | 63.25±4.05b | 112.43±17.88a | 100.72±5.34a |
| AKP活性/(μmol·g-1·d-1) AKP activity | 4.64±0.01b | 1.42±0.06e | 5.87±0.28a | 1.93±0.03d | 3.80±0.10c |
| UE活性/(μg·g-1·d-1) UE activity | 59.89±3.62a | 28.80±3.05b | 25.32±3.53b | 27.03±4.08b | 60.02±12.71a |
| 注: CAT:过氧化氢酶Catalase; PPO:多酚氧化酶Polyphenol oxidase; AKP:碱性磷酸酶Alkaline phosphatase; UE:脲酶Urease.下同。The same as follows. | |||||
门和科水平上选择丰度较高的前35种物种的OTU, 并与各项环境因子进行Spearman分析。结果显示:环境因子Na+、SAR和PPO、AKP在门水平上影响的细菌种类最多, 其次为TN、NH4+-N和AP; 在科水平上, 细菌群落组成结构受更多的环境因子影响, 如:TK、OM、Na+、SAR、PPO、AKP, 其次为TN。门水平上的Verrucomicrobia(疣微菌门)、Chlorobi(绿菌门)、TA06、Chlamydiae、WCHB1.60, 科水平上的Nitrosomonadaceae、Gallionellaceae(披毛菌科)、Comamonadaceae(丛毛单胞菌科)、unidentified Acidobacteria、Alcanivoracaceae(食烷菌科)都受到SAR、PPO和AKP共同作用的影响。前文中出现的盐生性细菌, 只有门水平上的Woesearchaeota DHVEG-6, 科水平上的Oceanospirillaceae、Alcanivoracaceae(食烷菌科)、Desulfobacteraceae(脱硫杆菌科)与Na+、SAR相关性显著, 而Euryarchaeota(古生菌门)、Halomonadaceae(盐单胞菌科)、Halobcateriaceae、Desulfobulbaceae(脱硫球菌科)则与TK、OM相关。在门水平上影响细菌种类较大的AP, 在科水平上对细菌群落的影响不显著, 类似的情况还有水分、UE和Ca2+, 而NO3--N、TP则在科水平上表现显著, 在门水平上不显著(图 5-A、B)。
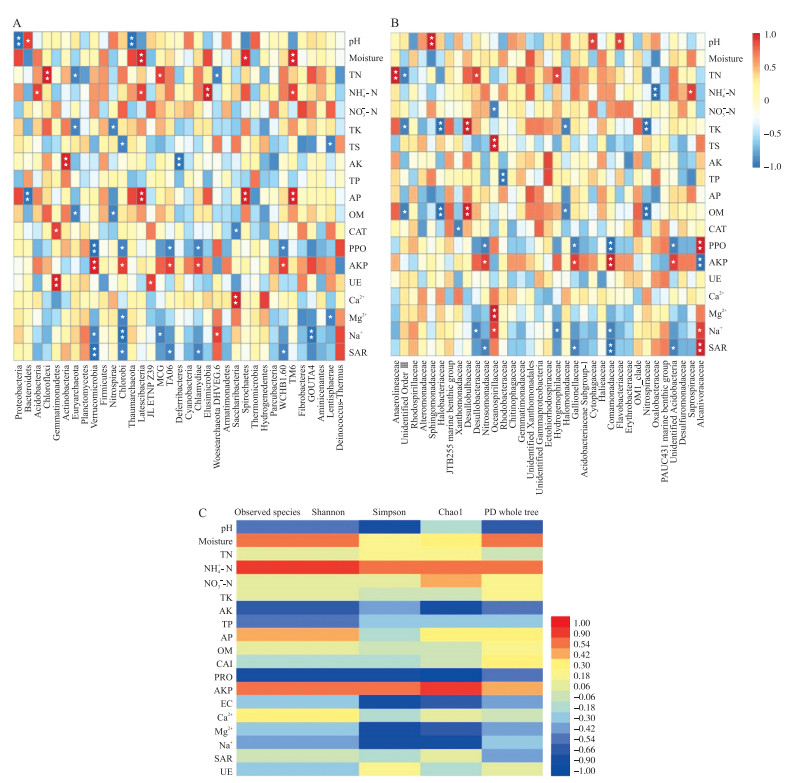
|
图 5 门水平下(A)、科水平下(B)细菌OTU和多样性指数(C)的Spearman相关性分析 Fig. 5 Spearman correlation analysis of the OTU of bacterial phyla(A), families(B)and the diversity metrics of soil bacterial communities(C) |
在土壤环境因子和土壤细菌群落多样性指数的Spearman分析中, Na+、SAR以及其余与盐分相关的环境因子对土壤细菌群落多样性指数无显著影响, 土壤PPO和AKP只影响Chao 1, 且前者与Chao 1呈负相关, 后者与Chao 1呈正相关。物种数目、丰富度和均匀度受NH4+-N影响, 呈正相关(图 5-C)。土壤环境因子与辛普森多样性指数(Simpson)以及系统发育多样性指数(PD whole tree)无显著性相关。
CCA分析结果(图 6)中, 土壤TN、Na+、SAR主要影响芦苇湿地、原始光滩地和碱蓬湿地, PPO和AKP主要影响芦苇湿地、盐蒿湿地和原始光滩地, 且AKP与其呈正相关, PPO与其呈负相关。在门水平上TN显著影响芦苇湿地和原始光滩地, SAR与芦苇湿地呈负相关, Na+、SAR显著影响碱蓬湿地; 科水平上Na+、SAR与原始光滩地呈负相关。

|
图 6 门水平(A、C)和科水平细菌群落(B、D)的CCA分析 Fig. 6 CCA analysis of the bacterial communities at the phylum level(A, C)and the family level(B, D) |
FAPROTAX结果表明, 土壤细菌群落功能的差异集中在对碳源、氮源以及含硫化合物的不同利用方式。研究表明, 相似环境中的微生物群落功能更相似, 而行使相似功能的微生物物种组成则可能有较大差异[20-22]。Louca等[23-24]又进一步证明, 不同生境间微生物群落组成差异较小, 但其微生物群落功能则可能有着较大的差异。同时, 互花米草湿地与原始光滩地的细菌群落功能相似, 但细菌群落组成差异较大; 芦苇湿地与原始光滩地的细菌群落功能差异较大, 但细菌群落差异组成较小。这说明, 互花米草与芦苇虽属禾本科, 但因其不同的周围环境, 在细菌群落组成甚至功能上也会有较大的差异。
我们的研究结果表明驱动碱蓬湿地中影响富营养细菌Bacteroidetes(拟杆菌门)丰度增加的环境因子是pH和有效磷(AP), 且其相对丰度与pH呈正相关, 与AP呈负相关, 这与Bacteroidetes(拟杆菌门)的相对丰度与施氮量呈正相关的研究结果[25]不符。可能的原因是高盐度会抑制微生物对磷素的吸收[26], 从而增加了Bacteroidetes(拟杆菌门)的丰度。碱蓬湿地中还出现了Euryarchaeota(广古菌门), 该类古生菌常常能在极端环境下生存, 例如高盐度[27-28]。然而在研究区域内, Euryarchaeota(广古菌门)不受盐度的影响, 而是与全钾(TK)、有机质(OM)呈负相关。Halomonadaceae(盐单胞菌科)、Halobcateriaceae也有类似结果, 而Desulfobulbaceae(脱硫球菌科)则与TK、OM呈正相关。值得注意的是, 研究区域内盐生性细菌的丰度变化, 一部分受TK与OM的影响, 一部分受Na+与SAR的影响。土壤TK与OM呈正相关[29], 这说明影响盐生性细菌群落组成的因子具有耦合关系, 并非单一因素。
植被通过影响土壤环境, 从而影响土壤微生物群落的结构和多样性, 可增加土壤中的微生物种类, 提高群落多样性[13]。研究区域内, 湿地植被群落差异明显, 同时5种生境下的土壤细菌群落有显著差异, 植被类型对土壤细菌群落多样性指数影响为0.218~0.441, 植被类型影响该地的土壤细菌群落结构和多样性[30]。表层土壤因直接暴露于空气中, 受到各种非生物因子的强烈干扰[31], 同时滩涂湿地生境中土壤微生物群落的多样性更受到盐分的制约[32], 碱蓬根系比其他植被根系浅, 对表层土壤影响更大[30], 从而造成了碱蓬湿地细菌群落多样性指数低于其他生境的结果。
Spearman结果显示, 土壤TN、Na+、SAR、PPO与AKP是影响研究区域内土壤细菌群落组成结构的主要环境因子, 这与已有的研究结果相同[13, 33-34]。且土壤TN、Na+、SAR主要影响芦苇湿地、原始光滩地和碱蓬湿地, PPO、AKP主要影响该区域的芦苇湿地、盐蒿湿地和原始光滩地。
NH4+-N、PPO和AKP对滨海湿地土壤细菌群落多样性有显著影响。有研究结果表明, NH4+-N不仅影响土壤微生物活性[35], 而且能显著提高多种土壤酶活性[36]。土壤PPO与土壤腐化过程有一定的相关性, 在凋落物较多的生态系统中, PPO活性随土壤氮素的增加而降低, 而在凋落物相对不稳定的生态系统中, PPO活性随氮的增加而增加[37]。土壤AKP直接影响土壤有机磷转化为无机磷的过程, 而磷含量的增高, 可以显著提高PPO的活性[38]。我们的研究结果与其不一致, 但Waldrop等[37]又阐述了土壤氮素对PPO活性影响的一种可能:对氮积极响应的微生物在凋落物相对不稳定的生态系统中占主导地位。同时, Kunito等[38]阐明了不一致的原因可能是产生PPO的微生物在土壤环境中的竞争差异。综上所述, 我们推测研究区域内NH4+-N、PPO和AKP是通过耦合关系作用于土壤细菌群落的组成, 并影响其生物多样性。而不同的植被类型[11]、土壤环境因子及滩涂围垦利用方式[3]都会对土壤微生物群落产生影响。
| [1] |
董科, 吕士成, Terry Healy. 江苏盐城国家级珍禽自然保护区丹顶鹤的承载力[J]. 生态学报, 2005, 25(10): 2608-2615. Dong K, Lü S C, Healy T. Carrying capacity of red-crowned cranes in the National Yancheng Rare Birds Nature Reserve, Jiangsu Province, China[J]. Acta Ecologica Sinica, 2005, 25(10): 2608-2615 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2005.10.022 |
| [2] |
蒋炳兴. 江苏省盐城市的海涂资源及其开发利用[J]. 自然资源学报, 1991, 6(3): 244-252. Jiang B X. The seabeach resources of Yancheng City, Jiangsu Province, and their exploitation and utilization[J]. Journal of Natural Resources, 1991, 6(3): 244-252 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-3037.1991.03.007 |
| [3] |
王加连, 刘忠权. 盐城滩涂生物多样性保护及其可持续利用[J]. 生态学杂志, 2005, 24(9): 1090-1094. Wang J L, Liu Z Q. Protection and sustainable utilization for the biodiversity of Yancheng Seashore[J]. Chinese Journal of Ecology, 2005, 24(9): 1090-1094 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4890.2005.09.023 |
| [4] |
张晓祥, 严长清, 徐盼, 等. 近代以来江苏沿海滩涂围垦历史演变研究[J]. 地理学报, 2013, 68(11): 1549-1558. Zhang X X, Yan C Q, Xu P, et al. Historical evolution of tidal flat reclamation in the Jiangsu coastal areas[J]. Acta Geographica Sinica, 2013, 68(11): 1549-1558 (in Chinese with English abstract). DOI:10.11821/dlxb201311010 |
| [5] |
刘青松, 李杨帆, 朱晓东. 江苏盐城自然保护区滨海湿地生态系统的特征与健康设计[J]. 海洋学报, 2003, 25(3): 143-148. Liu Q S, Li Y F, Zhu X D. Characteristics of coastal wetland ecosystems and their healthy design:a case study from Yancheng Natural Reserve, Jiangsu Province, China[J]. Acta Oceanologica Sinica, 2003, 25(3): 143-148 (in Chinese with English abstract). DOI:10.3321/j.issn:0253-4193.2003.03.017 |
| [6] |
Ke C Q, Zhang D, Wang F Q, et al. Analyzing coastal wetland change in the Yancheng National Nature Reserve, China[J]. Regional Environmental Change, 2011, 11(1): 161-173. DOI:10.1007/s10113-010-0130-8 |
| [7] |
张忍顺, 沈永明, 陆丽云, 等. 江苏沿海互花米草(Spartina alterniflora)盐沼的形成过程[J]. 海洋与湖沼, 2005, 36(4): 358-366. Zhang R S, Shen Y M, Lu L Y, et al. Formation of Spartina alterniflora salt marsh on Jiangsu coast, China[J]. Oceanologia et Limnologia Sinica, 2005, 36(4): 358-366 (in Chinese with English abstract). DOI:10.3321/j.issn:0029-814X.2005.04.011 |
| [8] |
徐国万, 卓荣宗.我国引种互花米草的初步研究[C]//米花研究的进展——22年来的研究成果论文集.南京: 南京大学出版社, 1985: 212-225. Xu G W, Zhuo R Z. Preliminary studies of introduced spartina alteriflora Loisel in China[C]//Advances in Spartina alterniflora research: proceeding of research for 22 years. Nanjing: Nanjing University Press, 1985: 212-225(in Chinese). |
| [9] |
Boyle S A, Yarwood R R, Bottomley P J, et al. Bacterial and fungal contributions to soil nitrogen cycling under Douglas fir and red alder at two sites in Oregon[J]. Soil Biology and Biochemistry, 2008, 40(2): 443-451. DOI:10.1016/j.soilbio.2007.09.007 |
| [10] |
Attiwill P M, Adams M A. Nutrient cycling in forests[J]. New Phytol, 1993, 124(4): 561-582. DOI:10.1111/j.1469-8137.1993.tb03847.x |
| [11] |
王淼, 曲来叶, 马克明, 等. 罕山土壤微生物群落组成对植被类型的响应[J]. 生态学报, 2014, 34(22): 6640-6654. Wang M, Qu L Y, Ma K M, et al. Response of soil microbial community composition to vegetation types[J]. Acta Ecologica Sinica, 2014, 34(22): 6640-6654 (in Chinese with English abstract). |
| [12] |
Smith J L, Paul E A. The significance of soil microbial biomass estimations[M]. New York: Routledge, 2017: 357-398.
|
| [13] |
Lin X G, Yin R, Zhang H Y, et al. Changes of soil microbiological properties caused by land use changing from rice-wheat rotation to vegetable cultivation[J]. Environmental Geochemistry and Health, 2004, 26(2): 119-128. DOI:10.1023/B:EGAH.0000039574.99651.65 |
| [14] |
Noval R M, Burton O T, Wise P, et al. A Microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis[J]. Journal of Allergy and Clinical Immunology, 2013, 131(1): 201-212. DOI:10.1016/j.jaci.2012.10.026 |
| [15] |
Stackebrandt E, Fowler V J, Schubert W, et al. Towards a phylogeny of phototrophic purple sulfur bacteria:the genus Ectothiorhodospira[J]. Archives of Microbiology, 1984, 137(4): 366-370. |
| [16] |
Ansede J H, Friedman R, Yoch D C. Phylogenetic analysis of culturable dimethyl sulfide-producing bacteria from a Spartina-dominated salt marsh and estuarine water[J]. Applied and Environmental Microbiology, 2001, 67(3): 1210-1217. DOI:10.1128/AEM.67.3.1210-1217.2001 |
| [17] |
Bowditch R D, Baumann L, Baumann P. Description of Oceanospirillum kriegii sp. nov. and O.jannaschii sp. nov. and assignment of two species of Alteromonas to this genus as O.commune comb. nov. and O.vagum comb. nov[J]. Current Microbiology, 1984, 10(4): 221-229. DOI:10.1007/BF01627259 |
| [18] |
Liu H M, Wang B, Hu X K. Sediment bacterial communities are more complex in coastal shallow straits than in oceanic deep straits[J]. Journal of Oceanology and Limnology, 2018, 36(5): 1643-1654. DOI:10.1007/s00343-018-7133-6 |
| [19] |
Wood S A, Gilbert J A, Leff J W, et al. Consequences of tropical forest conversion to oil palm on soil bacterial community and network structure[J]. Soil Biology and Biochemistry, 2017, 112: 258-268. DOI:10.1016/j.soilbio.2017.05.019 |
| [20] |
Menon R, Jackson C R, Holland M M. The influence of vegetation on microbial enzyme activity and bacterial community structure in freshwater constructed wetland sediments[J]. Wetlands, 2013, 33(2): 365-378. DOI:10.1007/s13157-013-0394-0 |
| [21] |
Yang D W, Zhang M K. Effects of land-use conversion from paddy field to orchard farm on soil microbial genetic diversity and community structure[J]. European Journal of Soil Biology, 2014, 64: 30-39. DOI:10.1016/j.ejsobi.2014.07.003 |
| [22] |
Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75(15): 5111-5120. DOI:10.1128/AEM.00335-09 |
| [23] |
Louca S, Parfrey L W, Doebeli M. Decoupling function and taxonomy in the global ocean microbiome[J]. Science, 2016, 353(6305): 1272-1277. DOI:10.1126/science.aaf4507 |
| [24] |
Louca S, Doebeli M. Taxonomic variability and functional stability in microbial communities infected by phages[J]. Environmental Microbiology, 2017, 19(10): 3863-3878. DOI:10.1111/1462-2920.13743 |
| [25] |
Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017. DOI:10.1038/ismej.2011.159 |
| [26] |
李玲玲, 郑西来, 褚衍洋. 高盐度废水的生物除磷特性研究[J]. 中国给水排水, 2009, 25(17): 73-75. Li L L, Zheng X L, Chu Y Y. Study on biological phosphorus removal from high salinity wastewater[J]. China Water & Wastewater, 2009, 25(17): 73-75 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4602.2009.17.021 |
| [27] |
Pesaro M. Identification of novel Crenarchaeota and Euryarchaeota clusters associated with different depth layers of a forest soil[J]. FEMS Microbiology Ecology, 2002, 42(1): 89-98. |
| [28] |
Poplawski A B, Mårtensson L, Wartiainen I, et al. Archaeal diversity and community structure in a swedish barley field:specificity of the EK510R/(EURY498)16S rDNA primer[J]. Journal of Microbiological Methods, 2007, 69(1): 161-173. DOI:10.1016/j.mimet.2006.12.018 |
| [29] |
王清奎, 汪思龙, 冯宗炜. 杉木人工林土壤可溶性有机质及其与土壤养分的关系[J]. 生态学报, 2005, 25(6): 1299-1305. Wang Q K, Wang S L, Feng Z W. A study on dissolved organic carbon and nitrogen nutrients under Chinese fir plantation:relationships with soil nutrients[J]. Acta Ecologica Sinica, 2005, 25(6): 1299-1305 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2005.06.010 |
| [30] |
左平, 欧志吉, 姜启吴, 等. 江苏盐城原生滨海湿地土壤中的微生物群落功能多样性分析[J]. 南京大学学报(自然科学), 2014, 50(5): 715-722. Zuo P, Ou Z J, Jiang Q W, et al. Function diversity of soil microbial communities in original coastal wetlands, Yancheng, Jiangsu Province[J]. Journal of Nanjing University(Natural Sciences Edition), 2014, 50(5): 715-722 (in Chinese with English abstract). |
| [31] |
Deng Y, He Z L, Xu M Y, et al. Elevated carbon dioxide alters the structure of soil microbial communities[J]. Applied and Environmental Microbiology, 2012, 78(8): 2991-2995. DOI:10.1128/AEM.06924-11 |
| [32] |
张雯雯.滩涂土壤盐分梯度对微生物群落结构影响的研究[D].扬州: 扬州大学, 2009. Zhang W W. Study on the effect of salt gradient on microbial community structure in tidal flat soil[D]. Yangzhou: Yangzhou University, 2009(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11117-2009192617.htm |
| [33] |
Gibbons S M. Microbial community ecology:function over phylogeny[J]. Nature Ecology & Evolution, 2017, 1: 32. |
| [34] |
Faoro H, Alves A C, Souza E M, et al. Influence of soil characteristics on the diversity of bacteria in the southern Brazilian Atlantic forest[J]. Applied and Environmental Microbiology, 2010, 76(14): 4744-4749. DOI:10.1128/AEM.03025-09 |
| [35] |
Wei Y, Wang Z Q, Zhang X Y, et al. Enzyme activities and microbial communities in subtropical forest soil aggregates to ammonium and nitrate-nitrogen additions[J]. Journal of Resources and Ecology, 2017, 8(3): 258-267. DOI:10.5814/j.issn.1674-764x.2017.03.006 |
| [36] |
Yu H Y, Ding W X, Luo J F, et al. Long-term effect of compost and inorganic fertilizer on activities of carbon-cycle enzymes in aggregates of an intensively cultivated sandy loam[J]. Soil Use and Management, 2012, 28(3): 347-360. DOI:10.1111/j.1475-2743.2012.00415.x |
| [37] |
Waldrop M P, Zak D R, Sinsabaugh R L. Microbial community response to nitrogen deposition in northern forest ecosystems[J]. Soil Biology and Biochemistry, 2004, 36(9): 1443-1451. DOI:10.1016/j.soilbio.2004.04.023 |
| [38] |
Kunito T, Akagi Y, Park H D, et al. Influences of nitrogen and phosphorus addition on polyphenol oxidase activity in a forested andisol[J]. European Journal of Forest Research, 2009, 128(4): 361-366. DOI:10.1007/s10342-009-0271-9 |




