文章信息
- 丁冠群, 刘雪霞, 原乔慧, 杨娜, 李楠, 吴寒, 甘立军, 李义
- DING Guanqun, LIU Xuexia, YUAN Qiaohui, YANG Na, LI Nan, WU Han, GAN Lijun, LI Yi
- 烟草中异源表达AtPAP2对细胞分裂素敏感性的影响
- Effect of heterologous expression of Arabidopsis PAP2 in tobacco on the sensitivity to cytokinin
- 南京农业大学学报, 2019, 42(6): 1080-1087
- Journal of Nanjing Agricultural University, 2019, 42(6): 1080-1087.
- http://dx.doi.org/10.7685/jnau.201902001
-
文章历史
- 收稿日期: 2019-02-10
2. 南京农业大学园艺学院, 江苏 南京 210095
2. College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China
黄酮类化合物包括黄酮醇类、黄烷酮类和花青素类, 是广泛存在于植物体内重要的次生代谢产物。它们参与植物的着色, 以及吸引昆虫等传粉, 在植物抵抗生物和非生物胁迫过程中发挥着重要作用[1-2]。
高等植物中, 黄酮类化合物的生物合成途径已较清楚[2-3]。合成的前体化合物苯丙氨酸经过苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、肉桂酸-4-羟化酶(cinnamate-4-hydroxylase, C4H)和4-香豆酰CoA连接酶(4-coumarate-CoA ligase, 4CL)3个关键酶的催化合成4-香豆酰CoA。从苯丙氨酸到4-香豆酰CoA的代谢途径也是许多植物次生代谢产物所共有的[2, 4]。一些早期基因(early biosynthetic genes, EBG)和晚期基因(late biosynthetic genes, LBG)编码的酶也参与下游的黄酮类化合物的合成。EBG编码的酶如查尔酮合成酶(chalcone synthase, CHS)、查尔酮异构酶(chalcone isomerase, CHI)、黄烷酮羟化酶(flavanone-3-hydroxylase, F3H)和类黄酮3′-羟化酶(flavonol 3′-hydroxylase, F3′H), 参与催化二氢黄酮醇等共同前体的产生[2-4]。LBG编码的酶包括二氢黄酮醇还原酶(dihydroflavonol-4-reductase, DFR)、花青素合成酶(anthocyanidin synthase, ANS)和花青素还原酶(anthocyanidin resuctase, ANR), 参与不同黄酮类化合物的合成[2-4]。
另外, 一些调节基因也参与调控黄酮类化合物的合成。R2R3-MYB转录因子基因MYB11、MYB12和MYB111编码的蛋白可激活EBG[4]。而MYB转录因子、碱性螺旋-环-螺旋转录因子(basic helix-loop-helix, bHLH)和WD40蛋白TTG1(transparent testa glabra 1)构成三聚体MBW蛋白复合体, 可以激活LBG基因的表达[4]。转录因子PAP1(production of anthocyanin pigment 1)以及PAP2/MYB90是拟南芥中典型的R2R3 MYB转录因子, 它们正调控黄酮类化合物合成相关基因的表达[5]。在番茄和烟草中过量表达AtPAP1或AtPAP2, 可使整个植株呈紫色[5-7]。
植物激素生长素、细胞分裂素、脱落酸和乙烯也都可以调控黄酮类化合物的合成[4]。生长素可激活黄酮类化合物合成基因CHS、FLS和F3′H以及调控基因MYB12、PAP1和TTG1的表达, 提高植物体内黄酮类化合物的含量[8]。细胞分裂素可调控苜蓿根中黄酮类化合物合成基因FLS和F3′H的转录[9]。在拟南芥中, 乙烯含量的增加也可诱导气孔保卫细胞内黄酮类化合物的产生[10]。
在植物中, 黄酮类化合物还可作为信号分子调控植物激素的生理效应[11]。一些黄酮类化合物, 特别是黄酮醇化合物是调控生长素极性运输的内源抑制剂[1, 12-13]。它们可通过影响PINOID激酶的活性来调控生长素输出载体PIN蛋白的定位[1]。它们还可以影响PIN蛋白基因的表达以及调控ABCB类生长素运输蛋白的活性[11]。黄酮类化合物还可通过调控生长素的代谢来影响生长素的浓度梯度[11]。另外, 黄酮类化合物还通过抑制MAPKs的活性以及清除活性氧来拮抗ABA诱导的气孔关闭[11, 14]。
然而, 黄酮类化合物是否影响其他植物激素的生理效应还未见报道。细胞分裂素和生长素相互作用调控植物的多种生理过程, 因此, 我们利用稳定遗传的35S∷AtPAP2转基因烟草作为试验材料, 探究烟草中异源表达AtPAP2基因是否提高内源黄酮类化合物含量, 研究转基因植物对细胞分裂素的响应, 以明确黄酮类化合物和细胞分裂素之间的相互作用。
1 材料与方法 1.1 植物材料与生长条件植物材料为烟草(Nicotiana tabacum ‘Xanthi’), 转基因烟草材料35S∷AtPAP2由本实验室通过转基因获得[7], 是经过转基因阳性苗自交3代得到的稳定遗传的植株, 目前有2个株系, 分别命名为PAP2-L1和PAP2-L2。用无菌水清洗种子2~3次, 75%(体积分数)乙醇消毒1 min, 无菌水清洗后, 用10%次氯酸钠溶液消毒7 min, 再用无菌水冲洗5~6次后, 播种于MS培养基上。将培养皿垂直放置, 培养7 d。试验条件:光照强度为250 μmol·m-2·s-1, 光/暗时间为16 h/8 h, 昼/夜温度为25 ℃/18 ℃。
1.2 激素处理将生长7 d的烟草幼苗转移到含有6-苄基腺嘌呤(6-BA)(0.2、1.0和2.0 μmol·L-1)、异戊烯基腺嘌呤(isopentenyladenine, iP)(0.2、1.0和5.0 μmol·L-1)和反式玉米素(trans-zeatin)(0.01、0.10和1.00 μmol·L-1)的培养基上, 不同激素先溶于乙醇, 然后加入到培养基中。每个培养皿中分别含有5株野生型和5株转基因植株, 每个处理设3个重复, 将培养皿垂直放置培养。开始激素处理时, 用记号笔标记主根的位置, 15 d后拍照, 用Image J软件(http://rsb.info.nih.gov/ij/)测量主根长。
在研究槲皮素与6-BA相互作用对根伸长生长的影响时, 将生长7 d的野生型烟草幼苗转移到分别含有50 μmol·L-1槲皮素、0.2 μmol·L-1 6-BA以及50 μmol·L-1槲皮素与0.2 μmol·L-1 6-BA的培养基上。10 d后测量主根伸长量。
在研究生长素极性运输抑制剂与6-BA相互作用时, 将生长7 d的野生型烟草幼苗转移到分别含有2, 3, 5-三碘苯甲酸(2, 3, 5-triiodobenzoic acid, TIBA)、萘基邻氨甲酰苯甲酸(1-naphthylphthalamic acid, NPA)、0.2 μmol·L-1 6-BA以及0.2 μmol·L-1 6-BA与TIBA或NPA的培养基上。TIBA和NPA的浓度均分别为0.2、1.0和5.0 μmol·L-1。10 d后测量主根伸长量。
1.3 烟草叶片不定芽的再生将生长2个月的烟草幼苗叶片剪下, 切成0.5 cm×0.5 cm的正方形叶片, 分别放在含有0、0.25、0.50和1.00 μmol·L-1 6-BA的MS培养基上培养。统计愈伤生长情况以及长芽的情况。在研究槲皮素与6-BA相互作用对不定芽再生的影响时, 槲皮素和6-BA的浓度分别为50和0.2 μmol·L-1。
1.4 黄酮醇含量的测定黄酮醇提取方法采用Maloney等[15]的方法, 略有改动。约1 g样品经液氮研磨后, 加入3 mL丙酮及3 mL 2 mol·L-1盐酸, 混合均匀后于75 ℃水浴锅内热激45 min, 再加入等体积的乙酸乙酯, 充分振荡10 min混匀。12 000 r·min-1、4 ℃离心15 min, 小心吸取上层有机相于新的离心管中, 原离心管中剩下的液体再提取1次, 混合2次的有机相。将提取后的液体在真空冷冻干燥机下干燥24 h后, 用1 mL 80%的甲醇溶解, 然后用0.22 μm有机系滤头过滤, 收集滤液。
采用超高效液相色谱UPLC仪(Waters, Milford, MA, USA)分析黄酮醇的含量。分析条件:色谱柱: ACQUITY UPLC BEH C18柱(100 mm× 2.1 mm ID, 1.7 μm; Waters); 流动相A:0.5%乙酸, 流动相B:乙腈; 流速:0.35 mL·min-1; 检测波长:380 nm; 进样量:2 μL; 进样温度:24 ℃; 梯度为5%流动相A 2 min, 5%~95%流动相B 10 min, 95%流动相B 2 min。上样之前用流动相平衡柱子。
1.5 RNA提取和定量PCR分析RNA提取参考RNA提取试剂盒(TaKaRa)进行操作。利用RNA反转录试剂盒对DNase Ⅰ处理后的RNA(1.0 μg)进行反转录。利用SYBR Premix Ex TaqTM及StepOnePlusTM Real-Time PCR进行荧光定量PCR分析。以ACTIN为内标, 相对表达量计算采用2-ΔΔCT法[16]。引物序列见表 1。
| 基因名称 Gene name | 登录号 Accession number | 正向引物序列 Forward premier sequence(5′→3′) | 反向引物序列 Reverse premier sequence(5′→3′) |
| ARR6 | LOC107825200 | GTTCAGCGAGGATCGGTTTAG | GGAGGATGGAGAGGAAGAAGAT |
| ARR9-1 | LOC107795059 | CAGAACAATCACAACCACAACC | GACAGTAGTTAGGCCACTGTATC |
| ARR9-2 | LOC107762160 | GCTGCAGAGTCTCAGTTTCA | ACAAGGCTGAGTTGAGTGATT |
| ARR15 | LOC107765816 | CCTTAAGTGGTGCACAGGAA | AGCCATTCTTCCACTCTCAAC |
| ACTIN | LOC107831145 | AATGGAACTGGAATGGTCAAGGC | TGCCAGATCTTCTCCATGTCATCCCA |
所有试验均重复3次。用GraphPad Prism 5软件处理数据并绘图, 用SPSS 16.0软件进行数据差异显著性分析。
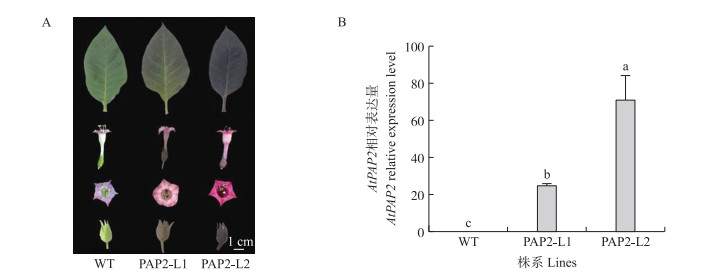
2 结果与分析 2.1 转基因植株的验证转AtPAP2的烟草植株的茎、叶、花瓣、花药以及蒴果的外部颜色都呈现紫色(图 1-A)。经过RT-qPCR验证, AtPAP2在转基因植株的2个株系中均大量表达, 而野生型中几乎没有表达(图 1-B)。
|
图 1 野生型和转基因烟草的表型(A)及AtPAP2基因相对表达量(B) Fig. 1 The phenotype(A)and relative expression of AtPAP2(B)in wild type(WT) and transgenic tobacco lines(PAP2-L1, PAP2-L2) 不同小写字母表示不同处理在0.05水平差异显著。下同。 Different small letters indicate significant differences among treatments(P < 0.05).The same as follows. |
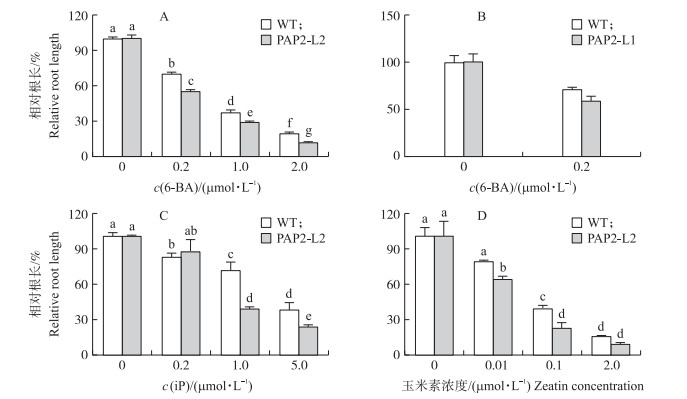
用0.2、1.0和2.0 μmol·L-1 6-BA分别处理野生型和转基因烟草PAP2-L2幼苗20 d后, 主根的伸长均受到显著抑制。6-BA抑制转基因植株根伸长的效果明显高于野生型。0.2 μmol·L-1 6-BA处理后, 野生型烟草主根伸长量为对照的69.93%, 转基因植株的主根伸长量为对照的55.11%(图 2-A)。这表明, 转基因烟草的主根伸长生长对6-BA的响应比野生型烟草更敏感。对转基因烟草株系PAP2-L1的研究也得到相似的结果(图 2-B)。因为AtPAP2基因在转基因株系PAP2-L2的表达量较高, 所以后续试验以PAP2-L2株系为主。
|
图 2 细胞分裂素处理对烟草幼苗主根伸长生长的影响 Fig. 2 Effects of cytokinins on the root length in tobacco seedlings 6-BA:6-苄基腺嘌呤6-benzylaminopurine; iP:异戊烯基腺嘌呤Isopentenyladenine.下同。The same as follows. |
植物体内源细胞分裂素异戊烯基腺嘌呤(iP)和玉米素抑制转基因烟草主根伸长生长的效果均强于野生型植株(图 2-C、D)。
2.3 不同浓度细胞分裂素对转基因烟草幼苗不定芽再生的影响将生长2个月的烟草植株相同状态的叶片切成0.5 cm×0.5 cm的方形叶片, 放在0、0.25、0.50和1.00 μmol·L-1 6-BA的培养基上培养15 d, 生长状态见图 3。培养基中不添加6-BA时, 离体叶片不能形成愈伤组织。随6-BA浓度的增加, 形成愈伤组织叶片的比例明显增加, 当6-BA浓度为1.00 μmol·L-1时, 转基因烟草和野生型中形成愈伤组织叶片的比例均达到最大(表 2)。当6-BA浓度为0.25 μmol·L-1时, PAP2-L2株系中形成愈伤组织叶片的比例明显高于野生型。当6-BA浓度为0.50和1.00 μmol·L-1时, 转基因烟草和野生型之间叶片长芽数目差异明显。0.50 μmol·L-1 6-BA处理下, 转基因烟草的叶片长芽数目是野生型的10.98倍。

|
图 3 不同浓度6-苄基腺嘌呤对烟草叶片不定芽再生的影响 Fig. 3 Effect of different concentations of 6-benzylaminopurine(6-BA) on adventitious bud regeneration in tobacco leaves |
| c(6-BA)/ (μmol·L-1) | 形成愈伤组织叶片比例/% Ratio of explants with callus | 每个叶片平均芽数 No. of buds per explant(with buds) | |||
| WT | PAP2-L2 | WT | AtPAP2-L2 | ||
| 0 | 0 | 0 | 0 | 0 | |
| 0.25 | 59.259±6.929d | 74.074±6.369c | 0 | 0 | |
| 0.50 | 83.330±4.536bc | 87.037±2.619ab | 0.167±0.373d | 1.833±1.343c | |
| 1.00 | 96.296±5.237a | 96.296±2.619a | 3.333±1.247b | 4.167±2.304a | |
| 注:形成愈伤组织叶片比例=长愈伤组织的叶片/叶片数×100%;叶片长芽平均数=芽的总数/长芽叶片数。 Note: Ratio of explants with callus=the number of explants with callus/the total number of leaves×100%; The average number of adventitious buds=the total number of adventitious buds/the total number of leaves with buds. | |||||
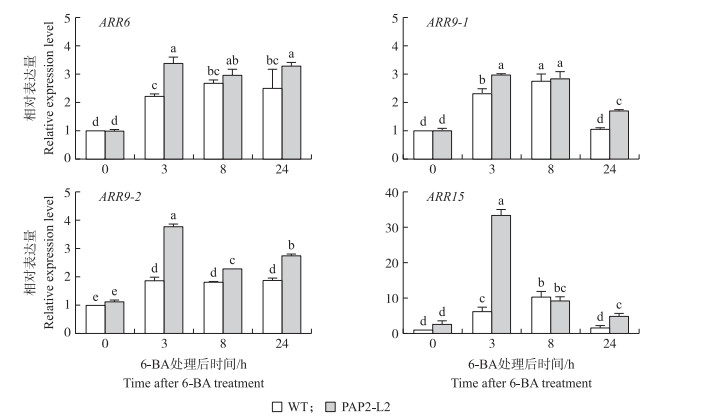
为了比较转基因烟草和野生型之间细胞分裂素响应的能力, 我们分析了细胞分裂素响应基因ARR6、ARR9-1、ARR9-2和ARR15的表达情况(图 4)。0.2 μmol·L-1 6-BA处理3 h即可诱导这些基因的表达。6-BA诱导ARR基因的表达水平在转基因植株中明显高于野生型。6-BA处理3 h时PAP2-L2株系中ARR15 的表达量是野生型中的5.39倍。
|
图 4 6-BA处理后不同时间对ARR基因表达的影响 Fig. 4 Effects of 6-BA treatment on the relative expressions of ARR genes at different time |
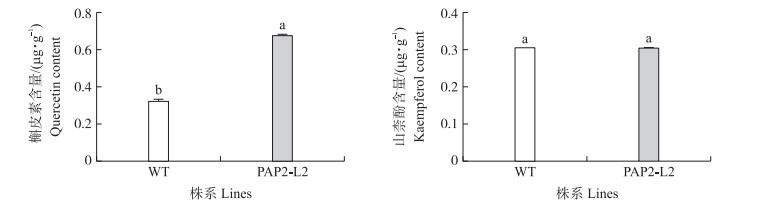
利用UPLC分析槲皮素和山柰酚的含量发现, 转基因烟草中内源槲皮素的含量是野生型的2.33倍, 但两者山柰酚的含量无明显差异(图 5)。
|
图 5 野生型和转基因烟草槲皮素和山柰酚的含量 Fig. 5 Quercetin and kaempferol content in wild type and PAP2-L2 roots |
用50 μmol·L-1槲皮素处理烟草幼苗, 对主根的伸长生长没有影响, 用0.2 μmol·L-1 6-BA和槲皮素共同处理时显著抑制主根的伸长生长, 并且相对根长显著小于6-BA单独处理(图 6-A)。同样, 离体叶片不定芽再生的试验也表明, 槲皮素和6-BA共同处理时诱导不定芽的效果显著高于槲皮素或6-BA单独处理(图 6-B)。
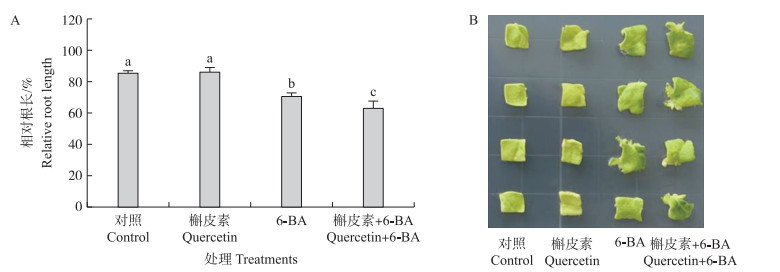
|
图 6 槲皮素和6-BA对烟草幼苗主根伸长(A)和不定芽再生(B)的影响 Fig. 6 Effect of quercetin and 6-BA on the primary root elongation(A) and adventitious bud regeneration(B)in tobacco seedlings |
为了验证槲皮素和6-BA之间的相互作用与改变生长素的极性运输的关系, 进一步研究生长素极性运输抑制剂2, 3, 5-三碘苯甲酸(TIBA)及萘基邻氨甲酰苯甲酸(NPA)与6-BA之间的相互作用。低浓度TIBA和NPA(0.2 μmol·L-1)没有改变6-BA对主根伸长的抑制, 但当TIBA和NPA的浓度为1.0或5.0 μmol·L-1时, 显著增强了6-BA对主根伸长的抑制作用(图 7)。
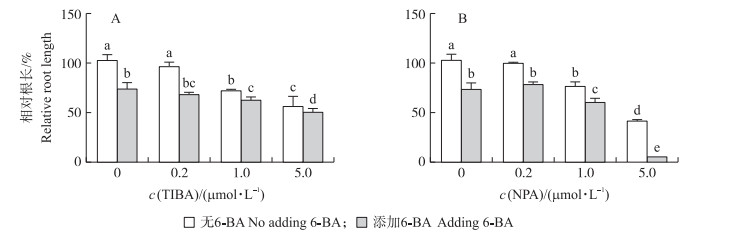
|
图 7 TIBA(A)和NPA(B)对6-BA抑制的主根伸长的影响 Fig. 7 Effect of TIBA(A)and NPA(B)on the inhibition of 6-BA on primary root elongation |
研究表明, 改变黄酮类化合物的合成基因或者调控基因的表达, 可以影响黄酮类化合物的含量[5, 7]。植物激素也可以调控黄酮类化合物的合成。黄酮类化合物除了可以作为抗氧化剂, 提高植物的抗性, 也可以作为信号分子影响植物的生长和发育[11]。一些黄酮类化合物是植物体内天然生长素极性运输的抑制剂, 但黄酮类化合物是否会影响其激素的生理效应的研究相对较少。本文中, 我们以细胞分裂素典型的生理效应(抑制主根的伸长生长[17]和诱导离体叶片不定芽的再生[17-18])为试验模式系统, 发现在转基因烟草中, 细胞分裂素6-BA抑制根生长的效果要明显强于野生型。另外, 植物体内天然存在的细胞分裂素iP和玉米素对转基因烟草抑制主根伸长生长的效果也明显强于野生型。在诱导离体叶片不定芽再生的试验中, 6-BA诱导转基因烟草不定芽再生的效应也明显高于野生型。这些结果均表明, 在烟草中过表达AtPAP2增强了转基因植株对细胞分裂素的响应。6-BA处理后不同时间ARR基因表达的分析, 也表明转基因植株中细胞分裂素的诱导效应强于野生型, 进一步支持转基因植株对细胞分裂素的敏感性强于野生型。
已有研究表明槲皮素和山柰酚是植物中主要的影响生长素极性运输的黄酮类化合物[12-13, 15]。我们分析了AtPAP2转基因植株中这2种化合物的含量, 发现其山柰酚含量与野生型没有明显区别, 但转基因植株中槲皮素含量明显高于野生型。用外源槲皮素和6-BA共同处理烟草幼苗发现, 槲皮素可以增强6-BA对主根伸长生长的抑制作用以及对离体叶片不定芽再生的诱导效应, 这表明外源添加槲皮素可以增强烟草幼苗对细胞分裂素的响应, 与Saranya等[19]的研究结果类似。这些结果表明, 转基因植物中槲皮素含量的升高增强了转基因植物对细胞分裂素的响应。
为了研究生长素极性运输的其他抑制剂是否具有和槲皮素类似的效果, 我们研究了TIBA和NPA对6-BA生理效应的影响, 同槲皮素一样, TIBA和NPA也可以增强6-BA对主根伸长生长的抑制效应, 与Hu等[20]的研究结果类似。这些结果表明改变生长素在植物体内的分布可以影响植物对细胞分裂素的敏感性。
生长素和细胞分裂素在很多方面存在相互作用。许多研究表明细胞分裂素可以通过调控生长素输出载体的表达和活性来调控生长素的极性运输[21-22]。细胞分裂素处理通过提高PIN3、PIN4和PIN7蛋白的积累来调控分枝[23]。细胞分裂素通过下调编码生长素输入载体LAX2和AUX1基因的表达来调控生长素从根部向地上部的运输[24]。另外, 细胞分裂素水平的上升可诱导生长素合成相关基因的转录来促进生长素合成[25]。相反, 生长素可通过激活细胞分裂素信号转导的负调控因子A型ARR基因来调控细胞分裂素的信号转导[26]。本文中, 无论是通过过表达AtPAP2基因提高槲皮素的含量或者是外源施用生长素极性运输的抑制剂, 如槲皮素、TIBA和NPA都可以改变生长素在植物体内的分布, 进而影响植物对细胞分裂素的信号转导, 来提高植物对细胞分裂素的敏感性, 具体机制有待进一步研究。
| [1] |
Buer C S, Imin N, Djordjevic M A. Flavonoids:new roles for old molecules[J]. Journal of Integrative Plant Biology, 2010, 52(1): 98-111. |
| [2] |
Saito K, Yonekura-Sakakibara K, Nakabayashi R, et al. The flavonoid biosynthetic pathway in Arabidopsis:structural and genetic diversity[J]. Plant Physiology and Biochemistry, 2013, 72: 21-34. DOI:10.1016/j.plaphy.2013.02.001 |
| [3] |
Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress[J]. Current Opinion in Plant Biology, 2002, 5(3): 218-223. DOI:10.1016/S1369-5266(02)00256-X |
| [4] |
Xu W, Dubos C, Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J]. Trends in Plant Science, 2015, 20(3): 176-185. DOI:10.1016/j.tplants.2014.12.001 |
| [5] |
Borevitz J O, Xia Y, Blount J, et al. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J]. The Plant Cell, 2000, 12(12): 2383-2394. DOI:10.1105/tpc.12.12.2383 |
| [6] |
Zuluaga D, Gonzali S, Loreti E, et al. Arabidopsis thaliana MYB75/PAP1 transcription factor induces anthocyanin production in transgenic tomato plants[J]. Functional Plant Biology, 2008, 35(7): 606-618. DOI:10.1071/FP08021 |
| [7] |
Li N, Wu H, Ding Q, et al. The heterologous expression of Arabidopsis PAP2 induces anthocyanin accumulation and inhibits plant growth in tomato[J]. Functional and Integrative Genomics, 2018, 18(3): 341-353. DOI:10.1007/s10142-018-0590-3 |
| [8] |
Lewis D R, Ramirez M V, Miller N D, et al. Auxin and ethylene induce flavonol accumulation through distinct transcriptional networks[J]. Plant Physiology, 2011, 156(1): 144-164. |
| [9] |
Ng J L, Hassan S, Truong T T, et al. Flavonoids and auxin transport inhibitors rescue symbiotic nodulation in the Medicago truncatula cytokinin perception mutant cre1[J]. The Plant Cell, 2015, 27(8): 2210-2226. DOI:10.1105/tpc.15.00231 |
| [10] |
Watkins J M, Hechler P J, Muday G K. Ethylene-induced flavonol accumulation in guard cells suppresses reactive oxygen species and moderates stomatal aperture[J]. Plant Physiology, 2014, 164(4): 1707-1717. DOI:10.1104/pp.113.233528 |
| [11] |
Brunetti C, Fini A, Sebastiani F, et al. Modulation of phytohormone signaling:a primary function of flavonoids in plant-environment interactions[J]. Frontiers in Plant Science, 2018, 9: 1042. DOI:10.3389/fpls.2018.01042 |
| [12] |
Jacobs M, Rubery P H. Naturally occurring auxin transport regulators[J]. Science, 1988, 241(4863): 346-349. DOI:10.1126/science.241.4863.346 |
| [13] |
Peer W A, Murphy A S. Flavonoids and auxin transport:modulators or regulators?[J]. Trends in Plant Science, 2007, 12(12): 556-563. DOI:10.1016/j.tplants.2007.10.003 |
| [14] |
Watkins J M, Chapman J M, Muday G K. Abscisic acid-induced reactive oxygen species are modulated by flavonols to control stomata aperture[J]. Plant Physiology, 2017, 175(4): 1807-1825. DOI:10.1104/pp.17.01010 |
| [15] |
Maloney G S, DiNapoli K T, Muday G K. The anthocyanin reduced tomato mutant demonstrates the role of flavonols in tomato lateral root and root hair development[J]. Plant Physiology, 2014, 166(2): 614-631. |
| [16] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
Werner T, Schmülling T. Cytokinin action in plant development[J]. Current Opinion in Plant Biology, 2009, 12(5): 527-538. DOI:10.1016/j.pbi.2009.07.002 |
| [18] |
Duclercq J, Sangwan-Norreel B, Catterou M, et al. De novo shoot organogenesis:from art to science[J]. Trends in Plant Science, 2011, 16(11): 597-606. DOI:10.1016/j.tplants.2011.08.004 |
| [19] |
Saranya K S R, Siril E A. Enhanced in vitro shoot regeneration in Oldenlandia umbellata L. by using quercetin:a naturally occurring auxin-transport Inhibitor[J]. Proceedings of the National Academy of Sciences India Section B:Biological Sciences, 2017, 87(3): 899-904. DOI:10.1007/s40011-015-0672-0 |
| [20] |
Hu W, Fagundez S, Katin-Grazzini L, et al. Endogenous auxin and its manipulation influence in vitro shoot organogenesis of citrus epicotyl explants[J]. Horticulture Research, 2017, 4: 17071. DOI:10.1038/hortres.2017.71 |
| [21] |
Ruzicka K, Simásková M, Duclercq J, et al. Cytokinin regulates root meristem activity via modulation of the polar auxin transport[J]. Proc Natl Acad Sci USA, 2009, 106(11): 4284-4289. DOI:10.1073/pnas.0900060106 |
| [22] |
Marhavy P, Bielach A, Abas L, et al. Cytokinin modulates endocytic trafficking of PIN1 auxin efflux carrier to control plant organogenesis[J]. Developmental Cell, 2011, 21(4): 796-804. DOI:10.1016/j.devcel.2011.08.014 |
| [23] |
Waldie T, Leyser O. Cytokinin targets auxin transport to promote shoot branching[J]. Plant Physiology, 2018, 177(2): 803-818. DOI:10.1104/pp.17.01691 |
| [24] |
Street I H, Mathews D E, Yamburkenko M V, et al. Cytokinin acts through the auxin influx carrier AUX1 to regulate cell elongation in the root[J]. Development, 2016, 143(21): 3982-3993. DOI:10.1242/dev.132035 |
| [25] |
Jones B, Gunnerås S A, Petersson S V, et al. Cytokinin regulation of auxin synthesis in Arabidopsis involves a homeostatic feedback loop regulated via auxin and cytokinin signal transduction[J]. The Plant Cell, 2010, 22(9): 2956-2969. DOI:10.1105/tpc.110.074856 |
| [26] |
Schaller G E, Bishopp A, Kieber J J. The yin-yang of hormones:cytokinin and auxin interactions in plant development[J]. The Plant Cell, 2015, 27(1): 44-63. DOI:10.1105/tpc.114.133595 |




