文章信息
- 黄磊, 彭英传, 韩召军
- HUANG Lei, PENG Yingchuan, HAN Zhaojun
- 大螟乙酰胆碱酯酶基因的克隆及其多态性分析
- Cloning and polymorphism analysis of acetylcholinesterase genes from Sesamia inferens
- 南京农业大学学报, 2019, 42(6): 1050-1058
- Journal of Nanjing Agricultural University, 2019, 42(6): 1050-1058.
- http://dx.doi.org/10.7685/jnau.201903046
-
文章历史
- 收稿日期: 2019-03-21
2. 江西农业大学昆虫研究所, 江西 南昌 330045
2. Institute of Entomology, Jiangxi Agricultural University, Nanchang 330045, China
乙酰胆碱酯酶(acetylcholinesterase, AChE)是丝氨酸水解酶, 它通过迅速水解神经递质乙酰胆碱(ACh)而终止胆碱能突触传递, 维持神经正常功能。有研究发现在神经系统以外的其他部位也存在AChE, 这些酶分子作为调控因子诱导轴突生长和突触形成, 参与细胞迁移、黏附和凋亡等过程[1], 但这一功能在昆虫中目前还鲜见报道。害虫体内的AChE也是有机磷和氨基甲酸酯类杀虫剂的作用靶标[2], AChE结构基因的点突变会导致AChE发生变构, 使其对杀虫剂的敏感性降低进而使害虫产生抗药性[3-6]。因此, AChE是生物学研究的重要生物功能大分子。
AChE是一种多分子型糖蛋白, 表面有2个主要的活性中心, 分别是阴离子结合部位和催化部位[7]。在昆虫体内AChE的主要存在形式会因昆虫种类的不同而有所不同, 在黑腹果蝇(Drosophila melanogaster)体内AChE主要以有糖酯锚的疏水型二聚体存在[8], 在豆荚草盲蝽(Lygus hesperus)和马铃薯甲虫(Leplirnotarsa decemlineata)体内, AChE则存在2种分子形式, 但主要以亲水型二聚体存在[9-10]。不同动物体内AChE的编码基因(ace)数量不等。在昆虫中, 双翅目蝇类仅具有1个编码基因ace2, 而大多数昆虫具有2个编码基因ace1和ace2, 而且与蝇类不同的是, ace1编码的酶是大多数昆虫体内杀虫剂的主要靶标, 目前已经在二化螟、小菜蛾等多种昆虫中发现了由于ace1的突变导致害虫产生抗药性, 因此ace1也是抗药性研究的重点基因[11-12]。另有研究表明某些害虫虽然存在不敏感的AChE, 但是并未发现AChE氨基酸序列发生突变[12], 所以AChE氨基酸序列突变和害虫产生抗药性之间的完整机制尚不清楚。
大螟是水稻的主要害虫之一, 其寄主范围广, 通常在稻田周边零星发生, 对水稻的危害总体不及二化螟和三化螟, 因此相关研究较少。张海艳等[13]曾报道过大螟对杀虫单和三唑磷产生明显抗药性。近年来部分地区大螟发生呈加重的趋势[14-15], 尤其是三化螟和二化螟危害变轻的地区。然而, 很多新型杀虫剂一般依据二化螟或三化螟研发, 防治大螟的效果不尽人意[16-18]; 相比较而言, 某些有机磷杀虫剂对大螟的防效较好, 且价格低廉, 如今仍是防治大螟的重要药剂[19]。由于田间测报、采集、饲养相对较难, 生物测定难以获得大量一致的试虫, 目前很少有人利用大螟进行药剂毒力生物测定筛选, 对大螟的抗药性了解甚少, 也未曾有克隆其杀虫剂靶标基因的报道。因此, 本研究试图克隆大螟的ace基因并进行序列分析, 寻找与有机磷类药剂抗性相关的突变, 从而建立可以利用田间采集的各种虫态和龄期进行抗药性监测的简便分子检测技术, 并为建立酶活抑制的高效杀虫剂分子筛选技术奠定基础。
1 材料与方法 1.1 供试虫源大螟种群于2018年8—10月分别采自江苏南京、广西南宁和广东江门的水稻田, 安徽合肥种群采于2019年3月。在养虫室内用茭白饲养, 并设置温度为(26±1)℃, 湿度为55%~65%, 光/暗培养时间为16 h/8 h。
1.2 大螟总RNA的提取、cDNA合成以及引物设计按照Trizol试剂盒(Invitrogen公司)说明书提取江苏南京种群大螟4龄幼虫总RNA, 利用Nanodrop 2000分光光度计(Thermo Electron公司)测定RNA浓度, 并利用Prime ScriptTM RT reagent Kit with gDNA Eraser(TaKaRa公司)将提取的总RNA反转录合成cDNA, 保存于-20 ℃待用。
通过搜索比对近缘种的AChE氨基酸序列, 根据保守序列设计简并引物, 随后再依据获得的目标片段设计RACE引物, 依据RACE结果设计全长验证引物。所有引物均利用Primer 5.0软件(Primer公司)设计, 具体序列见表 1, 引物合成均由南京金斯瑞公司完成。
| 引物名称 Primer names | 引物序列 Primer sequences(5′→3′) | 引物用途 Usage |
| S1 | F:ATGATGTGGAAYCCNAAYAC/R:TTDATYTCRTCNGCRTGCAT | ace1的片段克隆 Fragment cloning of ace1 |
| S2 | F:TGGGCNAAYCAYCAYGAYAC/R:CCRTGCATNACNCCCATCCA | ace2的片段克隆 Fragment cloning of ace2 |
| S3 | R:AACCCACCACCAAAGACCCAGAGC | ace1 5′ RACE |
| S4 | F:GTAAACGATGCTGGACGCCAGGCTA | ace1 3′ RACE |
| S5 | R:GTACTCCATGCCATGGGTCGATGGG | ace2 5′ RACE |
| S6 | F:CGGACTGGGAGGAAATTACCGATGG | ace2 3′ RACE |
| S7 | F:TGACGAATAGGATGTGAAGTGG/R:TGGACATCCAATATCCTTTGC | ace1全长验证 Full length verification of ace1 |
| S8 | F:ACTTCCGATTGTTCTCCGATA/R:TGGTTCAAGTGAGCTGCTGTA | ace2全长验证 Full length verification of ace2 |
通过搜索NCBI数据库并下载得到已经报道的鳞翅目昆虫AChE1和AChE2的氨基酸序列, 根据其保守序列设计简并引物S1和S2, 分别用来扩增大螟ace1和ace2的序列片段。所用PCR反应体系包括:1 μL cDNA模板, 12.5 μL 2×Taq酶, 正、反向引物(10 μmol·L-1)各1 μL, 9.5 μL ddH2O。PCR反应程序:95 ℃ 3 min; 95 ℃ 15 s, 54 ℃ 30 s, 72 ℃ 2 min, 30个循环; 72 ℃ 10 min。PCR产物用12 g·L-1琼脂糖凝胶电泳鉴定后, 进行回收、纯化、连接和转化, 挑取阳性克隆送至南京金斯瑞公司测序。
根据已经扩增得到的ace1和ace2的序列片段, 设计RACE扩增的特异性引物S3、S4、S5和S6, 分别用来扩增ace1和ace2的5′端和3′端。相应PCR体系中的另一条引物为RACE试剂盒中所提供的引物UPM和NUP。具体序列详见说明书。按照SMARTer RACE 5′/3′ Kit(Clontech公司)说明书, 利用SMART Scribe酶进行反转录获得5′-RACE cDNA模板和3′-RACE cDNA模板。然后利用巢式PCR程序进行扩增。PCR反应体系包括:9.5 μL ddH2O, 12.5 μL 2× Phanta Max Master Mix, 1 μL Specific Primer 1, 1 μL UPM/NUP, 1 μL RACE cDNA模板。巢式PCR第1轮扩增反应程序:98 ℃ 5 min; 98 ℃ 15 s, 72 ℃ 2 min, 10个循环; 98 ℃ 15 s, 70 ℃ 1 min, 72 ℃ 2 min, 10个循环; 98 ℃ 15 s, 68 ℃ 1 min, 72 ℃ 2 min, 28个循环; 72 ℃ 10 min, 4 ℃保存。PCR第2轮扩增条件同第1轮, cDNA模板为第1轮扩增产物的10倍稀释。PCR产物用12 g·L-1琼脂糖凝胶电泳鉴定后, 进行回收、纯化、连接和转化, 挑取阳性克隆交由南京金斯瑞公司测序。将ace1和ace2的片段与5′和3′端RACE序列拼接后分别得到ace1和ace2的完整序列, 最后利用end to end PCR进行全长验证。
1.4 基因生物信息分析序列的分析及比对使用Gene Doc和基因探索者等软件。基因序列的查找和同源性分析使用NCBI网站的在线分析程序BLAST。用signalP 4.1 Server在线分析软件预测信号肽。理论等电点(pI)和蛋白质相对分子质量(Mr)的预测使用ExPASy工具推导获得。
1.5 系统发育树的构建在NCBI中搜索并下载已经报道的昆虫AChE的氨基酸序列, 并用Clustal X 1.8软件进行多重序列比对分析。根据比对结果用Mega 5.0软件, 采用邻接法构建乙酰胆碱酯酶的分子系统进化树。
1.6 ace1多态性分析利用高保真酶以及end to end引物, 分别克隆采自安徽合肥、江苏南京、广西南宁和广东江门的水稻田大螟ace1基因编码区序列。PCR反应体系:9.5 μL ddH2O, 12.5 μL 2× Phanta Max Master Mix, 1 μL S7引物, 1 μL cDNA模板。PCR反应程序:98 ℃ 3 min; 98 ℃ 15 s, 54 ℃ 30 s, 72 ℃ 2 min, 30个循环; 72 ℃ 10 min。PCR产物用12 g·L-1琼脂糖凝胶电泳鉴定后, 将有条带的PCR原液送至南京金斯瑞公司测序。用Gene Doc和基因探索者以及Mega 5.0等软件分析不同地理种群大螟AChE1的核苷酸和氨基酸多态性位点。
1.7 生物测定分别采集江苏南京、广西南宁、广东江门和安徽合肥的老熟幼虫, 在养虫室内按地区分别建立地区品系, 待其化蛹、羽化、交配繁殖后, 选择第1代的初孵幼虫为试虫, 采用初孵幼虫人工饲料药膜法[14]进行药剂毒力测定。供试药剂为85%三唑磷原药(湖北仙隆化工股份有限公司)。三唑磷处理48 h后检查试虫死亡情况, 以触动幼虫后不能协调运动为死亡标准。毒力测定试验的对照死亡率控制在10%以下。
1.8 数据统计和分析生物测定所得数据用SPSS 18.0软件和Excel 2010软件根据死亡概率值法计算毒力回归方程、相关系数(r)、LC50值、95%置信区间以及相对毒力倍数。
2 结果与分析 2.1 大螟2个ace基因的克隆及序列分析通过设计简并引物扩增获得了大螟2个ace基因核心保守片段, BLAST比对确定其属于ace基因家族。进一步通过RACE技术扩增测序, 并进行end to end验证, 最终得到大螟2个ace基因的全长序列, 分别被命名为Sinace1和Sinace2。它们的基因编码区全长分别为2 085和1 917 bp, 分别编码694和638个氨基酸, 对应蛋白质的相对分子质量分别是77.94×103和71.70×103, 理论等电点分别是6.14和5.36。通过对大螟、二化螟(Chilo suppressalis)、三化螟(Scirpophaga incertulas)和稻纵卷叶螟(Cnaphalocrocis medinalis)的乙酰胆碱酯酶氨基酸序列进行多重序列比对, 发现Sinace1和Sinace2基因编码的蛋白质序列均含有乙酰胆碱酯酶家族的保守结构特征:1)由Ser、Glu和Hiss氨基酸残基组成的催化三联体结构; 2)由Gly、Gly和Ala氨基酸残基组成的氧负离子孔; 3)由Trp、Phe和Phe氨基酸残基组成的酰基口袋; 4)由Trp氨基酸残基形成的胆碱结合位点; 5)“FGESAG”保守结合域; 6)由3个Cys-Cys组成的分子内部二硫键; 7)外周阴离子部位以及峡谷内壁的14个芳香族氨基酸残基。其中, Sinace1和稻纵卷叶螟的ace1的相似度最高, 达到92%;Sinace2和二化螟的ace2的相似度最高, 达到96%(图 1)。

|
图 1 大螟、二化螟、三化螟和稻纵卷叶螟的AChE1(A)和AChE2(B)氨基酸序列比对 Fig. 1 Multiple sequence alignment of the amino acid sequences of AChE1(A)and AChE2(B)from Sesamia inferens (Sinf), Chilo suppressalis(Csup), Scirpophaga incertulas(Sinc)and Cnaphalocrocis medinalis(Cmed) 黑框里标注的氨基酸是信号肽; 黑色实心五角星标注氨基酸组成催化三联体结构; 黑色实心圆标注氨基酸组成氧负离子孔结构; 黑色实心三角形标注氨基酸组成酰基口袋结构; 黑色实心正方形标注氨基酸组成外周阴离子部位; 空心菱形标注氨基酸组成胆碱结合位点; 黑线标注氨基酸为保守的“FGESAG”结构; 黑色实心菱形标注氨基酸是AChE1的芳香族氨基酸; 空心方框标注的氨基酸为峡谷内壁的14个芳香族氨基酸残基; 空心圆标注的氨基酸为半胱氨酸形成的分子内二硫键(1、2和3)。 Signal peptides of two SiAChE are in black box; the catalytic triads are shown in black solid pentagram; the oxianion hole is shown in black solid circle; acyl pockets are identified by black solid triangles; peripheral anionic subsites are identified by black solid rectangles; the choline-binding sites are shown in hollow diamond; the characteristic"FGESAG"motif is indicated in black line, and the positional conserved cysteine residues in AChE1 are identified in black solid diamond; fourteen aromatic residues lining in the gorge are in hollow box, and cysteine residues forming intramolecular disulfide bonds are in hollow circle with the numbers 1, 2, and 3. |
将大螟的2个AChE氨基酸序列和其他昆虫(鳞翅目、鞘翅目、膜翅目、双翅目、直翅目、蜚蠊目、膜翅目和半翅目)的AChE氨基酸序列一起构建系统进化树。从图 2可以看出:昆虫的AChE被分为AChE1和AChE2这2大亚家族, 大螟的2个AChE被分别聚类到了各自对应的一支中。2个亚家族中, 不同目的AChE序列分别聚在一起, 其中大螟的AChE1和AChE2均与夜蛾科的棉铃虫和烟青虫聚类到了同一分支, 说明它们的亲缘关系最近(图 2)。
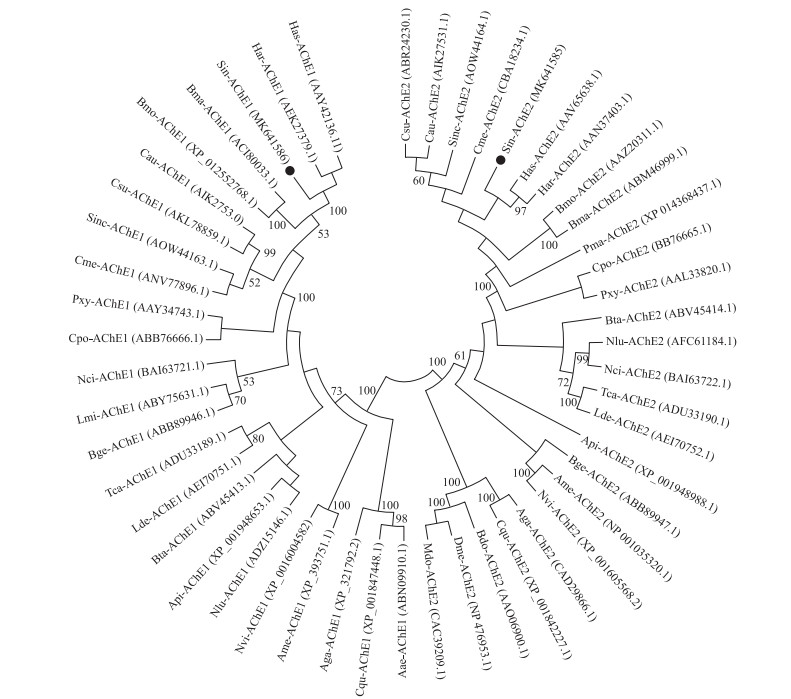
|
图 2 基于大螟和其他昆虫AChE1和AChE2氨基酸序列构建的系统进化树 Fig. 2 Phylogenetic tree constructed based on amino acid sequence of AChE1 and AChE2 from S.inferens and other insects Sin:大螟Sesamia inferens; Har:棉铃虫Helicoverpa armigera; Has:烟青虫Helicoverpa assulta; Cme:稻纵卷叶螟Cnaphalocrocis medinalis; Csu:二化螟Chilo suppressalis; Cau:台湾稻螟Chilo auricilius; Cpo:苹果蠹蛾Cydia pomonella; Bmo:家蚕Bombyx mori; Bma:野家蚕Bombyx mandarina; Pxy:小菜蛾Plutella xylostella; Sinc:三化螟Scirpophaga incertulas; Lde:马铃薯甲虫Rotarsa decemlineata; Tca:赤拟谷盗Tribolium castaneum; Ame:意大利蜜蜂Apis mellifera; Nvi:金小蜂Nasonia vitripennis; Aae:埃及伊蚊Aedes aegypti; Aga:冈比亚按蚊Anopheles gambiae; Cqu:致倦库蚊Culex quinquefasciatus; Nlu:褐飞虱Nilaparvata lugens; Nci:黑尾叶蝉Nephotettix cincticeps; Api:豌豆长管蚜Acyrthosiphon pisum; Bta:烟粉虱Bemisia tabaci; Bge:德国小蠊Blattella germanica; Lmi:东亚飞蝗Locusta migratoria manilensis; Pma:金凤蝶Papilio machaon; Dme:黑腹果蝇Drosophila melanogaster; Mdo:家蝇Musca domestica; Bdo:桔小实蝇Bactrocera dorsalis. |
采用单头克隆技术(每头1条), 从4个地理种群中成功克隆到97条大螟ace1基因(每个种群22~25条), 通过序列多重对比, 共发现了107种核苷酸多态性位点(表 2), 其中核苷酸多态性最高的是广东江门种群, 具有41种核苷酸多态性位点; 其次是广西南宁和安徽合肥种群, 各具有27和20种核苷酸多态性位点; 核苷酸多态性位点最少的是江苏南京种群, 具有19种核苷酸多态性位点。综合分析4个种群的核苷酸多态性位点, 比率最高的有G358A、A369G、C366T、G489A、T372C、G759A、C1029T、G1542A和G1761C, 但这些多态性位点均未改变氨基酸序列, 为同义突变。核苷酸的突变包括转换(嘌呤与嘌呤, 嘧啶与嘧啶之间的替代)和颠换(嘌呤与嘧啶之间的替代), 对4个不同地理种群ace1的核苷酸突变位点进行分析, 结果表明, 发生颠换的概率是26.9%, 发生转换的概率是73.1%, 其中C和T之间的转换概率最大, 为48.1%(表 2)。
| 种群 Populations | 位点 Sites | 比率 Ratio |
| 江苏南京 | T93C | 6/25 |
| Nanjing, | C165T | 8/25 |
| Jiangsu | A358G | 3/25 |
| T366C | 4/25 | |
| C399T | 10/25 | |
| T411C | 6/25 | |
| C444T | 5/25 | |
| A510G | 2/25 | |
| C732T | 4/25 | |
| C747A | 2/25 | |
| A759G | 2/25 | |
| T792C | 6/25 | |
| C1029T | 5/25 | |
| T1308C | 3/25 | |
| C1358A | 5/25 | |
| G1337T | 2/25 | |
| C1382G | 5/25 | |
| C1761G | 4/25 | |
| C1890T | 4/25 | |
| 安徽合肥 | T93C | 3/25 |
| Hefei, | C165T | 10/25 |
| Anhui | G369A | 2/25 |
| T399C | 10/25 | |
| C411T | 9/25 | |
| T729C | 10/25 | |
| T732C | 9/25 | |
| A747C | 10/25 | |
| A759G | 10/25 | |
| 安徽合肥 | C792T | 10/25 |
| Hefei, | A795C | 4/25 |
| Anhui | C900T | 4/25 |
| C1029T | 10/25 | |
| G1153A | 3/25 | |
| T1308C | 7/25 | |
| C1386G | 9/25 | |
| A1542G | 3/25 | |
| C1761G | 9/25 | |
| C1890T | 7/25 | |
| C2016T | 3/25 | |
| 广东江门 | G39A | 3/25 |
| Jiangmen, | T93C | 2/25 |
| Guangdong | C97T | 2/25 |
| C163T | 2/25 | |
| G358A | 4/25 | |
| C366T | 3/25 | |
| A369G | 3/25 | |
| C3779A | 12/25 | |
| T399C | 4/25 | |
| C411T | 5/25 | |
| A489G | 5/25 | |
| C609T | 8/25 | |
| G657A | 7/25 | |
| C660T | 7/25 | |
| T672C | 7/25 | |
| T696A | 4/25 | |
| G717C | 6/25 | |
| 广东江门 | T729C | 3/25 |
| Jiangmen, | C732T | 11/25 |
| Guangdong | G759A | 3/25 |
| C792T | 4/25 | |
| T900C | 8/25 | |
| T1029C | 8/25 | |
| T1227C | 3/25 | |
| A1240T | 3/25 | |
| T1308C | 2/25 | |
| C1386G | 12/25 | |
| T1394A | 9/25 | |
| G1512A | 3/25 | |
| G1542A | 7/25 | |
| C1614T | 5/25 | |
| A1662T | 11/25 | |
| A1722G | 2/25 | |
| G1761C | 5/25 | |
| G1799A | 8/25 | |
| G1827A | 12/25 | |
| C1890T | 2/25 | |
| C1955G | 4/25 | |
| C1968T | 2/25 | |
| G1999A | 6/25 | |
| C2013T | 4/25 | |
| 广西南宁 | G39A | 3/22 |
| Nanning, | A336C | 2/22 |
| Guangxi | C363A | 5/22 |
| C366T | 4/22 | |
| 广西南宁 | C382A | 9/22 |
| Nanning, | G414A | 2/22 |
| Guangxi | G417A | 2/22 |
| T576C | 5/22 | |
| C681T | 2/22 | |
| T696A | 3/22 | |
| G717C | 6/22 | |
| T732C | 10/22 | |
| T753G | 2/22 | |
| T843G | 3/22 | |
| T900C | 5/22 | |
| T1029C | 7/22 | |
| G1071A | 2/22 | |
| C1170T | 4/22 | |
| G1761C | 3/22 | |
| G1799A | 10/22 | |
| G1827A | 9/22 | |
| T1845G | 4/22 | |
| A1914G | 2/22 | |
| C1955G | 3/22 | |
| C1968T | 4/22 | |
| G1999A | 3/22 | |
| C2031T | 2/22 | |
| 注:比率=具有该多态性位点的序列数/检测样本数; 仅统计比率>1/22的位点。下同。 Note: Frequency=sequence with the sites/sample sequences checked; only those with occurrence ratio>1/22 were recorded. The same as follows. | ||
用Mega 5.0软件分析4个地理种群大螟AChE1的氨基酸序列, 并进行多重序列对比。结果(表 3)表明:4个地理种群共有21种氨基酸突变类型, 突变位点最多的是江苏南京种群, 共有12种; 其次是广东江门和安徽合肥种群, 分别有5和4种; 突变类型最少的是广西南宁种群, 仅有3种。在江苏南京、广东江门和广西南宁种群中均发现了突变G600D, 比率分别为1/25、8/25和10/22;在江苏南京和安徽合肥种群中均有1/25的G677C突变; 广东江门和广西南宁种群均有类似比率的H34Y突变; 其余的氨基酸突变位点均为不同种群独有(表 3)。
| 种群 Populations | 位点 Sites | 比率 Ratio |
| 江苏南京 Nanjing, Jiangsu | A50D | 1/25 |
| H96S | 1/25 | |
| G111R | 1/25 | |
| R123M | 1/25 | |
| R162G | 1/25 | |
| P453H | 5/25 | |
| P474S | 1/25 | |
| F520S | 1/25 | |
| E574D | 1/25 | |
| G600D | 1/25 | |
| S627Y/C | 1/25 | |
| G677C | 1/25 | |
| 安徽合肥 Hefei, Anhui | H423R | 1/25 |
| A503S | 1/25 | |
| G677C | 1/25 | |
| T687I | 1/25 | |
| 广东江门 Jiangmen, Guangdong | P33S | 2/25 |
| H34Y | 1/25 | |
| P55S | 2/25 | |
| R98Q | 1/25 | |
| G600D | 8/25 | |
| 广西南宁 Nanning, Guangxi | H34Y | 1/22 |
| K87E | 1/22 | |
| G600D | 10/22 |
以三唑磷为代表测定大螟对常用有机磷杀虫剂的抗性状况。从表 4毒力测定数据可以看出:三唑磷对不同地理种群大螟的毒力依次为安徽合肥(1.386~2.787 mg·L-1)、广西南宁(2.440~4.058 mg·L-1)、江苏南京(5.570~7.404 mg·L-1)和广东江门(8.209~11.783 mg·L-1), 即安徽合肥种群对三唑磷最敏感, 广西南宁种群次之, 广东江门种群对三唑磷最不敏感。4个地理种群的LC50置信区间大部分不重叠, 表明三唑磷对不同地理种群的大螟初孵幼虫的毒力明显不同。但相邻种群的敏感性并不相近, 反映了大螟迁移扩散能力相对较弱, 抗药性发展与局部地区用药和环境关系密切。另外, 从相对毒力倍数来看, 4个种群对三唑磷的耐药能力相差较小, 最敏感的安徽合肥种群和最不敏感的广东江门种群对三唑磷的LC50值仅相差5.003倍。
| 药剂 Insecticides | 年份 Years | 种群 Populations | 毒力回归线方程 Toxicity regression equation | 相关系数 Correlation coefficent | LC50(95% FL)/ (mg·L-1) | 相对毒力倍数 Relative toxicity index |
| 江苏南京 Nanjing, Jiangsu | y=2.255+3.398 4x | 0.961 | 6.422(5.570~7.404) | 3.267 | ||
| 三唑磷 | 2018 | 广东江门 Jiangmen, Guangdong | y=1.385+3.640 7x | 0.902 | 9.835(8.209~11.783) | 5.003 |
| Triazophos | 广西南宁 Nanning, Guangxi | y=3.823+2.363 8x | 0.973 | 3.147(2.440~4.058) | 1.601 | |
| 2019 | 安徽合肥 Hefei, Anhui | y=4.416+1.992 0x | 0.981 | 1.966(1.386~2.787) | 1.000 | |
| 注:相对毒力倍数=田间抗性种群LC50值/相对敏感种群LC50值。 Note:Relative toxicity index=LC50value of field resistant population/LC50 value of relatively sensitive population. | ||||||
二化螟、三化螟、稻纵卷叶螟和大螟均是水稻田危害严重的鳞翅目害虫, 有机磷药剂仍是某些地区防治水稻螟虫的重要药剂[19-20]。然而, 某些昆虫如二化螟和台湾稻螟(Chilo auricilius)等已经对三唑磷和毒死蜱等有机磷药剂产生了极高水平的抗性, 抗性倍数高达218.8倍[21], 并在抗性种群中检测到了ace1基因A314S突变[11]。在其他昆虫对有机磷农药的抗性品系中, 也检测到了同种突变类型, 说明ace1基因的突变是造成昆虫对有机磷类杀虫剂产生抗性的重要因素[22-23]。与此同时, 这些突变位点的存在与否也可作为田间害虫的抗性诊断标志物, 其突变频率是反映杀虫剂抗性水平的重要指标。姜晓静[24]根据FLP-PCR技术的原理, 通过对二化螟ace1基因A314S突变位点的检测与抗性水平的分析, 建立了二化螟对三唑磷靶标抗性的分子检测技术。罗光华等[25]利用此方法调查了20个地区的二化螟对三唑磷靶标抗性的突变频率, 发现突变频率与抗性水平具有明显的相关性。因此, 通过检测抗性突变位点预测抗性水平的分子技术也已成为杀虫剂抗性监测的一项重要手段, 解决了传统的生物测定方法需要大量的试虫并且灵敏度低的问题。但是该方法无法一次同时检测多个抗药性突变位点, 并且存在假阳性的问题[26-27]。Guo等[28]通过设计程序分析了7种害虫的转录组数据, 从中直接得到了ace基因的经典抗性位点频率。该方法可以一次大量检测不同的抗药性突变位点, 但是该方法必须首先确定抗性突变位点。
靶基因有多种突变可能导致抗药性, 前人已经报道了不少ace1基因抗药性突变位点, 本研究一方面通过序列分析检测是否存在已报道过的抗药性突变, 同时通过种群抗药性与靶基因多态性的对比分析, 寻找新的抗药性相关突变。通过分析其氨基酸多态性, 并未发现有经典的抗性诊断突变位点。通过分析其核苷酸多态性, 发现4个地理种群的核苷酸多态性位点主要集中在280~860 bp和1 220~2 057 bp, 几乎遍布了Sinace1 的峡谷内壁和底部。这与Mao等[29]报道的有关致倦库蚊(Culex quinquefasciatus)和淡色库蚊(Culex pipiens pallens)的ace1基因核苷酸突变主要集中在800~1 500 bp的结果不同。有报道发现在药剂筛选下, 昆虫靶标基因的氨基酸多态性的种类和频率会发生变化[30-31]。Ffrench-Constant等[32]在埃及伊蚊抗有机磷的品系中发现, 与抗性相关的突变位点数目越多, 其AChE对杀虫剂越不敏感。同时含有F105S、G285Y和F350Y这3个突变位点和同时含有G285Y和F350Y这2个突变位点的埃及伊蚊对对氧磷和残杀威的抗性更高。本研究发现不同种群中最普遍的突变位点是G600D, 在广西、广东、江苏和安徽种群中的突变比率分别为10/22、8/25、1/25和0, 但与它们对三唑磷的相对抗性(1.601、5.003、3.267和1.000)没有明显的相关关系。总之, 除了不同种群独有的突变还需要进一步研究外, 本研究没有发现与抗药性相关的突变。这可能是由于大螟的危害较二化螟和三化螟轻, 很少进行针对性防治, 且大螟具有明显的寄主转移习性, 因此药剂防治选择压力小, 以至于现在还没有发展到具有可测定的靶标抗药性突变的地步。
综上所述, 本研究并没有找到导致大螟对三唑磷产生抗药性的靶基因突变, 但首次克隆获得了大螟的2个ace基因全长, 并发现21种不同的氨基酸多态性位点, 为未来研究靶标突变分子检测预测害虫对有机磷的抗药性水平, 以及体外表达大螟ace1利用酶活力检测建立大螟敏感药剂的筛选方法, 奠定了坚实的基础。同时本研究揭示了大螟尚没有发展到对有机磷杀虫剂的靶标抗性, 这也为大螟防治的用药选择提供了理论依据。
致谢: 安徽农业科学院植物保护研究所、广西农业科学院植物保护研究所以及广东恩平市植保站为本研究提供的试虫。
| [1] |
Soreq H, Seidman S. Acetylcholinesterase:new roles for an old actor[J]. Nature Reviews Neuroscience, 2001, 2(4): 294-302. DOI:10.1038/35067589 |
| [2] |
Casida J E, Durkin K A. Neuroactive insecticides:targets, selectivity, resistance, and secondary effects[J]. Annual Review of Entomology, 2013, 58(1): 99-117. DOI:10.1146/annurev-ento-120811-153645 |
| [3] |
Oppenoorth F J, van Asperen K. Allelic genes in the housefly producing modified enzymes that cause organophosphate resistance[J]. Science, 1960, 132(3422): 298-299. DOI:10.1126/science.132.3422.298 |
| [4] |
Newcomb R D, Campbell P M, Ollis D L, et al. A single amino acid substitution converts a carboxylesterase to an organophosphorus hydrolase and confers insecticide resistance on a blowfly[J]. Proc Natl Acad Sci USA, 1997, 94(14): 7464-7468. DOI:10.1073/pnas.94.14.7464 |
| [5] |
Newcomb R D, Campbell P M, Russell R J, et al. cDNA cloning, baculovirus-expression and kinetic properties of the esterase, E3, involved in organophosphorus resistance in Lucilia cuprina[J]. Insect Biochemistry & Molecular Biology, 1997, 27(1): 15-25. |
| [6] |
Newcomb R D, Gleeson D M, Yong C G, et al. Multiple mutations and gene duplications conferring organophosphorus insecticide resistance have been selected at the rop-1 locus of the sheep blowfly, Lucilia cuprina[J]. Journal of Molecular Evolution, 2005, 60(2): 207-220. DOI:10.1007/s00239-004-0104-x |
| [7] |
Hall L M, Spierer P. The Ace locus of Drosophila melanogaster:structural gene for acetylcholinesterase with an unusual 5' leader[J]. The EMBO Journal, 1986, 5(11): 2949-2954. DOI:10.1002/j.1460-2075.1986.tb04591.x |
| [8] |
Arpagaus M, Fournier D, Toutant J P. Analysis of acetylcholinesterase molecular forms during the development of Drosophila melanogaster:evidence for the existence of an amphiphilic monomer[J]. Insect Biochemistry, 1988, 18(6): 539-549. DOI:10.1016/0020-1790(88)90005-4 |
| [9] |
Zhu K Y, Brindley W A. Enzymological and inhibitory properties of acetylcholinesterase purified from Lygus hesperus Knight(Hemiptera:Miridae)[J]. Insect Biochemistry and Molecular Biology, 1992, 22(3): 245-251. DOI:10.1016/0965-1748(92)90061-I |
| [10] |
Zhu K Y, Marshall Clark J. Purification and characterization of acetyl-cholinesterase from the Colorado potato beetle, Leptinotarsa decemlineata(say)[J]. Insect Biochemistry and Molecular Biology, 1994, 24(5): 453-461. DOI:10.1016/0965-1748(94)90040-X |
| [11] |
Jiang X J, Qu M J, Denholm I, et al. Mutation in acetylcholinesterase1 associated with triazophos resistance in rice stem borer, Chilo suppressalis(Lepidoptera:Pyralidae)[J]. Biochemical & Biophysical Research Communications, 2009, 378(2): 269-272. |
| [12] |
王敦, 唐振华, 尚金燕, 等. 昆虫乙酰胆碱酯酶基因研究进展[J]. 昆虫学报, 2006, 49(3): 497-503. Wang D, Tang Z H, Shang J Y, et al. Advances in the studies of acetylcholinesterase genes from insects[J]. Acta Entomologica Sinica, 2006, 49(3): 497-503 (in Chinese with English abstract). DOI:10.3321/j.issn:0454-6296.2006.03.023 |
| [13] |
张海艳, 李海东, 韩召军. 大螟田间种群对不同杀虫剂敏感性的差异[J]. 中国稻米, 2012, 18(1): 29-33. Zhang H Y, Li H D, Han Z J. Difference in susceptibility of field populations of Sesamia inferens(Walker)to various insecticides[J]. China Rice, 2012, 18(1): 29-33 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-8082.2012.01.006 |
| [14] |
吕亮, 常向前, 杨小林, 等. 湖北水稻蛀秆螟虫越冬情况调查[J]. 环境昆虫学报, 2018, 40(5): 1051-1057. Lü L, Chang X Q, Yang X L, et al. Biological survey on the overwintering larvae of rice stem borer in Hubei Province[J]. Journal of Environmental Entomology, 2018, 40(5): 1051-1057 (in Chinese with English abstract). |
| [15] |
周操, 王召, 杨洪, 等. 贵州中部稻区大螟和二化螟发生规律初探[J]. 山地农业生物学报, 2018, 37(4): 18-24, 94. Zhou C, Wang Z, Yang H, et al. Occurrence of stem borers in rice field of central Guizhou[J]. Journal of Mountain Agriculture and Biology, 2018, 37(4): 18-24, 94 (in Chinese with English abstract). |
| [16] |
高忠文, 陶岭梅, 苏建亚, 等. 防治稻纵卷叶螟高毒农药替代药剂的室内筛选[J]. 中国水稻科学, 2008, 22(6): 631-636. Gao Z W, Tao L M, Su J Y, et al. Laboratory screening of alternatives to highly toxic insecticides against the rice leafroller, Cnaphalocrocis medinalis[J]. Chinese Journal of Rice Science, 2008, 22(6): 631-636 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-7216.2008.06.012 |
| [17] |
周国辉, 凌炎, 龙丽萍. 不同杀虫剂对稻纵卷叶螟的毒效研究[J]. 中国农学通报, 2012, 28(6): 202-206. Zhou G H, Ling Y, Long L P. Effects of different insecticides on Cnaphalocrocis medinalis Guenee[J]. Chinese Agricultural Science Bulletin, 2012, 28(6): 202-206 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-6850.2012.06.037 |
| [18] |
常菊花, 何月平. 二化螟对常用杀虫剂的抗性研究进展[J]. 长江大学学报(自然科学版), 2016, 13(9): 4-6, 21. Chang J H, He Y P. Progress in the study on resistance of the Chilo suppressalis to common insecticides[J]. Journal of Yangtze University(Natural Science Edition), 2016, 13(9): 4-6, 21 (in Chinese). DOI:10.3969/j.issn.1673-1409(s).2016.09.002 |
| [19] |
姜海平, 阚李斌, 蔡超, 等. 不同杀虫剂防治水稻大螟田间药效试验研究[J]. 农药科学与管理, 2011, 32(5): 42-43. Jiang H P, Kan L B, Cai C, et al. Field efficacy of different insecticides against Sesamia inferens[J]. Pesticide Science and Administration, 2011, 32(5): 42-43 (in Chinese). DOI:10.3969/j.issn.1002-5480.2011.05.013 |
| [20] |
徐丽娜, 周子燕, 胡飞, 等. 安徽省二化螟不同地理种群对主要杀虫剂的敏感性[J]. 安徽农业大学学报, 2018, 45(4): 740-744. Xu L N, Zhou Z Y, Hu F, et al. The insecticide susceptibility of Chilo suppressalis in Anhui Province[J]. Journal of Anhui Agricultural University, 2018, 45(4): 740-744 (in Chinese with English abstract). |
| [21] |
黄诚华, 姚洪渭, 叶恭银, 等. 浙江省二化螟不同种群和大螟对三唑磷的敏感性研究[J]. 农药学学报, 2005, 7(4): 323-328. Huang C H, Yao H W, Ye G Y, et al. Susceptibility of different populations of Chilo suppressalis and Sesamia inferens to triazophos in Zhejiang Province of China[J]. Chinese Journal of Pesticide Science, 2005, 7(4): 323-328 (in Chinese with English abstract). DOI:10.3321/j.issn:1008-7303.2005.04.006 |
| [22] |
Li F, Han Z J. Mutations in acetylcholinesterase associated with insecticide resistance in the cotton aphid, Aphis gossypii Glover[J]. Insect Biochemistry and Molecular Biology, 2004, 34(4): 397-405. DOI:10.1016/j.ibmb.2004.02.001 |
| [23] |
Lee D W, Choi J Y, Kim W T, et al. Mutations of acetylcholinesterase1 contribute to prothiofos-resistance in Plutella xylostella(L.)[J]. Biochem Biophys Res Commun, 2007, 353(3): 591-597. DOI:10.1016/j.bbrc.2006.12.088 |
| [24] |
姜晓静.二化螟对三唑磷的靶标抗性研究[D].南京: 南京农业大学, 2009. Jiang X J. Studies on target resistance of Chilo suppressalis(Walker)to triazophos[D]. Nanjing: Nanjing Agricultural University, 2009(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10307-2010173960.htm |
| [25] |
罗光华, 张志春, 韩光杰, 等. 二化螟越冬种群特点及其对三唑磷靶标抗性突变频率分析[J]. 中国水稻科学, 2012, 26(4): 481-486. Luo G H, Zhang Z C, Han G J, et al. Characteristics of overwintering populations of rice stem borers and mutation frequencies of resistance to triazophos[J]. Chinese Journal of Rice Science, 2012, 26(4): 481-486 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-7216.2012.04.014 |
| [26] |
Gawad C, Koh W, Quake S R. Single-cell genome sequencing:current state of the science[J]. Nature Reviews Genetics, 2016, 17(3): 175-188. DOI:10.1038/nrg.2015.16 |
| [27] |
Castle P E, Porras C, Quint W G, et al. Comparison of two PCR-based human papillomavirus genotyping methods[J]. Journal of Clinical Microbiology, 2008, 46(10): 3437-3445. DOI:10.1128/JCM.00620-08 |
| [28] |
Guo D H, Luo J P, Zhou Y N, et al. ACE:an efficient and sensitive tool to detect insecticide resistance-associated mutations in insect acetylcholinesterase from RNA-Seq data[J]. BMC Bioinformatics, 2017, 18(1): 330. DOI:10.1186/s12859-017-1741-6 |
| [29] |
Mao Y, Tan F, Yan S G, et al. High-throughput genotyping of single-nucleotide polymorphisms in ace-1 gene of mosquitoes using MALDI-TOF mass spectrometry[J]. Insect Science, 2013, 20(2): 167-174. DOI:10.1111/j.1744-7917.2012.01520.x |
| [30] |
魏星.褐飞虱烟碱型乙酰胆碱受体β1亚基氨基酸多态性分析及与吡虫啉抗性关系研究[D].南京: 南京农业大学, 2013. Wei X. Analysis of nAChR β1 subunit polymorphism and associate with imidacloprid resistance in the brown planthopper[D]. Nanjing: Nanjing Agricultural University, 2013(in Chinese with English abstract). |
| [31] |
董德臻, 管利莎, 童巧琼, 等. 吡虫啉对褐飞虱DNA多态性的影响[J]. 核农学报, 2013, 27(5): 584-590. Dong D Z, Guan L S, Tong Q Q, et al. Effects of imidacloprid on DNA polymorphism in the brown planthopper[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(5): 584-590 (in Chinese with English abstract). |
| [32] |
Ffrench-Constant R H, Pittendrigh B, Vaughan A, et al. Why are there so few resistance-associated mutations in insecticide target genes?[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 1998, 353(1376): 1685-1693. DOI:10.1098/rstb.1998.0319 |




