文章信息
- 陈坤琳, 钱勇, 蒋临正, 王慧利, 邢光东, 李倩倩, 仲跻峰
- CHEN Kunlin, QIAN Yong, JIANG Linzheng, WANG Huili, XING Guangdong, LI Qianqian, ZHONG Jifeng
- SIRT7对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成关键基因表达的调控
- Effects of SIRT7 on the expression of key genes involved in lactoprotein, milk fat and lactose synthesis in dairy cow mammary epithelial cells
- 南京农业大学学报, 2019, 42(5): 917-923
- Journal of Nanjing Agricultural University, 2019, 42(5): 917-923.
- http://dx.doi.org/10.7685/jnau.201809033
-
文章历史
- 收稿日期: 2018-09-20
2. 江苏优源奶业产业研究院有限公司, 江苏 南京 211100;
3. 光明牧业有限公司, 上海 200436
2. Youyuan Research Institute of Dairy Industry Co. Ltd., Nanjing 211100, China;
3. Bright Farming Co. Ltd., Shanghai 200436, China
乳品质及其质量安全一直是乳业问题的关键[1-2]。目前, 我国奶牛的遗传改良已取得明显进步, 良种率已达到95%以上, 但牛乳中乳蛋白、乳脂含量仍低于发达国家, 乳营养品质低下已成为制约我国奶业持续健康发展的关键问题, 探索提高乳营养品质的手段和方法迫在眉睫。乳蛋白、乳脂和乳糖是构成牛奶营养品质的主要物质基础, 提高乳蛋白和乳脂含量对乳营养品质至关重要。
乳汁分泌是乳腺组织的分泌细胞以血液中的各种营养物质为原料, 在细胞中生成乳汁后分泌到腺泡腔中的过程。奶牛乳腺上皮细胞(dairy cow mammary epithelial cells, DCMEC)执行泌乳功能, 其分泌活性对牛奶生产至关重要[3]。乳汁主要营养成分包括乳蛋白、乳脂和乳糖。这些营养成分的合成与一些重要功能基因的表达和信号通路的转导密切相关。蛋白激酶B/雷帕霉素靶蛋白(protein kinase B/the mammalian target of rapamycin, AKT-mTOR)被认为是合成蛋白质的重要信号转导途径。mTOR在调节乳腺上皮细胞的生长、代谢等方面具有重要作用[4]。Janus激酶2-信号传导子与转录激活子5(janus kinase-signal transducer and activator of transcription, JAK2-STAT5)信号转导通路在调控乳中酪蛋白合成过程起重要作用。STAT5能通过影响催乳素的分泌和其他相关细胞生长因子的分泌从而调控乳蛋白的合成。同时ELF5是可以辅助STAT5调控乳蛋白合成的潜在细胞因子, 在泌乳期表达显著上调, 影响泌乳过程关键基因的表达。ELF5的表达受STAT5的调控, 并能增加STAT5的活性, 调节乳腺上皮细胞的分化促进泌乳[5]。mTOR信号通路贯穿整个泌乳周期, 与JAK2-STAT5信号途径相互影响, 共同调控泌乳相关因子和激素对蛋白的合成。SREBP1是乳脂合成中的一个固醇类调节元件, 在乳脂的生物合成过程中占有重要地位, 参与乳脂合成中多个关键酶的调节, SREBP1表达的上调可促进乳脂的合成与分泌[6]。PPARγ属于配体激活的转录因子, 它能促进前体脂肪细胞的分化, 促进脂肪组织中脂蛋白脂肪酶基因的表达并降低脂肪分解的速度; 在乳成分合成过程中, PPARγ能增加乳腺上皮细胞内甘油三酯的含量, 在合成乳脂过程中起关键作用[7]。GLUT1调节的转运途径可介导葡萄糖转运调节乳糖的合成, 从而影响奶牛的泌乳能力[8]。
去乙酰化蛋白(Sirtuins)是一类去乙酰化酶, 最初在酵母体内被发现, 它们的催化活性与细胞内的能量状态密切相关。自从Sirtuins被发现与延长低等生物如酵母、果蝇和线虫的生命有关后[9-10], 有关它们的功能逐渐成为研究热点。在哺乳动物体内, Sirtuins家族由SIRT1—SIRT7共7位成员组成, 这些成员的共同特点是具有NAD+连接区域以及酶催化活性。它们在细胞中有不同的定位, SIRT1和SIRT6主要分布在细胞核上, SIRT2主要分布在细胞质中, SIRT3—SIRT5主要分布在线粒体上, SIRT7主要分布在细胞核仁[11]。最近几年, 在细胞水平上对SIRT7的研究越来越多。研究表明, SIRT7除在核糖体DNA转录中具有重要作用外, 还广泛参与核糖体DNA转录、蛋白质合成、染色质重组、细胞再生以及脂质代谢等生物学过程[12-13]。然而, 有关SIRT7对奶牛泌乳过程的调控, 尤其对乳蛋白、乳脂和乳糖合成关键基因的表达的调控作用还未见报道。
本试验以体外培养的DCMEC为模型, 探讨SIRT7对DCMEC乳蛋白、乳脂和乳糖合成关键基因表达的影响, 为阐明SIRT7调控乳蛋白、乳脂和乳糖的合成机制提供理论基础。
1 材料与方法 1.1 材料DMEM/F12培养基、2.5 g·L-1胰蛋白酶和胎牛血清均购自Gibco公司; 二甲基亚砜和Ⅱ型胶原酶购自于Sigma公司; 甘油三酯(TG)检测试剂盒、青霉素和链霉素以及脱脂奶粉均购自北京索莱宝科技有限公司; 磷酸盐缓冲液(PBS)购自HyClone公司; 总RNA提取试剂盒购自北京百泰克生物技术有限公司; 反转录试剂盒购自TaKaRa公司; ChamQTM SYBRRR PCR Master Mix购于Vazyme公司; Lipofectamine 3000购于ThermoFisher公司; BCA试剂盒购于碧云天生物公司; SIRT7、GAPDH抗体购于Proteintech公司; CSN2抗体购于Cloud-Clone Corp公司; SREBP1、PPARγ、mTOR和p-mTOR抗体均购于Santa cruz公司; 所有二抗均购于Proteintech公司。
1.2 乳腺细胞的培养选取南京近郊牧场的健康中国荷斯坦奶牛, 屠宰后2 h内带回整个乳房, 无菌分离奶牛乳腺组织, PBS清洗5次, 去除血污和奶迹。将清洗干净的乳腺组织转移至无菌的10 cm培养皿中, 于超净工作台中待用。用眼科剪将乳腺组织剪为1.0 mm×1.0 mm×1.0 mm的组织块, 参照杨文浩等[14]两步酶消化法分离乳腺上皮细胞。消化离心后接种至T25的细胞培养瓶中, 于5% CO2培养箱中培养。根据成纤维细胞贴壁速度快于上皮细胞的特点, 采用差速贴壁法纯化细胞。连续纯化3次, 可观察到培养瓶中90%以上细胞呈鹅卵石状, 经角蛋白18免疫荧光染色鉴定后, 扩大培养。
1.3 奶牛SIRT7基因过表达质粒的构建根据NCBI发布的牛SIRT7基因的mRNA序列(NM_001075217.1), 利用Primer Premier 5.0软件设计全长CDS区的扩增引物, 引入XhoⅠ、NotⅠ双酶切位点。连接到pcDNA3.1-zeo(-)真核表达载体上。构建好的质粒经双酶切鉴定无误后, 送上海捷瑞生物技术有限公司测序。
1.4 过表达质粒的转染转染质粒参照Lipofectamine 3000试剂盒说明书进行, 接种纯化后第3代的DCMEC至6孔板中, 分为对照组(Control, Ctrl组)、空载组(pcDNA3.1, Mock组)和过表达质粒组(pcDNA3.1-SIRT7, SIRT组)。转染后48或72 h收集细胞, 进行后续试验。
1.5 实时荧光定量PCR(RT-qPCR)测定收集过表达转染48 h后的DCMEC, 根据试剂盒步骤提取总RNA, 反转录成cDNA, 进行RT-qPCR反应, 测定乳蛋白、乳脂和乳糖合成关键基因的mRNA相对表达量。引物由南京金斯瑞生物科技有限公司合成, 引物序列见表 1。RT-qPCR 20 μL体系如下:qPCR Master Mix(2×)10 μL, 上、下游引物(10 μmol·L-1)各0.4 μL, 模板cDNA 2 μL; 无菌蒸馏水7.2 μL。反应条件:95 ℃ 30 s; 95 ℃ 10 s, 60 ℃ 30 s, 40个循环; 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。用2-ΔΔCT法计算各基因的相对表达量。
| 基因名称 Gene name |
登录号 Accession No. |
预期产物长度/bp Product size |
引物对序列 Primer pairs sequence(5′→3′) |
| ELF5 | NM_001024569.1 | 154 | ATGTCGTGGACTGACCTGTT/GCTTGTACTGGTCACAGCAG |
| GLUT1 | NM_001290870.1 | 106 | CTGCTCATTAACCGCAACGA/GGCTCTCCTCCTTCATCTCC |
| SREBP1 | NM_001205999.2 | 82 | TGGACCAGGCAAGAGAAGAG/TCTTCCTCCAGCTTGACAGG |
| PPARγ | NM_181024.2 | 195 | TCTTGACGGGAAAGACGACA/TGGCGTACTCTGTGATCTCC |
| CSN1S1 | NM_181029.2 | 172 | GTGCTGAGGAACGACTTCAC/TGTGTGCCTAGTGGAACGTA |
| CSN2 | XM_010806178.2 | 168 | GAGGCTATGGCTCCTAAGCA/GACAGTTGGAGGAAGAGGCT |
| β-actin | NM_173979.3 | 188 | TCACCAACTGGGACGACA/GCATACAGGGACAGCACA |
| 注:ELF5:ETS转录因子5基因E74-like factor 5 gene; GLUT1:葡萄糖转运蛋白1基因Glucose transporter 1 gene; GLUT4:葡萄糖转运蛋白4基因Glucose transporter 4 gene; SREBP1:固醇调节元件结合蛋白1基因Sterol regulatory element binding protein 1 gene; γ-PPAR:γ过氧化物酶体增殖物激活受体基因Peroxisome proliferator-activated receptor gamma gene; CSN1S1:αs1-酪蛋白基因Casein alpha s1 gene; CSN2:酪蛋白基因β-casein gene; β-actin:β-肌动蛋白基因β-actin gene. | |||
收集转染72 h后的DCMEC, 提取总蛋白, BCA试剂盒测定蛋白浓度, 均一化蛋白浓度后, 变性, 点样, 将蛋白转到聚偏二氟乙烯膜(PVDF), 先用50 g·L-1脱脂奶粉封闭1 h, 然后加GAPDH、SIRT7、CSN2、PPARγ、SREBP1、mTOR和p-mTOR一抗(1:1 000稀释), 4 ℃孵育过夜, 再用TBST洗3次后, 用相应二抗(1:5 000)孵育2 h, TBST洗3次, ECL化学发光试剂进行显影, Image J软件分析目标条带的灰度值。
1.7 甘油三酯(TG)含量的测定将转染72 h后的细胞经PBS洗涤, 胰酶消化, 离心后, 超声波破碎, 用TG试剂盒分别测定DCMEC和培养液中TG含量。具体步骤参照试剂盒说明书。
1.8 数据统计与分析试验数据采用Excel 2007进行计算和整理, RT-qPCR试验结果采用2-ΔΔCT法进行相对定量分析。利用SAS 9.0软件的One-way ANOVA程序对数据进行单因素方差分析。
2 结果与分析 2.1 过表达SIRT7转染效率纯化后的DCMEC经Lipofectamine 3000转染72 h后, 收集细胞, Western blot检测SIRT7过表达效率。如图 1所示:与对照组(Ctrl组)和空载组(Mock组)相比, 过表达组(SIRT7组)SIRT7蛋白表达量极显著升高(P < 0.001), 过表达效率显著, 满足后续试验要求。
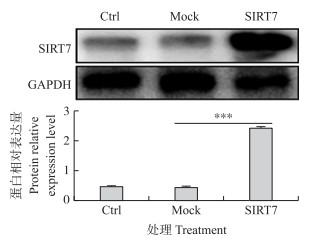
|
图 1 Western blot检测SIRT7蛋白过表达效率
Fig. 1 Overexpression efficiency of SIRT7assessed by Western blot
1)Ctrl:对照组Control group; Mock:空载组Blank Carrier group; SIRT7:过表达组Overexpression group; 2)* P < 0.05, ** P < 0.01, *** P < 0.001. The same as follows. |
如图 2所示:与Ctrl组和Mock组相比, SIRT7组中ELF5、CSN1S1和CSN2 mRNA相对表达量显著提高, 其中ELF5的表达量差异极显著(P < 0.001), CSN2的表达量差异显著(P < 0.05)。同时Western blot检测结果显示, 过表达SIRT7显著增加CSN2蛋白表达量, 同时mTOR磷酸化水平显著上升。
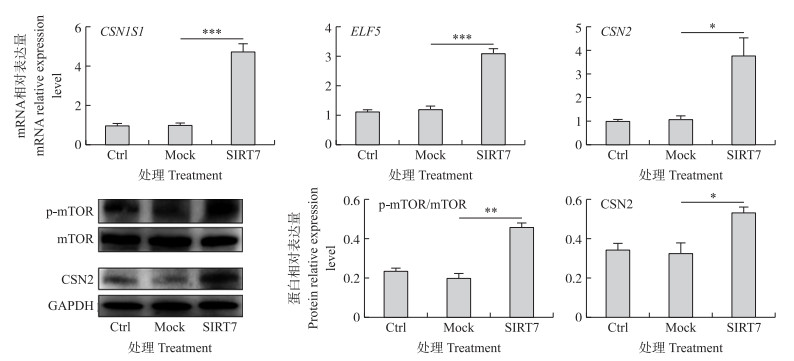
|
图 2 SIRT7对奶牛乳腺上皮细胞(DCMEC)乳蛋白合成关键基因和蛋白表达的影响 Fig. 2 Effects of SIRT7 on lactoprotein synthesis-related genes and protein expression in dairy cow mammary epithelial cells(DCMEC) |
我们分别通过RT-qPCR和Western blot检测乳脂合成关键基因的表达(图 3)。与Ctrl组和Mock组相比, SIRT7组PPARγ和SREBP1 mRNA和蛋白表达显著提高, 其中mRNA表达差异极显著(P < 0.01)。
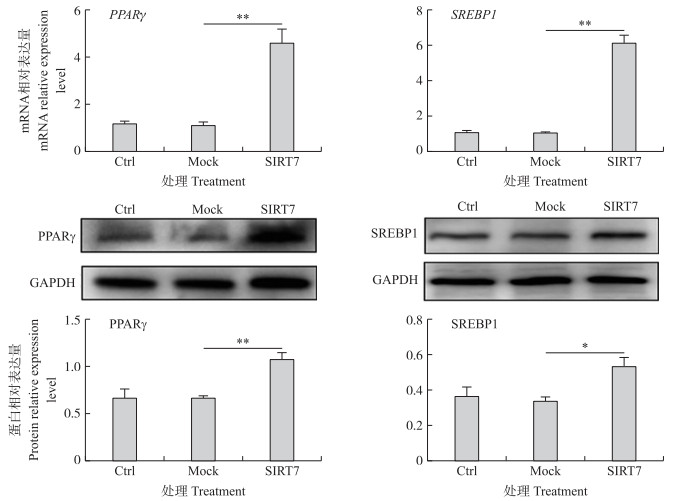
|
图 3 SIRT7对DCMEC乳脂合成关键基因和蛋白表达的影响 Fig. 3 Effects of SIRT7 on milk fat synthesis-related genes and protein expression in DCMEC |
收集转染72 h的细胞和培养基, 用TG试剂盒检测DCMEC胞内和培养基中TG含量(图 4)。与Ctrl组和Mock组相比, SIRT7组细胞中TG含量显著升高(P < 0.05), 而培养基中的TG含量也呈上升趋势, 但差异不显著(P>0.05)。
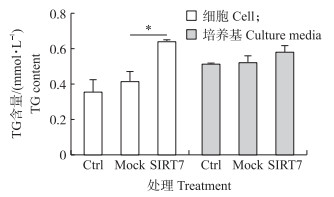
|
图 4 SIRT7对DCMEC胞内和培养基中甘油三酯(TG)含量的影响 Fig. 4 Effects of SIRT7 on triglyceride(TG)content in culture medium and DCMEC |
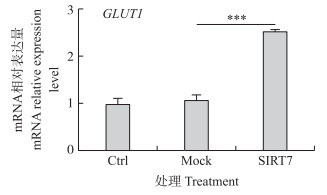
RT-qPCR检测DCMEC乳糖合成关键基因GLUT1 mRNA表达(图 5)。与Ctrl组和Mock组相比, SIRT7组细胞中GLUT1 mRNA表达极显著升高(P < 0.001)。
|
图 5 SIRT7对DCMEC内乳糖合成关键基因GLUT1 mRNA表达的影响 Fig. 5 Effects of SIRT7 on mRNA expression level of GLUT1 in DCMEC |
SIRT7作为Sirtuins蛋白家族(组蛋白去乙酰化酶类)成员之一, 是细胞应激反应的关键调节因子, 调节细胞衰老和疾病, 广泛参与蛋白的合成和脂质代谢等生理过程[15]。乳腺上皮细胞具有分泌性功能, 是乳腺具备泌乳功能的细胞基础, 是研究泌乳启动、功能维持和退化等生理过程首选试验材料[16]。本试验以体外培养的奶牛乳腺上皮细胞为研究对象, 探讨SIRT7对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成关键基因表达的影响。试验结果表明, 过表达SIRT7可促进奶牛乳腺上皮细胞合成乳蛋白、乳脂和乳糖关键基因的表达。
乳蛋白主要由酪蛋白和乳清蛋白组成, 是乳汁的主要成分之一, 其含量的高低是评价牛奶营养价值的重要指标之一。酪蛋白是乳中特有的蛋白, 占乳蛋白的80%, 可分为5种:αs1-酪蛋白(CSN1S1)、αs2-酪蛋白(CSN1S2)、β-酪蛋白(CSN2)、γ-酪蛋白和κ-酪蛋白(CSN3)[17]。酪蛋白含有全部的必需氨基酸, 是唯一可凝固的乳蛋白, 可与钙、磷形成稳定的微胶粒而提高对乳中钙、磷含量的吸收。过表达SIRT7可明显促进CSN1S1、CSN2基因的表达。有研究表明NF-κB激活CSN2从而调控细胞的增殖[18]。我们先前的研究也发现过表达SIRT7抑制NF-κB的磷酸化从而抑制炎症的发生, 因此SIRT7对酪蛋白CSN1S1、CSN2的表达也可能是通过SIRT7-NF-κB通路调控的, 但它们之间的相互关系还需要进一步研究。本试验结果表明, SIRT7可通过调节CSN1S1、CSN2基因的表达从而促进牛乳中酪蛋白的合成。
乳蛋白合成调控是一个协同过程, 涉及氨基酸、胰岛素、葡萄糖等水平及下游各信号转导途径, 这些因素之间的关系对于乳蛋白的合成发挥关键作用。乳蛋白基因的表达受多个因素调控, 其合成机制已经基本确定。具体机制主要包括:氨基酸转运系统、JAK2-STAT5信号转导途径和mTOR信号通路。JAK-STAT5途径是近年发现的一条由细胞因子介导的信号转导途径, 在细胞增殖、分化、免疫调节等方面具有重要作用, JAK2-STAT5信号途径是乳蛋白合成研究的热点[19]。转录因子ELF5作为JAK2-STAT5通路中核心因子STAT5的下游基因, 辅助STAT5调控乳蛋白的合成, 影响泌乳过程关键基因的表达, 在泌乳期表达显著上调, 并能增加STAT5的活性。ELF5表达缺失将会造成乳腺腺泡发育不良, 降低奶牛的产奶量[20]。mTOR信号通路贯穿整个泌乳周期, 其可以整合能量、激素和生长因子等因素, 参与调控基因转录和蛋白质翻译过程, 同时对乳腺上皮细胞的生长具有重要作用。有研究表明mTOR信号通路与JAK2-STAT5信号途径相互影响共同调控泌乳相关因子和激素对蛋白的合成[21]。本试验结果表明, 过表达SIRT7可增加ELF5 mRNA的表达, 同时可促进mTOR的磷酸化。我们在先前的研究中发现SIRT7与mTOR能够直接相互作用[22], 因此SIRT7可能直接通过调控mTOR参与乳蛋白的合成。但SIRT7是否直接作用于ELF5调控乳蛋白的合成, 还需进一步研究。研究发现SIRT6能通过调控JAK2/STAT3进而抑制胃癌细胞的增殖[23], 而SIRT6和SIRT7都定位于细胞核。因此我们推测SIRT7可能具有激活乳蛋白合成关键信号通路JAK2-STAT5和AKT-mTOR信号通路的潜能, 从而促进乳蛋白的合成。
乳脂是牛奶的主要营养成分, 可为人类提供营养和能量, 因此高乳脂的优质牛奶是健康食品的发展趋势。乳脂一般占牛乳的3%~5%, 其中97%可被人体吸收和利用。乳脂的主要成分是甘油三酯(TG), 占乳脂总量的95%左右。TG主要由脂肪酸和磷酸甘油在乳腺上皮细胞中合成。PPARγ和SREBP1是乳腺中乳脂肪合成与分泌过程中最重要的2个调控因子[20, 22]。SREBP1是人和动物乳脂合成的核心转录因子, 主要通过调控参与乳脂肪合成的多种酶和转运蛋白的表达活性, 影响乳腺上皮细胞TG的合成和分泌。SIRT1能直接脱乙酰化SREBP, 从而抑制其活性[23], 此外, SIRT6也能抑制SREBP1/2的活性。这进一步证明Sirtuins家族在SREBPs的激活过程中起着重要作用。PPARγ作为配体激活转录因子, 是核激素受体超家族的成员, 主要对脂肪酸的摄取、甘油三酯的转运、脂肪的β-氧化等脂肪代谢进行调控。Qin等[24]的研究表明PPARγ在乳腺中表达量较低, 但在泌乳期表达上调, 使FAS和SREBP1表达明显增加, 对脂肪的生成及脂滴的聚积有重要作用, 所以PPARγ极有可能调控乳腺组织中SREBP的活性。有研究发现, 在脂肪形成过程中, SIRT7作为PPARγ的上游基因直接调控脂肪的合成[25]。本试验结果表明, 过表达SIRT7可明显增加乳脂合成关键基因SREBP1、PPARγ的表达, 同时增加细胞中TG含量。这说明SIRT7对乳脂合成具有一定的促进作用。GLUT1作为乳腺上皮细胞中重要的葡萄糖转运载体, 能够介导葡萄糖的摄取, 主要参与哺乳动物乳腺泌乳期乳糖合成的调控。本试验结果显示, 过表达SIRT7增加GLUT1 mRNA水平, 推测SIRT7也可调控乳糖的合成。
综上所述, SIRT7可通过促进乳蛋白、乳脂和乳糖合成关键基因和蛋白的表达以及提高细胞中甘油三酯的含量, 从而调控牛乳中的营养成分含量, 这为阐明高品质牛奶的形成规律及其调控机制提供了理论基础。
| [1] |
Harvatine K J, Allen M S. The effect of production level on feed intake, milk yield, and endocrine responses to two fatty acid supplements in lactating cows[J]. Journal of Dairy Science, 2005, 88(11): 4018-4027. DOI:10.3168/jds.S0022-0302(05)73088-5 |
| [2] |
Purdie N G, Trout D R, Cieslar S R L, et al. The effect of short-term hyperammonaemia on milk synthesis in dairy cows[J]. Journal of Dairy Research, 2009, 76(1): 49-58. DOI:10.1017/S0022029908003634 |
| [3] |
Dessauge F, Lollivier V, Ponchon B, et al. Effects of nutrient restriction on mammary cell turnover and mammary gland remodeling in lactating dairy cows[J]. Journal of Dairy Science, 2011, 94(9): 4623-4635. DOI:10.3168/jds.2010-4012 |
| [4] |
Yang J, Kennelly J J, Baracos V E. The activity of transcription factor Stat5 responds to prolactin, growth hormone, and IGF-I in rat and bovine mammary explant culture[J]. Journal of Animal Science, 2000, 78(12): 3114-3125. DOI:10.2527/2000.78123114x |
| [5] |
Harris J, Stanford P M, Sutherland K, et al. Socs2 and elf5 mediate prolactin-induced mammary gland development[J]. Molecular Endocrinology, 2006, 20(5): 1177-1187. DOI:10.1210/me.2005-0473 |
| [6] |
Anderson S M, Rudolph M C, Mcmanaman J L, et al. Key stages in mammary gland development. Secretory activation in the mammary gland:it's not just about milk protein synthesis![J]. Breast Cancer Research Bcr, 2007, 9(1): 204-218. |
| [7] |
Bionaz M, Loor J J. ACSL1, AGPAT6, FABP3, LPIN1, and SLC27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation[J]. Journal of Nutrition, 2008, 138(6): 1019-1024. DOI:10.1093/jn/138.6.1019 |
| [8] |
Eger M, Hussen J, Koy M, et al. Glucose transporter expression differs between bovine monocyte and macrophage subsets and is influenced by milk production[J]. Journal of Dairy Science, 2016, 99(3): 2276-2287. DOI:10.3168/jds.2015-10435 |
| [9] |
Rogina B, Helfand S L. Sir2 mediates longevity in the fly through a pathway related to calorie restriction[J]. Proc Natl Acad Sci USA, 2004, 101(45): 15998-16003. DOI:10.1073/pnas.0404184101 |
| [10] |
Tissenbaum H A, Guarente L. Increased dosage of a sir-2 gene extends lifespan in Caenorhabditis elegans[J]. Nature, 2001, 410(6825): 227-230. DOI:10.1038/35065638 |
| [11] |
Michishita E, Park J Y, Burneskis J M, et al. Evolutionarily conserved and nonconserved cellular localizations and functions of human SIRT proteins[J]. Molecular Biology of the Cell, 2005, 16(10): 4623-4635. DOI:10.1091/mbc.e05-01-0033 |
| [12] |
Tang B L. SIRT7 and hepatic lipid metabolism[J]. Frontiers in Cell & Developmental Biology, 2015, 3: 1-3. |
| [13] |
Kim W, Kim J E. SIRT7 an emerging sirtuin:deciphering newer roles[J]. Journal of Physiology & Pharmacology, 2013, 64(5): 531-544. |
| [14] |
杨文浩, 朱丽萍, 齐晓楠, 等. 酶消化组织块法体外培养奶牛乳腺上皮细胞[J]. 畜牧与兽医, 2016, 48(3): 99-102. Yang W H, Zhu L P, Qi X N, et al. In vitro culture of bovine mammary gland epithelial cells by enzymatic digestion method[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(3): 99-102 (in Chinese). |
| [15] |
Kiran S, Anwar T, Kiran M, et al. Sirtuin 7 in cell proliferation, stress and disease:rise of the Seventh Sirtuin![J]. Cellular Signalling, 2015, 27(3): 673-682. DOI:10.1016/j.cellsig.2014.11.026 |
| [16] |
陈建晖, 佟慧丽, 李庆章, 等. 奶牛乳腺上皮细胞系的建立[J]. 畜牧兽医学报, 2009, 40(5): 743-747. Chen J H, Tong H L, Li Q Z, et al. Establishment of dairy cow mammary gland epithelial cell line[J]. Animal Husbandry & Veterinary Medicine, 2009, 40(5): 743-747 (in Chinese with English abstract). DOI:10.3321/j.issn:0366-6964.2009.05.022 |
| [17] |
Bai W L, Yin R H, Zhao S J, et al. Short communication:characterization of a kappa-casein genetic variant in the Chinese yak, Bos grunniens[J]. Journal of Dairy Science, 2008, 91(3): 1204-1208. DOI:10.3168/jds.2007-0376 |
| [18] |
Zhou W, Wang Q, Xu Y, et al. RMP promotes epithelial-mesenchymal transition through NF-κB/CSN2/Snail pathway in hepatocellular carcinoma[J]. Oncotarget, 2017, 8(25): 40373-40388. |
| [19] |
Massimo B, Loor J J. Gene Networks driving bovine mammary protein synthesis during the lactation cycle[J]. Bioinform Biol Insights, 2011, 5(5): 83-98. |
| [20] |
Loor J J, Massimo B. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9(1): 366-387. DOI:10.1186/1471-2164-9-366 |
| [21] |
Wang M, Xu B, Wang H, et al. Effects of arginine concentration on the in vitro expression of Casein and mTOR pathway related genes in mammary epithelial cells from dairy cattle[J]. PLoS One, 2014, 9(5): e95985. DOI:10.1371/journal.pone.0095985 |
| [22] |
Harvatine K J, Bauman D E. SREBP1 and thyroid hormone responsive spot 14(S14)are involved in the regulation of bovine mammary lipid synthesis during diet-induced milk fat depression and treatment with CLA[J]. Journal of Nutrition, 2006, 136(10): 2468. DOI:10.1093/jn/136.10.2468 |
| [23] |
Wu T, Liu Y H, Fu Y C, et al. Direct evidence of sirtuin downregulation in the liver of non-alcoholic fatty liver disease patients[J]. Annals of Clinical & Laboratory Science, 2014, 44(4): 410-418. |
| [24] |
Qin X, Xie X, Fan Y, et al. Peroxisome proliferator-activated receptor-δ induces insulin-induced gene-1 and suppresses hepatic lipogenesis in obese diabetic mice[J]. Hepatology, 2010, 48(2): 432-441. |
| [25] |
Fang J, Ianni A, Smolka C, et al. Sirt7 promotes adipogenesis in the mouse by inhibiting autocatalytic activation of Sirt1[J]. Proc Natl Acad Sci USA, 2017, 114(40): E8352-E8361. DOI:10.1073/pnas.1706945114 |




