文章信息
- 张旭辉, 孙斌, 魏志敏, 赵晨雨, 徐源洲, 张力浩, 徐莉
- ZHANG Xuhui, SUN Bin, WEI Zhimin, ZHAO Chenyu, XU Yuanzhou, ZHANG Lihao, XU Li
- 2株耐镉微生物的筛选及其对镉的吸附钝化差异机制
- Screening of two cadmium tolerant microorganisms and their differences in adsorption and immobilization of cadmium
- 南京农业大学学报, 2019, 42(5): 869-876
- Journal of Nanjing Agricultural University, 2019, 42(5): 869-876.
- http://dx.doi.org/10.7685/jnau.201901005
-
文章历史
- 收稿日期: 2019-01-02
重金属污染修复一直是环境修复领域研究的热点和难点, 其中镉是应用广泛、污染面积最广、危害最大的重金属元素之一, 因此镉污染及其治理受到极大关注[1]。目前, 对于镉污染废水的治理方法有化学沉淀法、滤膜法、离子交换法、吸附法和生物法等[2]。相对于传统治理方法, 生物修复, 特别是微生物修复技术, 具有操作简便、成本低、环境破坏性小等优点[3-4]。环境中广泛存在对镉具有耐性, 并能与镉发生吸附、沉淀、富集等作用的微生物[5]。Li等[6]筛选的鲁氏酵母菌在镉离子浓度分别为0.1和0.4 mmol·L-1的液体培养基中, 对镉离子的去除率达到65.88%和25.14%, 酿酒酵母菌对镉离子的去除率分别为28.47%和3.50%。Zhao等[7]发现芽胞杆菌GZ-22在镉离子浓度为10 mg·L-1的溶液中对镉离子的去除率为60.72%。郭山等[8]筛选的嗜麦芽寡养假单胞菌R16能耐10 mg·L-1的镉, 对镉的最大去除率达41%。微生物对溶液中重金属的去除机制主要有:微生物的吸附沉淀作用, 即微生物的生物钝化, 通过带电荷的细胞表面吸附重金属离子, 或利用其代谢产物, 如分泌的胞外聚合物(extracellular polymeric substances, EPS), 改变重金属镉离子的存在状态来降低重金属的毒性及其含量; 微生物对重金属的直接吸收作用, 将重金属富集在细胞内的不同部位, 降低重金属的移动性[9]。
诸多研究表明微生物分泌的胞外聚合物对重金属的吸附具有重要作用[10]。胞外聚合物是微生物分泌到体外的高分子聚合物, 有2种形式, 分别为分泌到培养基中的可溶性EPS和与细胞紧密结合的不可溶性EPS, 主要由蛋白和多糖组成[11-12]。EPS可以保护细胞不受外界恶劣环境的影响, 并在底物短缺时充当碳源和能源。EPS中存在着大量阴离子基团(羧基、羟基等), 对不同类型金属离子表现出强烈的亲和性, 可以和金属离子发生吸附或螯合[11]。目前, 有研究指出镉能促进硫酸还原菌EPS的分泌, 特别是蛋白质组分, 从而对镉离子的去除具有积极作用[13]。另有研究表明, 杰米拉类芽胞杆菌分泌的EPS对Pb2+有较好的吸附效果[14]。Ye等[15]研究表明节杆菌分泌的EPS能够有效去除废水中的Cu2+、Pb2+、Cr6+等重金属离子。相比于传统的吸附机制, 生长着的细胞能保持持续吸附重金属的能力, 从而具有更好的吸附潜能[16-17]。然而, 我们对胞外聚合物对重金属去除作用的了解有限, 特别是可溶性和不可溶性EPS对环境中重金属的去除作用在国内外还较少报道[18-19]。基于此, 本文首先筛选获得2株对重金属镉具有较高耐性的菌株, 然后比较二者生长过程中对镉的钝化去除特征, 并针对可溶性和不可溶性EPS的动态变化, 探究比较镉胁迫下的钝化去除机制, 为微生物修复提供一定的借鉴和参考。
1 材料与方法 1.1 试验材料 1.1.1 土样来源土壤样品采集于南京某重金属污染区, 采样深度为0~20 cm, 五点采样法采取土壤样品, 将各土样等量混匀后剔除石块及动植物残体, 最后过孔径5 mm筛备用。
1.1.2 主要仪器与试剂Agilent710 ICP原子发射光谱仪(710 ICP-OES)、721型紫外分光光度计等。CdCl2·2.5H2O、氯化钠等化学试剂均为国产分析纯。
1.1.3 培养基LB培养基:NaCl 10.0 g、胰蛋白胨10.0 g、酵母粉5.0 g、水1 000 mL。
1.2 试验方法 1.2.1 耐镉菌株的筛选分离与鉴定耐镉细菌分离采用平板法[20], 耐镉细菌的培养采用LB固体培养基(pH7)。取10 g采集土样, 将其置于装有适量玻璃珠和90 mL液体LB培养基的三角瓶中, 150 r·min-1、30 ℃振荡12 h。吸取1 mL稀释度为10-6的土壤悬液分别涂布于Cd2+质量浓度为100、200、300、400、500、600和700 mg·L-1的LB固体培养基平板上, 每个浓度设置3个重复, 平板置于30 ℃恒温箱中倒置培养24 h。观察其生长情况, 发现2株形态不同的菌株能在600 mg·L-1的镉浓度平板上生长, 之后挑取单菌落重新划线接种于Cd2+质量浓度为600 mg·L-1平板上, 30 ℃培养24 h。以上操作重复3次进行纯化, 直至获得纯净单菌。经分离与纯化后得到2株耐镉菌株, 分别保存于4 ℃和-80 ℃冰箱中待用。
对2株菌进行PCR扩增测定细菌的16S rRNA序列, 采用NCBI数据库BLAST进行同源性检索分析, 用MEGA 7.0软件构建系统发育树。
1.2.2 菌株对Cd2+的吸附试验取4 ℃冰箱保存的2株菌种, 分别接种于50 mL的LB液体培养基中, 30 ℃、150 r·min-1培养12 h, 作为种子培养液。按1%接种量(D600=0.8)接种于50 mL Cd2+质量浓度为50 mg·L-1的LB培养基中, 30 ℃、150 r·min-1振荡培养。分别于12、24、48、72、120和168 h采样, 每次采样10 mL, 10 000 r·min-1离心10 min, 上清液过0.22 μm滤膜后, 测定溶液残余镉的浓度; 菌体先用无菌水洗涤2次, 每次10 min, 洗去表面的LB培养; 再用0.05 mol·L-1 EDTA洗涤菌体30 min, 洗涤液中的镉即为菌体表面吸附的镉, 洗涤液过0.22 μm滤膜后待测; 菌体沉淀加硝酸微波消解后待测[7]; 上清液、洗涤液及消解液中镉的测定采用ICP-OES法, 同时监测菌株D600和溶液pH值的变化。
Cd2+的去除率:R=(C0-Ce)/C0×100%。式中:R为Cd2+的去除率; C0表示溶液的Cd2+初始质量浓度(mg·L-1); Ce表示上清液中残余的Cd2+质量浓度(mg·L-1)。
Cd2+的吸附率:R1=(C1×V1)/(C0×V0)×100%。式中:R1为Cd2+的吸附率; C0表示溶液的Cd2+初始质量浓度(mg·L-1); V0表示溶液初始体积(mL); C1表示洗涤液中的Cd2+质量浓度(mg·L-1); V1表示EDTA洗涤液体积(mL)。
Cd2+的吸收率:R2=(C2×V2)/(C0×V0)×100%。式中:R2为Cd2+的吸收率; C0表示溶液的Cd2+初始质量浓度(mg·L-1); V0表示溶液初始体积(mL); C2表示消解液定容后的Cd2+质量浓度(mg·L-1); V2表示消解液定容后体积(mL)。
1.2.3 EPS的提取与测定可溶性EPS和不可溶性EPS的制备分别采用离心法和加热法[21-22]。分别收集12、24、48、72、120和168 h的菌液10 mL, 10 000 r·min-1离心10 min后, 获得菌体和上清液。上清液用于测定可溶性EPS中的可溶性多糖及可溶性蛋白含量。为避免微生物细胞破碎, 把分离后的菌体用0.5 g·L-1的NaCl溶液重悬至原来体积, 于70 ℃的水浴中加热30 min, 10 000 r·min-1离心10 min后收集上清液, 用于测定菌体表面结合的不可溶性EPS中的不可溶性多糖及不可溶性蛋白含量。分别采用蒽酮比色法和考马斯亮蓝法测定多糖和蛋白质含量[23]。
1.3 数据分析采用Origin 8.5和SPSS 20软件进行数据处理与分析, LSD法进行多重比较分析。
2 结果与分析 2.1 2株耐镉菌株的筛选与鉴定将筛选出来的菌株分别命名为ZXH21和ZXH23, 经16S rRNA鉴定并与GenBank中已登录的核苷酸序列号进行同源性比较, 发现菌株ZXH21与Achromobacter xylosoxidans strain ZJY-526同源性为100%, 初步鉴定为无色杆菌属(Achromobacter sp. ZXH21), 菌株ZXH23与Pseudomonas aeruginosa DSM 50071同源性为100%, 初步鉴定为假单胞菌属(Pseudomonas sp. ZXH23)。菌株ZXH21的GenBank登录号为MK263021, 菌株ZXH23的GenBank登录号为MK263022。菌株ZXH21和菌株ZXH23的系统发育树如图 1所示。
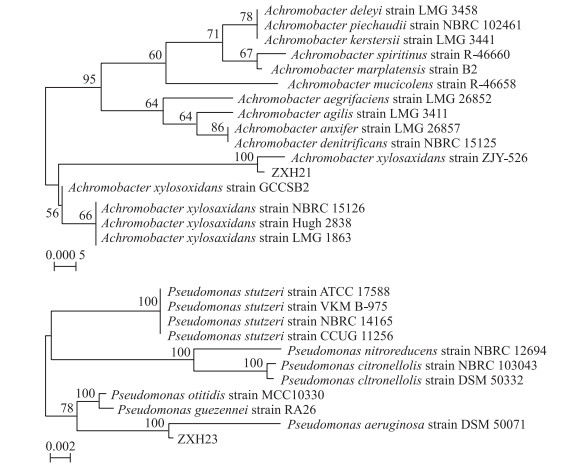
|
图 1 基于菌株ZXH21和ZXH23的16S rRNA基因序列构建的系统发育树 Fig. 1 Phylogenetic trees of ZXH21 and ZXH23 by using 16S rRNA sequences |
由图 2可知:菌株ZXH21和菌株ZXH23培养72 h时对Cd2+的去除率接近, 但在培养过程中表现出不同的镉去除特征。随培养时间的增加, 菌株ZXH21对Cd2+的去除率逐渐增加, 72 h前增幅较大, 72 h后增幅减小, 之后保持稳定, 在168 h时达到最大值(36.5%)。而菌株ZXH23对Cd2+去除率呈先增大后减小的趋势, 在72 h时达到最大, 为33.7%, 72 h后去除率逐渐降低。
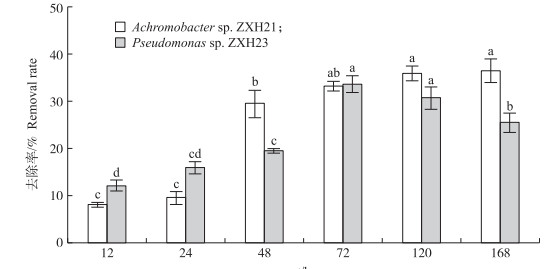
|
图 2 不同培养时间菌株Achromobacter sp. ZXH21和Pseudomonas sp. ZXH23对溶液中镉的总去除率 Fig. 2 The total cadmium removal rate of strains Achromobacter sp. ZXH21 and Pseudomonas sp. ZXH23 during different cultivation time 不同小写字母表示处理间差异显著(P < 0.05)。 Different lowercase letters showed significant difference between treatments(P < 0.05). The same as follows. |
观察2株菌的生长情况(图 3)可知:48 h前菌株ZXH21和菌株ZXH23的D600值随时间增加逐渐增加; 48 h时, 二者D600值接近:48 h后, 菌株ZXH23的D600值迅速降低, 而菌株ZXH21的D600值略有降低并趋于稳定, 整个培养周期中菌株ZXH21的D600值均高于菌株ZXH23。菌株对镉的去除率与菌株的生长情况呈相同趋势, 菌株ZXH21的镉去除率和D600值均随培养时间增加逐渐上升并稳定; 菌株ZXH23的镉去除率和D600值均随培养时间先上升后降低。随培养时间的增加, 2株菌培养液的pH值均增加。
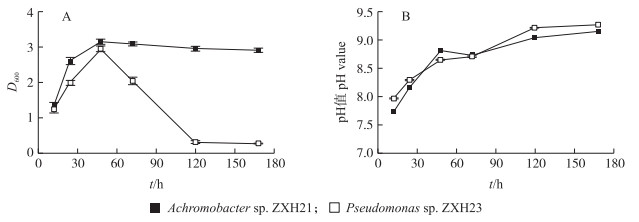
|
图 3 不同培养时间菌株Achromobacter sp. ZXH21和Pseudomonas sp. ZXH23耐镉生长情况(A)及菌液pH值的变化(B) Fig. 3 The cadmium tolerance growth(A)and change of bacterial solution pH(B)of strains Achromobacter sp. ZXH21 and Pseudomonas sp. ZXH23 during different cultivation time |
图 4结果表明:2株菌对镉的吸附率明显高于吸收率, 说明2株菌对培养液中镉的去除都以吸附为主, 吸收为辅。2株菌的吸附率与去除率呈相同的趋势。随培养时间增加, 菌株ZXH21对Cd2+吸附率逐渐增大, 72 h前增幅较大, 72 h后增幅减小, 并保持稳定, 168 h时吸附率达到最大值(27.32%); 菌株ZXH23对Cd2+吸附率呈先增大后减小的趋势, 在72 h时吸附率达到最大值(30.58%), 72 h后吸附率逐渐减小。菌株ZXH21吸收率随培养时间先增加后减少, 菌株ZXH23吸收率基本保持不变, 仅在120 h出现明显增加。菌株ZXH21吸收率高于菌株ZXH23(P < 0.05), 且差异显著。
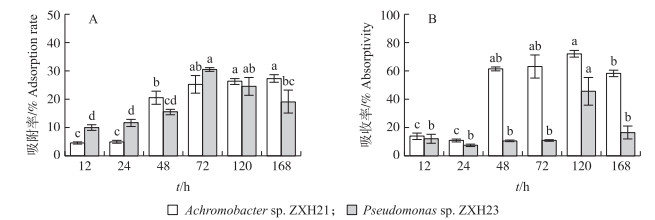
|
图 4 不同培养时间菌株Achromobacter sp. ZXH21和Pseudomonas sp. ZXH23对镉的吸附(A)及吸收(B)动态 Fig. 4 Dynamic characteristics of cadmium adsorption(A)and absorption(B)by Achromobacter sp. ZXH21 and Pseudomonas sp. ZXH23 during different cultivation time |
随培养时间的增加, 2株菌产生的可溶性蛋白和不可溶性蛋白含量均呈先升高再降低又逐渐升高的趋势(图 5-A、C)。菌株ZXH23的可溶性蛋白含量初期低于菌株ZXH21, 但在培养后期显著高于菌株ZXH21, 均在168 h时达最高。培养初期菌株ZXH23不可溶性蛋白含量显著高于菌株ZXH21, 168 h时菌株ZXH21显著高于菌株ZXH23, 且均在72 h达到最大。
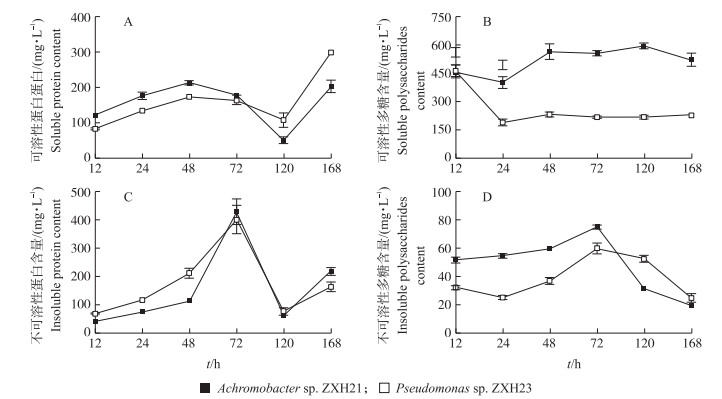
|
图 5 不同培养时间Achromobacter sp. ZXH21和Pseudomonas sp. ZXH23合成的胞外聚合物(EPS)组分及其含量 Fig. 5 Extracellular polymeric substances(EPS)components and contents synthesized by Achromobacter sp. ZXH21 and Pseudomonas sp. ZXH23 during different cultivation time |
在整个培养过程中, 菌株ZXH21产生的可溶性多糖含量明显高于菌株ZXH23, 且差异显著(图 5-B)。培养24 h前, 2株菌产生的可溶性多糖含量逐渐降低, 之后逐渐增加至基本稳定。2株菌产生的不可溶性多糖含量随培养时间增加逐渐增加, 在72 h时达到最大, 分别为75和59.91 mg·L-1, 72 h前菌株ZXH21不可溶多糖含量显著高于菌株ZXH23, 72 h后逐渐降低, 菌株ZXH23不可溶性多糖含量显著高于菌株ZXH21(图 5-D)。
2.5 2株菌不同指标间的相关性分析从表 1可知:菌株ZXH21对镉的去除率、吸附率、吸收率与D600、pH值、可溶性多糖极显著正相关, 与不可溶性蛋白显著正相关, 与不可溶性多糖负相关(P>0.05);去除率及吸附率与可溶性蛋白呈正相关关系, 吸收率与可溶性蛋白呈显著负相关关系。
| D600 | pH值 pH value |
可溶性蛋白含量 Soluble protein content |
可溶性多糖含量 Soluble polysaccharides content |
不可溶性蛋白含量 Insoluble protein content |
不可溶性多糖含量 Insoluble polysaccharides content |
|
| 去除率 Removal rate |
0.742** | 0.928** | 0.013 | 0.771** | 0.482* | -0.291 |
| 吸附率 Adsorption rate |
0.731** | 0.901** | 0.014 | 0.767** | 0.491* | -0.273 |
| 吸收率 Absorptivity |
0.718** | 0.880** | -0.051 | 0.845** | 0.422* | -0.169 |
| Note:*P < 0.05, **P < 0.01. The same as follows. | ||||||
从表 2可知:菌株ZXH23对镉的去除率、吸附率、吸收率只与pH值极显著正相关, 而与D600负相关, 且吸收率与D600极显著负相关; 去除率与不可溶性蛋白、不可溶性多糖极显著正相关, 与可溶性多糖极显著负相关; 吸附率与不可溶性蛋白、不可溶性多糖极显著正相关, 与可溶性多糖显著负相关。
| D600 | pH值 pH value |
可溶性蛋白含量 Soluble protein content |
可溶性多糖含量 Soluble polysaccharides content |
不可溶性蛋白含量 Insoluble protein content |
不可溶性多糖含量 Insoluble polysaccharides content |
|
| 去除率 Removal rate |
-0.262 | 0.723** | 0.302 | -0.529** | 0.530** | 0.638** |
| 吸附率 Adsorption rate |
-0.153 | 0.562** | 0.146 | -0.413* | 0.585** | 0.684** |
| 吸收率 Absorptivity |
-0.553** | 0.522** | -0.198 | -0.131 | -0.292 | 0.383 |
微生物修复技术治理重金属污染一直是国内外学者的研究热点, 其在治理水体重金属污染领域有极大的应用前景。目前, 耐镉微生物的筛选有很多报道。沈秋悦等[24]筛选的芽胞杆菌耐受镉最高质量浓度为50 mg·L-1, Zhang等[25]筛选得到具有镉耐性的乳酸菌, 耐镉能力达1 000 mg·L-1, 对镉的吸附率达31.34%。本研究筛选的菌株ZXH21和ZXH23均对镉有较好的耐性, 对镉的耐受质量浓度均达600 mg·L-1, 50 mg·L-1镉溶液72 h的去除率超过30%, 相比同类文献耐镉能力和去除能力处于中等水平。
本研究表明, 2株菌对镉离子的去除都以吸附为主, 吸收为辅。菌株ZXH21和ZXH23对镉的去除率最大值分别为36.5%和33.7%, 差异不显著, 但二者吸附率和吸收率不相同, 菌株ZXH21吸收率在48 h时迅速增加, 菌株ZXH23吸收率基本不变, 仅在120 h时显著增加, 且72 h时菌株ZXH21对镉的吸收率为菌株ZXH23的6倍。同时, 2株菌的吸附率和吸收率随培养时间逐渐变化, 菌株ZXH23的吸附率在72 h达最大值(30.58%), 之后逐渐减小, 菌株ZXH21的吸附率随时间逐渐增加, 在168 h时显著高于菌株ZXH23。
菌株ZXH21对镉的去除率、吸附率和吸收率均与D600值显著正相关, 而菌株ZXH23的去除率、吸附率和吸收率与D600值显著负相关, 说明对菌株ZXH21来说, 增加生物量是其对镉去除的主要机制。菌株ZXH23主要依靠表面吸附及阴离子电荷吸附等作用。菌株ZXH23在120 h后菌体基本自溶, 却仍然有较高的镉去除率, 是因为菌株ZXH23自溶后破裂的菌体暴露出更大的表面积及更多的吸附位点, 镉与细胞自溶物及细胞碎片结合, 依靠表面吸附及阴离子电荷吸附等作用, 提高了对镉的去除率。汤岳琴等[26]研究表明, 细胞自溶后铅仍然会与细胞碎片及细胞自溶物结合形成沉积物, 继续保持吸附去除能力。菌株ZXH23在120 h时吸收率较高, 是因为胁迫培养刺激了存活菌体抗性机制的运行, 提高菌株抗性的同时促进了胞内对镉的吸收。刘红娟等[27]研究表明, 重金属胁迫培养时, 菌株对重金属的抗性增强, 促进菌体内重金属的吸收积累。Mielniczki-Pereira等[28]研究表明, 培养液中金属离子浓度升高会促进金属离子向胞内转移, 增加胞内吸收率。
EPS对重金属的吸附及吸收起重要作用。镉胁迫下, 2株菌的EPS组分及产量随培养时间增加呈不同的趋势。48 h前, 菌株ZXH21和ZXH23的可溶性蛋白含量逐渐增多, 72 h前, 不可溶性蛋白和不可溶性多糖含量逐渐增多, 说明2株菌在初期为适应镉毒害环境会分泌EPS以保护细胞。微生物在重金属毒害下会应激产生EPS等分泌物阻挡毒害作用[29]。菌株ZXH21的可溶性多糖含量显著高于菌株ZXH23, 可能与菌株ZXH21的自身特有性质有关。菌株ZXH21对镉的去除率、吸附率和吸收率与可溶性多糖含量显著正相关, 说明可溶性多糖主要参与了对镉的吸附沉淀和胞内吸收。菌株ZXH23对镉的去除率和吸附率与可溶性多糖含量呈显著负相关关系, 与不可溶性多糖和不可溶性蛋白含量呈显著正相关关系, 说明不可溶性多糖和不可溶性蛋白可能是菌株ZXH23对镉去除的主要因素。张海欧等[30]研究表明, 深海菌株SCSE425-7通过分泌可溶性胞外多糖对镉有较高的抗性及去除能力, 而菌株SCSE709-6则通过分泌不可溶性蛋白和不可溶性多糖促进对镉的吸附去除, 本研究与其结果类似。
综上所述, 本研究筛选的2株菌均对镉有较强的耐受能力, 菌株ZXH21比菌株ZXH23有更强的耐镉生长特性及稳定的去除潜力。菌株ZXH21和菌株ZXH23在生长状态下对镉的去除机制不同, 菌株ZXH21去除镉的主要机制是生物量的增加以及分泌可溶性多糖, 菌株ZXH23去除镉的主要机制可能是表面吸附以及分泌不可溶性蛋白和不可溶性多糖。
| [1] |
Fu J, Xie X, Qian L, et al. Cadmium tolerance and bio-accumulation mechanisms of ralstonia pickettii strain DX-T3-01[J]. Chinese Journal of Applied & Environmental Biology, 2011, 17(5): 717-721. |
| [2] |
李倩, 张平, 廖柏寒, 等. 一株耐Cd菌株的分离、鉴定及基本特性[J]. 微生物学报, 2019, 59(1): 11-24. Li Q, Zhang P, Liao B H, et al. Isolation, identification and basic characteristics of a Cd-resistant strain[J]. Journal of Microbiology, 2019, 59(1): 11-24 (in Chinese with English abstract). |
| [3] |
Crisafi F, Genovese M, Smedile F, et al. Bioremediation technologies for polluted seawater sampled after an oil-spill in Taranto Gulf(Italy):a comparison of biostimulation, bioaugmentation and use of a washing agent in microcosm studies[J]. Marine Pollution Bulletin, 2016, 106(1/2): 119-126. |
| [4] |
Al-Gheethi A A S, Lalung J, Noman E A, et al. Removal of heavy metals and antibiotics from treated sewage effluent by bacteria[J]. Clean Technologies and Environmental Policy, 2015, 17(8): 2101-2123. DOI:10.1007/s10098-015-0968-z |
| [5] |
张兴梅, 杨清伟, 李扬. 土壤镉污染现状及修复研究进展[J]. 河北农业科学, 2010, 14(3): 79-81. Zhang X M, Yang Q W, Li Y. Research progress on cadmium pollution and remediation in soils[J]. Journal of Hebei Agricultural Sciences, 2010, 14(3): 79-81 (in Chinese with English abstract). DOI:10.3969/j.issn.1088-1631.2010.03.030 |
| [6] |
Li C, Jiang W, Ma N, et al. Bioaccumulation of cadmium by growing Zygosaccharomyces rouxii and Saccharomyces cerevisiae[J]. Bioresource Technology, 2014, 155(2): 116-121. |
| [7] |
Zhao Y, Yao J, Yuan Z, et al. Bioremediation of Cd by strain GZ-22 isolated from mine soil based on biosorption and microbially induced carbonate precipitation[J]. Environmental Science and Pollution Research, 2017, 24(1): 372-380. |
| [8] |
郭山, 桂恒俊, 陈翩, 等. 凤眼莲根际耐Cd、Zn细菌的分离鉴定及对Cd、Zn去除效果研究[J]. 农业环境科学学报, 2018, 37(3): 530-537. Guo S, Gui H J, Chen P, et al. Isolation and identification of Cd-and Zn-tolerant bacteria from the rhizosphere of water hyacinth and their removal effects on Cd and Zn[J]. Journal of Agricultural Environmental Sciences, 2018, 37(3): 530-537 (in Chinese with English abstract). |
| [9] |
徐粲然, 卢滇楠, 刘永民. 生物钝化修复镉污染土壤研究进展[J]. 化工进展, 2014, 33(8): 2174-2179. Xu C R, Lu D N, Liu Y M. Advances in biopassivation for remediation of cadmium-contaminated soils[J]. Progress in Chemical Engineering, 2014, 33(8): 2174-2179 (in Chinese with English abstract). |
| [10] |
李学龙, 刘国丽, 李超, 等. 蜡样芽胞杆菌菌体及其胞外聚合物对Cd2+的吸附作用[J]. 江苏农业学报, 2018, 34(2): 327-332. Li X L, Liu G L, Li C, et al. Adsorption of Cd2+ by Bacillus cereus and its extracellular polymers[J]. Jiangsu Agricultural Journal, 2018, 34(2): 327-332 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2018.02.015 |
| [11] |
Sheng G P, Yu H Q, Li X Y. Extracellular polymeric substances(EPS)of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [12] |
Ledin M. Accumulation of metals by microorganisms:processes and importance for soil systems[J]. Earth Science Reviews, 2000, 51(1): 1-31. |
| [13] |
彭书传, 虞艳云, 万正强, 等. 硫酸盐还原菌胞外聚合物(EPS)去除重金属离子Cd2+过程中的交互作用研究[J]. 南京大学学报(自然科学版), 2013, 49(6): 718-724. Peng S C, Yu Y Y, Wan Z Q, et al. Interaction in the removal of heavy metal ions Cd2+ by sulfate-reducing bacterial extracellular polymer(EPS)[J]. Journal of Nanjing University(Natural Science Edition), 2013, 49(6): 718-724 (in Chinese with English abstract). |
| [14] |
Pérez J A M, García-Ribera R, Quesada T, et al. Biosorption of heavy metals by the exopolysaccharide produced by Paenibacillus jamilae[J]. World Journal of Microbiology & Biotechnology, 2008, 24(11): 2699. |
| [15] |
Ye S H, Ma Z Y, Liu Z F, et al. Effects of carbohydrate sources on biosorption properties of the novel exopolysaccharides produced by Arthrobacter ps-5[J]. Carbohydrate Polymers, 2014, 112: 615-621. DOI:10.1016/j.carbpol.2014.05.076 |
| [16] |
Roane T M, Pepper I L. Microbial responses to environmentally toxic cadmium[J]. Microbial Ecology, 1999, 38(4): 358-364. DOI:10.1007/s002489901001 |
| [17] |
Hrynkiewicz K, Złoch M, Kowalkowski T, et al. Strain-specific bioaccumulation and intracellular distribution of Cd2+ in bacteria isolated from the rhizosphere, ectomycorrhizae, and fruitbodies of ectomycorrhizal fungi[J]. Environmental Science & Pollution Research, 2015, 22(4): 3055. |
| [18] |
Singh S, Singh A, Bashri G, et al. Impact of Cd stress on cellular functioning and its amelioration by phytohormones:an overview on regulatory network[J]. Plant Growth Regulation, 2016, 80(3): 253-263. DOI:10.1007/s10725-016-0170-2 |
| [19] |
董明, 宋卫锋, 程亚杰. 苯胺黑药高效降解菌(Bacillus vallismortis)胞外聚合物去除重金属的研究[J]. 环境科学学报, 2016, 36(12): 4367-4375. Dong M, Song W F, Cheng Y J. Studies on the removal of heavy metals by extracellular polymers of Bacillus vallismortis[J]. Journal of Environmental Sciences, 2016, 36(12): 4367-4375 (in Chinese with English abstract). |
| [20] |
吴海江, 冯侠, 郭红光, 等. 耐Cd细菌的筛选及富集作用研究[J]. 江西农业学报, 2011, 23(11): 175-177. Wu H J, Feng X, Guo H G, et al. Screening and enrichment of Cd-resistant bacteria[J]. Jiangxi Agricultural Journal, 2011, 23(11): 175-177 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-8581.2011.11.054 |
| [21] |
Li X Y, Yang S F. Influence of loosely bound extracellular polymeric substances(EPS)on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41(5): 1022-1030. |
| [22] |
Xu J, Sheng G P, Ma Y, et al. Roles of extracellular polymeric substances(EPS)in the migration and removal of sulfamethazine in activated sludge system[J]. Water Research, 2013, 47(14): 5298-5306. DOI:10.1016/j.watres.2013.06.009 |
| [23] |
刘美, 王湛. 胞外聚合物对膜污染的影响[J]. 水处理技术, 2007, 33(10): 7-13. Liu M, Wang Z. Effects of extracellular polymeric substances on membrane fouling[J]. Water Treatment Technology, 2007, 33(10): 7-13 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-3770.2007.10.003 |
| [24] |
沈秋悦, 曹志强, 朱月芳, 等. 一株耐镉细菌的分离鉴定及其吸附条件的优化[J]. 土壤, 2016, 48(3): 615-620. Shen Q Y, Cao Z Q, Zhu Y F, et al. Isolation and identification of a cadmium-tolerant bacterium and optimization of its adsorption conditions[J]. Soils, 2016, 48(3): 615-620 (in Chinese with English abstract). |
| [25] |
Zhang W L, Du Y, Zhai M M, et al. Cadmium exposure and its health effects:a 19-year follow-up study of a polluted area in China[J]. Science of the Total Environment, 2014, 470/471: 224-228. DOI:10.1016/j.scitotenv.2013.09.070 |
| [26] |
汤岳琴, 牛慧, 林军, 等. 产黄青霉废菌体对铅的吸附机理(Ⅱ)——铅生物吸附途径和吸附类型的确定[J]. 工程科学与技术, 2001, 33(4): 45-49. Tang Y Q, Niu H, Lin J, et al. Adsorption mechanism of lead by waste Penicillium chrysogenum(Ⅱ):determination of lead biosorption pathway and type[J]. Engineering Science and Technology, 2001, 33(4): 45-49 (in Chinese with English abstract). |
| [27] |
刘红娟, 党志, 张慧, 等. 蜡状芽孢杆菌抗重金属性能及对镉的累积[J]. 农业环境科学学报, 2010, 29(1): 25-29. Liu H J, Dang Z, Zhang H, et al. Heavy metal resistance and cadmium accumulation of Bacillus cereus[J]. Journal of Agro-Environment Science, 2010, 29(1): 25-29 (in Chinese with English abstract). |
| [28] |
Mielniczki-Pereira A A, Ana A B B, Bonatto D, et al. New insights into the Ca2+-ATPases that contribute to cadmium tolerance in yeast[J]. Toxicology Letters, 2011, 207(2): 104-111. |
| [29] |
Joshi N, Ngwenya B T, French C E. Enhanced resistance to nanoparticle toxicity is conferred by over production of extracellular polymeric substances[J]. Journal of Hazardous Materials, 2012, 241/242: 363-370. DOI:10.1016/j.jhazmat.2012.09.057 |
| [30] |
张海欧, 周维芝, 马玉洪, 等. 微生物胞外聚合物对重金属镉的解毒作用及红外光谱分析[J]. 光谱学与光谱分析, 2013, 33(11): 3041-3043. Zhang H O, Zhou W Z, Ma Y H, et al. Detoxification and infrared spectroscopy of microbial extracellular polymers on heavy metal cadmium[J]. Spectroscopy and Spectroscopy Analysis, 2013, 33(11): 3041-3043 (in Chinese with English abstract). DOI:10.3964/j.issn.1000-0593(2013)11-3041-03 |




