文章信息
- 武德亮, 范文越, 马志欣, 殷宪超, 谢彦杰
- WU Deliang, FAN Wenyue, MA Zhixin, YIN Xianchao, XIE Yanjie
- 渗透和干旱胁迫下H2S供体硫氢化钠对豆类植物生长及生理特性的影响
- Effects of H2S donor sodium hydrosulfide on the growth and physiological characteristics of legumes under osmotic and drought stress
- 南京农业大学学报, 2019, 42(5): 862-868
- Journal of Nanjing Agricultural University, 2019, 42(5): 862-868.
- http://dx.doi.org/10.7685/jnau.201904058
-
文章历史
- 收稿日期: 2019-04-27
2. 江苏省农业科学院农产品质量安全与营养研究所, 江苏 南京 210014
2. Institute of Food Quality and Nutrition, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
干旱是威胁全球经济作物生产的主要环境压力[1]。我国是全球干旱半干旱地区面积较大的国家, 每年因干旱导致约860万hm2农田受灾, 1.00×1011 kg以上粮食减产, 造成高额的经济损失[2-3]。因此, 如何提高植物抗旱性成为热门课题。H2S是一种新型的气体信号分子, 参与调节动物神经系统、心血管系统和呼吸系统及疾病防治[4-5], 参与调节植物气孔运动[6]、花的衰老及豌豆的胚根伸长等[7-8]。作为一种新型的植物气体信号分子, H2S具有用量少、价格低廉等特点, 备受人们青睐。研究H2S对植物抗旱性能的影响及作用具有重要意义。
Li等[9]研究发现, NaHS预处理通过诱导烟草悬浮培养细胞内水溶性巯基化合物含量增加及抗氧化酶活性提高, 以增强其耐热性。在水稻中, H2S一方面通过提高叶绿素、类胡萝卜素和可溶性蛋白质含量以及减少活性氧(reactive oxygen species, ROS)积累, 降低盐胁迫对植物造成的氧化损伤; 另一方面通过减少根组织对Na+的吸收及降低Na+/K+值来重建离子平衡, 从而缓解盐害[10]。张丽萍等[11]发现H2S可以通过降低白菜根组织丙二醛(MDA)含量、相对电导率和促进渗透调节物质如可溶性糖、脯氨酸的合成, 缓解镉(Cd)对幼苗的毒害。另外, Fang等[12]研究过量的金属铬离子(Cr6+)可以诱导拟南芥通过钙/钙调蛋白2(Ca2+/CaM2)途径, 提高H2S合成的关键酶L-半胱氨酸脱氢酶(L-cysteine dehydrothiolase, LCD)的转录水平, 进而促进内源H2S的产生, 达到缓解重金属胁迫的效果。也有研究表明, H2S在植物抗旱性中发挥重要作用, 如H2S通过调节多胺(polyamine, PA)和可溶性糖的生物合成来增强菠菜的耐旱性[13]; H2S能提高小麦相对含水量(relative water content, RWC), 减少硫代巴比妥酸反应物(thiobarbituric acid reactive substances, TBARS)和过氧化氢(H2O2)含量, 提高超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性, 从而降低干旱造成的氧化损伤[14]; 在小麦种子萌发过程中, NaHS可以增强种子体内淀粉酶和酯酶活性, 减少H2O2和MDA含量, 进而缓解渗透胁迫对种子萌发的抑制[15]; 干旱胁迫能提高LCD的表达水平, 促进内源H2S的产生, 同时外源H2S可以缓解干旱对拟南芥造成的损害[16]。综上, H2S可以广泛参与植物抗逆的各个生命活动过程中, 维持逆境条件下植物内环境稳态平衡及正常生理生化反应, 从而增强植物在逆境条件下的生存能力。
本文以绿豆和红小豆为材料, 通过外源H2S供体NaHS进行预处理, 研究H2S对渗透和干旱胁迫下绿豆和红小豆的种子发芽率、发芽指数和幼苗鲜质量、RWC和相对叶绿素含量的影响。同时, 获得NaHS溶液的最佳浓度, 为后期H2S的具体应用提供基础理论数据。
1 材料与方法 1.1 试验材料与试剂绿豆品种为:‘苏绿2号’‘苏抗3号’; 红小豆品种为:‘苏红2号’‘苏红3号’, 均由江苏省农业科学院提供。NaHS购自Sigma公司, PEG-6000购自南京峥阳生物科技有限公司。
1.2 试验方法 1.2.1 萌发期种子的培养与处理挑取颗粒饱满的种子, 5%(体积分数)次氯酸钠消毒10~15 min后, 用自来水冲洗至无次氯酸钠气味。分别将种子浸泡于0、0.01、0.05、0.1、0.4和1.6 mmol·L-1 NaHS溶液中6~12 h。将预处理的种子放置于含10~15 mL的PEG-6000的培养皿中。分别设置处理:L0-Control、0-PEG、0.01-PEG、0.05-PEG、0.1-PEG、0.4-PEG和1.6-PEG。0-Control为未处理对照; 0-PEG、0.01-PEG、0.05-PEG、0.1-PEG、0.4-PEG和1.6-PEG分别表示0、0.01、0.05、0.1、0.4和1.6 mmol·L-1 NaHS溶液处理的种子在PEG-6000渗透胁迫下的处理。绿豆使用250 g·L-1的PEG-6000;红小豆使用200 g·L-1的PEG-6000。以上处理均转移至25 ℃暗培养箱中, 连续培养12~96 h, 测定其发芽率、芽长及发芽指数等[15]。
1.2.2 植物幼苗培养与处理将消毒后的种子放置于25 ℃恒温暗培养箱中催芽24 h。将催芽后的种子播种于含50 g营养土(营养土、蛭石的质量比为1:3)的盆钵中, 每盆播种5~7颗种子, 并向其中浇入充足的1/2 Hoagland营养液。放置于25 ℃恒温光照培养箱中, 培养至2叶1心。
用0、0.01、0.05、0.1、0.4和1.6 mmol·L-1 NaHS的营养液分别预处理幼苗, 连续处理5 d, 之后正常浇灌营养液(Control)或干旱处理(Drought), 干旱组停止浇灌营养液12~13 d。设置处理分别为0-Control、0.01-Control、0.05-Control、0.1-Control、0.4-Control、1.6-Control; 0-Drought、0.01-Drought、0.05-Drought、0.1-Drought、0.4-Drought、1.6-Drought, 干旱结束后测定相关生理生化指标[16]。
1.2.3 发芽率、发芽指数及芽长的测定种子培养24或48 h后, 观察不同处理种子的发芽情况并记录发芽数, 芽长大于种子大小50%的视为发芽。用数显游标卡尺测量芽长[17-18]。种子发芽率=发芽结束期发芽种子数/供试种子数×100%;发芽指数=发芽总数/发芽时间。
1.2.4 鲜质量的测定干旱结束后, 用分析天平称量幼苗的鲜质量, 每个处理选取9株, 记录数据, 每个重复3次。
1.2.5 叶片相对叶绿素含量的测定用手持叶绿素仪(SPAD-502)测量每株叶片的叶绿素相对含量, 以SPAD值作为测定指标。测定前, 将手持叶绿素仪准确调零, 测量时, SPAD值大于50视为不可靠数据, 每片叶片测量3次(不同部位)取平均值, 每个处理测量10片叶片, 试验重复3次[19]。
1.2.6 叶片相对含水量的测定采用饱和法[20]测定相对含水量(RWC):将干旱后的叶片剪下, 称量其鲜质量, 放入去离子水中浸泡2~4 h后, 称其饱和鲜质量, 再放入取样袋中, 于50~60 ℃烘箱中, 连续烘干36~48 h, 称其干质量。RWC=(鲜质量-干质量)/(饱和鲜质量-干质量)×100%。
1.3 数据分析与处理所有试验数据均由3次平行试验数据的平均值来表示, 用SPSS 16.0软件进行数据的统计分析, 用Duncan’s多重测验方法进行数据差异性检验。
2 结果与分析 2.1 NaHS对渗透胁迫下豆类植物种子萌发的影响从图 1和表 1可知:在非渗透胁迫(0-Control)下, ‘苏绿2号’‘苏抗3号’‘苏红2号’和‘苏红3号’种子的发芽率、发芽指数及芽长等生理指标均处于较高水平。在渗透胁迫(PEG)下4个品种的种子发芽率、发芽指数及芽长明显减少。与单独渗透胁迫(0-PEG)相比, NaHS预处理后的种子发芽率均有不同程度的提高, 在预处理24 h且浓度分别为0.1和0.05 mmol·L-1时, ‘苏绿2号’和‘苏抗3号’的种子萌发率和发芽指数增加极显著, 发芽率分别增加了21.99%和30.01%, 发芽指数分别增加了5.5和7.5;当0.1和0.05 mmol·L-1 NaHS预处理36 h时, ‘苏绿2号’和‘苏抗3号’的芽长分别增加了9.27(P < 0.01)和12.93 mm(P < 0.05)。

|
图 1 NaHS对渗透胁迫下4个品种豆类植物种子萌发的影响 Fig. 1 Effect of NaHS on seed germination of four legume varieties under osmotic stress |
| 品种 Variety |
测定指标 Measurement index |
处理 Treatment |
||||||
| 0-Control | 0-PEG | 0.01-PEG | 0.05-PEG | 0.1-PEG | 0.4-PEG | 1.6-PEG | ||
| 12 h发芽率/% Germination rate in 12 h | 62.00±7.21** | 30.00±2.00 | 32.00±2.00** | 36.66±2.31** | 45.33±1.15** | 22.00±3.46 | 28.66±1.14 | |
| 苏绿2号 | 24 h发芽率/% Germination rate in 24 h | 86.00±4.00** | 57.33±4.16 | 62.00±2.00* | 65.34±1.15** | 79.32±3.05** | 65.33±5.03** | 73.33±3.04** |
| Sulü 2 | 36 h芽长/mm Shoot length in 36 h | 26.01±2.41** | 12.16±1.13 | 18.09±3.60** | 13.14±2.76 | 21.43±3.58** | 17.68±1.19** | 15.98±1.53** |
| 发芽指数 Germination index |
21.50±1.00** | 14.33±1.04 | 15.50±0.50* | 16.33±0.28** | 19.83±0.76** | 16.34±1.25** | 18.33±0.76** | |
| 12 h发芽率/% Germination rate in 12 h | 48.00±4.21** | 9.33±1.15 | 17.33±1.15** | 24.00±4.00** | 10.67±3.05 | 14.00±2.00* | 10.00±2.00 | |
| 苏抗3号 | 24 h发芽率/% Germination rate in 24 h | 84.00±3.46** | 32.66±3.05 | 49.33±1.15** | 62.67±3.15** | 53.33±3.10** | 46.68±3.20** | 41.33±1.13** |
| Sukang 3 | 36 h芽长/mm Shoot length in 36 h | 46.68±1.85** | 15.05±2.21 | 18.81±1.62* | 27.98±1.69* | 15.92±0.92 | 19.15±1.14* | 15.59±3.07 |
| 发芽指数 Germination index |
21.00±0.86** | 8.16±0.76 | 12.33±0.28** | 15.66±0.77** | 13.33±0.74** | 11.66±0.78** | 10.33±0.30** | |
| 48 h发芽率/% Germination rate in 48 h | 73.33±3.81** | 23.43±2.88 | 19.16±3.80 | 18.33±3.82 | 37.50±5.00** | 29.67±3.03* | 35.00±4.03** | |
| 苏红2号 | 72 h发芽率/% Germination rate in 72 h | 89.16±5.02** | 47.50±3.61 | 36.67±2.88 | 50.83±3.81 | 68.33±2.80** | 46.66±1.27 | 54.16±2.68* |
| Suhong 2 | 96 h芽长/mm Shoot length in 96 h | 26.12±2.34** | 12.35±1.33 | 9.72±0.76 | 15.99±0.90* | 16.28±1.97* | 8.24±0.85 | 12.30±1.31 |
| 发芽指数 Germination index |
11.89±0.69** | 6.33±0.88 | 4.88±0.38 | 6.77±0.50 | 9.11±0.36** | 6.23±1.50 | 7.21±0.33* | |
| 48 h发芽率/% Germination rate in 48 h | 69.16±3.29** | 12.50±2.50 | 20.00±2.51** | 35.83±1.44** | 24.16±1.40** | 20.83±1.41** | 15.85±1.45** | |
| 苏红3号 | 72 h发芽率/% Germination rate in 72 h | 79.16±3.81** | 27.50±2.50 | 35.00±2.47** | 52.50±2.55** | 39.17±1.44** | 31.67±2.89** | 37.50±2.53** |
| Suhong 3 | 96 h芽长/mm Shoot length in 96 h | 24.02±4.51* | 11.60±1.63 | 15.21±1.71* | 18.91±3.18* | 13.65±1.06* | 15.94±1.52* | 10.45±0.92 |
| 发芽指数 Germination index |
10.56±0.51** | 3.67±0.33 | 4.66±0.30** | 7.00±0.32** | 5.22±0.19** | 4.22±0.38** | 5.00±0.33** | |
| 注:0-Control:未处理Untreated; 0-PEG、0.01-PEG、0.05-PEG、0.1-PEG、0.4-PEG和1.6-PEG分别表示经0、0.01、0.05、0.1、0.4和1.6 mmol·L-1 NaHS溶液处理的种子在渗透胁迫下的处理。0-PEG, 0.01-PEG, 0.05-PEG, 0.1-PEG, 0.4-PEG and 1.6-PEG respectively represent treatments of seeds treated with 0, 0.01, 0.05, 0.1, 0.4 and 1.6 mmol·L-1 NaHS solution under osmotic stress.*P < 0.05, **P < 0.01。 | ||||||||
在72 h时, 0-Control处理的‘苏红2号’和‘苏红3号’种子可以正常发芽, 在PEG处理下显著抑制种子萌发。经不同浓度NaHS溶液预处理后的种子与0-PEG处理相比, 0.01 mmol·L-1的NaHS溶液对渗透胁迫下红小豆种子的萌发没有促进作用, 0.4-PEG和1.6-PEG处理红小豆种子的萌发出现无规则变化。0.05-PEG和0.1-PEG处理的‘苏红2号’和‘苏红3号’种子与0-PEG处理相比发芽效果较好。0.1-PEG处理‘苏红2号’72 h发芽率及发芽指数与0-PEG处理相比分别增加了20.83%和2.78, 96 h时, 芽长增加了3.93 mm; 0.05-PEG处理‘苏红3号’72 h发芽率及发芽指数与0-PEG处理相比分别增加了25.00%和3.33, 96 h时, 芽长增加了7.31 mm。
2.2 NaHS对干旱胁迫下豆类植物生长的影响从图 2可知:干旱胁迫与非干旱胁迫相比, 干旱显著抑制4个品种豆类植物的生长。在非干旱条件下, 不同浓度NaHS预处理的4个品种植物的生长状态与单独非干旱对照(0-Control)相比长势相似。干旱处理时, 与其单独干旱对照(0-Drought)相比, NaHS改善4个品种材料的生长状态, 在NaHS浓度为0.1和0.05 mmol·L-1时改善效果较好。干旱胁迫下, 0-Drought处理的叶片明显萎蔫、干枯, 而在0.1和0.05 mmol·L-1 NaHS溶液下, 其叶片的萎蔫程度明显降低, 叶片只有极少部分黄化。
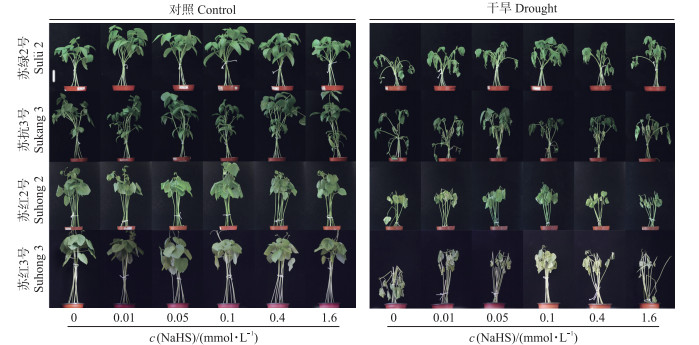
|
图 2 NaHS对干旱胁迫下4个品种豆类植物生长的影响 Fig. 2 Effects of NaHS on the growth of four legume varieties under drought stress |
从图 3可知:与非干旱处理相比, 干旱显著降低4个品种豆类植物的鲜质量。在非干旱时, 与0-Control相比, 0.1 mmol·L-1 NaHS预处理的‘苏绿2号’和‘苏红2号’鲜质量显著提高, ‘苏红3号’的鲜质量无显著性差异, 且不同浓度的NaHS预处理均能提高‘苏抗3号’的鲜质量。在干旱时, 与0-Drought处理相比, 随NaHS浓度的逐渐增加, ‘苏绿2号’‘苏抗3号’‘苏红2号’和‘苏红3号’的鲜质量均呈上升趋势, 当NaHS浓度达到0.05或0.1 mmol·L-1时, 鲜质量均呈下降趋势。当NaHS浓度分别为0.1、0.05、0.1和0.1 mmol·L-1时, 对应的‘苏绿2号’‘苏抗3号’‘苏红2号’和‘苏红3号’的鲜质量分别比0-Drought处理增加0.250、0.473、0.378和0.466 g。
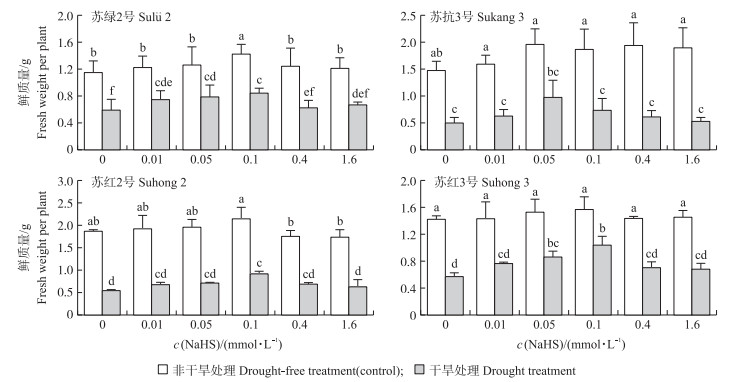
|
图 3 NaHS对干旱胁迫下4个品种豆类植物鲜质量的影响 Fig. 3 Effects of NaHS on fresh weight of four fegume varieties under drought stress 不同字母表示各处理在0.05水平差异显著。下同。 Different letters indicate significant difference of each treatment at 0.05 level. The same as follows. |
从图 4可知:在非干旱条件下, 4个品种豆类植物的叶片均具有较高的RWC。与0-Control相比, 不同浓度的NaHS溶液预处理后其RWC无显著差异。与非干旱相比, 干旱时4个品种豆类植物的RWC显著降低, 不同浓度NaHS预处理后其RWC随浓度的增加不断提高。与0-Drought相比, NaHS溶液浓度分别为0.1、0.05、0.1和0.1 mmol·L-1时, 对应的‘苏绿2号’‘苏抗3号’‘苏红2号’和‘苏红3号’的RWC较高, 分别提高了21.09%、24.87%、25.13%和18.82%。
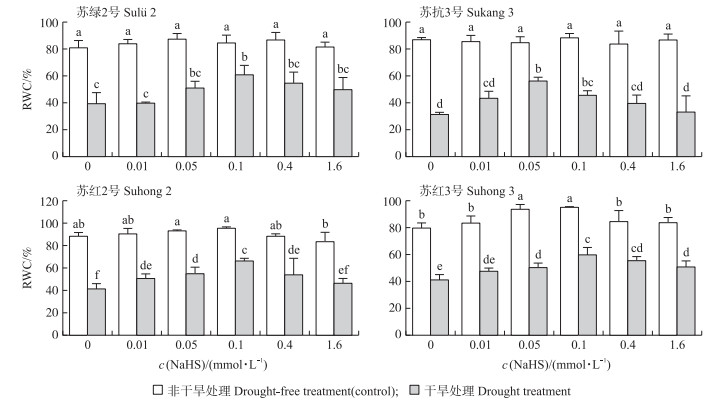
|
图 4 NaHS对干旱胁迫下4个品种豆类植物叶片相对含水量的影响 Fig. 4 Effects of NaHS on relative water content(RWC)of leaves of four legume varieties under drought stress |
非干旱胁迫下, 4个品种豆类植物的叶片并没有出现黄化的现象, 而在干旱时, 4个品种的叶片均出现不同程度的黄化(图 2)。从图 5可知:在非胁迫条件下, 4个品种的SPAD值均具有较高的水平。不同浓度的NaHS溶液预处理, 叶片的黄化程度得到显著缓解。与0-Drought处理相比, 当NaHS浓度分别为0.1、0.05、0.1和0.1 mmol·L-1时, 对应的‘苏绿2号’‘苏抗3号’‘苏红2号’和‘苏红3号’的SPAD值较高, 分别提高了9.29、9.06、7.05和7.26。
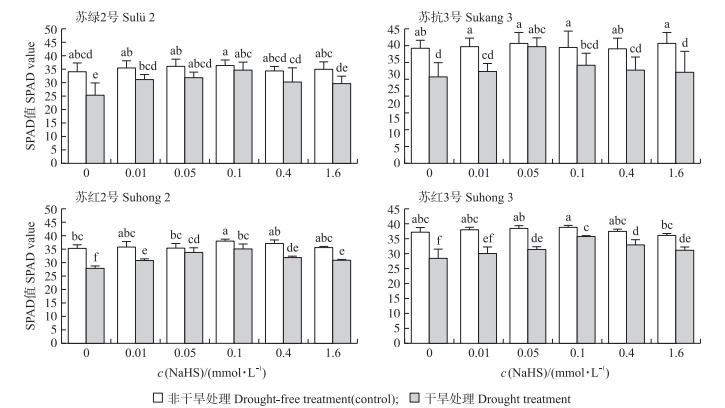
|
图 5 NaHS对干旱胁迫下4个品种豆类植物相对叶绿素含量的影响 Fig. 5 Effects of NaHS on relative chlorophyll content of four legume varieties under drought stress |
干旱严重抑制植物生长发育, 造成农作物产量锐减[21-22]。H2S是近年来发现的一种新型气体信号分子, 广泛参与调节植物的各种生理过程[23-24]。本试验用H2S供体NaHS预处理, 发现H2S可以增强豆类植物的抗旱能力并且获得NaHS的最佳浓度。渗透胁迫抑制种子萌发, 不同浓度NaHS溶液预处理能显著缓解渗透造成的抑制作用。当NaHS浓度为0.05 mmol·L-1时, ‘苏抗3号’和‘苏红3号’的发芽率显著提高; 0.1 mmol·L-1 NaHS能够提高‘苏绿2号’及‘苏红2号’种子的发芽率。另有报道指出, 外源H2S促进花椰菜种子萌发[17]。本研究结果说明适宜浓度的NaHS不仅可以促进正常生长条件的种子萌发, 还能缓解渗透胁迫对种子萌发的抑制作用。
当植株处于幼苗期时, H2S可以通过减缓叶绿素和叶片水分的损失速率, 降低铜对甘薯的氧化损伤[25]。本研究中, 0.05 mmol·L-1 NaHS显著提高干旱胁迫下‘苏抗3号’的鲜质量、SPAD和RWC; NaHS浓度为0.1 mmol·L-1时, ‘苏绿2号’‘苏红2号’和‘苏红3号’的鲜质量、SPAD和RWC均明显提高。上述结果说明, 适宜浓度的NaHS可以提高植物的保水能力, 缓解干旱胁迫造成的物质合成及代谢受阻, 从而增强植物的抗旱性。
综上所述, 干旱胁迫不仅能抑制种子的发芽, 而且通过加速叶片水分的流失, 降低叶绿素含量, 削弱叶肉细胞对光能的捕捉能力从而减弱植物的光合作用, 导致绿豆和红小豆生长发育缓慢。通过施加适宜浓度(0.05或0.1 mmol·L-1)的NaHS溶液, 可以有效缓解因干旱造成的种子生长受阻及幼苗水分流失, 增加幼苗叶片的保水能力, 缓解干旱造成的物质合成及代谢受阻, 使其在干旱胁迫下维持正常的生理功能, 提高植物在干旱胁迫下的生存能力。
| [1] |
Farooq M, Hussain M, Siddique K H M. Drought stress in wheat during flowering and grain-filling periods[J]. Critical Reviews in Plant Sciences, 2014, 33(4): 331-349. DOI:10.1080/07352689.2014.875291 |
| [2] |
方创琳, 张小雷. 干旱区生态重建与经济可持续发展研究进展[J]. 生态学报, 2001, 21(7): 1163-1170. Fang C L, Zhang X L. The progress of ecological reconstruction and economic sustainabledevelopment in arid region[J]. Acta Ecologica Sinica, 2001, 21(7): 1163-1170 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2001.07.020 |
| [3] |
魏志刚, 王玉成. 植物干旱胁迫响应机制[M]. 北京: 科学出版社, 2015. Wei Z G, Wang Y C. Response Mechanism of Drought Stress in Plants[M]. Beijing: Science Press, 2015 (in Chinese). |
| [4] |
Bełtowski J. Hydrogen sulfide in pharmacology and medicine:an update[J]. Pharmacological Reports, 2015, 67(3): 647-658. |
| [5] |
Lu M, Jiang X, Tong L Q, et al. MicroRNA-21-regulated activation of the akt pathway participates in the protective effects of H2S against liver ischemia-reperfusion injury[J]. Biological and Pharmaceutical Bulletin, 2018, 41(2): 229-238. DOI:10.1248/bpb.b17-00769 |
| [6] |
Yamasaki H, Cohen M F. Biological consilience of hydrogen sulfide and nitric oxide in plants:gases of primordial earth linking plant, microbial and animal physiologies[J]. Nitric Oxide, 2016, 55/56: 91-100. DOI:10.1016/j.niox.2016.04.002 |
| [7] |
李东波, 肖朝霞, 刘灵霞, 等. 外源硫化氢对豌豆根尖及其边缘细胞的影响[J]. 植物学报, 2010, 45(3): 354-362. Li D B, Xiao Z X, Liu L X, et al. Effects of exogenous hydrogen sulfide(H2S)on the root tip and root border cells of Pisum sativum[J]. Chinese Bulletin of Botany, 2010, 45(3): 354-362 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-3466.2010.03.007 |
| [8] |
Zhang H, Hu S L, Zhang Z J, et al. Hydrogen sulfide acts as a regulator of flower senescence in plants[J]. Postharvest Biology and Technology, 2011, 60(3): 251-257. DOI:10.1016/j.postharvbio.2011.01.006 |
| [9] |
Li Z G, Long W B, Yang S Z, et al. Involvement of sulfhydryl compounds and antioxidant enzymes in H2S-induced heat tolerance in tobacco(Nicotiana tabacum L.)suspension-cultured cells[J]. In Vitro Cellular & Developmental Biology-Plant, 2015, 51(4): 428-437. |
| [10] |
Mostofa M G, Saegusa D, Fujita M, et al. Hydrogen sulfide regulates salt tolerance in rice by maintaining Na(+)/K(+)balance, mineral homeostasis and oxidative metabolism under excessive salt stress[J]. Frontiers in Plant Science, 2015, 6: 1055. |
| [11] |
张丽萍, 刘志强, 金竹萍, 等. H2S对镉胁迫下白菜幼苗根系渗透胁迫的调节作用[J]. 农业环境科学学报, 2016, 35(2): 247-252. Zhang L P, Liu Z Q, Jin Z P, et al. Regulation of H2S on Cd-induced osmotic stress in roots of Chinese cabbage seedling[J]. Journal of Agro-Environment Science, 2016, 35(2): 247-252 (in Chinese with English abstract). |
| [12] |
Fang H H, Liu Z Q, Long Y P, et al. The Ca2+/calmodulin2-binding transcription factor TGA3 elevates LCD expression and H2 S production to bolster Cr6+ tolerance in Arabidopsis[J]. The Plant Journal, 2017, 91(6): 1038-1050. DOI:10.1111/tpj.13627 |
| [13] |
Chen J, Shang Y T, Wang W H, et al. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings[J]. Frontiers in Plant Science, 2016, 7: 1173. |
| [14] |
Li H, Gao M Q, Xue R L, et al. Effect of hydrogen sulfide on D1 protein in wheat under drought stress[J]. Acta Physiologiae Plantarum, 2015, 37(11): 1-9. |
| [15] |
Zhang H, Wang M J, Hu L Y, et al. Hydrogen sulfide promotes wheat seed germination under osmotic stress[J]. Russian Journal of Plant Physiology, 2010, 57(4): 532-539. |
| [16] |
Jin Z P, Shen J J, Qiao Z J, et al. Hydrogen sulfide improves drought resistance in Arabidopsis thaliana[J]. Biochemical and Biophysical Research Communications, 2011, 414(3): 481-486. DOI:10.1016/j.bbrc.2011.09.090 |
| [17] |
Chen Z, Yang B F, Hao Z K, et al. Exogenous hydrogen sulfide ameliorates seed germination and seedling growth of cauliflower under lead stress and its antioxidant role[J]. Journal of Plant Growth Regulation, 2018, 37(1): 5-15. |
| [18] |
Zhou R W, Zhou R S, Zhang X H, et al. Effects of atmospheric-pressure N2, He, air, and O2 microplasmas on mung bean seed germination and seedling growth[J]. Scientific Reports, 2016, 6: 32603. DOI:10.1038/srep32603 |
| [19] |
董帅, 卢伟, 赵小红, 等. SPAD-502型叶绿素计在估测大面积区域叶绿素含量中的应用[J]. 林业科技情报, 2011, 43(4): 26-27, 29. Dong S, Lu W, Zhao X H, et al. The application of SPAD-502 in the estimation of chlorophyll content in large area[J]. Forestry Science and Technology Information, 2011, 43(4): 26-27, 29 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-3303.2011.04.012 |
| [20] |
García-Mata C, Lamattina L. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4): 977-984. DOI:10.1111/j.1469-8137.2010.03465.x |
| [21] |
Li P, Zhang Y X, Wu X X, et al. Drought stress impact on leaf proteome variations of faba bean(Vicia faba L.)in the Qinghai-Tibet Plateau of China[J]. 3 Biotech, 2018, 8(2): 110. |
| [22] |
贾立国, 陈玉珍, 樊明寿, 等. 干旱对马铃薯光合特性及块茎形成的影响[J]. 干旱区资源与环境, 2018, 32(2): 188-193. Jia L G, Chen Y Z, Fan M S, et al. Influence of drought stress on potato photosynthetic characteristics and tuberization and its possible mechanism[J]. Journal of Arid Land Resources and Environment, 2018, 32(2): 188-193 (in Chinese with English abstract). |
| [23] |
Ge Y, Hu K D, Wang S S, et al. Correction:hydrogen sulfide alleviates postharvest ripening and senescence of banana by antagonizing the effect of ethylene[J]. PLoS One, 2018, 13(1): e0191351. DOI:10.1371/journal.pone.0191351 |
| [24] |
Baba I, Tajima K. Physiological studies on the root of crop plant. Ⅲ. Effect of hydrogen sulphide on the photosynthesis, respiration and ripening of rice plants through root rot[J]. Japanese Journal of Crop Science, 1962, 31(1): 11-14. DOI:10.1626/jcs.31.11 |
| [25] |
Zhang H, Ye Y K, Wang S H, et al. Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling leaves and alleviates oxidative damage against osmotic stress[J]. Plant Growth Regulation, 2009, 58(3): 243-250. |




