文章信息
- 朱文姣, 刘璐, 章甲, 陈敏, 徐玉伟, 杨清
- ZHU Wenjiao, LIU Lu, ZHANG Jia, CHEN Min, XU Yuwei, YANG Qing
- ABA合成基因StNCED2对马铃薯块茎形成的影响
- Effects of over-expressing ABA synthetic gene StNCED2 on potato tuberization
- 南京农业大学学报, 2019, 42(5): 854-861
- Journal of Nanjing Agricultural University, 2019, 42(5): 854-861.
- http://dx.doi.org/10.7685/jnau.201901041
-
文章历史
- 收稿日期: 2019-01-25
马铃薯是目前世界上种植最广泛且食用最多的一种粮食作物。它的块茎富含丰富的营养物质, 如淀粉、维生素和蛋白质等。目前, 提高马铃薯产量的主要方法是通过改进栽培技术和培育新品种。目前, 栽培品种并不满足生产的需要, 因此, 研究人员开始关注马铃薯块茎形成的分子机制, 以期为马铃薯高产育种打下坚实的理论基础。
马铃薯块茎形成经历3个阶段:匍匐茎延伸、匍匐茎向块茎转化、匍匐茎在感知和适应短日照下膨大[1-2]。这个过程受到许多内外源因素的调控。外源因素如氮含量、温度、光等, 块茎形成发生在低氮含量、短日照和冷凉环境中[3]; 内源因素如激素、蔗糖、RNA和Ca2+对块茎形成也非常重要[4-5]。植物激素在块茎形成的不同阶段发挥不同的功能, 并且相互交错形成一个复杂的网络[6]。如赤霉素(GA)抑制匍匐茎向块茎转化, 降低GA含量可以促进块茎形成[7]; 茉莉酸促进块茎膨大, 但不诱导匍匐茎向块茎转化[8]。生长素通过在匍匐茎中累积促进块茎形成[9-10]。细胞分裂素通过促进细胞分裂, 抑制细胞伸长促进块茎形成[11]。乙烯不仅抑制匍匐茎延伸, 而且抑制块茎起始[12]。油菜素甾醇在田间能够提高马铃薯产量[13]。独脚金内酯调控匍匐茎的结构, 抑制次生块茎形成[9, 14]。脱落酸(ABA)作为一种增强植物耐旱和耐高盐的激素, 通过抑制匍匐茎延伸, 诱导其向块茎转化促进块茎形成[15]。大多数研究关注于环境和激素对块茎形成的调控作用及其用于遗传工程的潜在元件[16], 如何利用其改良马铃薯产量还需进一步研究。
施加外源ABA试验和信号元件ABF4、StPP2Ac2b基因过表达研究表明, ABA拮抗GA促进块茎形成[15, 17-18]。Liu等[19]研究发现, 过表达ABA代谢基因StCYP707A1能降低内源ABA的含量, 从而抑制块茎形成[19]。这些研究均表明可以利用遗传工程增加ABA含量来改进马铃薯的产量。因此, 本研究从ABA的合成基因StNCED入手, 已进行StNCED1的过表达遗传转化[20], 以期明确其在马铃薯遗传改造中的作用及机制。
1 材料与方法 1.1 植物材料和生长条件马铃薯(Solanum tuberosum L.)栽培品种‘Desiree’, 由南京农业大学生命科学学院植物分子生物学实验室保存。
以‘Desiree’的试管苗为材料, 其茎段作为外植体。试管苗的繁殖:将带有1个腋芽的茎段扦插在固体MS培养基上(含30 g·L-1蔗糖和8 g·L-1琼脂, pH5.8)于(24±1)℃条件下培养, 光/暗培养时间为12 h/12 h。每4周做1次寄代, 继代条件同上述培养条件。
生根的试管苗转移到混合土(黏土、蛭石、珍珠岩的质量比为1:1:1)里, 于温室中在自然温度和光照条件下生长。采集马铃薯的根、茎、叶、芽、匍匐茎和块茎, 经液氮速冻后, -80 ℃保存, 分别用于基因克隆和表达分析。4周龄的组培苗作为外植体用于遗传转化。
1.2 NCED蛋白系统树的构建通过BLAST比对, 获得不同植物中的NCED蛋白, 利用Clustal X2软件进行序列比较, 再利用MEGA 5.1软件, 以邻接法为原则构建NCED蛋白的系统树。
1.3 基因表达的半定量RT-PCR分析以初始匍匐茎、延伸匍匐茎、膨大匍匐茎(直径2~3 mm)、初始块茎(直径7~8 mm)、成熟块茎(直径大约3 cm)为材料, 测定StNCED1和StNCED2基因在块茎形成中的组织表达水平; 以幼嫩叶片为材料, 用Trizol试剂提取总RNA, 测定ABA受体基因StPYL1和StPYL8的表达水平。参照Prime ScriptTM 1st Strand cDNA synthesis试剂盒(TaKaRa)手册合成第1条cDNA链。以StEF-1α(延伸因子)作为内参, 分别利用特异性引物(表 1)扩增目标基因。PCR反应条件:94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s, 28个循环; 72 ℃10 min。
| 引物名称 Primer name | 引物序列 Primer sequence(5′→3′) | 功能 Function |
| StEF-1α F/StEF-1α R | ATTCAAGTATGCCTGGGTGCT/GTGGTGGAGTCAATAATGAGGAC | 内参基因 Reference gene |
| StNCED1F/StNCED1R | TCTTCTCATTTCCCACCTCT/CCATTGCTGCTGCTTTCTGC | 半定量 RT-PCR Semi-quantitative RT-PCR |
| StNCED2 F/StNCED2 R | CCTTCTCAACTCTCTATTCC/TGCAAAAGTCGACTTATCAA | 半定量 RT-PCR Semi-quantitative RT-PCR |
| StNCED2-F1/StNCED2-R1 | GGTTCATGCTGTCACTGTCG/CGAAAACTCCACGGGCATAG | 实时定量 qRT-PCR Real-time qRT-PCR |
| StNCED2-F2/StNCED2-R2 | GAAGATCTTTCTCATTTCTCCCTTTCTTT/ GGACTAGTACGCCCTTTCTACCCTTCTAAT |
扩增 StNCED2的 cDNA序列 Amplify cDNA sequence of StNCED2 |
| 1304F1/StNCED2 g-R | ATTACGAATATCTGCATCGGCG/TCACGGGTTGGGGTTTCTAC | 鉴定转基因株系中载体和序列的整合 Identify integration of pCAMBIA1304-StNCED2 vector in transgenic lines |
| StPYL1 F/StPYL1 R | CCTTCCTCTCTCTATTTCTT/TCACCTGTGACTTACATCAC | 半定量 RT-PCR Semi-quantitative RT-PCR |
| StPYL8 F/StPYL8 R | GGTTAAAAAGTTGGAAATTT/ACAGGATACACCATACACGC | 半定量 RT-PCR Semi-quantitative RT-PCR |
| StABF1 F/StABF1 R | CCGATTTTCCCTAAGCAGCC/CCACCCATTAGAGCATTGCC | 实时定量 PCR Real-time qRT-PCR |
| StGA20ox1 F/StGA20ox1 R | ATGTCAGAAACCGGAGCTCA/TAGCGCCATAAATGTGTCGC | 实时定量 PCR Real-time qRT-PCR |
| StGA3ox2 F/StGA3ox2 R | CCCGAATCACATGCATGGAG/CCGCACGTTTCCATATCGTT | 实时定量 PCR Real-time qRT-PCR |
| StGA2ox1 F/StGA2ox1 R | CACCATGTCCAGAGTTGCTT/AGTAGGGATCAGGTGGGACT | 实时定量 PCR Real-time qRT-PCR |
| GAMYB F/GAMYB R | GATCACAAACACCCAACGCT/GGTCCTCCAATGAACCTCCA | 实时定量 PCR Real-time qRT-PCR |
| 注:下划线为BglⅡ和SpeⅠ的酶切位点; 酶切位点之前碱基为保护碱基。 Note:Underlined sites are the sequence of BglⅡ and SpeⅠ. The front bases of the restriction site are protective bases. |
||
对照‘Desiree’于温室中生长40 d时, 取其植株叶片材料, 提取总RNA并进行反转合成cDNA。利用特异性引物(表 1)扩增StNCED2的cDNA片段。PCR反应条件:94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 2 min, 30个循环; 72 ℃ 10 min。通过将StNCED2的cDNA序列插入到载体pCAMBIA1304的BglⅡ和SpeⅠ酶切位点之间, 获得StNCED2过表达载体pCAMBIA1304-StNCED2, 然后用冻融法将其导入农杆菌GV3101菌株中。
1.5 马铃薯的遗传转化和植株再生使用生长20 d的马铃薯组培苗茎段外植体进行农杆菌介导的马铃薯转化试验[19-20]。待分化出的芽长到1~2 cm时剪下, 在含50 mg·L-1潮霉素Hyg B的生根筛选培养基上诱导生根筛选, 筛选2~3次后获得完整植株。4周后, 存活的植株转移到温室的盆里生长, 用于后续的转基因鉴定和基因表达分析。
1.6 转基因株系的鉴定以具有潮霉素抗性的马铃薯转化植株和对照组‘Desiree’叶片为材料, 采用CTAB法提取基因组DNA。利用载体和基因的特异序列引物(表 1)扩增预期长度的片段。PCR反应条件:94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 2 min, 32个循环; 72 ℃ 10 min。
1.7 ABA含量测定收集2015年9月种植生长50 d的转基因株系和对照组顶叶向下第4片叶1.0 g, 避光条件下放入预冷的研钵中用液氮研磨成粉末, 加入8 mL预冷的80%(体积分数)甲醇, 研磨至匀浆, 将匀浆转入50 mL离心管, 4 ℃浸提12 h后, 8 000 r·min-1、4 ℃离心15 min, 取上清液转入新的50 mL离心管, 4 ℃保存, 下层残渣加入6 mL预冷的80%甲醇, 继续4 ℃浸提12 h后, 8 000 r·min-1、4 ℃离心15 min, 上清液与第1次收集的上清液混合, 于4 ℃保存, 残渣加入6 mL预冷的80%甲醇进行第3次浸提, 4 ℃浸提12 h后, 8 000 r·min-1、4 ℃离心15 min, 上清液与前2次收集的上清液混合。将上清液在旋转蒸发仪中37 ℃浓缩至水相后, 加入0.2 g聚乙烯吡咯烷酮(PVPP), 摇匀, 4 ℃放置1 h后, 8 000 r·min-1、4 ℃离心15 min, 取上清液至50 mL离心管, 用等体积的乙酸乙酯萃取3次, 合并有机相(上层)于新的50 mL离心管, 在旋转蒸发仪中37 ℃蒸发至干, 用1 mL甲醇溶解, 过0.45 μm有机系超微滤膜, 收集至2 mL离心管中, 4 ℃保存待测。
用甲醇配制内参D6-ABA梯度标准溶液。配制的ABA标准溶液浓度为50、100、200、400和600 μg·mL-1。标准溶液过0.45 μm有机系超微滤膜, 收集至2 mL离心管, 4 ℃保存待测。利用Agilent 1100 HPLC系统进行分析。检测条件:色谱柱为ZORBAX C18(4.6 mm×250 mm, 粒径5 μm), 流动相为甲醇和乙酸(0.6%)的混合液(体积比为45:55), 流速为1 000 μL·min-1, 检测波长为254 nm, 柱温为25 ℃, 进样量为20 μL。
1.8 基因表达的实时定量PCR分析分别以转基因和对照组株系的叶片、膨大匍匐茎、初始块茎和成熟块茎为材料, 采用上述方法提取总RNA, 并合成cDNA, 用于实时定量PCR试验。引物见表 1, 以马铃薯StEF-1α为内参, 并采用20 μL反应体系, 按照SYBR Premix Ex TaqTM(TaKaRa)说明进行操作, PCR反应条件:94 ℃ 1 min; 95 ℃ 15 s, 56 ℃ 20 s, 40个循环。相对表达水平利用公式2-ΔΔCT来计算。每个样品3个重复。
1.9 块茎产量分析分别于2015年9月和2016年3月田间种植过表达株系T1、T7和对照‘Desiree’, 于2015年12月中旬和2016年6月末分别收获每个株系的块茎(至少10株), 栽培与管理条件相同。收获时, 2015年每个株系选10株苗, 2016年每个株系选15株苗, 并记录薯块质量和单株薯块数量。
1.10 数据分析采用Excel 2010软件进行数据统计分析, 数值为平均值±标准误。采用学生双尾t测验进行差异显著性分析。
2 结果与分析 2.1 马铃薯中StNCED1和StNCED2的系统进化树分析马铃薯中2个ABA合成NCED基因(StNCED1和StNCED2)调控马铃薯块茎组织收获后储存和休眠状态[21]。为了鉴定这2个基因是否参与块茎形成, 将StNCED1和StNCED2编码的氨基酸序列与GenBank中其他植物的NCED氨基酸序列进行系统进化树分析。结果(图 1)显示:StNCED1和StNCED2位于不同的分支; StNCED1与茄科作物赭黄茄、智利番茄、番茄和秘鲁番茄同源性较高, StNCED2与烟草同源性较高。

|
图 1 不同植物NCED蛋白的系统进化树分析 Fig. 1 Phylogenetic tree analysis of NCED proteins from different plants |
利用半定量RT-PCR检测马铃薯块茎分化与发育过程中StNCED1和StNCED2的转录表达水平, 结果(图 2)发现:StNCED1在初始匍匐茎和延伸匍匐茎中表达, 但在膨大匍匐茎、初始块茎和成熟块茎中表达量非常低, 甚至检测不到; 同时, StNCED2在块茎形成的整个过程中均表达, 并且在延伸匍匐茎中表达量最高。这暗示StNCED2可能参与块茎分化和发育的整个过程, 因此, 我们选择StNCED2继续深入研究。
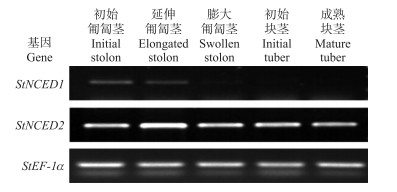
|
图 2 StNCED1和StNCED2在马铃薯块茎形成不同阶段的组织表达分析 Fig. 2 Tissue-expression analysis of StNCED1 and StNCED2 during potato tuber formation |
将StNCED2的cDNA序列插在质粒pCAMBIA1304的BglⅡ和SpeⅠ酶切位点之间(图 3-A), 构建StNCED2过表达转基因株系。以马铃薯茎段为外植体, 利用农杆菌转化法进行马铃薯的转化和再生。经愈伤形成、芽形成和潮霉素筛选后, 获得9个过表达的候选植株。以转基因株系的马铃薯基因组DNA为模板, 设计特异引物扩增既含有载体片段又含有目标片段的产物。结果(图 3-B)发现:9个候选苗中有7个植株带有特异片段。选择2个阳性株系T1和T7进行表达分析, 定量PCR结果显示:转基因株系T1和T7的叶片、膨大匍匐茎、初始块茎和成熟块茎中的StNCED2表达量比非转基因对照‘Desiree’高(图 3-C), 这表明转基因株系T1和T7是StNCED2过表达的阳性株系。
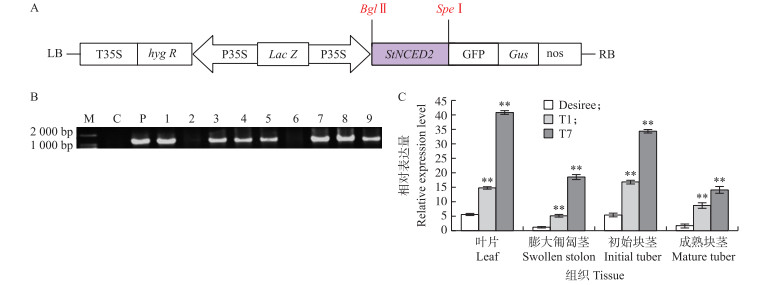
|
图 3 StNCED2转基因株系的构建和PCR鉴定 Fig. 3 Construction and PCR-based identification of StNCED2-overexpressing potato lines A. pCAMBIA1304-StNCED2载体图谱; B.过表达转基因株系的PCR鉴定(M:DNA标记; C:非转基因株系; P:质粒模板; 1~9:潮霉素抗性植株); C.过表达转基因株系T1和T7及对照组非转基因株系‘Desiree’不同组织中StNCED2的qRT-PCR分析。** P < 0.01。 A. Schematic representations of pCAMBIA1304-StNCED2 vector; B. PCR-based identifications of over-expression transgenic lines(M:DNA marker; C:Non-transgenic line; P:Plasmid template; 1-9:Transgenic lines with Hyg B resistance); C. QRT-PCR analysis of StNCED2 transcript levels of over-expression transgenic lines(T1 and T7)and control line'Desiree'in leaf, swollen stolon, initial tuber and mature tuber. ** P < 0.01. |
过表达株系T1、T7中的ABA含量比对照组高(图 4-A), 进一步证实T1和T7是StNCED2过表达的阳性植株。半定量RT-PCR检测ABA受体StPYL1和StPYL8基因的表达水平发现, 与对照‘Desiree’相比, 转基因株系T1和T7中受体基因感知高浓度的ABA而受到诱导(图 4-B)。在块茎形成过程中, 过表达株系T1和T7的膨大匍匐茎、初始块茎和成熟块茎中ABA信号下游转录因子StABF1的表达量更高(图 4-C), 表明StNCED2的过表达导致ABA信号在块茎形成过程中增强。
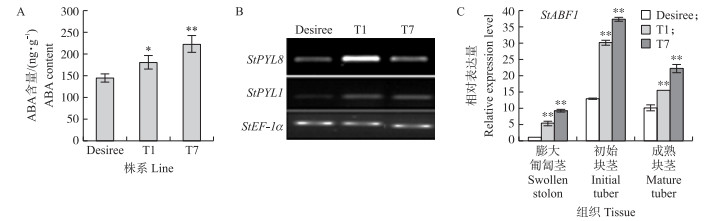
|
图 4 StNCED2过表达株系T1、T7和对照‘Desiree’的ABA含量和信号通路基因的表达分析 Fig. 4 ABA content and expression level of genes related to ABA signaling in StNCED2 overexpression lines T1, T7 and control line 'Desiree' A. StNCED2过表达株系T1、T7和对照‘Desiree’的ABA含量; B.半定量RT-PCR检测StNCED2过表达株系T1、T7和对照‘Desiree’中ABA受体基因StPYL1和StPYL8的表达水平; C.定量RT-PCR检测StNCED2过表达株系T1、T7和对照‘Desiree’的膨大匍匐茎、初始块茎和成熟块茎中ABA信号下游转录因子StABF1的表达水平。* P < 0.05, ** P < 0.01。 A. ABA content in StNCED2 overexpression lines T1, T7 and control line 'Desiree'; B. Semi-quantitative RT-PCR analysis for transcript expression level of ABA signal receptor genes StPYL1 and StPYL8 in StNCED2 overexpression lines T1, T7 and control line 'Desiree'; C. QRT-PCR analysis for transcript levels of ABA signaling transcription factor StABF1 in swollen stolon, initial tuber, and mature tuber of StNCED2 overexpression lines T1, T7 and control line'Desiree'. * P < 0.05, ** P < 0.01. |
过表达株系T1、T7和对照‘Desiree’的表型见图 5-A和B。过表达StNCED2的株系T1和T7与对照‘Desiree’相比, 单株平均产量增加(图 5-C和D), 单株平均薯数基本不变(图 5-E和F), 平均单个薯块质量增加(图 5-G和H), 表明过表达StNCED2株系的单株平均产量增加是由平均单个薯块质量而不是单株平均薯块数量引起的。
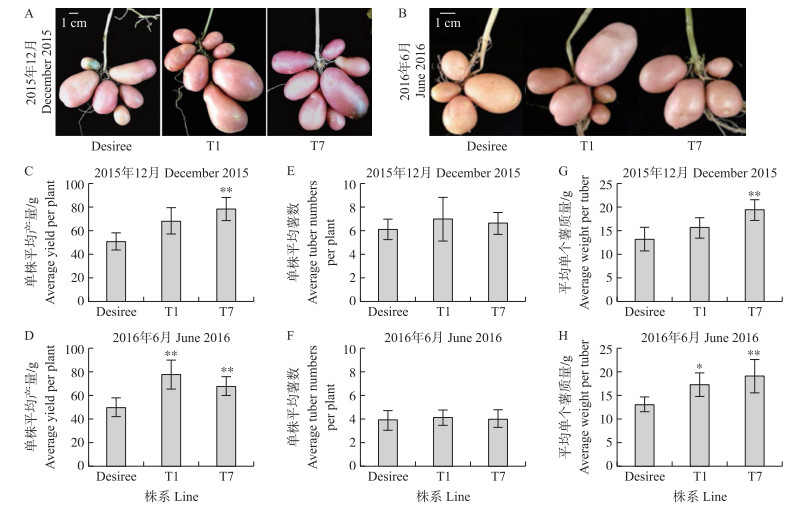
|
图 5 StNCED2过表达株系T1、T7和对照‘Desiree’的结薯表型和产量分析 Fig. 5 Tuber phenotype and yield analysis of StNCED2 overexpression lines T1, T7 and control line 'Desiree' *P < 0.05, ** P < 0.01. |
定量qRT-PCR检测GA合成基因GA3ox2和GA20ox1, GA代谢基因GA2ox1以及GA信号转录因子GAMYB的基因表达。与对照‘Desiree’相比, 过表达株系T1和T7的膨大匍匐茎、初始块茎和成熟块茎中合成基因和信号基因的表达量下降, 代谢基因表达上调(图 6)。这暗示StNCED2过表达导致马铃薯中GA信号减弱, 从而促进块茎形成。
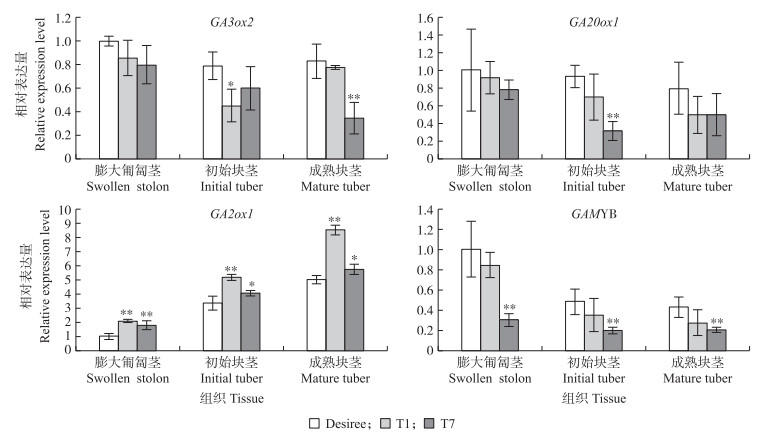
|
图 6 StNCED2过表达株系T1、T7和对照株系‘Desiree’的膨大匍匐茎、初始块茎和成熟块茎中GA相关基因的转录表达分析 Fig. 6 qRT-PCR analysis for transcript levels of GA related genes in swollen stolon, initial tuber, and mature tuber of StNCED2 overexpression lines T1, T7 and control line 'Desiree' |
2个NCED基因StNCED1和StNCED2参与调控块茎的收后储存和休眠状态[21]。我们研究发现StNCED1和StNCED2的进化关系并不亲密, 而且组织表达图谱也不一样。StNCED1只在块茎形成早期阶段表达, 尤其是匍匐茎的发育, 而StNCED2在块茎形成的所有阶段均表达。这表明StNCED2更适合作为潜能基因, 用于遗传工程获得产量增加的改良品种。
本研究中, 与对照组相比, 构建的StNCED2过表达株系产量更高, 是由于单个薯块质量的增加而不是薯块数目的增加引起的。这个结果表明StNCED2诱导的ABA主要作用于块茎大小, 这与细胞分裂素促进细胞分裂的功能相似, 但ABA和细胞分裂素是否协同作用调控马铃薯块茎大小需要进一步验证。已有研究构建了StNCED1过表达株系, 但未进行产量分析[9]。因此, 无法确定StNCED1对块茎形成的影响。
我们研究发现, 马铃薯中过表达StNCED2能够促进ABA信号转录因子StABF1和GA代谢基因StGA2ox1表达, 同时抑制GA合成基因StGA3ox2和StGA20ox1表达。虽然有许多间接证据显示ABA通过拮抗GA促进块茎形成[15, 17-18], 但仍缺乏ABA和GA互作的直接证据。在拟南芥中, ABA信号转录因子ABI4能够直接结合GA2ox7和NCED6的启动子区域促进其转录表达[22], 这暗示马铃薯StABF1可能也可以直接结合StGA2ox1的启动子。因此, 我们分析StGA2ox1基因上游的2 000 bp(即启动子序列), 发现这段序列里有3个StABF1结合的潜在位点ABRE元件(CACGTG)(本文未列出此结果), 后期可利用ChIP、GMSA和双分子荧光素酶试验进一步证实。
综上所述, 过表达马铃薯StNCED2基因能够通过增加ABA含量来促进块茎形成。ABA信号转录因子StABF1可能直接调控GA的代谢基因StGA2ox1。这些结果提示StNCED2能够作为一个有潜力的候选基因, 用于遗传工程转化从而增加马铃薯产量。
| [1] |
Viola R, Roberts A G, Haupt S, et al. Tuberization in potato involves a switch from apoplastic to symplastic phloem unloading[J]. The Plant Cell, 2001, 13(2): 385-398. |
| [2] |
Navarro C, Cruz-Oró E, Prat S. Conserved function of FLOWERING LOCUS T(FT)homologues as signals for storage organ differentiation[J]. Current Opinion in Plant Biology, 2015, 23: 45-53. DOI:10.1016/j.pbi.2014.10.008 |
| [3] |
Prat S. Hormonal and daylength control of potato tuberization[M]//Plant Hormones.Dordrecht:Springer Netherlands, 2010:574-596.
|
| [4] |
Sarkar D. The signal transduction pathways controlling in planta tuberization in potato:an emerging synthesis[J]. Plant Cell Reports, 2008, 27(1): 1-8. |
| [5] |
Ghate T H, Sharma P, Kondhare K R, et al. The mobile RNAs, StBEL11 and StBEL29, suppress growth of tubers in potato[J]. Plant Molecular Biology, 2017, 93(6): 563-578. DOI:10.1007/s11103-016-0582-4 |
| [6] |
Aksenova N P, Sergeeva L I, Kolachevskaya O O, et al. Hormonal regulation of tuber formation in potato[M]//Bulbous Plants. New York:Biotechnology:CRC Press, 2014, 3-36.
|
| [7] |
Escalante B Z, Langille A R. Photoperiod, temperature, gibberellin, and an anti-gibberellin affect tuberization of potato stem segments in vitro[J]. HortScience, 1998, 33(4): 701-703. |
| [8] |
Abdala G, Castro G, Miersch O, et al. Changes in jasmonate and gibberellin levels during development of potato plants(Solanum tuberosum)[J]. Plant Growth Regulation, 2002, 36(2): 121-126. |
| [9] |
Roumeliotis E, Kloosterman B, Oortwijn M, et al. The effects of auxin and strigolactones on tuber initiation and stolon architecture in potato[J]. Journal of Experimental Botany, 2012, 63(12): 4539-4547. DOI:10.1093/jxb/ers132 |
| [10] |
Kolachevskaya O O, Alekseeva V V, Sergeeva L I, et al. Expession of auxin synthesis gene tms1 under control of tuber-specific promoter enhances potato tuberization in vitro[J]. Journal of Integrative Plant Biology, 2015, 57(9): 734-744. DOI:10.1111/jipb.12314 |
| [11] |
Hannapel D J. Signalling the induction of tuber formation[M]//Potato Biology and Biotechnology:Advances and Perspectives. Amsterdam:Elsevier Science BV, 2007:237-256.
|
| [12] |
Vreugdenhil D, van Dijk W. Effects of ethylene on the tuberization of potato(Solanum tuberosum)cuttings[J]. Plant Growth Regulation, 1989, 8(1): 31-39. |
| [13] |
Ali B. Practical applications of brassinosteroids in horticulture:some field perspectives[J]. Scientia Horticulturae, 2017, 225: 15-21. DOI:10.1016/j.scienta.2017.06.051 |
| [14] |
Pasare S A, Ducreux L J M, Morris W L, et al. The role of the potato(Solanum tuberosum)CCD8 gene in stolon and tuber development[J]. New Phytologist, 2013, 198(4): 1108-1120. DOI:10.1111/nph.12217 |
| [15] |
Xu X, van Lammeren A A M, Vermeer E, et al. The role of gibberellin, abscisic acid, and sucrose in the regulation of potato tuber formation in vitro[J]. Plant Physiology, 1998, 117(2): 575-584. DOI:10.1104/pp.117.2.575 |
| [16] |
Dutt S, Manjul A S, Raigond P, et al. Key players associated with tuberization in potato:potential candidates for genetic engineering[J]. Critical Reviews in Biotechnology, 2017, 37(7): 942-957. DOI:10.1080/07388551.2016.1274876 |
| [17] |
Muñiz García M N, Stritzler M, Capiati D A. Heterologous expression of Arabidopsis ABF4 gene in potato enhances tuberization through ABA-GA crosstalk regulation[J]. Planta, 2014, 239(3): 615-631. DOI:10.1007/s00425-013-2001-2 |
| [18] |
Muñiz García M N, Muro M C, Mazzocchi L C, et al. The protein phosphatase 2A catalytic subunit StPP2Ac2b acts as a positive regulator of tuberization induction in Solanum tuberosum L.[J]. Plant Molecular Biology, 2017, 93(3): 227-245. |
| [19] |
Liu L, Zhang R J, Zhu W J, et al. Inhibitory effect of StCYP707A1 gene on tuberization in transgenic potato[J]. Plant Biotechnology Reports, 2017, 11(4): 219-228. DOI:10.1007/s11816-017-0442-y |
| [20] |
马瑞, 张宁, 杨江伟, 等. 马铃薯StNCED1基因过表达载体的构建及其遗传转化[J]. 分子植物育种, 2017, 15(1): 174-179. Ma R, Zhang N, Yang J W, et al. Construction of overexpression vector of StNCED1 gene and its genetic transformation of potato[J]. Molecular Plant Breeding, 2017, 15(1): 174-179 (in Chinese with English abstract). |
| [21] |
Destefano-Beltrán L, Knauber D, Huckle L, et al. Effects of postharvest storage and dormancy status on ABA content, metabolism, and expression of genes involved in ABA biosynthesis and metabolism in potato tuber tissues[J]. Plant Molecular Biology, 2006, 61(4/5): 687-697. |
| [22] |
Shu K, Chen Q, Wu Y R, et al. ABI4 mediates antagonistic effects of abscisic acid and gibberellins at transcript and protein levels[J]. The Plant Journal, 2016, 85: 348-361. DOI:10.1111/tpj.13109 |




