文章信息
- 王倩倩, 顾建锋, 李红梅, 杜宇, 王暄
- WANG Qianqian, GU Jianfeng, LI Hongmei, DU Yu, WANG Xuan
- 荷兰进境铃兰苗中铃兰短体线虫的鉴定
- Identification of Pratylenchus convallariae intercepted in seedlings of Convallaria majalis from Netherlands
- 南京农业大学学报, 2019, 42(5): 835-841
- Journal of Nanjing Agricultural University, 2019, 42(5): 835-841.
- http://dx.doi.org/10.7685/jnau.201812053
-
文章历史
- 收稿日期: 2018-12-29
2. 宁波出入境检验检疫局检验检疫技术中心, 浙江 宁波 315012;
3. 云南出入境检验检疫局检验检疫技术中心, 云南 昆明 650000
2. Technical Center of Ningbo Entry-exit Inspection and Quarantine Bureau, Ningbo 315012, China;
3. Technical Center of Yunnan Entry-exit Inspection and Quarantine Bureau, Kunming 650000, China
短体属线虫(Pratylenchus Filipjev, 1936)又称根腐线虫, 是一类迁移性的植物内寄生线虫, 不仅能够直接取食根组织, 引起根系表皮破损和内部组织的腐烂, 而且能诱发真菌或细菌的二次侵染[1]。短体线虫在世界各地均有分布, 寄主范围广泛, 可危害香蕉、谷类作物、咖啡、玉米、大豆、花生、马铃薯以及多种水果等, 造成经济作物的巨大损失, 对全球经济作物的影响仅次于根结线虫(Meloidogyne spp.)和孢囊线虫(Heterodera spp.和Globodera spp.)[2]。
2007年Castillo等[1]整理了短体线虫属有效种68个, 2013年Geraert[3]整理了短体线虫属有效种99个, 此后又相继报道了油橄榄短体线虫(P.oleae)[4]、类圆肌短体线虫(P.quasitereoides)[5]、拟玉米短体线虫(P.parazeae)[6]、海阳短体线虫(P.haiduongensis)[7]和卢旺达短体线虫(P.rwandae)[8], 迄今短体线虫有效种已达104种。其中, 短体属线虫非中国种是我国进境植物检疫性有害生物[9], 该类线虫一旦传入定殖, 将对我国农林业生产造成破坏[10]。因此, 必须加强口岸植物检疫和除害处理工作, 才能防患于未然。
2018年3月, 云南口岸从来自荷兰的一批铃兰洗根苗中发现1种短体属线虫, 经形态学和分子生物学比对分析, 将其鉴定为铃兰短体线虫(Pratylenchus convallariae Seinhorst, 1959)[11]。铃兰短体线虫曾经在我国浙江的甘薯[12]以及四川巴中的莴苣[13]上有过报道, 但其形态描述不详, 且无分子生物学信息的佐证, 其种类鉴定的准确性还有待核实。因此, 本文对截获自荷兰的铃兰短体线虫进行详细的形态学特征描述, 并进行分子特征分析, 旨在为我国进出境植物线虫检疫鉴定提供参考依据。
1 材料与方法 1.1 样品采集和线虫分离荷兰进境的铃兰洗根苗, 长约10 cm, 根部未发现明显病害症状。随机取5~10株长势较弱的铃兰苗, 置于取样袋中密封, 做好标记, 带回实验室。
剪取3~5株苗的根部, 用双层纱布包好后, 置于改良贝曼漏斗中进行线虫的分离[14], 于25 ℃培养箱中静置24~48 h后, 用凹面皿接取10 mL线虫悬浮液, 在体视显微镜下进行检测。重复分离铃兰根样1次。
1.2 形态学鉴定从分离的线虫悬浮液中挑取线虫, 制成临时玻片, 在光学显微镜下观察、拍照。将线虫杀死固定后, 采用甘油-乙醇快速脱水法对线虫脱水[15], 将脱水处理过的线虫挑入甘油滴中, 用石蜡封片, 做成永久玻片。用Zeiss Imager Z1自动显微镜和Zeiss Axio Cam MRm数码相机进行形态观察、拍照, 并采用De Man公式对雌虫和雄虫进行测计[16]。根据形态学特征和形态测计结果, 结合短体属线虫种类鉴定多歧检索表[1]和相关文献的形态描述比对, 初步进行种的鉴定。
1.3 分子生物学鉴定单条线虫DNA的提取参照王江玲等[17]的方法。核糖体DNA(rDNA)的28S-D2/D3区扩增所用的引物对为:上游引物D2A(5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和下游引物D3B(5′-TCGGAAGGAACCAGCTACTA-3′)。PCR扩增程序参照de Ley等[18]的方法, 扩增产物送至上海美吉生物医药科技有限公司进行测序。
用MEGA 6.0软件拼接序列, 将拼接后的序列提交至GenBank获得登录号。从GenBank下载短体线虫属相关种类和群体的28S-D2/D3序列, 用ClustalW程序进行序列比对。使用MrBayes 3.2.3软件[19]对得到的序列进行比对并构建贝西斯法系统进化树, 选择肋状纵纹盖垫刃线虫(Coslenchus costatus)和纤细基狭垫刃线虫(Basiria gracilis)作为外群。用MODELTEST软件进行评估得到相应的核苷酸替换模型, 参照MrBayes 3.2.3软件说明对程序做出设定, 在4条马尔科夫链(Markov chain)下独立进行3条热链和1条冷链的1×107次运行, 每1 000次进行1次贝叶斯树的抽样, 并设置“burn-in”值为25%, 即剔除前25%可能未处于稳态时的系统进化树。采用多数一致(50%)原则, 用MCMC(Markov chain Monte Carlo)方法获得贝叶斯系统进化树的后验概率值[20], 最后使用TreeGraph 2对系统进化树进行查看和编辑[21]。
2 结果与分析 2.1 荷兰线虫群体的测计值从荷兰进境的铃兰洗根苗中2次都分离到同一种短体线虫, 洗根苗中的群体密度约为每100 g土壤8~10条线虫。截获的荷兰线虫群体测计值见表 1。将截获群体的测计值与原始描述的铃兰短体线虫群体[11]的测计值进行比较, 发现除了后阴子宫囊(PUS)(20~29 μm)略长于原始描述群体[11]的PUS长度(16~26 μm), 其他测计值基本一致, 因此初步将进境截获的荷兰线虫群体鉴定为铃兰短体线虫(P.convallariae)。
| 测计值 Measurement |
雌虫Females | 雄虫Males | |||
| 本研究群体 Population in this study |
原始种群 Original population |
本研究群体 Population in this study |
原始种群 Original population |
||
| n | 6 | 10 | 4 | 10 | |
| L/μm | 541.0±23.8(519~590) | 580~610 | 468.0±28.9(430~506) | 490~580 | |
| a | 23.0±1.3(20.4~24.9) | 23~27 | 28.4±3.2(24.0~33.1) | 27~36 | |
| b | 7.4±0.3(7.1~7.9) | 6.0~9.0 | 6.2±0.3(5.8~6.5) | 5.2~6.0 | |
| b′ | 4.2±0.3(3.8~4.8) | 4.4±0.2(4.0~4.8) | 3.7±0.2(3.4~3.9) | — | |
| c | 18.3±1.5(17.1~21.5) | 17~28 | 19.1±2.4(15.5~22.2) | 20~23 | |
| c′ | 2.2±0.1(2.0~2.3) | 2.2±0.1(2.0~2.4) | 2.2±0.2(2.0~2.5) | — | |
| V/% | 79.7±0.9(78.8~81.6) | 78~81 | — | — | |
| 口针长/μm Stylet | 15.9±0.7(15.2~17.0) | 16~17 | 15.0±0.1(14.8~15.2) | 15~17 | |
| 唇环Lip annuli | 3 | 3 | 3 | 3 | |
| 口针基部球高/μm Knob height | 2.4±0.2(2.2~2.8) | — | 2.1±0.1(2.1~2.2) | — | |
| 口针基部球宽/μm Knob width | 4.2±0.3(3.8~4.6) | — | 3.7±0.2(3.4~4.0) | — | |
| 口针基部球宽/高Ratio of knob width to knob height | 1.8±0.2(1.5~2.1) | — | 1.7±0.1(1.6~1.9) | — | |
| DGO/μm | 2.2±0.1(2.1~2.3) | — | 2.4±0.1(2.3~2.6) | — | |
| 头前端至食道肠交接处距离/μm Distance from esophagus-intestine junction to anterior end |
72.6±1.7(70.0~75.0) | — | 75.6±1.5(74.0~78.0) | — | |
| 肠交接处至食道腺末端距离/μm Distance from intestine junction to pharyngeal glands end |
55.3±7.3(41.0~65.0) | — | 51.7±8.8(44.3~66.4) | — | |
| 最大体宽/μm Body width | 23.6±1.7(21.0~26.0) | — | 16.6±1.0(15.3~17.9) | — | |
| 阴门处体宽/μm Body width at vulva | 21.1±1.8(19.2~24.6) | 17.1±1.6(14~20) | — | — | |
| 肛门处体宽/μm Body width at anus | 13.7±0.4(13.0~14.4) | — | 11.1±0.7(10.0~11.9) | — | |
| 肛阴距/μm Distance from vulva to anus | 76.7±6.9(66.5~88.3) | 76.8±6.5(70~-88) | — | — | |
| 尾长/μm Tail length | 29.6±1.2(27.5~31.4) | — | 24.8±2.9(21.8~29.3) | — | |
| 尾环数Tail annuli | 20.4±1.5(18~22) | 16~19 | — | — | |
| 后阴子宫囊长/μm Length of post-uterine sac(PUS) | 25.9±2.9(20.0~29.0) | 19.9±2.6(16~26) | — | — | |
| 后阴子宫囊长/肛阴距(%) Post-uterine sac length/distance from vulva to anus |
33.8±3.4(30.1~40.6) | 21~25 | — | — | |
| 受精囊至阴门处距离/μm Distance from spermatheca to vulva |
48.2±5.0(43.3~56.0) | 34.2±7.3(23.0~50.0) | — | — | |
| 卵巢长/μm Ovary length | 243.0±28.1(215~296) | — | — | — | |
| 交合刺长/μm Spicule length | — | — | 15.8±0.9(14.4~16.8) | — | |
| 精巢长/μm Testis length | — | — | 215.0±21.4(190~237) | — | |
| 注:n代表样本数; L为体长; a为体长与最大体宽的比值; b为体长与头端至食道与肠交接处长度的比值; b′为体长与头端至食道腺末端长度的比值; c为体长与尾长的比值; c′为尾长与肛门处体宽的比值; V为体前端至阴门的距离与口针长的比例; DGO为口针基部球末端至背食道腺开口的距离。 Note:n:Number of specimens; L:Total body length; a=Body length/body width; b=Body length/distance from anterior end to junction of oesophagus and intestine; b′=Body length/distance from anterior end to pharyngeal glands end; c=Body length/tail length; c′=Tail length/body width at anus; V=Distance from anterior end to vulva/body length×100%;DGO:Dorsal pharyngeal gland opening from stylet konbs. | |||||
铃兰短体线虫的光学显微照片见图 1, 形态描述如下。
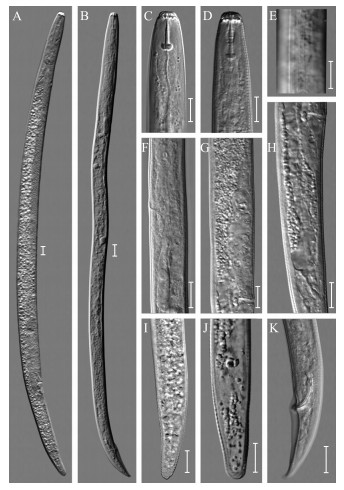
|
图 1 铃兰短体线虫的光学显微照片 Fig. 1 Light photomicrographs of Pratylenchus convallariae A.雌虫整体Female entire body; B.雄虫整体Male entire body; C.雌虫头部Female head; D.雄虫头部Male head; E.侧线Lateral lines; F.食道Oesophagus; G, H.生殖管Gonad region; I, J.雌虫尾Female tail; K.雄虫尾Male tail.标尺Scar bar=10 μm. |
雌虫:虫体较短, 体较宽, 体表环纹细, 宽约1.5 μm, 侧区有4条侧线, 光滑, 内侧2条侧线一直延伸至尾端(图 1-A, E)。唇区略缢缩, 唇环3个; 口针粗壮, 长约15~17 μm, 基部球呈郁金香球状, 背食道腺开口位于口针基部球后(DGO为2.0~2.3 μm)(图 1-C)。中食道球卵圆形, 约占体宽的1/2(图 1-A, F)。食道腺从腹面覆盖肠端, 覆盖长度为41~65 μm; 排泄孔位于食道和肠连接处, 半月体位于排泄孔之前(图 1-F)。阴门横裂, 单卵巢, 卵母细胞单行排列, 受精囊近球形至矩形(图 1-G), 内部充满精子, 子宫较短, 后阴子宫囊长(PUS为16~26 μm)(图 1-H)。尾近圆柱形, 有时圆锥形, 尾末端略平截, 尾环数18~22个, 尾末端粗糙或有不规则环纹, 侧尾腺位于尾的中间(图 1-I, J)。
雄虫:体前部与雌虫相似, 仅虫体稍窄(图 1-B, D)。交合刺较窄, 长14~17 μm; 尾圆锥形, 交合伞包裹至尾末端(图 1-K)。
2.3 荷兰线虫群体的鉴定及其与近似种的关系短体属线虫种的主要鉴定特征包括:唇环数、雄虫的有无、口针长、受精囊的有无及形状、V值、后阴子宫囊长、雌虫尾形和尾末端形态、食道腺覆盖长度、阴门区侧线数以及侧带结构等。根据Castillo等[1]整理的短体线虫属种类鉴定多岐检索表, 铃兰短体线虫的鉴定代码依次为A2-B2-C3-D2-E2-F6-G2-H2-I3-J1-K1, 而截获的荷兰群体代码为A2-B2-C2(3)-D2(4)-E2(3)-F4(3)-G2(3)-H2-I4(3)-J1-K1。对比鉴定代码发现, 截获群体的鉴定代码与铃兰短体线虫原始描述群体的代码基本一致, 截获群体只是在口针长、受精囊形状、V值、尾形以及食道腺覆盖长的代码, 比原始描述群体对应的代码覆盖度略微广一点, 这可能是由于不同地理来源的种群间存在差异所致, 因此将该短体线虫群体鉴定为铃兰短体线虫。铃兰短体线虫的主要鉴别特征:1)唇区略缢缩, 唇环3个; 2)口针粗壮, 长15~17 μm, 基部球呈郁金香球状; 3)受精囊近球形至矩形, 内部充满精子; 4)后阴子宫囊长20.0~29.0 μm; 5)尾端略平截, 粗糙或常有不规则环纹。
2017年, Janssen等[22]利用核糖体和线粒体基因序列对穿刺短体线虫组(Penetrans group)进行了多基因系统进化分析, 揭示该组成员包括铃兰短体线虫(P.convallariae)、沙丘短体线虫(P.dunensis)、伪短体线虫(P.fallax)、油橄榄短体线虫(P.oleae)、穿刺短体线虫(P.penetrans)和肥尾短体线虫(P.pinguicaudatus), 共6个有效种。
铃兰短体线虫与沙丘短体线虫[1]的主要区别:1)铃兰短体线虫唇环3个, 而沙丘短体线虫唇环2个; 2)铃兰短体线虫尾近圆柱形, 有时圆锥形, 尾末端粗糙, 而沙丘短体线虫尾圆柱形, 尾末端光滑; 3)铃兰短体线虫阴门处侧带区光滑, 而沙丘短体线虫阴门处侧带区部分呈网格状。
铃兰短体线虫与伪短体线虫[23]的主要区别:1)铃兰短体线虫体长0.52~0.59 μm, 而伪短体线虫体长0.42~0.56 μm, 相对较短; 2)铃兰短体线虫口针基部球呈郁金香球状, 而伪短体线虫口针基部球呈圆形或锚状; 3)铃兰短体线虫尾环数18~22个, 而伪短体线虫尾环纹更多更窄, 可达16~26个。
铃兰短体线虫与油橄榄短体线虫[4]的主要区别:1)铃兰短体线虫雄虫常见, 而油橄榄短体线虫雄虫未见; 2)铃兰短体线虫受精囊近球形至矩形, 内部充满精子, 而油橄榄短体线虫受精囊不明显, 内部无精子; 3)铃兰短体线虫食道腺从腹面覆盖肠, 覆盖长度为41~65 μm, 而油橄榄短体线虫食道腺覆盖长度为22~36 μm, 相对较短; 4)铃兰短体线虫阴门处侧带区光滑, 而油橄榄短体线虫阴门处侧带区呈网格状。
铃兰短体线虫与穿刺短体线虫[1]的主要区别:1)铃兰短体线虫尾末端粗糙, 或有不规则环纹, 而穿刺短体线虫尾末端光滑, 无环纹; 2)铃兰短体线虫侧区的2条内侧线一直延伸至尾端, 而穿刺短体线虫侧区侧线并未延伸至尾端。
铃兰短体线虫与肥尾短体线虫[1]的主要区别:1)铃兰短体线虫雄虫常见, 而肥尾短体线虫雄虫未见; 2)铃兰短体线虫受精囊近球形至矩形, 内部充满精子, 而肥尾短体线虫受精囊圆形, 内部无精子; 3)铃兰短体线虫后阴子宫囊长16~26 μm, 而肥尾短体线虫后阴子宫囊长小于16 μm, 相对较短; 4)铃兰短体线虫尾末端粗糙, 而肥尾短体线虫尾末端光滑。
2.4 分子生物学分析将测序所得的铃兰短体线虫28S-D2/D3区3条序列提交至GenBank, 登录号分别为MH700784、MH700785和MH700786。截获荷兰群体的3条28S-D2/D3序列相似性为97.3%~98.6%, 与铃兰短体线虫2个美国群体(登录号分别为KY828372和AF307328)、比利时群体(登录号为KY828373)和2个法国群体[22](登录号分别为AF264181和AF196351)的序列相似性为98.0%~100%, 与穿刺短体线虫5条序列(登录号分别为JQ003984、EU130857、KX842614、KY828357和AM231936)的序列相似性为95.6%~97.1%, 与伪短体线虫3条序列(登录号分别为KY828362、KY828365和KY828366)的序列相似性为94.3%~96.3%, 与沙丘短体线虫3条序列(登录号分别为AM231938、AM231944和AM231946)的序列相似性为86.6%~88.2%, 与油橄榄短体线虫3条序列(登录号分别为KJ510856、KJ510857和KJ510859)的序列相似性为86.0%~88.3%, 与肥尾短体线虫2条序列(登录号分别为KP289344和KP289346)的序列相似性为86.7%~88.2%。序列相似性分析结果揭示:铃兰短体线虫与穿刺短体线虫和伪短体线虫的亲缘关系较近。
从基于28S-D2/D3区序列构建的短体属线虫系统发育树(图 2)中可以看出:该截获的荷兰群体与铃兰短体线虫美国群体、比利时群体和法国群体聚类在1个单独分支, 后验概率值为100, 而沙丘短体线虫、伪短体线虫、油橄榄短体线虫、穿刺短体线虫和肥尾短体线虫则各自形成了单独的分支。综合形态学鉴定和分子特征分析结果, 我们将截获的荷兰线虫群体鉴定为铃兰短体线虫。
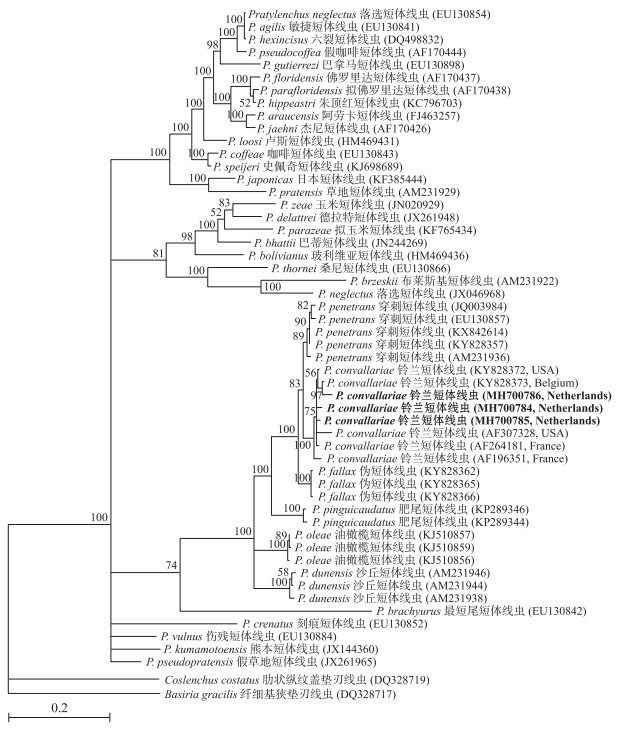
|
图 2 基于rDNA 28S-D2/D3区序列构建的短体属线虫群体系统进化树 Fig. 2 Phylogeny tree of Pratylenchus populations based on partial rDNA 28S-D2/D3 sequences |
短体属线虫种间形态特征比较相似, 唇环数、口针长、有无受精囊及其形状、PUS长、V值、尾形等是重要的鉴定特征。然而, 唇环数有时不易看清, V值往往重叠, PUS和尾形等其他特征的变异也较大。随着DNA测序、DNA条形码技术的不断推广, 分子生物学方法已成为植物病原线虫种类鉴定的一种重要辅助手段[24]。
1959年, Seinhorst[11]首先在荷兰的铃兰上发现铃兰短体线虫, 并确认其为独立的种。该线虫分布广泛, 在德国、波兰、葡萄牙、俄罗斯、斯洛文尼亚、西班牙、日本等国都有报道, 寄主主要包括铃兰、莴苣、甘薯、玉兰、茶条槭、高山茶藨子、树莓以及蔷薇属植物等[25]。1974年Banck[26]报道在瑞典的进境铃兰苗木中检测到铃兰短体线虫的数量可高达每克根300~400条; 受侵染的铃兰根系特别是根尖和分支部位, 呈现大量的红色斑点和褐色坏死; 当根系线虫量达到每克根16条时, 可使铃兰质量损失20%。1985年我国还进等[12]曾报道从浙江甘薯中发现该线虫, 但形态特征描述不详, 墨线图中的卵巢伸长至近中食道球且回折、后阴子宫囊较长等特征与原始文献描述的不相符。1994年李笃肇[13]曾报道在四川巴中的莴苣上发现该线虫, 但受精囊、口针基部球等特征与原始文献描述有一定差异。2001年Handoo等[23]从法国进境美国的铃兰中检测到了铃兰短体线虫和伪短体线虫, 并发现形态特征与两者相似的1个新种阿灵顿短体线虫(P.arlingtoni), 形态鉴别发现该新种与刻痕短体线虫(P.crenatus)最为相似, 而分子亲缘关系上与铃兰短体线虫和伪短体线虫最接近。2017年Janssen等[22]采用Handoo提交的阿灵顿短体线虫和伪短体线虫的rDNA 28S序列(分别为AF307328和AF264181), 利用MrBayes软件构建系统进化树, 揭示2条序列均与铃兰短体线虫的序列聚集在同一分支上, 后验概率值为100, 推测序列AF307328和AF264181有可能是来自错误挑取的法国铃兰短体线虫, 而形态特征与刻痕短体线虫很相似的阿灵顿短体线虫被认为是可疑种(inquirendae species)。在本文中, 我们所构建的28S序列系统进化树也显示, 序列AF307328和AF264181与截获的荷兰群体以及来自美国和比利时群体的序列聚类在同一个分支上, 支持了Janssen等[22]的研究结果。
综上所述, 单纯依靠形态特征难以对铃兰短体线虫进行准确鉴定, 我国早期报道的浙江甘薯[12]和四川巴中莴苣[13]上的铃兰短体线虫均缺乏分子特征分析, 是否为铃兰短体线虫还有待进一步的考证, 因此, 铃兰短体线虫在我国的分布尚不明确。美国于1988至2000年期间至少6次从进口的法国铃兰中检测到铃兰短体线虫[23], 我国北京口岸在2014年也从来自美国的铃兰中截获该线虫[27], 可见该种线虫随种苗传播扩散的风险较高。对铃兰短体线虫较为有效的预防措施是在收获后的秋季或春季, 对植物材料进行热处理, 将芽浸入43.5 ℃约60 min并立即在冷水中冷却[26]。目前, 铃兰短体线虫主要分布在欧洲各国, 建议我国各口岸检疫部门加强对来自欧洲植物种苗(球)的检疫监管力度, 降低线虫传入的概率。
| [1] |
Castillo P, Vovlas N. Pratylenchus(Nematoda:Pratylenchidae):Diagnosis, Biology, Pathogenicity and Management[M]. Leiden: Brill Academic Publising, 2007: 1-203.
|
| [2] |
Jones J T, Haegeman A, Danchin E G J, et al. Top 10 plant-parasitic nematodes in molecular plant pathology[J]. Molecular Plant Pathology, 2013, 14(9): 946-961. DOI:10.1111/mpp.12057 |
| [3] |
Geraert E. The Pratylenchidae of the World:Identification of the Family Pratylenchidae(Nematoda:Tylenchida)[M]. Ghent: Academia Press, 2013: 230-388.
|
| [4] |
Palomares-Rius J E, Guesmi I, Horrigue-Raouani N, et al. Morphological and molecular characterisation of Pratylenchus oleae n. sp.(Nematoda:Pratylenchidae)parasitizing wild and cultivated olives in Spain and Tunisia[J]. European Journal of Plant Pathology, 2014, 140(1): 53-67. DOI:10.1007/s10658-014-0443-4 |
| [5] |
Hodda M, Collins S J, Vanstone V A, et al. Pratylenchus quasitereoides n. sp. from cereals in Western Australia[J]. Zootaxa, 2014, 3866(2): 277-288. DOI:10.11646/zootaxa.3866.2.6 |
| [6] |
Wang H H, Zhuo K, Ye W M, et al. Morphological and molecular charaterisation of Pratylenchus parazeae n. sp.(Nematoda:Pratylenchidae)parasitizing sugarcane in China[J]. European Journal of Plant Pathology, 2015, 143(1): 173-191. DOI:10.1007/s10658-015-0674-z |
| [7] |
Nguyen T D, Le T M L, Nguyen H T, et al. Morphological and molecular characteristics of Pratylenchus haiduongensis sp. n., a new species of root-lesion nematodes associated with carrot in Vietnam[J]. Journal of Nematology, 2017, 49(3): 276-285. |
| [8] |
Singh P R, Nyiragatare A, Janssen T, et al. Morphological and molecular characterisation of Pratylenchus rwandae sp.n.(Tylenchida:Pratylenchidae)associated with maize in Rwanda[J]. Nematology, 2018, 20(8): 781-794. DOI:10.1163/15685411-00003175 |
| [9] |
顾建锋, 王江岭, 王金成. 根结线虫非中国种问题初探[J]. 植物检疫, 2012, 26(3): 58-60. Gu J F, Wang J L, Wang J C. The preliminary discussion of non-Chinese species of Meloidogyne[J]. Plant Quarantine, 2012, 26(3): 58-60 (in Chinese). |
| [10] |
王宁, 顾建锋, 王暄, 等. 进境鸡爪槭中日本短体线虫的鉴定[J]. 南京农业大学学报, 2014, 37(4): 76-82. Wang N, Gu J F, Wang X, et al. Identification of Pratylenchus japonicus intercepted in Acer palmatum from Japan[J]. Journal of Nanjing Agricultural University, 2014, 37(4): 76-82 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2014.04.011 |
| [11] |
Seinhorst J W. Two new species of Pratylenchus[J]. Nematologica, 1959, 4(1): 83-86. DOI:10.1163/187529259X00417 |
| [12] |
还进, 许美琴. 浙江省主要农作物寄生线虫种类鉴定2.寄生甘薯(Ipomoea batatas)的5个种[J]. 浙江农业大学学报, 1985, 11(2): 231-235. Huan J, Xu M Q. A report on the identification of plant parasitic nematodes of staple crops in Zhejiang Province Ⅱ. The five species of parasitic nematodes on sweet potatodes[J]. Acta Agricultural Universitatis Zhejiangensis, 1985, 11(2): 231-235 (in Chinese with English abstract). |
| [13] |
李笃肇. 四川省植物和食用菌寄生线虫种类名录[J]. 西南农业大学学报, 1994, 16(1): 1-10. Li D Z. List of parasitic nematodes on plants and edible fungi in Sichuan Province, China[J]. Journal of Southwest Agricultural University, 1994, 16(1): 1-10 (in Chinese with English abstract). |
| [14] |
Whitehead A G, Hemming J R. A comparison of some quantitative methods of extracting small vermiform nematodes from soil[J]. Annals of Applied Biology, 1965, 55(1): 25-38. DOI:10.1111/j.1744-7348.1965.tb07864.x |
| [15] |
Seinhorst J W. A rapid method for the transfer of nematodes from fixative to anhydrous glycerin[J]. Nematologica, 1959, 4(1): 67-69. DOI:10.1163/187529259X00381 |
| [16] |
谢辉. 植物线虫分类学[M]. 2版. 北京: 高等教育出版, 2005: 38-41. Xie H. Taxonomy of Plant Nemadodes[M]. 2nd ed. Beijing: Higher Education Press, 2005: 38-41 (in Chinese). |
| [17] |
王江岭, 张建成, 顾建锋. 单条线虫DNA提取方法[J]. 植物检疫, 2011, 25(2): 32-35. Wang J L, Zhang J C, Gu J F. Method of extract DNA from a single nematode[J]. Plant Quarantine, 2011, 25(2): 32-35 (in Chinese with English abstract). |
| [18] |
de Ley P, Félix M A, Frisse L M, et al. Molecular and morphological characterisation of two reproductively isolated species with mirror-image anatomy(Nematoda:Cephalobidae)[J]. Nematology, 1999, 1(6): 591-612. DOI:10.1163/156854199508559 |
| [19] |
Ronquist F, Huelsenbeck J P. MrBayes 3:bayesian phylogenetic inference under mixed models[J]. Bioinformatics, 2003, 19(12): 1572-1574. DOI:10.1093/bioinformatics/btg180 |
| [20] |
Larget B, Simon D L. Markov chain Monte Carlo algorithms for the Bayesian analysis of phylogenetic trees[J]. Molecular Biology & Evolution, 1999, 16(6): 750-759. |
| [21] |
Stöver B C, Müller K F. TreeGraph 2:combining and visualizing evidence from different phylogenetic analyses[J]. BMC Bioinformatics, 2010, 11: 7. DOI:10.1186/1471-2105-11-7 |
| [22] |
Janssen T, Karssen G, Orlando V, et al. Molecular characterization and species delimiting of plant-parasitic nematodes of the genus Pratylenchus from the Penetrans group(Nematoda:Pratylenchidae)[J]. Molecular Phylogenetics and Evolution, 2017, 117: 30-48. DOI:10.1016/j.ympev.2017.07.027 |
| [23] |
Handoo Z A, Carta L K, Skantar A M. Morphological and molecular characterisation of Pratylenchus arlingtoni n. sp., P.convallariae and P.fallax(Nematoda:Pratylenchidae)[J]. Nematology, 2001, 3(6): 607-618. DOI:10.1163/156854101753389220 |
| [24] |
王金成, 魏亚东, 顾建锋, 等. 基于核糖体ITS区和28S rRNA D2-D3区的短体线虫系统发育研究[J]. 动物分类学报, 2012, 37(4): 687-693. Wang J C, Wei Y D, Gu J F, et al. Phylogenetic analysis of Pratylenchus(Nematoda:Pratylenchidae)based on ribosomal internal transcribed spacers(ITS)and D2-D3 expansion segments of 28S rRNA gene[J]. Acta Zootaxonomica Sinica, 2012, 37(4): 687-693 (in Chinese with English abstract). |
| [25] |
Kurppa S. Root parasitic nematodes in nursery plants imported to Finland in 1980[J]. Journal of Agricultural Science in Finland, 1985, 57(3): 155-162. DOI:10.23986/afsci.72197 |
| [26] |
Banck A. Root nematode, especially Pratylenchus convallariae, causes losses in lily of the valley[J]. Vaxtskyddsnotiser, 1974, 38(4): 67-72. |
| [27] |
边勇, 周琦, 高文娜, 等. 北京口岸进境苗木线虫检出分析[J]. 植物保护, 2014, 40(4): 148-152. Bian Y, Zhou Q, Gao W N, et al. Checkout nematode analysis of import seedlings from Beijing port[J]. Plant Protection, 2014, 40(4): 148-152 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-1542.2014.04.030 |




