文章信息
- 魏玲玲, 王武, 郑焕, 陶建敏
- WEI Lingling, WANG Wu, ZHENG Huan, TAO Jianmin
- 单穗不同留果量对‘阳光玫瑰’葡萄果实品质及香气物质积累的影响
- Effect of different fruit loads per cluster on fruit quality and aroma accumulation in'Shine Muscat'grape
- 南京农业大学学报, 2019, 42(5): 818-826
- Journal of Nanjing Agricultural University, 2019, 42(5): 818-826.
- http://dx.doi.org/10.7685/jnau.201812017
-
文章历史
- 收稿日期: 2018-12-11
葡萄品种‘阳光玫瑰’(Vitis labruscana Bailey × Vitis vinifera L.)属二倍体欧美杂交新品种, 亲本为‘安芸津21号’和‘白南’[1]。因其外形美观、皮薄可食、肉脆多汁、玫瑰香味浓郁、生产上易于栽培等特点, 近几年来受到了广泛的关注。
香气是衡量果实品质非常重要的一个指标, 是一个相对复杂的性状, 其由多种挥发性化合物共同构成。对于某些品种来说, 其特征香气物质是独一无二的并对果实的香气类型起决定性作用[2]。果实中特征香气物质的确定取决于其在果实中的浓度以及感知阈值[3]。不同挥发性化合物所表现出的香气特征有明显的差异, 且在不同品种中的含量及组成也有很大不同[4]。玫瑰香型葡萄品种中主要的挥发性化合物为通过萜烯类代谢途径合成的芳樟醇、橙花醇和香叶醇, 其中芳樟醇的感知阈值最低, 对葡萄果实的玫瑰香味贡献值最大[5-6]。此外葡萄果实中还包括由脂肪酸代谢途径产生的醛类、醇类、酮类等C6/C9挥发性化合物, 这些化合物的阈值很高, 个别化合物(如己醛、己烯醛等)在果实中的含量也极高, 这些C6/C9化合物对构成葡萄果实草香味发挥着重要的作用[7]。
2-甲基-D-赤藓糖醇-4-磷酸(MEP)途径主要由上游途径限速酶脱氧木酮糖-5-磷酸合成酶(DXS)、5-磷酸-脱氧木酮糖还原异构酶(DXR)、1-羟基-2-甲基-2-丁烯基-4-二磷酸还原酶(HDR), 中游途径限速酶香叶基焦磷酸合成酶(GPPS)和下游萜烯合酶(TPS)共同调控[8]。芳樟醇/橙花醇合成酶基因是TPS中的一员, 其表达水平与葡萄果实单萜物质积累显著相关[9]。脂肪酸代谢途径中的相关限速酶为脂氧合酶(LOX)、脱氢氧化裂解酶(HPL)、醇脱氢酶(ADH)和醇酰基转移酶(AAT)[7], 这些酶的相关基因表达水平与果实中C6/C9化合物含量相关[10]。
疏花疏果处理是葡萄生产管理过程中不可或缺的环节, 其通过改变负载量影响库源关系, 进而影响果实品质及产量[11-12]。合理疏花疏果处理可促进穗形美观, 成熟一致, 从而提高果实的商品价值。葡萄植株负载量变化显著影响果实品质和风味[13-14]。研究表明, 产量过高会导致葡萄果实可溶性固形物含量降低, 酸度偏高, 香气及风味物质含量减少; 产量过低会使树体营养生长过旺而影响果实生长发育, 进而影响整体经济效益[15]。因此, 合理的疏花疏果处理是提高果实品质非常重要的措施之一。
目前, 国内外更多的研究是针对葡萄产量对果实风味品质的影响, 而具体到单穗不同留果量对葡萄品质的影响则鲜有报道。本试验采用不同留果量处理(单穗40粒、60粒、80粒), 研究葡萄‘阳光玫瑰’果实中香气物质组成及相关基因的转录变化规律, 以期为指导田间实践、改善果实风味品质提供理论依据。
1 材料与方法 1.1 试验材料试验于2017和2018年在南京农业大学汤山葡萄试验基地进行。平架棚“H”型整形, 避雨栽培, 株距为8.0 m, 行距为6.0 m。以8年生葡萄品种‘阳光玫瑰’为试验材料, 选择树势一致, 生长良好的植株, 栽培管理措施同常规。在盛花期用25 mg · L-1赤霉素(GA3)+5 mg · L-1氯吡脲(CPPU)处理果穗, 盛花后2周再用25 mg · L-1GA3处理果穗。盛花后1周进行疏果处理, 疏去畸形果、发育较小果以及排列过密的果粒, 最终每穗分别保留40粒、60粒、80粒, 分别用L40、L60、L80表示。每个处理3棵树, 每个枝条上只保留1个果穗。
1.2 试验方法 1.2.1 样品采集从盛花后8周开始采集样品, 每隔2周采集1次, 采样时果穗上、中、下位置果粒均等采集, 每次采集90~100粒, 分为3个生物学重复。样品采完后立即放入冰盒中, 带回实验室, 一部分进行生理指标测定, 另一部分放入超低温-70 ℃冰箱保存备用。
1.2.2 果实品质测定于成熟期(花后16周)进行果实品质测定。使用游标卡尺测量单个果实纵、横径; 使用电子天平测量20~30个果实质量, 3次重复, 进而计算单果质量; 使用PAL-1便携式数显折光仪测定单个果实的可溶性固形物含量; 采用常规酸碱中和滴定法测定果实中的可滴定酸含量。
1.2.3 总RNA的提取以及荧光定量PCR使用植物总RNA提取试剂盒(Bioteke公司)提取果实总RNA。以总RNA为模板, 使用Prime ScriptTMRT-PCR试剂盒(TaKaRa)反转录合成cDNA。内参基因为VviUbiquitin, qRT-PCR引物利用Beacon Designer 7软件(Premier Biosoft公司)设计(表 1)。引物由上海捷瑞生物工程有限公司合成。反应体系为20 μL:SYBR Premix Ex Taq(TaKaRa)10 μL, 上、下游引物各0.5 μL, 250 μg · mL-1 cDNA 1 μL, 去离子水8 μL。反应程序:95 ℃ 4 min; 95 ℃ 20 s, 60 ℃ 20 s, 72 ℃ 30 s, 共40个循环。
| 基因名称 Gene name |
登录号 Gene ID |
引物序列 Primer sequence(5′→ 3′) |
功能 Function |
| VvDXS | LOC100247834 | GCTTGGGTACGGAGTTATGG/TAGTTGTCGGGTAGAGCGAT | 萜烯合成酶基因 |
| VvGPPS | LOC100232975 | AGAATCTGGGATTGGCATTCC/TGGCGGATGTCAGACAATGA | Terpene synthase genes |
| VvPNLinNer1 | LOC100854729 | AGATGGGATTTGTCTGCTTTCA/CTTATGCTCCTTGTGGACCTTG | |
| VvLOX | LOC100232917 | GGAAGGAAGCTGGCAGACAT/AGCCATCTTGATCAGCAGTGT | 脂肪酸代谢相关基因 |
| VvADH | LOC100247106 | TTGTGGCGGCTTCCATAGTT/CTAGGGGTTTGGGCCTTGAG | Fatty acid metabolism genes |
| VviUbiquitin | LOC100253716 | GTGGTATTATTGAGCCATCCTT/AACCTCCAATCCAGTCATCTAC | 内参基因Reference gene |
| 注: DXS:脱氧木酮糖-5-磷酸合成酶Deoxyxylulose-5-phosphate synthase; GPPS:香叶基焦磷酸合成酶Geranyl pyrophosphate synthase; PNLinNerl:芳樟醇合成酶Linalool synthase; LOX:脂氧合酶Lipoxygenase; ADH:醇脱氢酶Alcohol dehydrogenase.下同。The same as follows. | |||
采用王继源等[16]的方法, 并稍作改动。将葡萄样品去果柄和种籽, 用液氮研磨后, 取8 g置于20 mL顶空瓶中, 加入磁力搅拌子、1.0 g NaCl和10 μL 20 ng · μL-1 3-辛醇(内标), 50 ℃下平衡30 min, 萃取30 min, 磁力搅拌子转速为800 r · min-1。250 ℃下解离5 min。升温程序:40 ℃保持5 min, 然后以2 ℃ · min-1升至160 ℃, 保持2 min, 再以10 ℃ · min-1升至220 ℃, 保持1 min。载气为氦气, 不分流。色谱柱:DB Wax(30.0 m×250 μm×0.25 μm), 萃取头为50/30 μm PDMS/DVB/CAR SPME。
1.3 数据处理质谱图采用标准谱库NIST/WILEY和相关文献确定峰保留时间进行定性分析, 定量分析则采用峰面积归一法。
采用SPSS 17.0和Excel 2010软件进行统计学分析, 采用LSD检验进行显著性方差分析(P < 0.05)。
2 结果与分析 2.1 不同留果量处理对葡萄果实品质的影响由图 1可见:不同留果量处理对葡萄果实外观品质的影响明显。L40处理穗形美观, 果粒紧凑饱满, 果实色泽均匀; L80处理果粒偏小, 杂含大小果, 果实色泽不均匀; L60处理果实外观品质介于L40和L80处理之间。表明过多留果量会影响果实的外在品质, 不利于美观。由表 2可见:在2017和2018年, L40处理果实的纵、横径和单果质量显著高于L60和L80处理; L40处理果实可溶性固形物含量最高, 但与其余2个处理的差异不显著; L40处理果实可滴定酸含量明显低于L60和L80处理。

|
图 1 不同留果量处理的葡萄果实外观比较 Fig. 1 The comparison of the grape in different fruit load treatments L40、L60、L80分别表示单穗留果量为40粒、60粒、80粒的处理。下同。 L40, L60, L80 indicate the treatment of 40, 60, 80 berry numbers per cluster. The same as follows. |
| 指标Index | 2017 | 2018 | |||||
| L40 | L60 | L80 | L40 | L60 | L80 | ||
| 果实纵径/mm Longitudinal diameter | 34.79±1.09a | 31.90±1.49b | 29.40±2.12c | 34.53±1.02a | 32.62±1.12b | 28.93±1.95c | |
| 果实横径/mm Transverse diameter | 27.18±1.08a | 24.97±1.34b | 24.22±1.91b | 26.41±0.99a | 24.76±1.38b | 24.31±1.08b | |
| 果形指数Fruit shape index | 1.28±0.04a | 1.28±0.02a | 1.21±0.06b | 1.31±0.09a | 1.32±0.12a | 1.20±0.14b | |
| 单果质量/g Weight per fruit | 15.98±0.43a | 13.04±0.94b | 12.23±0.27c | 15.63±0.45a | 12.97±0.54b | 12.09±0.54c | |
| 可溶性固形物含量/% Soluble solid content | 18.70±0.62a | 18.57±0.75a | 17.90±0.97a | 18.10±0.53a | 17.92±1.21a | 17.82±1.79a | |
| 可滴定酸含量/(mg·L-1) Titratable acidity content | 0.14±0.01c | 0.22±0.02b | 0.32±0.01a | 0.17±0.02b | 0.19±0.01b | 0.28±0.02a | |
| 注:不同字母表示不同处理间差异显著(P < 0.05)。下同。 Note:Different letters indicate significant difference at 0.05 level among different treatments. The same as follows. | |||||||
由表 3可见:随着葡萄果实不断发育成熟, 果实中的芳香物质总含量不断升高, 但各香气物质组分的发展趋势不同。C6化合物在果实香气成分中占有很高的比例, 尤其是己醛和2-己烯醛, 随着果实不断发育其含量呈明显上升趋势, 并于花后14周达峰值, 随后下降, 但在2017年花后16周, L40和L80处理果实己醛和己烯醛含量继续上升。2017和2018年, L60处理果实己醛含量总体上高于其他2个处理。2-己烯醛含量变化同己醛变化规律相似, 均为先升高后降低。在2018年的花后12、14和16周, L60处理2-己烯醛含量均显著高于L40和L80处理。3-己烯-1-醇和1-己醇在果实中的含量比己醛和2-己烯醛低很多, 并且各处理间含量变化规律与己醛和己烯醛差异较大。在2018年花后16周, L60处理果实中3-己烯-1-醇和1-己醇含量显著高于其他处理。
| ng·g-1 | |||||||||
| 种类 Kinds |
化合物 Compound |
花后周数 WAF |
2017 | 2018 | |||||
| L40 | L60 | L80 | L40 | L60 | L80 | ||||
| C6化合物 C6 compound |
己醛 Hexanal |
8 | 63.98c | 97.23a | 84.10b | 71.46b | 132.94a | 125.46a | |
| 10 | 126.75b | 163.39b | 223.77a | 173.42a | 185.47a | 80.09b | |||
| 12 | 154.08b | 164.86a | 119.02c | 218.24b | 268.95a | 269.54a | |||
| 14 | 163.19b | 290.26a | 143.96c | 402.54b | 503.92a | 302.83c | |||
| 16 | 196.54b | 210.25a | 183.23c | 312.53b | 342.67a | 264.34c | |||
| 2-己烯醛 2-hexenal |
8 | 23.78c | 56.12a | 34.21b | 33.51a | 11.04c | 30.73b | ||
| 10 | 64.38c | 74.07a | 73.50b | 148.75a | 127.75b | 62.28c | |||
| 12 | 71.52a | 73.27a | 37.50b | 154.45c | 183.91a | 183.71b | |||
| 14 | 64.41a | 68.89a | 38.61b | 271.60c | 425.07a | 355.20b | |||
| 16 | 41.97b | 44.61a | 44.36a | 246.90b | 316.41a | 242.78b | |||
| 3-己烯-1-醇 3-hexen-1-ol |
8 | 10.48a | 9.79b | 5.62c | 6.87b | 8.55a | 2.94c | ||
| 10 | 18.74b | 20.03a | 9.37c | 7.91a | 7.04a | 7.49a | |||
| 12 | 42.77a | 22.75b | 13.80c | 4.25a | 4.12ab | 3.60b | |||
| 14 | 53.81a | 32.65b | 20.76c | 12.95c | 16.43b | 17.12a | |||
| 16 | 42.21a | 31.21b | 30.98b | 15.98c | 18.73a | 17.58b | |||
| 1-己醇 1-hexanol |
8 | 6.45c | 10.38a | 9.76b | 3.69b | 4.55a | 3.83ab | ||
| 10 | 10.83c | 13.51a | 12.30b | 4.31b | 9.62a | 4.55b | |||
| 12 | 24.69a | 18.08b | 11.27c | 4.76c | 13.90a | 11.53b | |||
| 14 | 23.46b | 52.67a | 19.74c | 5.87c | 14.69a | 12.57b | |||
| 16 | 30.19b | 28.37c | 33.27a | 11.48c | 15.09a | 12.53b | |||
| 总含量 Total content |
8 | 104.69c | 173.52a | 133.69b | 115.53c | 157.08b | 162.96a | ||
| 10 | 220.70c | 271.00b | 318.94a | 334.39a | 329.88b | 154.41c | |||
| 12 | 293.06a | 278.96b | 181.59c | 381.70b | 470.88a | 468.38a | |||
| 14 | 304.87b | 444.47a | 223.07c | 692.96b | 960.11a | 687.72c | |||
| 16 | 310.91a | 314.44a | 291.84b | 586.89b | 692.90a | 537.23c | |||
| 萜烯类 Terpenes |
芳樟醇 Linalool |
8 | — | 2.35a | 1.94b | — | — | 1.87 | |
| 10 | 8.79b | 8.95b | 9.75a | 7.48c | 9.24b | 12.89a | |||
| 12 | 13.30b | 30.33a | 10.09c | 13.01b | 16.67a | 12.55b | |||
| 14 | 47.60b | 56.74a | 46.71b | 30.31b | 39.55a | 25.85c | |||
| 16 | 66.56a | 24.66c | 27.65b | 55.26a | 42.31b | 29.25c | |||
| 香叶醇 Geraniol |
8 | 1.98a | 1.05b | 0.83b | — | — | — | ||
| 10 | 2.34a | 1.97ab | 1.63b | 2.10ab | 1.95c | 2.32a | |||
| 12 | 1.63a | 1.64a | 1.56b | 2.55c | 5.30a | 3.39b | |||
| 14 | 2.83b | 3.06a | 2.13c | 13.39a | 10.70b | 9.69c | |||
| 16 | 3.72a | 3.60b | 2.44c | 15.43a | 11.70b | 10.67c | |||
| 萜品醇 Terpineol |
8 | 0.65c | 3.19a | 2.47b | — | — | — | ||
| 10 | 1.92b | 5.28a | 5.03a | — | — | — | |||
| 12 | 4.00b | 6.57a | 6.65a | — | — | — | |||
| 14 | 4.89b | 10.85a | 10.44a | — | — | — | |||
| 16 | 8.01a | 4.81c | 6.68b | — | — | — | |||
| 6-甲基-5-庚烯-2-酮 6-methyl-5-hepten-2-one |
8 | 1.98c | 2.63a | 2.35b | 2.38b | 1.43c | 2.67a | ||
| 10 | 2.81c | 3.29b | 3.98a | 6.12a | 3.81b | 2.32c | |||
| 12 | 2.78b | 3.45a | 3.82a | 5.64a | 3.33b | 3.53b | |||
| 14 | 3.84b | 5.82a | 5.79a | 5.15b | 12.23a | 4.67b | |||
| 16 | 5.39b | 6.21a | 6.64a | 8.54b | 11.87a | 5.61c | |||
| 橙花醇 Nerol |
8 | — | — | — | — | — | — | ||
| 10 | 2.68a | 1.73b | 2.27a | 1.56b | 2.64a | 2.10a | |||
| 12 | 1.03c | 1.77b | 2.63a | 1.70c | 3.43a | 1.97b | |||
| 14 | 2.06a | 1.73ab | 1.66b | 8.39a | 6.88b | 5.71c | |||
| 16 | 2.01a | 1.72b | 1.17c | — | — | — | |||
| 去氢芳樟醇 Hotrienol |
8 | — | — | — | — | — | — | ||
| 10 | 2.35b | 2.16b | 3.27a | — | — | — | |||
| 12 | 1.45a | 1.46a | 1.30a | — | — | — | |||
| 14 | 3.83c | 9.55a | 7.54b | — | — | — | |||
| 16 | 5.38a | 4.48b | 4.46b | — | — | — | |||
| 顺式氧化芳樟醇 Cis-linaloloxide |
8 | — | 0.42a | 0.31a | — | — | — | ||
| 10 | 1.12a | 1.02ab | 0.84b | — | — | — | |||
| 12 | 1.81a | 1.78a | 1.12b | — | — | — | |||
| 14 | 5.50a | 5.09b | 4.42c | — | — | — | |||
| 16 | 3.77 | — | — | — | — | — | |||
| 香茅醇 Citronellol |
8 | — | — | — | — | 1.92a | 1.60a | ||
| 10 | — | — | — | 1.65b | 2.24ab | 2.98a | |||
| 12 | — | — | — | 2.47b | 2.65b | 4.02a | |||
| 14 | — | — | — | 4.86 | — | — | |||
| 16 | — | — | — | — | — | — | |||
| 总含量 Total content |
8 | 4.61c | 9.64a | 7.90b | 2.38c | 3.35b | 6.14a | ||
| 10 | 22.01c | 24.40b | 26.77a | 18.91c | 19.88b | 22.61a | |||
| 12 | 26.00b | 47.00a | 27.17b | 25.37b | 31.38a | 25.46b | |||
| 14 | 70.55c | 92.84a | 78.69b | 62.10b | 69.36a | 45.92c | |||
| 16 | 94.84a | 45.48c | 49.04b | 79.23a | 65.88b | 45.53c | |||
| 注:WAF:花后周数。下同。 Note:WAF:Week after flowering. The same as follows. | |||||||||
随着果实不断发育成熟, L40处理果实中萜烯类总含量逐渐升高并于花后16周显著高于其他处理, 而L60和L80处理于花后14周达最大值, 之后下降。芳樟醇在萜烯类物质中占有比例较高。在2017年, L40处理果实中芳樟醇含量逐步上升, 于花后16周达最高值, 而L60和L80处理于花后14周达最高值, 随后下降; 在2018年, 3种处理均是于花后16周达最高值, 且L40处理果实其含量增长速度最快。果实中香叶醇含量同样随果实发育呈上升趋势。花后16周时, L40处理其含量显著高于其他处理。萜品醇仅在2017年的果实中被检测到, 在L40处理果实中其含量逐步上升, 而L60和L80处理果实其含量于花后14周达峰值并高于L40处理, 但在花后16周显著低于L40处理。与此相反, 香茅醇则仅在2018年的果实中检测到, 其在L40处理果实中消失时间较L60、L80处理更晚。
2.3 不同留果量处理对葡萄果实香气合成相关基因表达的影响由图 2可见:在果实发育前期, L40处理果实中的VvLOX和VvADH表达量高于其余2个处理, 且在2017年和2018年的花后10周, L40处理显著高于其他处理。花后14周, L60处理果实VvLOX表达量显著高于其他2个处理。在果实发育后期, L60处理果实VvADH表达量一直上调, 于花后16周与其他2个处理差异显著。
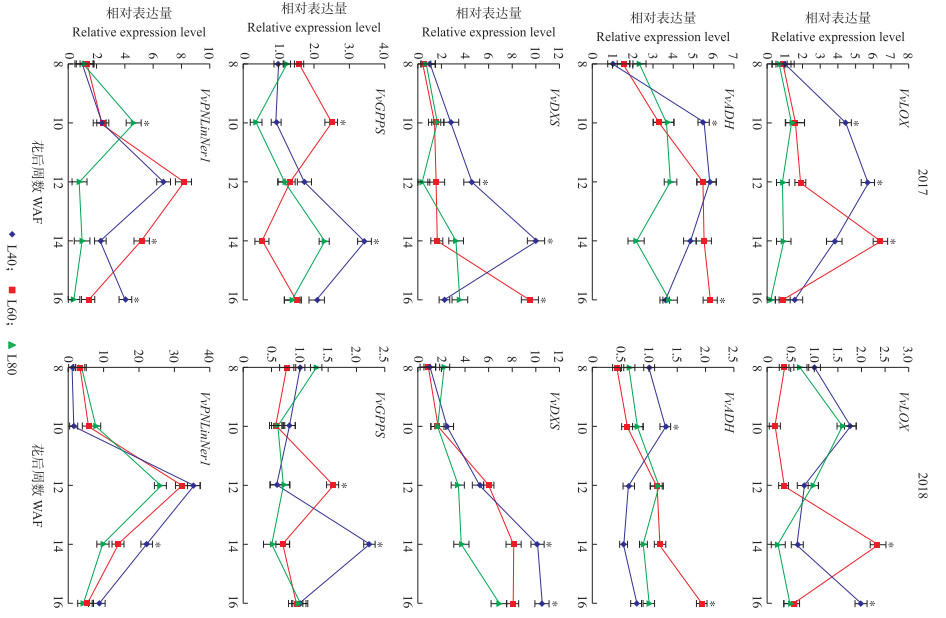
|
图 2 不同留果量处理对葡萄香气相关基因表达的影响 Fig. 2 Effect of different fruit load treatments on the expression level of aroma related genes in grape *P < 0.05. |
在2017年果实发育前期, L40处理果实的VvDXS表达呈上调趋势, 并于花后14周达峰值且显著高于其他处理; 在2018年, 3个处理果实的VvDXS表达均呈上调趋势, 在花后14和16周, L40处理显著高于其他2个处理。L40处理果实VvGPPS表达水平在花后14周显著高于其他2个处理。在2017年, L80处理果实VvPNLinNer1基因表达量于花后10周达到表达高峰, L40和L60处理于花后12周达表达峰值, 并且L60处理最高表达量高于L40处理; 但在花后16周, L40处理VvPNLinNer1基因表达量上调, 并且显著高于其他处理; 在2018年也表现出类似的表达变化趋势, L80处理果实于发育前期其表达量高于其他2个处理, 而在果实发育中、后期, L40处理表达水平较高。
由表 4可见:VvLOX基因的表达与2-己烯醛、3-己烯-1-醇和1-己醇均呈显著相关关系, 而VvADH则与2种醇类呈极显著相关关系(P < 0.01)。在萜烯类代谢途径中, VvDXS基因的转录表达与全部的萜烯类呈显著或极显著相关关系, 并且与果实中萜烯总含量极显著相关。VvPNLinNer1基因的转录表达未与任何香气物质合成相关。
| 化合物Compound | VvLOX | VvADH |
| 己醛Hexanal | ||
| 2-己烯醛2-hexenal | 0.589* | |
| 3-己烯-1-醇3-hexen-1-ol | 0.575* | 0.728** |
| 1-己醇1-hexanol | 0.545* | 0.699** |
| 芳樟醇Linalool | 0.472* | |
| 香叶醇Geraniol | 0.734* | |
| 6-甲基-5-庚烯-2-酮6-methyl-5-hepten-2-one | 0.612** | |
| 橙花醇Nerol | 0.480* | |
| 香茅醇Citronellol | 0.709* | 0.712* |
| 顺式氧化芳樟醇Cis-linaloloxide | 0.628* | |
| 萜烯类总含量Total content of terpenes | 0.544** | |
| Note:*P < 0.05, * * P < 0.01. | ||
葡萄生产栽培管理过程中的疏花疏果处理可以减少树体负载量, 调节植株营养生长和生殖生长的均衡发展, 避免过分耗损树体营养, 从而减少大小年现象的发生[17]。研究表明, 不同负载量会显著影响葡萄果实糖、酸等营养品质, 适当进行疏穗处理能有效提高果实品质[11-12]。Gil等[18]通过对葡萄进行疏减穗数和单穗疏果处理发现, 2种处理较对照组均明显提高果实单果质量, 降低可滴定酸含量, 并且疏穗处理显著提高可溶性固形物含量, 但疏果处理作用不显著。本试验表明, L40处理较L60、L80处理其单果质量显著提高, 可滴定酸含量显著降低, 可溶性固形物含量差异不明显, 与上述研究结果相一致。疏果处理对果实外观品质影响明显, L80处理较其余处理果粒偏小、果面色泽不均匀, 成熟度不一致, 这与宋润刚等[19]的研究结果相一致。另有研究表明, 光照条件会显著影响果实的内在和外在品质, 影响果实着色[20], 与L40处理相比, L80处理果粒分布过于紧凑, 导致受光面积不均匀, 因而果实发育不一致。
负载量的高低对果实的风味也有极大的影响, 负载量的改变直接影响到树体的库源平衡从而影响果实风味物质积累[13, 21]。本试验结果表明, L60处理果实中C6化合物总含量在整个发育过程中始终高于L40处理, 这与Naor等[22]的试验结果一致, 随着负载量的增加, 葡萄果实的草香味增加。同时, L80处理果实中C6化合物含量在果实发育前期高于L40处理, 但发育后期低于L40处理, 可能是由于L80处理果穗在发育后期所需营养需求过大, 库源矛盾突出导致营养物质积累减少, 从而导致果实中风味物质合成减少[23-24]。本研究中L60处理果实在发育后期其VvLOX基因表达量明显升高且高于其他2个处理, 这与醛类物质合成变化规律相似。VvADH基因在果实发育后期依然保持较高的表达水平, 这与成熟期果实中高含量醇类物质有关[7], 且相关性分析表明VvADH转录变化规律与2种醇类物质含量极显著相关。
萜烯类物质是玫瑰香型葡萄中含量非常丰富的一类化合物, 其中含量较高的为单萜类物质[6]。有研究表明, 增加枝条负载量会降低葡萄果实中芳樟醇及芳樟醇氧化物含量[25]。Rutan等[26]认为疏穗处理会使果实中C13降异戊二烯衍生物和单萜含量增加。但也有研究表明, 疏穗处理不会显著影响果实单萜含量[27], 这或许是因为品种不同或当地气候条件的影响[21]。本试验中, 葡萄果实成熟期萜烯类物质总含量随留果量的增加而降低。在果实不同发育阶段, 各处理间的萜烯类物质总含量变化趋势与VvDXS转录变化规律相一致, 且显著相关。随着果实发育成熟, 萜烯类物质总含量逐渐增加, VvDXS转录上调, 这与Zhang等[28]的试验结果相类似。相关性分析表明, VvDXS转录变化与不同处理果实中各香气组分积累差异相关, 表明留果量处理会显著影响VvDXS的转录表达, 进而影响果实中各萜烯类物质组分含量。芳樟醇在果实中的含量被认为与VvPNLinNer1转录水平相关[9]。在本试验中, 各处理间的芳樟醇含量变化趋势与VvPNLinNer1的转录变化规律类似, 花后16周L40处理果实芳樟醇含量高于其他处理, 但不同处理间的VvPNLinNer1转录与芳樟醇含量无相关关系。对于其他萜烯类物质如萜品醇、橙花醇、去氢芳樟醇、香茅醇、6-甲基-5-庚烯-2-酮, 这些物质在L60和L80处理果实中其含量都先于L40处理到达高峰, 之后下降, 与VvGPPS转录变化趋势相类似。这与王继源等[16]报道VvGPPS转录水平与果实中萜烯物质含量有关相符。在2017和2018年, 各处理间果实中萜烯类物质组成成分有差异, 可能是由于大部分物质是以结合态形式贮存在果实中, 游离态形式含量太低以致未被检测到[29]。
综上所述, 相比L60和L80处理, L40处理的果实品质最佳, 香味保留持久, 可以显著提高果实的商品价值, 延长挂果期, 从而为指导葡萄田间疏果管理提供了一定的理论基础。
| [1] |
Yamada M, Yamane H, Sato A, et al. New grape cultivar 'Shine Muscat'[J]. Bulletin of the National Institute of Fruit Tree Science, 2008, 7: 21-38. |
| [2] |
Tomas Barberan F A. Phytochemistry of Fruit and Vegetables[M]. Oxford: Oxford University Press, 1997: 23-25.
|
| [3] |
Seymour G B, Taylor J E, Tucker G A. Biochemistry of Fruit Ripening[M]. Dordrecht: Springer, 1993: 217-219.
|
| [4] |
Wu Y, Duan S, Zhao L, et al. Aroma characterization based on aromatic series analysis in table grapes[J]. Scientific Reports, 2016, 6: 31116. DOI:10.1038/srep31116 |
| [5] |
Marais J. Terpenes in the aroma of grapes and wines:a review[J]. South African Journal of Enology and Viticulture, 1983, 4(2): 49-58. DOI:10.21548/4-2-2370 |
| [6] |
Genovese A, Lamorte S A, Gambuti A, et al. Aroma of Aglianico and Uva di Troia grapes by aromatic series[J]. Food Research International, 2013, 53(1): 15-23. DOI:10.1016/j.foodres.2013.03.051 |
| [7] |
Kalua C M, Boss P K. Evolution of volatile compounds during the development of Cabernet Sauvignon grapes(Vitis vinifera L.)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3818-3830. DOI:10.1021/jf803471n |
| [8] |
Martin D M, Chiang A, Lund S T, et al. Biosynthesis of wine aroma:transcript profiles of hydroxymethylbutenyl diphosphate reductase, geranyl diphosphate synthase, and linalool/nerolidol synthase parallel monoterpenol glycoside accumulation in Gewürztraminer grapes[J]. Planta, 2012, 236(3): 919-929. DOI:10.1007/s00425-012-1704-0 |
| [9] |
Sasaki K, Takase H, Matsuyama S, et al. Effect of light exposure on linalool biosynthesis and accumulation in grape berries[J]. Bioscience, Biotechnology and Biochemistry, 2016, 80(12): 2376-2382. DOI:10.1080/09168451.2016.1217148 |
| [10] |
Rambla J L, Trapero-Mozos A, Diretto G, et al. Gene-metabolite networks of volatile metabolism in airen and tempranillo grape cultivars revealed a distinct mechanism of aroma bouquet production[J]. Frontiers in Plant Science, 2016, 7: 1619. DOI:10.3389/fpls.2016.01619 |
| [11] |
Matus M, Rodriguez J, Ocvirk M. Raleo de racimos en Vitis vinifera cv. Malbec:efecto sobre los componentes del rendimiento y la composición polifenólica de las bayas[J]. Rev Fac Cienc Agrar, 2006, 38(1): 105-112. |
| [12] |
李越, 姚冠榕, 陈武, 等. 疏穗处理对'赤霞珠'葡萄果实糖、酸及异戊二烯类香气物质积累的影响[J]. 果树学报, 2018, 35(2): 185-194. Li Y, Yao G R, Chen W, et al. Effect of cluster thinning on sugar/acidity and the accumulation of isoprene-derivated volatiles in 'Cabernet Sauvignon' grape berries[J]. Journal of Fruit Science, 2018, 35(2): 185-194 (in Chinese with English abstract). |
| [13] |
Jackson D I, Lombard P B. Environmental and management practices affecting grape composition and wine quality:a review[J]. American Journal of Enology and Viticulture, 1993, 44(4): 409-430. DOI:10.0000/PMID303 |
| [14] |
Bureau S M, And R L B, Razungles A J. Effects of vine or bunch shading on the glycosylated flavor precursors in grapes of Vitis vinifera L. cv. Syrah[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1290-1297. DOI:10.1021/jf990507x |
| [15] |
Gambetta J M, Bastian S E P, Cozzolino D, et al. Factors influencing the aroma composition of chardonnay wines[J]. Journal of Agricultural and Food Chemistry, 2014, 62(28): 6512-6534. DOI:10.1021/jf501945s |
| [16] |
王继源, 冯娇, 侯旭东, 等. CPPU对'阳光玫瑰'葡萄品质及香气合成相关基因表达的影响[J]. 南京农业大学学报, 2016, 39(6): 915-923. Wang J Y, Feng J, Hou X D, et al. Effects of CPPU on aroma components and biosynthetic genes expression in 'Shine Muscat' grapes[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 915-923 (in Chinese with English abstract). DOI:10.7685/jnau.201603020 |
| [17] |
刘显臣.负载量及套袋对京亚葡萄产量和品质的影响[D].北京: 中国农业科学院, 2007: 10-14. Liu X C. Affections toward yielding quantity and quality of Jingya grape by loading amount and bag-wrappig[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007: 10-14(in Chinese with English abstract). |
| [18] |
Gil M, Esteruelas M, González E, et al. Effect of two different treatments for reducing grape yield in Vitis vinifera cv Syrah on wine composition and quality:berry thinning versus cluster thinning[J]. Journal of Agricultural and Food Chemistry, 2013, 61(20): 4968-4978. DOI:10.1021/jf400722z |
| [19] |
宋润刚, 路文鹏, 沈育杰, 等. 山葡萄单株留果量对产量和果实品质的影响[J]. 中外葡萄与葡萄酒, 2008(1): 14-16. Song R G, Lu W P, Shen Y J, et al. Effect of load of individual vine on the yield and fruit quality of V. amurensis Rupr[J]. Sino-Overseas Grapevine and Wine, 2008(1): 14-16 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-7360.2008.01.004 |
| [20] |
张秀美, 王宏, 刘志, 等. '岳帅'苹果不同负载量光照分布与果实品质的关系[J]. 果树学报, 2017, 34(11): 1408-1414. Zhang X M, Wang H, Liu Z, et al. Relationships between distribution of relative light intensity and quality in 'Yueshuai' apple with different fruit loads[J]. Journal of Fruit Science, 2017, 34(11): 1408-1414 (in Chinese with English abstract). DOI:10.13925/j.cnki.gsxb.20170014 |
| [21] |
Condurso C, Cincotta F, Tripodi G, et al. Effects of cluster thinning on wine quality of Syrah cultivar(Vitis vinifera L.)[J]. European Food Research and Technology, 2016, 242(10): 1719-1726. DOI:10.1007/s00217-016-2671-7 |
| [22] |
Naor A, Gal Y. Shoot and cluster thinning influence vegetative growth, fruit yield, and wine quality of 'Sauvignon blanc' grapevines[J]. Journal of the American Society for Horticultural Science, 2002, 127(4): 628-634. DOI:10.21273/JASHS.127.4.628 |
| [23] |
刘传和, 陈杰忠, 刘运春, 等. 疏果对黄皮果实发育着色及树体器官碳水化合物含量的影响[J]. 园艺学报, 2008, 35(6): 869-872. Liu C H, Chen J Z, Liu Y C, et al. Effects of fruit-thinning on fruits development, pigmentation and carbohydrate content in plant organs of wampee[J]. Acta Horticulturae Sinica, 2008, 35(6): 869-872 (in Chinese with English abstract). DOI:10.3321/j.issn:0513-353X.2008.06.015 |
| [24] |
Diago M P, Vilanova M, Blanco J A, et al. Effects of mechanical thinning on fruit and wine composition and sensory attributes of Grenache and Tempranillo varieties(Vitis vinifera L.)[J]. Australian Journal of Grape and Wine Research, 2010, 16(2): 314-326. DOI:10.1111/j.1755-0238.2010.00094.x |
| [25] |
Reynolds A G, Edwards C G, Wardle D A, et al. Shoot density affects 'riesling' grapevines. Ⅱ. Wine composition and sensory response[J]. Journal of the American Society for Horticultural Science, 1994, 119(5): 881-892. DOI:10.21273/JASHS.119.5.881 |
| [26] |
Rutan T E, Herbst-Johnstone M, Kilmartin P A. Effect of cluster thinning Vitis vinifera cv. Pinot Noir on wine volatile and phenolic composition[J]. Journal of Agricultural and Food Chemistry, 2018, 66(38): 10053-10066. DOI:10.1021/acs.jafc.8b04062 |
| [27] |
Kok D. Variation in total phenolic compounds, anthocyanin and monoterpene content of 'Muscat Hamburg' table grape variety(V. vinifera L.)as affected by cluster thinning and early and later period basal leaf removal treatments[J]. Erwerbs-Obstbau, 2016, 58(4): 241-246. DOI:10.1007/s10341-016-0283-9 |
| [28] |
Zhang E, Chai F, Zhang H, et al. Effects of sunlight exclusion on the profiles of monoterpene biosynthesis and accumulation in grape exocarp and mesocarp[J]. Food Chemistry, 2017, 237: 379-389. DOI:10.1016/j.foodchem.2017.05.127 |
| [29] |
D'Onofrio C, Matarese F, Cuzzola A. Study of the terpene profile at harvest and during berry development of Vitis vinifera L. aromatic varieties Aleatico, Brachetto, Malvasia di Candia aromatica and Moscato bianco[J]. Journal of the Science of Food and Agriculture, 2017, 97(9): 2898-2907. DOI:10.1002/jsfa.8126 |




