文章信息
- 钟廷龙, 朱拼玉, 王雪艳, 王团团, 李季, 陈劲枫
- ZHONG Tinglong, ZHU Pinyu, WANG Xueyan, WANG Tuantuan, LI Ji, CHEN Jingfeng
- 乙烯信号通路转录因子EIL1参与番茄单性结实的机制
- Mechanism of transcriptional factor EIL1 in ethylene signaling pathway regulating parthenocarpy in tomato
- 南京农业大学学报, 2019, 42(5): 811-817
- Journal of Nanjing Agricultural University, 2019, 42(5): 811-817.
- http://dx.doi.org/10.7685/jnau.201812038
-
文章历史
- 收稿日期: 2018-12-24
单性结实是指植物子房不经授粉/受精而直接形成果实的现象。在生物进化过程中, 植物的无籽果实比有籽果实更能够吸引食果鸟类的注意力, 减少了种子被吞食的概率, 对植物的生存和繁衍有重要的生物学意义[1-2]。在作物生产中, 低温阴雨天气会降低花粉活力与数量, 导致果实败育, 影响瓜果类作物的产量, 若利用单性结实性则能够避免这些问题[3]。且无籽果实还能解决设施生产中使用虫媒或人工授粉成本高的问题, 有效降低劳动强度, 提高经济效益。由于缺少种子, 无籽果实果肉更厚, 品质更好, 果实的储藏时间和货架期可以有效延长[4-6]。
植物单性结实受到多种激素与环境的共同调控。早在20世纪30年代, 研究者便发现生长素是调控单性结实的重要激素, 在番茄等多种植物的子房柱头上涂抹生长素类物质能够导致子房产生单性结实[7]。在子房或胚珠中人工表达外源生长素相关基因同样能够诱导单性结实[8-10]。番茄生长素信号通路相关基因的研究发现, 过量表达生长素受体基因SlTIR1能引起单性结实[11], 而分别下调生长素应答基因SlIAA9和SlARF7也能够引起单性结实[12-13]。另外, 降低生长素极性运输基因SlPIN4的表达也能够形成单性结实[14]。乙烯是植物生长发育调控的另一种重要激素, 既与植物器官的成熟衰老密切相关, 也参与调控花的雌雄性型分化[15]。目前, 有关乙烯的研究主要集中在果实的成熟后调控, 但有研究发现乙烯在果实发育过程中也参与了调控。在单性结实番茄品种的开花期, 乙烯可以模仿授粉信号, 诱导子房中的生长素合成, 促进子房生长, 最终形成无籽果实[16]。
EIN3/EIL是乙烯信号通路中关键转录因子, 参与一系列的乙烯应答反应调控。拟南芥突变体研究显示, EIN3突变严重减弱了植物对乙烯的响应, 而过量表达EIN3/EIL会造成植株矮小、早衰等组成性的乙烯表型。Teiman等[17]研究发现在番茄中下调表达SlEIL1能显著降低植株对乙烯的敏感性, 使叶片向上生长, 延迟花的衰老和果实的成熟。Li等[18]进一步观察到在番茄中过量表达SlEIL1基因可以引起明显的乙烯表型, 例如花蕾早衰、果实早熟等现象, 而共抑制表达(co-suppression)SlEIL1会形成专性单性结实表型(obligate parthenocarpy), 即无论授粉与否果实均为无籽果实[19]。本研究利用SlEIL1上调表达和下调表达转基因材料, 开展了乙烯信号通路转录因子EIL1参与番茄单性结实的机制研究, 为明确乙烯在番茄单性结实中的作用提供理论基础。
1 材料与方法 1.1 试验材料供试材料为野生型番茄(WT)、EIL1过量表达转基因番茄(EIL-OX)、EIL1共抑制表达转基因番茄(EIL-CS)、EIL1启动子驱动GUS报告基因的转基因番茄(PE1∷GUS)、DR5启动子驱动GUS报告基因的转基因番茄(DR5∷GUS)、EIL-OX与DR5∷GUS植株的杂交F1(EIL-OX/DR5∷GUS)[19], 均由南京农业大学葫芦科作物遗传与种质创新实验室保存。每种材料取10株种植于人工气候箱, 培养条件:光/暗时间为12 h/12 h, 光/暗温度为28 ℃/23 ℃。
EIL-OX和DR5∷GUS的杂交授粉:开花前2 d对EIL-OX进行去雄处理并套袋, 对DR5∷GUS直接进行套袋处理。开花当天取套袋的DR5∷GUS花粉对EIL-OX进行授粉, 之后套袋处理。果实成熟后收取杂交种子。
1.2 Ag+处理植株模拟EIL1下调试验由于EIL-CS是专性单性结实表型, 并未获得其自交种子。Ag+是乙烯信号细胞膜受体的竞争性抑制因子, 本研究将硫代硫酸银(AgS2O3)作为乙烯抑制剂, 开展试验处理。当WT和DR5∷GUS植株进入花期后, 选择开花前2 d(花瓣刚转黄色)的25个花蕾去雄, 使用现配的100 mg · L-1的AgS2O3喷洒花蕾, 1周后进行第2次喷洒处理。处理在番茄处于暗周期的条件下进行, 喷洒量以不滴液为准, 完成后套袋标记。
1.3 各发育时期番茄花的GUS染色各材料分别取开花前1 d(花瓣为明显的黄色但未开花)、开花当天和开花后1 d的花蕾各10个, 每个花蕾保留果柄且去掉能被染色的花药。花蕾使用无菌水冲洗数次, 置于2 mL离心管中, 采用李季[19]的GUS染色方法进行组织染色, 并利用体式显微镜进行观察拍照。
1.4 各发育时期番茄石蜡组织切片将50%(体积分数)乙醇90 mL、冰醋酸5 mL和38%甲醛(福尔马林)5 mL混合配制成植物组织固定液。每种材料分别在开花前1 d、当天和开花后1 d随机取5个样品, 去掉果柄和花药, 分别置于固定液中。随后以-25 kPa抽真空, 维持5~10 min, 常温固定24~36 h。样品石蜡切片使用1%(体积分数)甲苯胺蓝或番红-固绿染色, 切片由南京菲尔特生物技术有限公司制作, 每个样品做3张石蜡切片。
1.5 EIL1转基因番茄中生长素(IAA)含量的测定从栽培10周的成熟植株上分别采取花蕾、花以及幼果期(花后4 d)、绿熟期(花后35 d)、破色期(花后42 d)和成熟期(花后50 d)的果实各3个用于IAA含量的测定。采用ELISA酶联免疫法测定IAA含量, 操作方法参照试剂盒(上海碧云天生物技术有限公司)说明书。
1.6 EIL1基因表达分析采用Trizol(Invitrogen)法提取番茄组织总RNA, 采用10 g · L-1琼脂糖凝胶电泳检测纯度, 按照RevertAidTM First Strand cDNA Synthesis Kit说明书合成cDNA。采用SYBR Green/ROX qPCR试剂盒进行RT-qPCR, 3次重复。基因SlEIL1(登录号:543679)的RT-qPCR的引物为EIL1-F:5′-CGGAAATCTACCTAGCATTGGATAC-3′和EIL1-R:5′-ACTTCTGGCTGGCTAGTACAAA-3′; 内参基因SlUbi3 (X58253)的引物:Ubi-F:5′-CAGGACAAGGAAGGGAT-3′和Ubi-R:5′-ACCGCACTCAGCATTAG-3′, 均由南京金斯瑞生物公司合成。采用2-ΔΔCT法计算EIL1基因相对表达量。
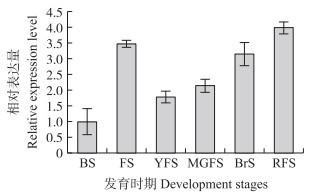
2 结果与分析 2.1 EIL1基因在番茄不同发育时期的表达分析由图 1可见:在番茄不同发育时期, EIL1基因的表达量呈升高-降低-升高的趋势, 即在花蕾期较低, 开花期时迅速升高, 是花蕾期的3.5倍; 开花后SlEIL1基因在果实中的表达量又迅速降低, 之后随果实的成熟逐渐升高, 并在果实成熟时达到峰值。
|
图 1 EIL1基因在番茄不同发育时期的表达分析 Fig. 1 Expression analysis of EIL1 gene of tomato at different development stages BS:花蕾期Bud stage; FS:开花期Flowering stage; 幼果期Young fruit stage; MGFS:绿熟期Mature green fruit stage; BrS:破色期Break stage; RFS:成熟期Ripen fruit stage.下同。The same as follows. |
在植株营养生长阶段, 各株系的生长状态无明显差异, 但在进入开花期后, EIL1基因过量表达的植株, 包括EIL-OX和EIL-OX/DR5∷GUS均表现为植株较矮, 叶片小而内卷并向地生长, 侧枝大量出现(图 2); 而EIL-CS植株的株高基本无变化, 但叶片较厚, 叶面平展且叶间距增大, 无侧芽形成(图 3); 进入盛花期后, EIL1过量表达植株虽然开花数量与野生型无差别, 但是部分花蕾出现凋亡, 且生殖后期植株提前衰老(图 3)。

|
图 2 野生型及EIL1转基因番茄植株表型 Fig. 2 The phenotypes of wild-type and EIL1 transgenic tomato WT:野生型植株Wild-type plant; EIL-OX:EIL1过量表达转基因番茄EIL1 overexpressing transgenic tomato; EIL-CS:EIL1共抑制表达转基因番茄EIL1 co-suppression transgenic tomato; DR5∷GUS:DR5启动子驱动GUS报告基因的转基因番茄Transgenic tomato of GUS reporter gene driven by DR5 promoter; PE1∷GUS:EIL1启动子驱动GUS报告基因的转基因番茄Transgenic tomato of GUS reporter gene driven by the EIL1 promoter.下同。The same as follows. |

|
图 3 EIL1转基因与野生型番茄的叶、花、果表型比较 Fig. 3 Phenotypes comparison of leaf, flower and fruit in wild-type and EIL1 transgenic tomatoes |
对转基因植株果实的观察发现, 过量表达SlEIL1基因能够促进果实的成熟, 但对坐果无影响, EIL-OX与WT植株的果实无明显差异(图 3)。而在EIL-CS植株中, 无论是去雄处理还是不去雄处理, 其果实均可形成无籽果实, 表明下调SlEIL1基因表达会引起番茄的单性结实。Ag+处理不能诱导去雄花蕾形成单性结实果实, 未去雄花蕾在Ag+处理后所形成的果实与未处理果实在表型上无明显差异(表 1)。
| 处理Treatment | WT | EIL-OX | EIL-CS | Ag+/WT |
| 未去雄No emasculation | 0/30/30 | 0/23/23 | 26a/26/26 | 0/20/20 |
| 去雄Emasculation | 0/0/30 | 0/0/19 | 22b/22/22 | 0/0/10 |
| 注:3个数值分别表示无籽果实数(a)或单性结实果实数(b)、坐果数、花蕾总数。Ag+/WT:Ag+处理野生型植株。 Note: Three values indicate the number of seedless fruits(a) or parthenocarpic fruits(b), number of fruits, total number of flower buds, respectively. Ag+/WT:WT treated by Ag+. | ||||
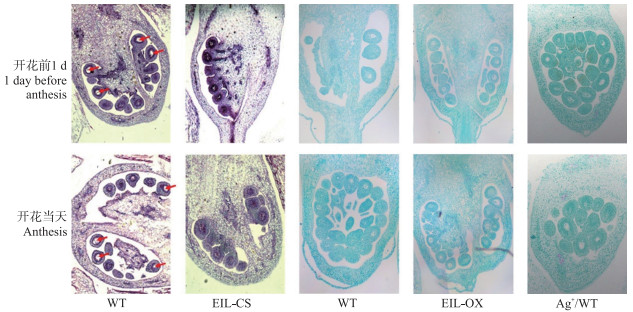
由图 4可见:在EIL-CS的花蕾中, 胚珠的发育较野生型植株明显缓慢, 在开花当天未能形成正常胚囊结构, 这可能是EIL-CS未去雄花蕾也形成无籽果实的直接原因。另一方面, EIL1基因的过量表达以及Ag+处理对胚珠的发育并未造成明显影响。
|
图 4 野生型(WT)、Ag+/WT和EIL1转基因番茄植株开花前子房显微切片 Fig. 4 Paraffin section of ovary before flowering in wild-type(WT), Ag+/WT and EIL1 transgenic tomato plants 红色箭头表示胚囊。 Red arrow shows embryosac. |
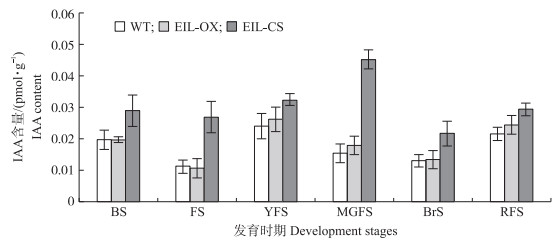
由图 5可见:从花蕾期到果实成熟全过程, EIL-OX植株的果实中生长素含量与WT没有显著差异。EIL-CS植株每个时期的生长素含量都显著高于EIL-OX和WT, 且生长素含量从花蕾期到绿果期持续上升, 直至果实开始成熟生长素含量才逐渐下降。这说明子房生长素含量较高是EIL-CS植株形成单性结实的原因, 而下调EIL1表达可以促进番茄果实中生长素的合成。
|
图 5 野生型和EIL1转基因番茄不同发育时期的生长素含量变化 Fig. 5 Changes of auxin content of wild-type and EIL1 transgenic tomato at different development stages |
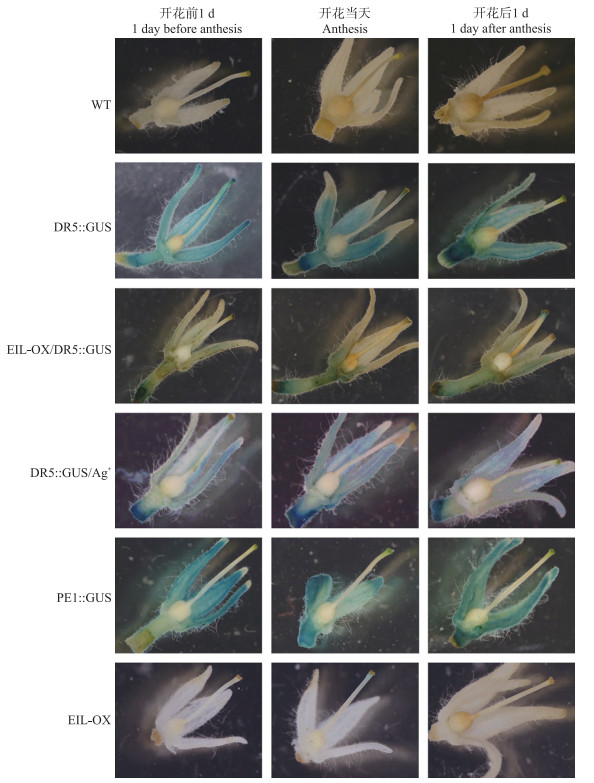
由图 6可见:DR5∷GUS植株授粉前生长素主要集中在果柄和萼片; 授粉后, 子房中的生长素开始增加, 这可能是由于萼片或果柄处的生长素向子房转运的结果。与DR5∷GUS相比, EIL-OX/DR5∷GUS除花托外, 不同时期的果实和萼片中均未出现明显染色, 表明EIL1过量表达可以降低萼片和果实中生长素水平; 采用Ag+处理后的DR5∷GUS植株的染色结果与DR5∷GUS基本一致, 表明仅抑制细胞接收乙烯信号无法提高生长素水平; PE1∷GUS转基因番茄的EIL1则主要在萼片和果柄处表达。
|
图 6 野生型和EIL1转基因番茄不同发育时期花的GUS染色观察 Fig. 6 GUS staining of flower at different development stages of wild-type and EIL1 transgenic tomato 蓝色表示检出GUS活性。 Blue indicates detection of GUS activity. |
乙烯和生长素相互作用的研究开展较早, 但是对其作用机制仍不清楚。研究发现, 生长素能诱导乙烯合成酶基因表达, 从而影响乙烯的生成, 另一方面内源乙烯也能促进生长素合成, 从而控制根细胞的扩增[20-23]。Ruzicka等[24]和Stepanova等[25]也认为乙烯主要通过刺激生长素合成和生长素的转运, 进一步影响生长素在植物体内的分布。本文研究发现乙烯在番茄植株形态建成过程中, 对生长素的合成或运输起着负调控作用。我们观察到转基因番茄在早期生长过程中与野生型番茄表型差异不大, 但随着植株生长时间延长, EIL-OX植株出现了顶端优势丧失的现象:大量侧枝长出, 侧枝叶片向性恢复正常且侧枝长度和叶片大小明显超过主茎, 而EIL-CS植株一直表现为主枝生长较强、无侧枝形成。
Vriezen等[26]研究发现在果实形成前乙烯合成相关基因表达水平很高, 因此认为乙烯在坐果过程中可能发挥着生长素拮抗剂的功能, 从而保护子房使其保持休眠状态, 即阻止授粉/受精前果实的提前发育。本研究中的转基因杂交试验能更直观地检测到乙烯与生长素在果实形成过程中的相互作用。EIL-OX/DR5∷GUS植株果实的GUS染色显示过量表达EIL1确实能降低萼片和果柄中的生长素水平。值得一提的是, 由于EIL-CS植株表现为专性单性结实, 即无论授粉与否均可形成无籽果实, 我们未能获得EIL-CS/DR5∷GUS的杂交植株, 因此本研究采用了Ag+离子处理DR5∷GUS植株花蕾的方式来研究抑制乙烯信号对果实中生长素水平的影响。已有研究报道Ag+处理部分葫芦科作物的雌花可以诱导单性结实[27-28], 表明乙烯与果实发育确有关系。但本研究却发现Ag+离子处理的去雄子房并未形成单性结实果实, 同时GUS染色表明果柄和萼片中的生长素水平也未受到影响。研究发现外源乙烯或乙烯抑制剂处理并不能影响EIN3/EIL的转录[17, 29], 暗示EIL1可能是影响果实中生长素表达和分布的直接调控因子。另外, 本课题组在研究黄瓜单性结实激素调控机制时发现, 在多种非单性结实黄瓜材料中采用与本文试验相同浓度的Ag+处理, 均可以诱导单性结实[28], 预示黄瓜也许是研究果实发育中乙烯/生长素互作机制更佳的模式植物。
研究表明SlEIL1基因的下调会抑制番茄果实的成熟[17]。本研究发现SlEIL1基因的下调可以使番茄果实发育过程中生长素始终处于高水平, 引起果实胚珠发育缺陷, 进而形成了无籽果实, 这与已知的高浓度生长素会引起番茄单性结实的结论相一致[30]。然而, 本试验中内源生长素测定显示, 在EIL-OX番茄果实器官中的生长素整体水平与野生型无明显差异, 但GUS染色却发现果实形成过程中子房和萼片组织中的生长素浓度发生了显著变化, 说明EIL基因可能并不影响生长素的代谢, 但可以影响生长素在不同组织中的积累(或运输)。因此, 我们提出了乙烯-生长素在果实形成过程中可能的互作模式:EIN3/EIL的存在抑制了生长素通过果柄向子房转运的活性。授粉后, 一系列的生理变化使EIN3/EIL的转录受到抑制并解除其对生长素向子房运输的抑制作用, 能够运输生长素进入子房, 并与受精后子房合成的生长素共同促进果实的发育; 而人工下调EIN3/EIL的表达, 直接解除了其抑制作用, 从而提高子房生长素水平, 刺激未受精子房膨大并最终形成单性结实。本文研究初步探明了果实形成过程中生长素水平受到乙烯信号系统的负调控, 但EIN3/EIL对生长素运输抑制调控机制还需要进一步研究。
| [1] |
Zangerl A R, Berenbaum M R, Nitao J K. Parthenocarpic fruits in wild parsnip:decoy defence against a specialist herbivore[J]. Evolutionary Ecology, 1991, 5(2): 136-145. DOI:10.1007/BF02270830 |
| [2] |
Ramos-Ordoñez M F, Arizmendi M C. Parthenocarpy, attractiveness and seed predation by birds in Bursera morelensis[J]. Journal of Arid Environments, 2011, 75(9): 757-762. DOI:10.1016/j.jaridenv.2011.04.013 |
| [3] |
Makrogianni D I, Karapanos I C, Passam H C. Seasonal fluctuations in pollen production and viability in eggplant and the quality of seed-containing and seedless(auxin-set)fruits[J]. Journal of Plant Growth Regulation, 2018, 37(3): 937-946. |
| [4] |
Acciarri N, Restaino F, Vitelli G, et al. Genetically modified parthenocarpic eggplants:improved fruit productivity under both greenhouse and open field cultivation[J]. BMC Biotechnology, 2002, 2(1): 4. |
| [5] |
Mao Z, Yu Q, Zhen W, et al. Expression of ipt gene driven by tomato fruit specific promoter and its effects on fruit development of tomato[J]. Chinese Science Bulletin, 2002, 47(11): 928-932. DOI:10.1360/02tb9208 |
| [6] |
Varoquaux F, Blanvillain R, Delseny M, et al. Less is better:new approaches for seedless fruit production[J]. Trends in Biotechnology, 2000, 18(6): 233-242. DOI:10.1016/S0167-7799(00)01448-7 |
| [7] |
Gustafson F G. Inducement of fruit development by growth-promoting chemicals[J]. Proc Natl Acad Sci USA, 1936, 22(11): 628-636. DOI:10.1073/pnas.22.11.628 |
| [8] |
Mezzetti B, Landi L, Pandolfini T, et al. The defH9-iaaM auxin-synthesizing gene increases plant fecundity and fruit production in strawberry and raspberry[J]. BMC Biotechnology, 2004, 4: 10. DOI:10.1186/1472-6750-4-10 |
| [9] |
Breitel D A, Chappell-Maor L, Meir S, et al. AUXIN RESPONSE FACTOR 2 intersects hormonal signals in the regulation of tomato fruit ripening[J]. PLoS Genetics, 2016, 12(3): e1005903. DOI:10.1371/journal.pgen.1005903 |
| [10] |
Xu J, Li J, Cui L, et al. New insights into the roles of cucumber TIR1 homologs and miR393 in regulating fruit/seed set development and leaf morphogenesis[J]. BMC Plant Biology, 2017, 17(1): 130. DOI:10.1186/s12870-017-1075-6 |
| [11] |
Ren Z, Wang X. SlTIR1 is involved in crosstalk of phytohormones, regulates auxin-induced root growth and stimulates stenospermocarpic fruit formation in tomato[J]. Plant Science, 2016, 253: 13-20. DOI:10.1016/j.plantsci.2016.09.005 |
| [12] |
Wang H, Jones B, Li Z, et al. The tomato Aux/IAA transcription factor IAA9 is involved in fruit development and leaf morphogenesis[J]. The Plant Cell, 2005, 17(10): 2676-2692. DOI:10.1105/tpc.105.033415 |
| [13] |
de Jong M, Wolters-Arts M, Feron R, et al. The Solanum lycopersicum auxin response factor 7(SlARF7)regulates auxin signaling during tomato fruit set and development[J]. The Plant Journal, 2009, 57(1): 160-170. DOI:10.1111/j.1365-313X.2008.03671.x |
| [14] |
Mounet F, Moing A, Kowalczyk M, et al. Down-regulation of a single auxin efflux transport protein in tomato induces precocious fruit development[J]. Journal of Experimental Botany, 2012, 63(13): 4901-4917. DOI:10.1093/jxb/ers167 |
| [15] |
Trebitsh T, Staub J E, O'neill S D. Identification of a 1-aminocyclopropane-1-carboxylic acid synthase gene linked to the Female(F)locus that enhances female sex expression in cucumber[J]. Plant Physiology, 1997, 113(3): 987-995. DOI:10.1104/pp.113.3.987 |
| [16] |
Pascual L, Blanca J M, Canizares J, et al. Transcriptomic analysis of tomato carpel development reveals alterations in ethylene and gibberellin synthesis during pat3/pat4 parthenocarpic fruit set[J]. BMC Plant Biology, 2009, 9: 67. DOI:10.1186/1471-2229-9-67 |
| [17] |
Tieman D M, Ciardi J A, Taylor M G, et al. Members of the tomato LeEIL(EIN3-like)gene family are functionally redundant and regulate ethylene responses throughout plant development[J]. The Plant Journal, 2001, 26(1): 47-58. DOI:10.1046/j.1365-313x.2001.01006.x |
| [18] |
Li J, Li Z, Tang L, et al. A conserved phosphorylation site regulates the transcriptional function of ETHYLENE-INSENSITIVE3-like1 in tomato[J]. Journal of Experimental Botany, 2012, 63(1): 427-439. |
| [19] |
李季.番茄Sl-EIL1转录激活域EPR1的鉴定及其磷酸化对转录调控功能的影响研究[D].重庆: 重庆大学, 2011. Li J. Identification and analysis the function of EPR1: a phosphorylation-mediated tomato Sl-EIL1 transcriptional activation domain[D]. Chongqing: Chongqing University, 2011(in Chinese with English abstract). |
| [20] |
Alonso J M, Stepanova A N, Solano R, et al. Five components of the ethylene-response pathway identified in a screen for weak ethylene-insensitive mutants in Arabidopsis[J]. Proc Natl Acad Sci USA, 2003, 100(5): 2992-2997. DOI:10.1073/pnas.0438070100 |
| [21] |
Strader L, Chen G, Bartel B. Ethylene directs auxin to control root cell expansion[J]. The Plant Journal, 2010, 64(5): 874-884. DOI:10.1111/j.1365-313X.2010.04373.x |
| [22] |
张德健, 夏仁学, 曹秀, 等. 生长调节剂和基质对枳根毛发育的影响[J]. 应用生态学报, 2011, 22(6): 1437-1442. Zhang D J, Xia R X, Cao X, et al. Effects of growth regulators and growth media on root-hair development of Poncirus trifoliate[J]. Chinese Journal of Applied Ecology, 2011, 22(6): 1437-1442 (in Chinese with English abstract). |
| [23] |
Swarup R, Perry P, Hagenbeek D, et al. Ethylene upregulates auxin biosynthesis in Arabidopsis seedlings to enhance inhibition of root cell elongation[J]. The Plant Cell, 2007, 19(7): 2186-2196. DOI:10.1105/tpc.107.052100 |
| [24] |
Ruzicka K, Ljung K, Vanneste S, et al. Ethylene regulates root growth through effects on auxin biosynthesis and transport-dependent auxin distribution[J]. The Plant Cell, 2007, 19(7): 2197-2212. DOI:10.1105/tpc.107.052126 |
| [25] |
Stepanova A N, Yun J, Likhacheva A V, et al. Multilevel interactions between ethylene and auxin in Arabidopsis roots[J]. The Plant Cell, 2007, 19(7): 2169-2185. DOI:10.1105/tpc.107.052068 |
| [26] |
Vriezen W H, Feron R, Maretto F, et al. Changes in tomato ovary transcriptome demonstrate complex hormonal regulation of fruit set[J]. New Phytologist, 2008, 177(1): 60-76. |
| [27] |
Martinez C, Manzano S, Megias Z, et al. Involvement of ethylene biosynthesis and signalling in fruit set and early fruit development in zucchini squash(Cucurbita pepo L.)[J]. BMC Plant Biology, 2013, 13: 139. DOI:10.1186/1471-2229-13-139 |
| [28] |
Li J, Xu J, Guo Q, et al. Proteomic insight into fruit set of cucumber(Cucumis sativus L.)suggests the cues of hormone-independent parthenocarpy[J]. BMC Genomics, 2017, 18(1): 896. DOI:10.1186/s12864-017-4290-5 |
| [29] |
Chao Q, Rothenberg M, Solano R, et al. Activation of the ethylene gas response pathway in Arabidopsis by the nuclear protein ETHYLENE-INSENSITIVE3 and related proteins[J]. Cell, 1997, 89(7): 1133-1144. DOI:10.1016/S0092-8674(00)80300-1 |
| [30] |
凌丹燕, 张清杨, 刘姗, 等. 植物生长素影响单性结实的研究进展[J]. 浙江师范大学学报(自然科学版), 2015, 38(2): 201-205. Ling D Y, Zhang Q Y, Liu S, et al. The progress of parthenocarpy in plant[J]. Journal of Zhejiang Normal University(Natural Sciences), 2015, 38(2): 201-205 (in Chinese with English abstract). |




