文章信息
- 王正磊, 周艺琳, 周美意, 董心仪, 臧琦铭, PHOUTHAPANE Vanhnaseng, 苗晋锋
- WANG Zhenglei, ZHOU Yilin, ZHOU Meiyi, DONG Xinyi, ZANG Qiming, PHOUTHAPANE Vanhnaseng, MIAO Jinfeng
- 牛磺酸对乳房链球菌感染引起的氧化应激影响及其机制
- The effects of taurine on oxidative stress induced by Streptococcus uberis infection and its mechanism
- 南京农业大学学报, 2019, 42(3): 491-498
- Journal of Nanjing Agricultural University, 2019, 42(3): 491-498.
- http://dx.doi.org/10.7685/jnau.201812007
-
文章历史
- 收稿日期: 2018-12-07
2. 老挝科技部生态与生物技术研究所, 老挝 万象 01000
2. Animal Science Center at Biotechnology and Ecology Institute, Ministry of Science and Technology of Laos, Vientiane 01000, Laos
当机体受到损伤、化学物质刺激、病原微生物感染时, 会产生大量活性氧(reactive oxygen species, ROS)、活性氮(reactive nitrogen species, RNS)、细胞因子等生物活性物质, 引起氧化应激[1-3]。其实质是产生的生物活性物质超过了机体的抵抗能力, 导致机体氧化与抗氧化系统动态失衡。氧化应激发生时会引起宿主发生炎症反应, 造成组织损伤及疾病[4-5]。
Keap1-Nrf2-ARE系统被认为是机体内重要的维持氧化还原平衡的因素, 核转录因子E2相关因子2(nuclearfactor erythroid-2-related factor-2, Nrf2)在氧化应激发生时进入细胞核与抗氧化反应元件(antioxidant response element, ARE)结合, 启动下游一系列抗氧化基因的转录表达, 如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽硫转移酶(glutathione S-transferase, GST)、血红素加氧酶1(heme oxygenase-1, HO-1)[6-9]。Kelch样环氧氯丙烷相关蛋白1(Kelch-like epichlorohydrin-associated protein 1, Keap1)是Nrf2的内源性抑制剂, 在正常情况下介导Nrf2降解, 使其保持较低水平。氧化应激发生时, Keap1变构并与Nrf2解偶联, 之后Nrf2入核调控相关基因表达[10-12]。
牛磺酸作为一种重要的“多功能营养元素”, 具有抗炎、抗氧化、维持离子平衡、调节代谢和免疫等生理功能。本实验室前期研究发现金黄色葡萄球菌和大肠杆菌感染乳腺上皮细胞会引起细胞内ROS、丙二醛(malondialdehyde, MDA)含量显著升高, 总抗氧化能力(total antioxidant capacity, T-AOC)显著降低, 而牛磺酸可以缓解这些变化, 这在宿主的抗感染过程中发挥重要的作用, 但其机制尚不明确[13]。Keap1-Nrf2-ARE系统在机体抗氧化应激反应中发挥着重要的作用, 牛磺酸是否通过影响该系统发挥其抗氧化作用; 牛磺酸能够缓解乳房链球菌(Streptococcus uberis)感染诱发的炎症, 在该过程中牛磺酸调控Keap1-Nrf2-ARE系统影响宿主的抗氧化能力是否也发挥重要的作用。基于此, 本试验以乳房链球菌(S.uberis 0140J)和牛乳腺上皮细胞(MAC-T)为研究对象, 对Keap1-Nrf2-ARE信号通路的关键蛋白等指标进行检测, 以期阐明抗氧化在牛磺酸缓解乳房链球菌感染中的作用及机制。
1 材料与方法 1.1 试验材料牛乳腺上皮细胞(MAC-T)由美国伊利诺伊大学香槟分校Juan J Loor博士惠赠; 乳房链球菌(S.uberis 0140J)购于美国模式培养物集存库(ATCC); DMEM细胞培养液、胎牛血清、蛋白Marker、ECL发光液购于Thermo Fisher公司; 牛磺酸购于上海生工生物工程公司; ROS荧光探针、BCA试剂盒、RIPA缓冲液、蛋白上样缓冲液购于南京碧云天公司; Keap1、Nrf2、GAPDH抗体购于南京巴傲得生物科技公司; Nrf2抗体和二抗购于CST公司; 生化试剂盒(T-AOC、SOD、MDA、CAT)购于南京建成生物工程研究所; siRNA及转染试剂购于广东锐博生物科技公司; 全波长酶标仪购于Thermo Fisher公司; C6型流式细胞仪购于BD公司; Tanon-3900成像系统购于上海天能科技有限公司; 激光共聚焦显微镜购于德国卡尔蔡司公司。
1.2 试验方法 1.2.1 牛乳腺上皮细胞培养将牛乳腺上皮细胞传代至细胞瓶中, 加入适量含有10%胎牛血清的DMEM培养液, 放置于37 ℃、5% CO2培养箱中培养至覆盖瓶底80%左右, 待用。
1.2.2 乳房链球菌培养将S.uberis 0140J按菌液与培养基1 : 50接种于灭菌的含2%胎牛血清的Todd- Hewitt Broth(THB)液体培养基中, 在37 ℃、180 r · min-1的恒温摇床中培养至紫外吸光值(A600)=0.5, 待用。
1.2.3 牛磺酸预处理将牛乳腺上皮细胞传代至6孔板中, 加入适量含10%(体积分数)胎牛血清的DMEM培养液, 放置于37 ℃、5% CO2培养箱中培养至覆盖6孔板板底80%左右。弃培养液, 用PBS洗3次, 加入含有70 mmol · L-1牛磺酸的10%胎牛血清DMEM培养液继续培养4 h, 待用。
1.2.4 乳房链球菌侵染试验将牛乳腺上皮细胞传代至6孔板中, 加入适量含有10%胎牛血清的DMEM培养液, 放置于37 ℃、5% CO2培养箱中培养至覆盖6孔板板底80%左右, 更换新鲜的含10%胎牛血清的DMEM培养液。按感染复数(MOI)=10加入新鲜菌液, 轻轻混匀后放置于37 ℃、5% CO2培养箱继续培养3 h, 收集样品。
1.2.5 蛋白提取及电泳条件将细胞用PBS缓冲液清洗3次, 加入RIPA裂解液与广谱蛋白酶抑制剂裂解细胞, 然后将细胞刮下收集至EP管中(均在冰上进行); 12 000 r · min-1离心10 min收集上清液, 用BCA法测定其蛋白浓度, 加入上样缓冲液充分混匀, 煮沸10 min, 分装待用。
将预染蛋白标准品和样品上样至SDS-PAGE胶孔里, 80 V电泳至浓缩胶与分离胶分界线, 然后调节电压至120 V, 电泳至凝胶下部, 停止电泳; 100 V湿转90 min, 5% BSA室温封闭2 h后加入一抗, 4 ℃过夜孵育; TBST清洗后加入1 : 10 000稀释的二抗, 室温孵育2 h, TBST清洗后放入发光成像系统拍照并用Image J软件统计分析。
1.2.6 siRNA转染将牛乳腺上皮细胞传代至6孔板中, 加入适量含有10%胎牛血清的DMEM培养液, 放置于37 ℃、5% CO2培养箱中培养至6孔板板底50%左右, 然后按照siRNA转染试剂盒说明书加入终浓度为20 nmol · L-1的siTauT、siPAT1, 转染48 h, 再依据试验条件进行其他处理。siTauT、siPAT1序列分别为5′-GGATAGCCAGTTTGTGGAA-3′、5′-CCAATGGGACCACCAACAA-3′。
1.2.7 流式细胞检测将细胞用PBS洗3次, 加入终浓度为10 μmol · L-1的DCFH-DA(2, 7-二氯二氢荧光素二乙酸酯), 37 ℃培养箱中孵育20 min, 然后弃上清液, PBS洗3次, 加入胰酶消化, 收集于流式管中, 用流式细胞仪进行检测。仪器参数设置为激发波长488 nm, 发射波长525 nm。
1.2.8 免疫荧光染色将长满细胞的细胞爬片用PBS洗3次, 加入4%甲醛固定15 min, PBS洗3次, 再用0.5% PBST透膜20 min, PBS洗3次。用5%山羊血清室温封闭1 h, PBS洗3次, 4 ℃过夜孵育稀释后的一抗, PBS洗3次, 加入二抗室温孵育2 h, 再用PBS洗3次, 用DAPI(4, 6-二脒基-2-苯基吲哚)进行细胞核染色, 最后封片观察。
1.2.9 细胞破碎将细胞用PBS洗3次, 每孔再加入1 mL PBS。先用刮刀将细胞刮下并收集到1.5 mL EP管中, 进行超声破碎(条件:400 W, 5 s, 间隔15 s, 连续10次), 最后4 ℃、3 500 r · min-1离心10 min, 取上清液备用。
1.2.10 生化指标测定分别采用ABTS法、TBA法、WST-1法、钼酸铵法测定T-AOC水平、MDA含量、SOD和CAT活性, 详细操作参见说明书。
1.3 数据处理与分析用SPSS 18.0软件进行统计分析, 采用单因素方差(One-way ANOVA)分析和差异显著性检验, 用Graph Pad Prism 5.0软件对数据作图。数据结果表示为平均值±标准差(x±SD)。
2 结果与分析 2.1 乳房链球菌感染及牛磺酸预处理对细胞内活性氧(ROS)水平的影响如图 1所示:与空白组相比, 乳房链球菌感染显著提高细胞内ROS水平, 牛磺酸预处理降低这种作用(P < 0.05)。说明乳房链球菌感染可能导致细胞产生氧化应激, 牛磺酸对其有干预作用。

|
图 1 牛磺酸及乳房链球菌感染对细胞中活性氧(ROS)水平的影响(n=3)
Fig. 1 The effects of taurine and Streptococcus uberis infection on reactive oxygen species(ROS)level in cells
A.统计结果The statistical results of different groups; B.对目标细胞群设门(区域R1) Gating of the cells population(region R1);C-F.分别表示CK、T、S、ST组细胞中活性氧水平The reactive oxygen species levels of CK, T, S and ST groups in cells. CK:未处理Untreated; T:用70 mmol · L-1牛磺酸处理4 h Treated with 70 mmol · L-1 taurine for 4 h; S:乳房链球菌感染3 h Infected by S.uberis for 3 h; ST:先用70 mmol · L-1牛磺酸预处理4 h, 再加入乳房链球菌感染3 h Treated with 70 mmol · L-1 taurine for 4 h before infecting by S.uberis for 3 h. 不同小写字母表示处理间差异显著(P < 0.05)。Different lowercase letters indicate significant difference at 0.05 level.下同。The same as follows. |
如图 2所示:与空白组相比, 牛磺酸处理能够显著提高细胞内T-AOC水平及SOD、CAT活性(P < 0.05), 对MDA含量有降低的趋势(P>0.05)。与空白组相比, 乳房链球菌感染显著降低T-AOC水平, 提高MDA含量, 同时在一定程度上提高了SOD、CAT活性(P < 0.05)。与乳房链球菌感染组相比, 牛磺酸预处理显著提高细胞内T-AOC水平和SOD、CAT活性, 降低MDA含量(P < 0.05)。上述结果进一步说明乳房链球菌感染产生的氧化应激在一定程度上被牛磺酸预处理抑制。
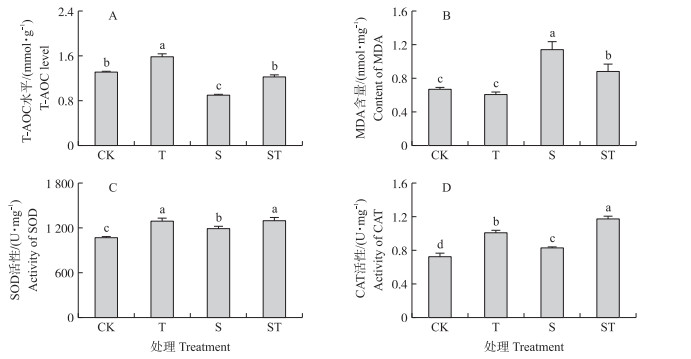
|
图 2 牛磺酸及乳房链球菌感染对细胞中T-AOC水平、MDA含量及SOD、CAT活性的影响(n=3) Fig. 2 The effects of taurine and S.uberis infection on T-AOC level, MDA content and SOD, CAT activities in cells |
如图 3所示:与空白组相比, 牛磺酸处理及乳房链球菌感染使Keap1蛋白表达量显著降低, Nrf2蛋白表达量显著升高(P < 0.05)。与乳房链球菌感染组相比, 牛磺酸预处理降低了Keap1蛋白水平, 提高了Nrf2蛋白水平(P < 0.05)。说明乳房链球菌感染对Keap1-Nrf2通路有一定的激活作用, 而牛磺酸预处理可以对其进一步激活。
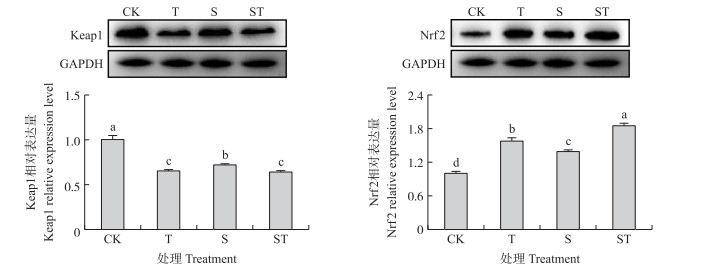
|
图 3 牛磺酸及乳房链球菌感染对Keap1、Nrf2蛋白表达的影响(n=3) Fig. 3 The effects of taurine and S.uberis infection on the protein expression level of Keap1 and Nrf2 |
如图 4所示:正常情况下(图 4-a3)Nrf2的表达水平较低且均匀分布在胞液中。牛磺酸处理(图 4-b3)或乳房链球菌感染(图 4-c3)明显提高了Nrf2的表达, 并促进Nrf2入核, 表现在荧光信号在核区集聚, 而且牛磺酸处理比乳房链球菌感染作用更加明显。在乳房链球菌感染时, 牛磺酸预处理(图 4-d3)同样提高Nrf2的表达及入核。说明牛磺酸可以激活Nrf2蛋白, 促进其入核诱导靶基因的转录与翻译。
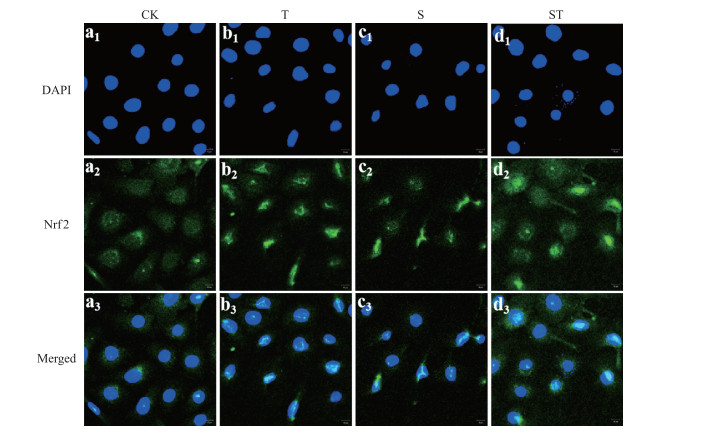
|
图 4 牛磺酸及乳房链球菌感染对Nrf2的表达及其在胞内分布的影响(n=3) Fig. 4 The effects of taurine and S.uberis infection on Nrf2 expression and its distribution in cells |
如图 5所示:用70 mmol · L-1牛磺酸处理牛乳腺上皮细胞4 h后, Keap1的表达量显著降低, Nrf2的表达量显著升高(P < 0.05)。TauT、PAT1表达被同时干扰后, 牛磺酸降低Keap1和升高Nrf2表达量的作用被显著抑制(P < 0.05)。说明牛磺酸可能通过转运载体进入细胞中, 激活Keap1-Nrf2信号通路, 发挥其抗氧化作用。
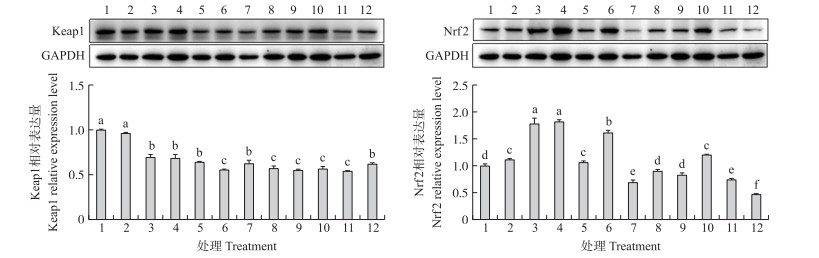
|
图 5 抑制牛磺酸转运对Keap1、Nrf2蛋白表达的影响(n=3) Fig. 5 The effect of inhibiting taurine transport on protein expression of Keap1 and Nrf2 1.未处理; 2.加入Lipo3000处理48 h; 3. 70 mmol · L-1牛磺酸处理4 h; 4.先加Lipo3000处理48 h, 再加70 mmol · L-1牛磺酸处理4 h; 5.加入20 nmol · L-1 siNC转染48 h; 6.先加20 nmol · L-1 siNC转染48 h, 再加70 mmol · L-1牛磺酸处理4 h; 7.加入20 nmol · L-1 siTauT转染48 h; 8.先加20 nmol · L-1 siTauT转染48 h, 再加70 mmol · L-1牛磺酸处理4 h; 9.加入20 nmol · L-1 siPAT1转染48 h; 10.先加20 nmol · L-1 siPAT1转染48 h, 再加70 mmol · L-1牛磺酸处理4 h; 11.加入20 nmol · L-1 siTauT和siPAT1转染48 h; 12.先加20 nmol · L-1 siTauT和siPAT1转染48 h, 再加70 mmol · L-1牛磺酸处理4 h。 1. Untreated; 2. Incubated with Lipo3000 for 48 h; 3. Treated with 70 mmol · L-1 taurine for 4 h; 4. Incubated with Lipo3000 for 48 h then treated with 70 mmol · L-1 taurine for 4 h; 5. Incubated with 20 nmol · L-1 siNC for 48 h; 6. Incubated with 20 nmol · L-1 siNC for 48 h then treated with 70 mmol · L-1 taurine for 4 h; 7. Incubated with 20 nmol · L-1 siTauT for 48 h; 8. Incubated with 20 nmol · L-1 siTauT for 48 h then treated with 70 mmol · L-1 taurine for 4 h; 9. Incubated with 20 nmol · L-1 siPAT1 for 48 h; 10. Incubated with 20 nmol · L-1 siPAT1 for 48 h then treated with 70 mmol · L-1 taurine for 4 h; 11. Incubated with 20 nmol · L-1 siTauT and siPAT1 for 48 h; 12. Incubated with 20 nmol · L-1 siTauT and siPAT1 for 48 h then treated with 70 mmol · L-1 taurine for 4 h. |
如图 6所示:乳房链球菌感染引起乳腺上皮细胞中ROS水平等显著升高, 造成机体的氧化损伤。牛磺酸通过TauT和PAT1这2个转运载体进入细胞, 抑制Keap1蛋白的表达, 促进Keap1与Nrf2解偶联, 降低Keap1介导Nrf2降解的作用, 使Nrf2蛋白水平升高。Nrf2进入细胞核诱导其调控区抗氧化反应元件基因的转录和翻译, 使SOD、CAT等抗氧化酶的活性升高, 加快清除由乳房链球菌感染引起的ROS等, 减少脂质过氧化的发生, 提高机体的总抗氧化能力, 进而缓解氧化损伤。
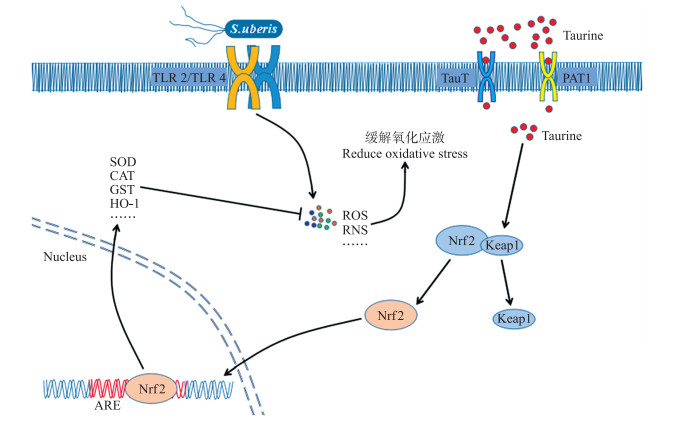
|
图 6 牛磺酸缓解乳房链球菌感染引起的氧化应激示意图 Fig. 6 Taurine reduces the oxidative stress level caused by S.uberis infection |
乳房链球菌是重要的环境性乳腺炎致病菌, 可以黏附、内化进入乳腺上皮细胞形成胞内感染[22]。这对其防控带来了困难。近年来, 本实验室应用牛磺酸调控其感染发现牛磺酸能提高机体的免疫能力, 缓解乳腺组织的炎性反应, 降低乳腺组织的载菌量, 这和牛磺酸有强大的抗氧化能力有关[13-14]。感染会引起氧化应激已经成为共识, 氧化应激以大量的ROS产生开始, 因此常把ROS水平作为衡量机体氧化应激严重程度的重要指标之一[1-3]。本试验结果显示, S.uberis感染显著提高细胞内ROS水平, 而牛磺酸预处理显著降低了ROS水平的升高。说明乳房链球菌感染可能导致细胞产生氧化应激, 牛磺酸预处理显著改善了这种变化。
T-AOC由机体中抗氧化物质和抗氧化酶构成, 能衡量机体对自由基清除能力[15]。MDA是脂质过氧化产物, 能与含有氨基的化合物如蛋白、核酸及卵磷脂等发生化学反应, 使之相互交联。同时MDA也能将ROS转化成活性化学剂, 通过链式反应放大ROS的生理作用, 加剧氧化应激损伤[16]。本试验结果表明:S.uberis感染显著降低T-AOC水平, 提高MDA含量, 而牛磺酸对这些改变有缓解作用。提示, 可能ROS的积累造成T-AOC水平下降, 并引起脂质过氧化, 造成MDA含量增加, 这与以前的报道相符[17-18]。此外, 机体中存在多种抗氧化酶, 能分解、清除ROS, 使机体免受氧化应激损伤。例如SOD催化O2-产生H2O2, 生成的H2O2再被CAT分解成水[19-20]。细胞中SOD和CTA活性检测结果显示, 感染时, 在ROS的诱导下2种酶的活性升高, 牛磺酸有进一步提高它们活性的能力。上述结果证实牛磺酸缓解了S.uberis感染引发的乳腺上皮细胞的氧化应激反应。Keap1-Nrf2-ARE系统在机体抗氧化应激过程中发挥重要作用。Nrf2是一种核转录因子, 氧化应激发生时与其偶联的抑制因子Keap1发生变构并与其分离, 之后活化Nrf2转位入核结合到ARE区域, 启动SOD、CAT等一系列抗氧化酶的表达[6-9]。Song等[21]研究显示, 蓝莓花青素通过激活Nrf2-HO-1通路缓解糖尿病造成的大鼠视网膜细胞的氧化应激损伤。孔媛等[22]、李乐慧等[23]发现牛磺酸可以通过Nrf2-ARE信号通路显著提高三氧化二砷(AS2O3)诱导的胰腺损伤模型中大鼠的TRX水平, 也可以通过Nrf2-ARE信号通路诱导OH-1以及GPX1水平上升来应对甲基汞产生的氧化应激。与上述研究结果相似, 本试验中, S.uberis感染时, 牛磺酸预处理显著降低Keap1的表达, 促进Nrf2的表达和入核, 说明牛磺酸在调控感染过程中发挥抗氧化作用是可能通过激活Keap1-Nrf2-ARE系统实现。
牛磺酸作为一种含硫的非蛋白氨基酸, 在机体中发挥着多种生理功能, 其摄取主要依赖TauT、PAT1 2个转运载体[24-25]。为了进一步验证牛磺酸是否通过激活Keap1-Nrf2-ARE系统缓解S.uberis感染引起的氧化应激反应, 本试验用靶向siRNA干扰牛磺酸的2个转运载体的表达。结果表明, 抑制牛磺酸转运后, Keap1的降低及Nrf2的升高明显减弱。结果证实牛磺酸进入细胞中激活Keap1-Nrf2-ARE系统, 发挥其抗氧化作用, 这是牛磺酸缓解S.uberis感染造成的氧化损伤的重要机制之一。
乳房链球菌感染牛乳腺上皮细胞能够引起其发生氧化应激反应, 机体为了保护自身免受其伤害, 也能够在一定程度上激活Keap1-Nrf2-ARE信号通路, 提高SOD、CAT活性。由于乳房链球菌感染会导致机体产生大量的ROS等自由基, 消耗大量的抗氧化物质, 超过了机体的清除能力, 因此会导致T-AOC水平显著降低, MDA含量显著升高; 当用牛磺酸对其进行预处理, 其能够更进一步激活Keap1-Nrf2-ARE信号通路, 促进Nrf2的入核, 进而促进抗氧化反应元件(ARE)内抗氧化基因表达, 使机体的SOD、CAT等抗氧化酶活性更进一步增强, 提高对ROS等自由基的清除能力, 使机体T-AOC水平显著升高, MDA、ROS显著降低, 极大地改善了乳房链球菌感染引起的氧化应激反应。同时, 干扰TauT和PAT1的基因表达后, 牛磺酸对Keap1-Nrf2信号通路的激活作用被显著抑制, 进一步说明牛磺酸进入细胞中是其激活Keap1-Nrf2信号通路的前提。
综合本试验结果, 乳房链球菌感染会引起机体氧化应激反应的发生; 牛磺酸可以显著减轻乳房链球菌感染引起的氧化应激反应, 这可能与牛磺酸激活Keap1-Nrf2-ARE系统有关。本试验为牛磺酸缓解氧化应激损伤提供了理论依据。
| [1] |
李晓华, 唐乃夫, 厉永强, 等. p62/Nrf2信号途径在细胞保护中的作用[J]. 药学学报, 2018, 53(12): 1995-2005. Li X H, Tang N F, Li Y Q, et al. Cytoprotective effect of p62/Nrf2 signaling pathway[J]. Acta Pharmaceutica Sinica, 2018, 53(12): 1995-2005 (in Chinese with English abstract). |
| [2] |
Nair N, Gongora E. Oxidative stress and cardiovascular aging:interaction between NRF-2 and ADMA[J]. Current Cardiology Reviews, 2017, 13: 183-188. |
| [3] |
Kattoor A J, Pothineni N V K, Palagiri D, et al. Oxidative stress in atherosclerosis[J]. Curr Atheroscler Rep, 2017, 19(11): 42. DOI:10.1007/s11883-017-0678-6 |
| [4] |
Warolin J, Coenen K R, Kantor J L, et al. The relationship of oxidative stress, adiposity and metabolic risk factors in healthy black and white american youth[J]. Pediatr Obes, 2014, 9(1): 43-52. DOI:10.1111/ijpo.2014.9.issue-1 |
| [5] |
Morais J B S, Severo J S, Santos L R, et al. Role of magnesium in oxidative stress in individuals with obesity[J]. Biol Trace Elem Res, 2017, 176(1): 20-26. DOI:10.1007/s12011-016-0793-1 |
| [6] |
Hayes J D, Dinkova-Kostova A T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism[J]. Trends Biochem Sci, 2014, 39(4): 199-218. DOI:10.1016/j.tibs.2014.02.002 |
| [7] |
Ma Q. Role of Nrf2 in oxidative stress and toxicity[J]. Annu Rev Pharmacol Toxico, 2013, 53: 401-426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [8] |
Jaiswal A K. Nrf2 signaling in coordinated activation of antioxidant gene expression[J]. Free Radic Biol Med, 2004, 36(10): 1199-1207. DOI:10.1016/j.freeradbiomed.2004.02.074 |
| [9] |
Suzuki T, Motohashi H, Yamamoto M. Toward clinical application of the Keap1-Nrf2 pathway[J]. Trends Pharmacol Sci, 2013, 34(6): 340-346. DOI:10.1016/j.tips.2013.04.005 |
| [10] |
Baird L, Llères D, Swift S, et al. Regulatory flexibility in the Nrf2-mediated stress response is conferred by conformational cycling of the Keap1-Nrf2 protein complex[J]. Proc Natl Acad Sci USA, 2013, 110: 15259-15264. DOI:10.1073/pnas.1305687110 |
| [11] |
Sihvola V, Levonen A L. Keap1 as the redox sensor of the antioxidant response[J]. Arch Biochem Biophys, 2017, 617: 94-100. DOI:10.1016/j.abb.2016.10.010 |
| [12] |
Canning P, Cooper C D O, Krojer T, et al. Structural basis for Cul3 protein assembly with the BTB-Kelch family of E3 ubiquitin ligases[J]. Biol Chem, 2013, 288(11): 7803-7814. DOI:10.1074/jbc.M112.437996 |
| [13] |
Zheng L H, Xu Y Y, Lu J Y, et al. Variant innate immune responses of mammary epithelial cells to challenge by Staphylococcus aureus, Escherichia coli and the regulating effect of taurine on these bioprocesses[J]. Free Radic Biol Med, 2016, 96: 166-180. DOI:10.1016/j.freeradbiomed.2016.04.022 |
| [14] |
代斌, 卢劲晔, 郑六海, 等. 牛磺酸对乳房链球菌侵染乳腺上皮细胞所致炎性变化的缓解作用[J]. 畜牧与兽医, 2015, 47(7): 25-30. Dai B, Lu J Y, Zheng L H, et al. Attenuation of taurine on Streptococcus uberis-induced inflammation changes in mouse mammary epithelial cells[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(7): 25-30 (in Chinese with English abstract). |
| [15] |
Harasym J, Oledzki R. Effect of fruit and vegetable antioxidants on total antioxidant capacity of blood plasma[J]. Nutrition, 2014, 30(5): 511-517. DOI:10.1016/j.nut.2013.08.019 |
| [16] |
韩月, 黄友解, 王友明. 氧化应激对动物肠道的危害及其营养学缓解措施[J]. 上海畜牧兽医通讯, 2017(4): 44-49. Han Y, Huang Y J, Wang Y M. Damage of oxidative stress to animal intestine and its nutritional mitigation measures[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2017(4): 44-49 (in Chinese with English abstract). |
| [17] |
Kwiecien S, Jasnos K, Magierowski M, et al. Lipid peroxidation, reactive oxygen species and antioxidative factors in the pathogenesis of gastric mucosal lesions and mechanism of protection against oxidative stress-induced gastric injury[J]. J Physiol Pharmacol, 2014, 65(5): 613-622. |
| [18] |
Angelova P R, Horrocks M H, Klenerman D, et al. Lipid peroxidation is essential for α-synuclein-induced cell death[J]. J Neurochem, 2015, 133(4): 582-589. DOI:10.1111/jnc.13024 |
| [19] |
Meng S L, Chen J Z, Xu P, et al. Hepatic antioxidant enzymes SOD and CAT of Nile tilapia(Oreochromis niloticus)in response to pesticide methomyl and recovery pattern[J]. Bull Environ Contam Toxicol, 2014, 92(4): 388-392. DOI:10.1007/s00128-014-1232-7 |
| [20] |
Ding X, Wang D, Li L L, et al. Dehydroepiandrosterone ameliorates H2O2-induced Leydig cells oxidation damage and apoptosis through inhibition of ROS production and activation of PI3K/Akt pathways[J]. The International Journal of Biochemistry & Cell Biology, 2016, 70: 126-139. |
| [21] |
Song Y, Huang L L, Yu J F. Effects of blueberry anthocyanins on retinal oxidative stress and inflammation in diabetes through Nrf2/HO-1 signaling[J]. Journal of Neuroimmunology, 2016, 301: 1-6. DOI:10.1016/j.jneuroim.2016.11.001 |
| [22] |
孔媛.牛磺酸保护三氧化二砷引起的子代大鼠胰腺自噬性损伤的实验研究[D].大连: 大连医科大学, 2017. Kong Y. Investigation of taurine ' s protection against As2O3-induced autophagy in livers of rats ' offspring[D]. Dalian: Dalian Medical University, 2017(in chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10161-1017132770.htm |
| [23] |
李乐慧, 徐兆发, 奉姝, 等. 牛磺酸对甲基汞染毒大鼠脑皮质Nrf2及HO-1、γ-GCS、Gpx-1表达的影响[J]. 中国工业医学杂志, 2013, 26(3): 163-166. Li L H, Xu Z F, Feng Z, et al. Effect of taurine on expression of Nrf2, HO-1, γ-GCS and Gpx-1 in cerebral cortex of methylmercury exposed rat[J]. Chinese J Ind Med, 2013, 26(3): 163-166 (in Chinese with English abstract). |
| [24] |
Nielsen C U, Bjerg M, Ulaganathan N, et al. Oral and intravenous pharmacokinetics of taurine in sprague-dawley rats:the influence of dose and the possible involvement of the proton-coupled amino acid transporter, PAT1, in oral taurine absorption[J]. Physiol Rep, 2017, 5(19): e13467. DOI:10.14814/phy2.13467 |
| [25] |
Anderson C M H, Howard A, Walters J R F, et al. Taurine uptake across the human intestinal brush-border membrane is via two transporters:H+-coupled PAT1(SLC36A1)and Na+-and Cl--dependent TauT(SLC6A6)[J]. J Physiol, 2009, 587: 731-744. DOI:10.1113/jphysiol.2008.164228 |




